苯环的溴代反应
溴苯和NaOH反应方程式

溴苯和NaOH反应方程式溴苯和NaOH反应方程式可以表示为:C6H5Br + NaOH → C6H5OH + NaBr溴苯和NaOH发生反应生成苯酚和溴化钠。
下面我将详细解释这个反应的过程。
我们来看一下溴苯和NaOH的结构。
溴苯是由苯环上的一个氢原子被溴取代而成的化合物。
NaOH是氢氧化钠,是一种碱性化合物。
溴苯和NaOH在反应中发生的是酸碱中和反应。
在反应开始时,溴苯中的溴原子与NaOH中的氢氧根离子(OH-)发生反应。
溴原子的碳-溴键断裂,释放出一个溴离子(Br-)。
同时,氢氧根离子和苯环上的氢原子结合,形成水(H2O)分子。
C6H5Br + NaOH → C6H5OH + NaBr这个反应是一个酸碱中和反应,因为溴苯中的溴原子失去了一个负电荷,而NaOH中的氢氧根离子失去了一个负电荷。
在反应结束后,产生了苯酚和溴化钠。
苯酚是一种无色液体,具有特殊的芳香气味。
它是一种弱酸,可以和碱发生中和反应。
在这个反应中,苯酚的酸性质使它和NaOH中的氢氧根离子发生中和反应,生成水和盐。
NaBr是溴化钠,是一种无色晶体。
它是溴苯和NaOH反应的产物之一。
溴化钠在水中可以完全离解,产生溴离子和钠离子。
溴苯和NaOH反应的过程可以用化学方程式表示如下:C6H5Br + NaOH → C6H5OH + NaBr这个反应是一个酸碱中和反应,通过溴苯中的溴原子和NaOH中的氢氧根离子发生反应,生成苯酚和溴化钠。
这个反应是一个重要的有机合成反应,在工业上被广泛应用于制取苯酚和其他有机化合物。
同时,这个反应也可以用于实验室中的有机合成实验。
溴苯和NaOH反应的方程式为C6H5Br + NaOH → C6H5OH + NaBr。
这个反应是一个酸碱中和反应,通过溴苯中的溴原子和NaOH中的氢氧根离子发生反应,生成苯酚和溴化钠。
这个反应在有机合成和实验室中的有机合成实验中具有重要的应用价值。
NBS溴代反应后处理

NBS溴代反应后处理1.正好我也做NBS溴化。
看看你选用的溶剂,如果极性大地话,你的副产物就会溶到溶剂中,而如果用极性小的溶剂,副产物丁二酰亚胺就会析出,后处理的时候可以考虑先过滤。
副产物其实可以用水洗去,如果你的产品不溶于水,那最好了,把过量的NBS 淬灭后,用水洗即可。
另:NBS量加多了会导致二溴产物,要控制量。
用极性溶剂和非极性溶剂区别也很大,好像是一个亲电反应,一个是自由基反应,我也不是很清楚。
最好选择合适的条件,不让反应太快,太快了我感觉容易产生杂质2.来源于有机化学论坛kopsia (2007-3-19 12:24:00)做此类反应,溶剂最好干燥,脱氧;用光引发要比加热引发效果好,可以确保反应按自由基取代历程进行。
自己看文献的一点心得,仅供参考。
penny198321 (2007-3-19 12:49:00)顶!ruguo (2007-3-19 15:04:00)同意二楼,不过溶剂可以用正己烷,毒性小一点,溶解性差一点,你自己选择吧。
memory-363 (2007-3-19 15:35:00)我的谱好象显示有2溴取代物请问如何会阻止这种反应发生呢?CCL4没有经过无水处理对反应有什么影响呢?diller1309 (2007-3-20 09:52:00)我总结一下个人见解:1.溶剂最好干燥,以确保反应的引发,但微量的水或酸反而是对引发反应有利的;2.最好采取分批投料,一是防止反应过于剧烈,另外还可以减少多溴代副产物的生成。
多溴代副产物一旦生成就很不好除;3.该反应速度一般很快,所以必须严格跟踪反应进度,有时体系多反应10min都会对后续处理带来很大不便;4.一般在芳环上的取代可使用极性的DMF,DMSO等,而烯丙基型大家都知道用苯,CCl4了。
祝你成功!musiceast (2007-3-20 13:47:00)我觉得慎用四氯化碳和苯,毒性太大!同意楼上的意见!可以考虑,但是使用DMF和DMSO又带来了后处理难度加大,同时污水的量也可能增加!xiaoxinqiang (2007-3-20 18:52:00)以下为转贴:1、四氯化碳作溶剂,加催化量偶氮二异丁腈或过氧化苯甲酰作引发剂,也可以滴几滴氢溴酸,最后回流。
邻二溴苯生成格式试剂

矿产资源开发利用方案编写内容要求及审查大纲
矿产资源开发利用方案编写内容要求及《矿产资源开发利用方案》审查大纲一、概述
㈠矿区位置、隶属关系和企业性质。
如为改扩建矿山, 应说明矿山现状、
特点及存在的主要问题。
㈡编制依据
(1简述项目前期工作进展情况及与有关方面对项目的意向性协议情况。
(2 列出开发利用方案编制所依据的主要基础性资料的名称。
如经储量管理部门认定的矿区地质勘探报告、选矿试验报告、加工利用试验报告、工程地质初评资料、矿区水文资料和供水资料等。
对改、扩建矿山应有生产实际资料, 如矿山总平面现状图、矿床开拓系统图、采场现状图和主要采选设备清单等。
二、矿产品需求现状和预测
㈠该矿产在国内需求情况和市场供应情况
1、矿产品现状及加工利用趋向。
2、国内近、远期的需求量及主要销向预测。
㈡产品价格分析
1、国内矿产品价格现状。
2、矿产品价格稳定性及变化趋势。
三、矿产资源概况
㈠矿区总体概况
1、矿区总体规划情况。
2、矿区矿产资源概况。
3、该设计与矿区总体开发的关系。
㈡该设计项目的资源概况
1、矿床地质及构造特征。
2、矿床开采技术条件及水文地质条件。
苯环的亲电加成

苯环的亲电加成苯环的亲电加成是有机化学中的一个重要反应类型。
亲电加成是指亲电试剂与双键之间形成新的化学键的反应过程。
在苯环的亲电加成中,苯环上的π电子云与亲电试剂发生相互作用,生成新的化学键。
苯环是由六个碳原子组成的环状结构,每个碳原子上都有一个氢原子。
苯环的π电子云非常稳定,使得苯环具有很高的稳定性和惰性。
因此,苯环对于亲电试剂来说是不活泼的,很难与之发生反应。
然而,通过引入适当的官能团,可以改变苯环的性质,使其对亲电试剂更具反应性。
苯环的亲电加成反应可以分为两类:亲电芳香取代反应和亲电芳香加成反应。
亲电芳香取代反应是指亲电试剂取代苯环上的一个氢原子,生成新的官能团的反应。
这类反应常常需要在强酸或强碱的条件下进行。
例如,硝酸可以取代苯环上的一个氢原子,生成硝基苯。
硝基苯是一种重要的有机合成中间体,可用于制备多种化合物,如苯酚和苯二酚。
亲电芳香加成反应是指亲电试剂与苯环上的双键形成新的化学键的反应。
这类反应常常需要在较强的亲电试剂存在下进行。
例如,溴水可以与苯环上的双键反应,生成溴代苯。
溴代苯是一类重要的有机化合物,可用于制备多种有机合成中间体。
除了上述两类反应,苯环的亲电加成还可以发生在其他位置上,形成不同的产物。
例如,亲电试剂可以与苯环上的氧原子或氮原子反应,生成醚类化合物或胺类化合物。
这些化合物在有机合成中也具有重要的应用价值。
在苯环的亲电加成反应中,选择适当的亲电试剂是非常关键的。
常用的亲电试剂包括溴水、硝酸、酸性高锰酸钾等。
通过选择不同的亲电试剂,可以实现对苯环不同位置的亲电加成反应。
总结起来,苯环的亲电加成是有机化学中重要的反应类型。
通过引入适当的官能团,可以改变苯环的性质,使其对亲电试剂更具反应性。
亲电芳香取代反应和亲电芳香加成反应是苯环亲电加成的两类典型反应。
选择适当的亲电试剂,可以实现对苯环不同位置的亲电加成反应。
苯环的亲电加成反应在有机合成中具有广泛的应用价值,为合成各类有机化合物提供了重要的方法和途径。
(1) 苯环上的亲电取代反应

10
2 分子轨道理论
6 个相互交盖的 2p轨道 组合成6个分子轨道
简并轨道
苯的π分子轨道和能级
11
3 共振论对苯分子结构的解释
Kekulé结构式:
两个或多个经典结构的共振杂化体:
其共振能为:149.4 kJ· mol
环状的共轭体系导致苯分子具有相当高的稳定性。
12
5.3 单环芳烃的物理性质:
苯及其同系物一般为无色液体,相对密度小于1,但比 相对分子质量相近的烷烃和烯烃的相对密度大,不溶于水, 可溶于有机溶剂,有些有机化合物常被用来萃取芳烃。单 环芳烃具有特殊气味,有毒。 在二取代苯的三种异构体中,对位异构体的对称性最大, 所以其熔点比其它两个异构体高。所以可以通过重结晶来 分离。 烷基取代基越多,稳定性越大。稳定性的大小可从生成 热上看出,生成热越小,越稳定。
选择合成路线:
例如:
NH2
NH2 COCH3
CH3
COOH
Br
NO2
CH3
COOH NO2 NO2
CH3
COOH NO2
39
练习:用箭头表示新进入基团主要进入苯环的哪个部位
CHO
OH
NH2
NR2 CH3
NO2
Cl
NO2
C 2 H5
OH
Br
CH3 CHO
COOH
CH3
CH3
NO2
40
5.11 加特曼(Gattermann)—科赫(Koch )反应
多官能团化合物的命名
6
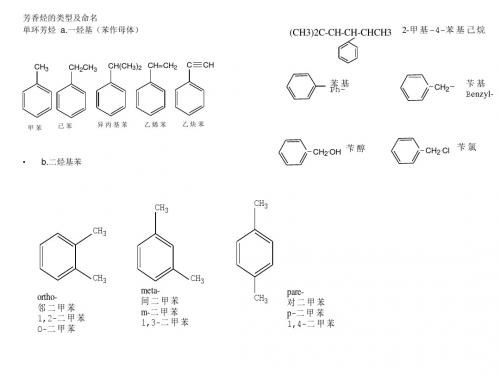
二取代苯的3个异构体:
CH3 CH3
1,2–二甲苯 邻二甲苯 o–二甲苯
CH3 CH3
1,3–二甲苯 间二甲苯 m–二甲苯
苯环上的反应

苯环取代反应1.实验室里用苯与溴反应制取溴苯,反应后将所得液体倒入水中,分层后水底褐色的液体是A 溴苯B 溶有溴的苯C 溶有溴的溴苯D 氢溴酸2.将溴水与苯混合振荡静置后分液分离,将分出的苯层置于一只试管中,加入某物质后可产生白雾,这种物质是A 亚硫酸钠固体 B 溴化铁 C 锌粉 D 乙烯3.已知有两种一氯取代物,则的一氯取代物有A 3种B 4种C 6种D 8种4.二甲苯的苯环上的一溴代物有6种同分异构体。
可用一定的方法将这6种同分异构体除去溴元素后制成3种二甲苯。
有关物质的熔点如下:溴二甲苯的熔点(℃)234 206 213.8 204 214.5 205对应二甲苯的熔点(℃)13 -54 -27 -54 -27 -54 由此推断熔点为234℃的溴二甲苯是。
5.联苯是由两个苯环通过单键连接而成。
假定二氯联苯分子中苯环间单键可自由旋转,理论上由异构形成的二氯联苯共有。
6.联三苯的结构式是--,其一氯取代物的同分异构体分别是7.邻苯联苯的结构简式为,它的一氯代物有多少种?8.某有机物的结构简式如下:-CH2-CH2-。
它与过量的浓硝酸、浓硫酸混和共热后,生成有机物的结构简式是。
9.某化学课外小组用右图装置制取溴苯。
先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
(1)写出A中反应的化学方程式(2)观察到A中的现象是。
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是,写出有关的化学方程式。
(4)C中盛放CCl4的作用是。
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。
另一种验证的方法是向试管D中加入,现象是。
10.右图是实验室制取溴苯的装置图:(1)烧瓶内发生反应的化学方程式是;(2)导管出口附近能发现的现象是;(3)导管口不能插入锥形瓶中的液面之下,其原因是;(4)采用长导管的作用是;(5)反应结束向锥形瓶中的液体中加入硝酸银溶液,可见到的现象是。
苯及苯环上的亲电取代反应
五、定位规则在有机合成上的应用
CH3 NO2
例一:由
合成
CH3 CH3Cl AlCl3 con H2SO4 100 。 C
CH3 混酸 SO3H
CH3 NO2
SO3H
CH3 dil H2SO4 NO2
例二: 由 O2N
路线一:
O2N CH3 混酸 O2N
CH3 合成 O2N
COOH NO2
CH3 NO2
Cl2 h
CH2CH3
Br2 h
CHCH3 + Cl 56%
CH2CH2Cl 44%
CHCH3 (用NBS / CCl4亦可) Br 100%
溴代比氯代的选择性更高
注意α-H的卤代反应条件与苯环上的卤代反应条件 是不相同的,不可混淆。
四、取代苯的亲电取代反应的活性和定位规律
1、取代基定位及活化、钝化作用 *** 第一类定位基
HOOC NO2 COOH O2N
三、非苯系芳香烃
C H3 C H2C H2C C H 3 C l C HC H 3 C H3
AlCl 3
C H3 C H3
分子内烷基化
C H2C H2C H2 C C l
=
O
AlCl 3
分子内酰基化
=
O
不同点
a. 烷基化反应难停留在一取代阶段,而 酰基化反应却可以停留在一取代阶段。
C H3
CH3Cl AlCl 3 CH3Cl AlCl 3
在极性溶剂中,萘的酰基化产物以β-异构体为主;在非 极性溶剂中以α-异构体为主。
CH2COOH + ClCH2COOH FeCl3 KBr 。C 200-218
工业上用于制备α-萘乙酸(一种植物生长激素)
苯的卤代反应现象

苯的卤代反应现象
苯是一种典型的芳香烃化合物,由于苯环上存在sp2杂化碳原子和大量的空余π电子,使其具有很高的稳定性和芳香性。
苯的化学性质十分活泼,具有多种反应,其中的卤代反应因为其阳离子的中间体相对稳定,是苯的重要反应之一。
苯的卤代反应通常指苯和卤素(如氯、溴、碘等)在存在卤代烷(如三氯甲烷、四氯化碳等)的催化下发生的取代反应。
反应机理如下:
1.氯化鉴定:在试管中加入少量碘化钾,再加入测试化合物,若有氯离子存在,试管中的溶液会变成淡黄色或黄色。
2.溴化鉴定:在试管中加入一滴丙酮,再加入少量溴水,再加入测试化合物,若有溴离子存在,混合物会变为橙红色或棕红色。
3.碘化鉴定:在试管中加入少量碘化钾和少量氢氧化钠,再加入测试化合物,若有碘离子存在,试管中的溶液会变为紫色或黑色。
4.氯代苯生成:苯和氯气在四氯化碳存在下于室温下反应生成氯代苯,反应需要较长的时间,常常需要加热才能使反应快速进行。
5.溴代苯生成:苯和溴在在四氯化碳存在下于室温下反应生成溴代苯,反应速率比氯代苯的反应速率要快,但溴代苯不稳定,易发生不同取代基的发生互换反应。
6.碘代苯生成:苯和碘在四氯化碳存在下于室温下反应生成碘代苯,反应速率非常缓慢,因此需加热反应。
苯的卤代反应具有重要的科学研究价值和实际应用价值,可以用于制
备各种卤代苯衍生物,如氯代苯、溴代苯和碘代苯等。
同时,苯的卤
代反应也是有害的,因为卤代苯衍生物常常是毒性较强的环境污染物,可对人体和环境造成危害。
因此,在工业生产和化学实验中应当严格
控制卤代反应的条件和反应产物的排放。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
苯环的溴代反应
一、导言
苯环的溴代反应是一类典型的有机反应,早在1877年就被Fischer发现。
近些年,由于它的合成意义和重要性,苯环的溴代反应变得越来越受到研究人员的重视。
本文将介绍苯环的溴代反应的反应原理、机理、条件、反应效率以及它与其他有机反应的对比。
二、反应原理
苯环的溴代反应原理是一种Electrophilic Aromatic Substitution (EAS)反应,它是一种高效、官能化程度高的有机反应,可以将活性官能团取代芳环碳上的其他官能团,从而形成新的有机分子。
其反应原理是,活性官能团(如溴或氯)与芳环碳上的质子发生反应,形成芳环电荷中心(又称“芳环质点”),随后,芳环电荷中心受到电荷驱动力的作用,寻找其它的官能团,进而与其形成反应,最终实现官能团取代,从而产生新的有机分子。
三、反应机理
苯环的溴代反应的反应机理可以分为三个步骤:
1. 慢反应步骤:活性官能团(如溴或氯)与芳环碳上的质子发生反应,形成芳环电荷中心,也可称为“芳环质点”。
2. 快反应步骤:芳环电荷中心受到电荷驱动力的作用,非特异性地寻找最邻近的可以换下来的官能团,而后经历转移反应,最终形成新的有机分子。
3. 进一步反应步骤:有些官能团会受到活性官能团的异构化反
应,形成不同键型,最终形成新的有机分子。
四、反应条件
1. 溴代反应的反应条件需要比较高的溴浓度,一般情况下,溴水溶液的浓度在2%~5%范围之内;
2. 反应温度一般在室温到120℃左右,通常控制在60℃以下,反应时间以每分钟几十秒为宜;
3. 如果加入一定量的水强化剂(如KI、NaOH等),可以提高反应速度;
4. 部分溴代反应可以在一定程度上受到催化剂的作用,有些催化剂可以有效地提高反应速率。
五、反应效率
苯环的溴代反应效率是极高的。
实验数据表明,苯环的溴代反应可以达到99.8%以上的收率。
如果合适的溶剂和反应条件被采用,收率可以达到98%以上。
而且,由于它的高选择性,只会在有活性官能团的化合物上发生反应,因此,收率较高,反应特性稳定。
