湖北省四校(襄州一中、枣阳一中、宜城一中、曾都一中)2018-2019学年高二下学期期中联考数学(理)试题
湖北省襄阳市四校(襄州一中、枣阳一中、宜城一中)2017-2018学年高二下学期期中联考数学(理)答案

2 m 4
6分
m 2或m 4 当p为假,q为真时 m -2 m 2 综上可知,m的取值范围为(-,-2] (2,4) y12 4 x1
2 y2 4 x2
8分 10分
18、 (1)
2 y12 y2 4 x1 x2
k
3 ,得 CO 1 .
............8 分
建立如图所示的空间直角坐标系 O xyz ,则 P (0, 0, 3) , D (0,1, 0) , C ( 3, 0, 0) ,
B( 3, 1, 0) , BC (0,1, 0) , PC ( 3, 0, 3) , CD ( 3,1, 0) ,
CO O ,∴ AD 平面 POC ,............3 分
∵ PC 平面 POC ,∴ AD PC .
B 又 AD / / BC ,
X
所以 BC PC ...........5 分 (Ⅱ)由面 PAD 面 ABCD , PO AD ,∴ PO 平面 ABCD , 可得 OP , OD , OC 两两垂直,又直线 PC 与平面 ABCD 所成角为 45 , 即 PCO 45 , 由 AD 2 ,知 PO
y1 y2 4 2 x1 x2 y1 y2
.........4 分
AB 所在的直线方程为 2 x y 1 0 ......6 分
2 x y 1 0 2 (2) 得 y 2y 2 0 2 y 4 x y y 2 由韦达定理得 1 2 y1 y2 2
曾都一中 襄州一中
枣阳一中 宜城一中
2017—2018 学年下学期高二期中考试 数学试题(理科)参考答案
湖北省四校襄州一中枣阳一中宜城一中曾都一中2018-2019学年高二物理上学期期中联考试卷【经典版】.doc

22湖北省四校(襄州一中、枣阳一中、宜城一中、曾都一中)2018-2019学年高二物理上学期期中联考试题第 I 卷(选择题,共 50 分)一、选择题(本题共 10 小题,每小题 5 分,共 50 分,其中第 1-6 小题为单选,第7-10 为多选。
全部选对得 5 分,选不全得 3 分,选错或不选得 0 分)1.下列哪些说法正确()A.最小的电荷量最早由美国物理学家密立根通过实验测出来的,一般情况,其值可以取e = 1.60 ⨯10-18 C 。
B.法拉第不仅提出“场”的概念,而且用电场线直观地描绘了“场”的清晰图景。
C.电流能使磁针偏转是安培首先发现的。
D.奥斯特认为,物质微粒内的分子电流相当于一个个的小磁体。
2.如图在边长为l 的正方形的每个顶点都放置一个电荷。
a、c 两点电荷的电荷量为+q ,b、d 两点的电荷量为-q 。
如果保持它们的位置不变,每个电荷受到的其它三个电荷的静电力的合力是()kq2A.2l 2kq2 ⎛ 1 ⎫B.l 2kq2 ⎛ 1 ⎫C. -⎪l 2 ⎝ 2 ⎭D. +⎪l 2 ⎝ 2 ⎭2kq23.如图所示,匀强电场的电场线与AC 平行,把10-8 C 的负电荷从A 点移到B 点,电场力做功为6 ⨯10-8 J ,AB 长 6cm,AB 与AC 成60︒角。
若B 处电势为-1V ,则A 处电势和电子在A 点的电势能分别为()A.- 7V ,-7eV C.- 5V ,-5eV B.- 7V ,7eV D.- 5V ,5eV4.把标有“220 V,100 W”的A灯和“220 V,200 W”的B灯串联起来,接入 220 V 的电路中,不计导线电阻,则下列判断中正确的是( )A.两灯的电阻之比R A∶R B=1∶2 B.两灯实际消耗的功率之比P A∶P B=1∶2C.两灯的实际电压之比 U A∶U B=2∶1D.在相同时间内,两灯实际发热之比 Q A∶Q B=1∶25.如图为某电动自行车的铭牌,已知该车在额定电压下工作时,电动机的效率为75%。
湖北省四校襄州一中枣阳一中宜城一中曾都一中2018_2019学年高二地理上学期期中联考试题2-含答案

做题破万卷,下笔如有神湖北省四校(襄州一中、枣阳一中、宜城一中、曾都一中)2018-2019学年高二地理上学期期中联考试题注意事项:1、答卷前,考生务必将姓名、准考证号等在答题卷上填写清楚。
2、选择题答案用2B 铅笔在答题卷上把对应题目的答案标号涂黑,非选择题用0.5mm 的黑色签字笔在每题对应的答题区域内做答,答在试题卷上无效。
第I卷(选择题)一、选择题(本题有25 小题,每小题2 分,共50 分。
每小题只有1 个正确选项,不选、多选、错选均不得分。
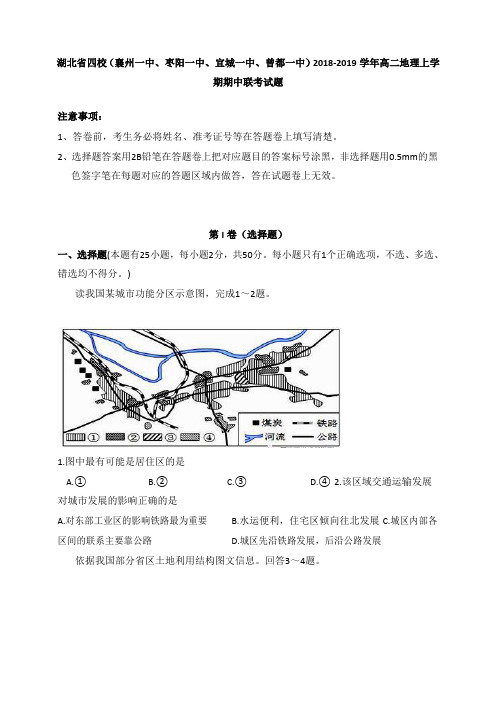
)读我国某城市功能分区示意图,完成1~2 题。
1.图中最有可能是居住区的是A.①B.②C.③D.④2.该区域交通运输发展对城市发展的影响正确的是A.对东部工业区的影响铁路最为重要B.水运便利,住宅区倾向往北发展C.城区内部各区间的联系主要靠公路 D.城区先沿铁路发展,后沿公路发展依据我国部分省区土地利用结构图文信息。
回答3~4 题。
3.甲和土地利用类型Ⅰ、Ⅱ分别为A.藏,牧草地、居民点及工矿用地B.滇,交通运输用地、居民点及工矿用地C.黑,园地、耕地 D.新,耕地、牧草地4.内蒙古A.水域面积不大,湖泊类型多样,既有风成湖,也有冰蚀湖B.地势平坦,宜大幅度提高农业耕地的比例,大力推广机械化C.受降水和气温影响,既有温带落叶阔叶林分布,也有针叶林分布D.其他及未利用地面积比重少,后备土地资源不足棕油是一种植物油,提取自油棕子,是续大豆油之后的第二大食用油。
棕榈油是从油棕树上的棕果中榨取出来的,棕榈树原产西非,18 世纪末传到世界各地,在部分地区得到广泛种植。
廉价的棕榈油及其衍生产品为很多公司带来了丰厚利润。
某地为扩大油棕种植面积,放火焚烧雨林,下图为该地油棕种植园景观。
据此完成5~7 题。
5.该地区最可能位于A.夏威夷岛B.塔斯马尼亚岛C.纽芬兰岛D.爪哇岛6.生产廉价的棕榈油及其衍生产品为很多公司带来了丰厚利润主要原因是A.成本低,销售量大B.生产规模大,产量高C.政策扶持,地价低D.用途广,资金投入大7.该地区实施可持续发展的主要措施是A.扩大油棕种植规模B.改良传统加工工艺C.全面恢复原生植被D.合理集约利用土地高原夏菜又称冷凉蔬菜,是指夏季在气候干冷地区生长的蔬菜。
湖北省四校襄州一中枣阳一中宜城一中曾都一中2018-2019学年高二地理上学期期中联考试卷【经典版】.doc
湖北省四校(襄州一中、枣阳一中、宜城一中、曾都一中)2018-2019学年高二地理上学期期中联考试题注意事项:1、答卷前,考生务必将姓名、准考证号等在答题卷上填写清楚。
2、选择题答案用2B 铅笔在答题卷上把对应题目的答案标号涂黑,非选择题用0.5mm 的黑色签字笔在每题对应的答题区域内做答,答在试题卷上无效。
第I卷(选择题)一、选择题(本题有25 小题,每小题2分,共50 分。
每小题只有1个正确选项,不选、多选、错选均不得分。
)读我国某城市功能分区示意图,完成1~2 题。
1.图中最有可能是居住区的是A.①B.②C.③D.④2.该区域交通运输发展对城市发展的影响正确的是A.对东部工业区的影响铁路最为重要B.水运便利,住宅区倾向往北发展C.城区内部各区间的联系主要靠公路D.城区先沿铁路发展,后沿公路发展依据我国部分省区土地利用结构图文信息。
回答3~4 题。
3.甲和土地利用类型Ⅰ、Ⅱ分别为A.藏,牧草地、居民点及工矿用地B.滇,交通运输用地、居民点及工矿用地C.黑,园地、耕地D.新,耕地、牧草地4.内蒙古A.水域面积不大,湖泊类型多样,既有风成湖,也有冰蚀湖B.地势平坦,宜大幅度提高农业耕地的比例,大力推广机械化C.受降水和气温影响,既有温带落叶阔叶林分布,也有针叶林分布D.其他及未利用地面积比重少,后备土地资源不足棕油是一种植物油,提取自油棕子,是续大豆油之后的第二大食用油。
棕榈油是从油棕树上的棕果中榨取出来的,棕榈树原产西非,18 世纪末传到世界各地,在部分地区得到广泛种植。
廉价的棕榈油及其衍生产品为很多公司带来了丰厚利润。
某地为扩大油棕种植面积,放火焚烧雨林,下图为该地油棕种植园景观。
据此完成5~7 题。
5.该地区最可能位于A.夏威夷岛B.塔斯马尼亚岛C.纽芬兰岛D.爪哇岛6.生产廉价的棕榈油及其衍生产品为很多公司带来了丰厚利润主要原因是A.成本低,销售量大B.生产规模大,产量高C.政策扶持,地价低D.用途广,资金投入大7.该地区实施可持续发展的主要措施是A.扩大油棕种植规模B.改良传统加工工艺C.全面恢复原生植被D.合理集约利用土地高原夏菜又称冷凉蔬菜,是指夏季在气候干冷地区生长的蔬菜。
湖北四校(曾都一中枣阳一中襄州一中宜城一中)2020学年下学期高二期中考试数学试题含答案

---------------------4 分
展开式中共有 8 项,其中二项式系数最大的项为第 4,第 5 项
79
所以 T4 2 3C73x 2 280x1 , T5
2
7 12
4
C
4 7
x
2
5
560 x 2 -----------6 分
(2) 展开式中系数最大的项必须在正的系数项中产生,即在 r 0,2,4,6 时,
-----------------------------------------------2 分
四校联考数学试题参考答案 第 1页,共 4 页
又 x 2 7 展开式的通项为: x
Tr1 C7r
x 7r 2 r x
2
C x r
r
7r r 2
7
73r
2 r C7r x 2
f xmax maxf 2, f 3
因为 f (2) 4 8 f (4) f (3) ln 2 ln 4
f
xmax
f
2
4 ln 2
所以
f
(x)
的值域为
2e,
4 ln 2
-----------------------------12 分
19.(1) 由题意知 Cn3 Cn4 , n 7
(2)若函数 f x 有两个零点,求实数 a 的取值范围.
21. (本题满分 12 分)
已知各项均正的数列{an} 的前 n 项和为 Sn ,且 a1 1,6Sn an2 3an 2 n 2,n N
(1)求数列{an} 的通项公式;
(2)若数列 bn满足 bn
Sn nc
,是否存在非零实数 c 使得 bn为等差数列?
湖北省四校(襄州一中、枣阳一中、宜城一中、曾都一中)2018-2019学年高二上学期期中联考语文试题(pdf版)

2018—2019学年上学期高二期中考试 语 文 试 题 时间:150分钟命题学校: 枣阳一中 曾都一中 宜城一中 分值:150分 命题老师:一、现代文阅读(36分)(一)论述类文本阅读(本题共3小题,9分)阅读下面的文字,完成1—3题。
成为具有中国情怀、全球视野的人才,不仅能肩负起建设祖国的使命,而且能承担起为世界、为人类作贡献的责任。
当今时代,知识更新的节奏不断加快。
有学者曾根据放射性元素衰变的原理,提出“知识半衰期”说法:一个专业人士的知识如果不更新,在“半衰期”后,基础知识仍可用,但其他一半新知识却已落伍。
据测算,1950年前的知识半衰期为50年,21世纪知识的半衰期平均为3.2年,IT 高级工程师的仅为1.8年。
如今的学习,没有完成时、只有进行时,还需保持加速度。
增长知识见识,可以说是一辈子的功夫。
另一方面,教育的普及、出版的繁荣、互联网的兴盛,使得知识获取的成本大大下降。
“学好数理化”不再成为求知边界,通识教育正不断打开知识视野。
因此,若以知识宽度论,今天学子可以完胜过去。
然而,广度之外,同样需要有深度。
书不多,反能精读以致“韦编三绝”;诱惑少,所以心无旁骛不断钻研。
将有限的注意力资源用到最有效的地方,才会有“铁杵磨成针”的成就。
因此,既要重视知识的宽度,也要重视学习的深度,在努力扩大知识半径的同时,避免陷入平面化的“知识焦虑”,落入浅尝辄止的学习路径。
既有知识的宽度,又有知识的深度,才能在积累知识的基础上形成卓越的见识。
面对全球化竞争,教育者需要引导学生,摆脱简单的记诵,在慎思明辨上下功夫;关注知识的积累,更注重思维的锤炼。
换句话说,一种好的教育,既教会学生如何数清掉落的苹果,更激发学生思考为何苹果是掉下来而非飞上天。
知识传承很重要,见识的培育更关键。
知是获取信息,是第一层级;识是具备见解,是更高层级。
由知而识,方为智慧。
一方面,正所谓“师父领进门,修行在个人”,注重把所学知识内化于心,形成自己的见解,才算得上学懂弄通;而另一方面,具备粗中取精的信息筛选力、去伪存真的知识鉴别力、把握时代大势的洞察力,方能在信息爆炸的时代从容不迫。
【精编】湖北省四校襄州一中、枣阳一中、宜城一中、曾都一中2018-2019学年高一化学下学期期中联考试卷.doc
湖北省四校(襄州一中、枣阳一中、宜城一中、曾都一中)2018-2019学年高一化学下学期期中联考试题注意事项:1.本试卷分为选择题和非选择题两部分。
满分100分,考试时间90分钟。
2.答卷前请将答题卷密封线内有关项目填写清楚。
3.可能用到的相对原子质量:H-1 Li -7 C-12 N-14 O-16 Na-23 Mg-24 Al-27K-39 Rb—85 Cs-133 Pb—207 Rn—222第Ⅰ卷一、选择题:(每小题只有一个正确选项,每小题3分,共48分)1.某些建筑材料含有放射性元素氡(),会对人体产生一定危害。
研究表明氡的α射线会致癌,WHO认定的19种致癌因素中,氡为其中之一,仅次于吸烟。
该原子的中子数与质子数之和及之差分别是()A.136,86 B.50,136 C.222,86 D.222 ,502.下列有关化学用语表达正确的是()A.氮气的电子式: N∶∶∶N B.二氧化碳的分子式:O=C=OC.甲烷的比例模型:D.次氯酸的结构式:H—Cl—O3.下列说法中,正确的是()A.在周期表中,副族元素的族序数一定不等于该族元素的最外层电子数B.卤族单质随原子序数的增大,其熔沸点逐渐升高C.化学反应的过程一定有能量变化,同样有能量变化的过程一定发生了化学反应D.金属元素易失去电子而非金属元素易得到电子4.对于反应2HI (g )H 2(g )+I 2(g,紫色),下列叙述能够说明已达平衡状态的是( ) A .混合气体的质量不再变化B .温度和体积一定时,容器内压强不再变化C .1molH -H 键断裂的同时有2molH -I 键断裂D .各物质的物质的量浓度之比为2∶1∶1 5.下列说法不正确的是( )A .含有离子键的化合物一定是离子化合物B .在共价化合物中一定含有共价键C .只含有共价键的物质一定是共价化合物D .双原子单质分子中的共价健一定是非极性键6.实验室用锌粒和稀硫酸制取H 2,下列措施可使反应速率加快的是( )A .改用98%的浓硫酸B .增加锌粒的量C .用锌块代替锌粒D .加入少许硫酸铜溶液7. 纳米是长度单位,1纳米等于1×10-9米,物质的颗粒达到纳米级时,具有特殊的性质。
湖北省襄阳市(襄州一中、枣阳一中、宜城一中、曾都一中)四校联考高二化学下学期期中试卷(含解析)
2015-2016学年湖北省襄阳市(襄州一中、枣阳一中、宜城一中、曾都一中)四校联考高二(下)期中化学试卷(选修3)一、选择题(本题包括16小题,每小题3分,共48分.每小题只有一个选项符合题意)1.在化学试卷的开始处有“可能用到的相对原子质量”一项,如H:1 C:12 Cl:35.5 S:32等.请问对这些数值准确的说法应该是()A.某种核素的相对原子质量的近似值B.某种核素的相对原子质量C.某种元素的相对原子质量的近似值D.某种元素的相对原子质量2.下列现象与氢键无关的是()①NH3的熔、沸点比VA族其他元素氢化物的熔、沸点高②小分子的醇、羧酸可以和水以任意比互溶③邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的熔、沸点低④水分子高温下也很稳定⑤水分子较硫化氢分子稳定.A.①②③④ B.④⑤ C.③④⑤D.①②③3.下面有关晶体的叙述中,正确的是()A.金刚石为网状结构,由共价键形成的碳原子环中,最小的环上有4个碳原子B.12 g石墨中含有4N A个C﹣C键C.氯化铯晶体中,每个Cs+周围紧邻8个Cl﹣D.干冰晶体中,每个CO2分子周围紧邻6个CO2分子4.下列关于乙烯(CH2=CH2)的说法不正确的()A.乙烯分子中2个碳原子都是sp2杂化B.乙烯分子存在非极性键C.乙烯分子中4个H原子在同一平面上D.乙烯分子有6个σ键5.下列说法或有关化学用语的表达不正确的是()A.在基态多电子原子中,p轨道电子能量不一定高于s轨道电子能量B.核外电子排布由1s22s22p63s1→1s22s22p6的变化需要吸收能量C.某元素基态原子的电子排布图D.Ca2+离子基态电子排布式为1s22s22p63s23p66.若不断地升高温度,实现“液氨→氨气→氮气和氢气→氮原子和氢原子“的变化.在变化的各阶段被破坏的粒子间主要的相互作用是()A.氢键;分子间作用力;非极性键B.氢键;极性键;非极性键C.氢键;极性键;分子间作用力D.分子间作用力;氢键;非极性键7.下列说法不正确的是()①NaCl晶体中与每个Na+距离相等且最近的Na+共有12个②含有共价键的晶体一定具有高的熔、沸点及硬度③s﹣s σ键与s﹣p σ键的电子云形状相同④含有π键的化合物与只含σ键的化合物的化学性质不同⑤中心原子采取sp3杂化的分子,其立体构形不一定是正四面体⑥配位键在形成时,是由成键双方各提供一个电子形成共用电子对.A.①②⑤B.①④⑥C.②③⑤D.②③⑥8.有关金属晶体的说法不正确的是()A.金属Cu的晶体的配位数为12B.金属键是金属阳离子与自由电子间的相互作用C.金属的延展性可以用电子气理论解释D.金属Mg、Zn、Ti都是六方最密堆积,空间利用率是68%9.下列有关说法正确的是()A.水合铜离子的模型如图1所示,1个水合铜离子中有4个配位键B.CaF2晶体的晶胞如图2所示,每个CaF2晶胞平均占有4个Ca2+,4个F﹣C.H原子的电子云图如图3所示,H原子核外大多数电子在原子核附近运动D.原子堆积模型如图4,可表示Mg原子的堆积方式10.下列分子是极性分子的是()A.PCl3B.SO3C.BF3D.CS211.现有四种元素的基态原子的电子排布式如下:①[Ne]3s23p4;②1s22s22p63s23p3;③1s22s22p5.则下列有关比较中不正确的是()A.最高正化合价:③>②>① B.原子半径:②>①>③C.电负性:③>①>②D.第一电离能:③>②>①12.下面的排序正确的是()A.晶体熔点由低到高:CCl4<CBr4<CI4<CF4B.硬度由大到小:金刚石>晶体硅>碳化硅C.熔点由高到低:Na>Mg>AlD.晶格能由大到小:NaF>NaCl>NaBr>NaI13.向盛有硫酸锌水溶液的试管里加入氨水,首先形成难溶物,继续滴加氨水,难溶物溶解,得到透明溶液.下列对此现象说法不正确的是()A.反应后溶液中不存在任何沉淀,所以反应前后Zn2+的浓度不变B.沉淀溶解后,将生成配合离子[Zn(NH3)4]2+C.用硝酸锌溶液代替硫酸锌溶液进行实验,能观察到同样的现象D.在[Zn(NH3)4]2+离子中,NH3给出孤对电子,Zn2+提供空轨道14.下列对一些实验事实及其理论解释都正确的是()选项实验事实理论解释A N原子的第一电离能小于O原子同周期元素原子的电离能随原子序数增大而增大B CO2为直线形分子CO2分子中C为sp杂化,键角为180°C 金刚石的熔点高于石墨金刚石是原子晶体,石墨是分子晶体D HF的沸点低于HCl HF的相对分子质量小于HClA.A B.B C.C D.D15.有下列离子晶体立体结构示意图:若以M代表阳离子,以R代表阴离子,则各离子晶体的组成表达式完全正确的组合是()A.①MR②MR2③MR3④MR4B.①MR②MR2③MR2④MRC.①MR2②MR2③MR2④MR D.①MR②MR③MR2④MR216.已知NaCl的摩尔质量为Mg•mol﹣1,晶体的密度为d g•cm﹣3,如图中Na+与最邻近的Cl ﹣的核间距离为x cm,那么阿伏加德罗常数的值可表示为()A.2Mx3d B.C.D.二、非选择题:(共52分)17.下列物质在一定条件下形成晶体:①水晶②金刚石③碳化硅④白磷⑤晶体氩⑥氢氧化钠⑦铝⑧氧化钙⑨过氧化钠⑩碳化钙⑪冰醋酸⑫干冰⑬过氧化氢.请用序号回答:(1)属于原子晶体的化合物.(2)由极性分子构成的晶体是,含有非极性键的离子晶体是.18.下表为长式周期表的一部分,其中的编号代表对应的元素.请回答下列问题:(1)表中属于d区元素的名称是.(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子的立体构型为;③和⑦形成的一种常见溶剂的立体构型为.(3)某元素原子的外围电子排布式为ns n np n+1,该元素与元素①形成的最简单分子属于分子(填“极性”或“非极性”).(4)元素④的第一电离能(填“>”“=”或“<”,下同)元素⑤的第一电离能;元素⑥的电负性元素⑦的电负性.(5)上表中元素②与元素⑤的单质及其化合物有相似的性质.请写出元素②的最高价氧化物的水化物与NaOH溶液反应的离子方程式:.19.水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.(1)水分子中氧原子在基态时核外电子排布式为;(2)与H2O分子中电子数相等的5核的分子和离子的化学式分别是.(3)水也是一种良好的溶剂,氨气极易溶于水的原因是:.(4)冰的晶体类型与钠、碘、金刚石、干冰、氯化钠晶体中的一种晶胞相似.如图是冰晶胞的一部分,其中小黑点表示水分子,请将剩余的水分子用小黑点补充完整.20.已知 X、Y、Z、M、R五种元素中,原子序数X<Y<Z<M<R,其结构或性质信息如下表.请根据信息回答有关问题:元素结构或性质信息X 原子的L层上s电子数等于p电子数.Y 原子核外的L层有3个未成对电子.Z 在元素周期表的各元素中电负性仅小于氟.M 单质常温、常压下是气体,原子的M层上有1个未成对的p电子.R 第四周期过渡元素,其价电子层各能级处于半充满状态(1)元素M的原子核外共有种不同运动状态的电子,有种不同能级的电子.(2)X、Y、Z三种元素的第一电离能较高的是(写元素符号),原因是.(3)R的一种配合物的化学式为RCl3•6H2O.已知0.01molRCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀.此配合物最可能是.A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2•H2O C.[R(H2O)4Cl2]Cl•2H2O D.[R(H2O)3Cl3]•3H2O.21.能源、材料和信息是现代社会的三大“支柱”.(1)目前,利用金属或合金储氢的研究已取得很大进展,如图是一种镍基合金储氢后的晶胞结构图.①Ni在元素周期表中的位置是,原子序数比其大1的原子外围电子排布式是.②该合金储氢后,含1mol La的合金可吸收H2的物质的量为 mol.(2)南师大结构化学实验室合成了一种多功能材料﹣﹣对硝基苯酚水合物(化学式为C6H5NO3•1.5H2O).实验表明,加热至94℃时该晶体能失去结晶水,由黄色变成鲜亮的红色,在空气中温度降低又变为黄色,具有可逆热色性;同时实验还表明它具有使激光倍频的二阶非线性光学性质.硝基苯酚水合物晶体中四种基本元素的电负性由大到小的顺序是.(3)科学家把NaNO3和Na2O在一定条件下反应得到一种白色晶体,已知其中阴离子与SO42﹣互为等电子体,该阴离子的化学式是,其中心原子的杂化方式是.22.A、B、C、D、E、F为前四周期元素且原子序数依次增大,其中A含有3个能级,且每个能级所含的电子数相同;C的最外层有6个运动状态不同的电子;D是短周期元素中电负性最小的元素;E的最高价氧化物对应的水化物酸性最强;F除最外层原子轨道处于半充满状态,其余能层均充满电子.G元素与D元素同主族,且相差3个周期.(1)元素E的最高价含氧酸的酸性强于元素B,试用分子结构的理论解释原因:.(2)F的晶体的堆积方式为.(3)D与E、G与E形成的晶体类型相同,但晶体的配位数不同,其原因是.(4)已知DE晶体的晶胞如图所示.若将DE晶胞中的所有E离子去掉,并将D离子全部换为A原子,再在其中的4个“小立方体”中心各放置一个A原子,且这4个“小立方体”不相邻.位于“小立方体”中的A原子与最近的4个A原子以单键相连,由此表示A的一种晶体的晶胞(已知A﹣A键的键长为a cm,N A表示阿伏加德罗常数),则该晶胞中含有个A原子,该晶体的密度是g/cm3.2015-2016学年湖北省襄阳市(襄州一中、枣阳一中、宜城一中、曾都一中)四校联考高二(下)期中化学试卷(选修3)参考答案与试题解析一、选择题(本题包括16小题,每小题3分,共48分.每小题只有一个选项符合题意)1.在化学试卷的开始处有“可能用到的相对原子质量”一项,如H:1 C:12 Cl:35.5 S:32等.请问对这些数值准确的说法应该是()A.某种核素的相对原子质量的近似值B.某种核素的相对原子质量C.某种元素的相对原子质量的近似值D.某种元素的相对原子质量【考点】相对原子质量及其计算.【分析】某种元素的相对原子质量,是按各种天然同位素原子所占的一定百分比算出来的平均值.【解答】解:在正规化学试卷的开始处总有“可能用到的相对原子质量”,是元素的相对原子质量的近似值,按各种天然同位素原子所占的一定百分比算出来的平均值的近似值,故选C.2.下列现象与氢键无关的是()①NH3的熔、沸点比VA族其他元素氢化物的熔、沸点高②小分子的醇、羧酸可以和水以任意比互溶③邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的熔、沸点低④水分子高温下也很稳定⑤水分子较硫化氢分子稳定.A.①②③④ B.④⑤ C.③④⑤D.①②③【考点】氢键的存在对物质性质的影响.【分析】N、O、F元素的电负性较强,对应的氢化物可形成氢键,氢键是一种较强的分子间作用力,是由电负性强的原子(如F,O,N)对氢原子的吸引力产生的,能够影响物质的熔点、沸点、密度等,以此解答该题.【解答】解:①氨气分子之间能形成氢键,熔、沸点高,所以NH3的熔、沸点比VA族其他元素氢化物的熔、沸点高,故正确;②小分子的醇、羧酸含有﹣OH,与水分子之间形成氢键,可以和水以任意比互溶,故正确;③邻羟基苯甲酸主要存在分子内氢键,对羟基苯甲酸主要存在分子间氢键,所以邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的熔、沸点低,故正确;④水分子中O﹣H的键能很大,所以水分子在高温下也很稳定,与氢键无关,故错误;⑤非金属性越强,其氢化物越稳定,所以水分子较硫化氢分子稳定,与氢键无关,故错误;故选B.3.下面有关晶体的叙述中,正确的是()A.金刚石为网状结构,由共价键形成的碳原子环中,最小的环上有4个碳原子B.12 g石墨中含有4N A个C﹣C键C.氯化铯晶体中,每个Cs+周围紧邻8个Cl﹣D.干冰晶体中,每个CO2分子周围紧邻6个CO2分子【考点】原子晶体;离子晶体.【分析】A.金刚石的结构中,每个碳原子能形成4个共价键,根据教材图片确定由共价键形成的最小碳环上的碳原子个数;B.在石墨晶体中1个C原子对应3×0.5=1.5个C﹣C键.C.氯化铯晶体晶胞结构如图:,Cs+位于该晶胞的体心;而Cl﹣位于该晶胞的顶点;D.采用沿X、Y、Z三轴切割的方法判断二氧化碳分子的个数.【解答】解:A.根据教材图片知,金刚石结构中,每个碳原子能形成4个共价键,由共价键形成的最小碳环上有6个碳原子,故A错误;B.在石墨晶体中1个C原子对应1.5个C﹣C键,12 g石墨中含有C﹣C键的个数为1.5N A,故B错误.C.根据晶胞图片知,在CsCl晶体中每个Cs+周围都紧邻8个Cl﹣,每个Cs+等距离紧邻的有6个Cs+,故C正确;D.根据教材图片,采用沿X、Y、Z三轴切割的方法判断二氧化碳分子的个数为12,所以在CO2晶体中,与每个CO2分子周围紧邻的有12个CO2分子;故D错误,故选C.4.下列关于乙烯(CH2=CH2)的说法不正确的()A.乙烯分子中2个碳原子都是sp2杂化B.乙烯分子存在非极性键C.乙烯分子中4个H原子在同一平面上D.乙烯分子有6个σ键【考点】原子轨道杂化方式及杂化类型判断;化学键.【分析】A.根据价层电子对互斥理论确定杂化方式;B.同种非金属元素之间存在非极性共价键,不同非金属元素之间存在极性共价键;C.乙烯分子的空间结构为平面方形;D.共价单键是σ 键,共价双键中一个是σ 键一个是π键.【解答】解:A.乙烯分子中2个碳原子的价层电子对数为3,所以碳碳双键两端的碳原子采用sp2杂化,故A正确;B.同种非金属元素之间存在非极性共价键,不同非金属元素之间存在极性共价键,所以分子存在非极性键,故B正确;C.乙烯分子的空间结构为平面方形,所以4个H原子在同一平面上,故C正确;D.共价单键是σ 键,共价双键中一个是σ 键一个是π键,所以乙烯中有5个σ 键,1个π 键,故D错误;故选D.5.下列说法或有关化学用语的表达不正确的是()A.在基态多电子原子中,p轨道电子能量不一定高于s轨道电子能量B.核外电子排布由1s22s22p63s1→1s22s22p6的变化需要吸收能量C.某元素基态原子的电子排布图D.Ca2+离子基态电子排布式为1s22s22p63s23p6【考点】原子核外电子排布.【分析】A.没有指明p轨道电子和s轨道电子是否处于同一能层;B.3s能级电子获得能量脱离原子核的束缚;C.违背洪特规则,2p轨道2个单电子应自旋方向相同;D.Ca原子失去4s能级的电子形成Ca2+离子.【解答】解:A.同一能层中的p轨道电子的能量一定比s轨道电子能量高,高能层中s轨道电子能量则比低能层中p轨道电子能量高,故A错误;B.3s能级的电子获得能量后脱离原子核的束缚而失去形成1s22s22p6,故B正确;C.某元素基态原子的电子排布图,违背洪特规则,2p轨道2个单电子应自旋方向相同,基态原子核外电子排布图应为,故C错误;D.Ca原子失去4s能级的电子形成Ca2+离子,Ca2+离子基态电子排布式为1s22s22p63s23p6,故D正确.故选:C.6.若不断地升高温度,实现“液氨→氨气→氮气和氢气→氮原子和氢原子“的变化.在变化的各阶段被破坏的粒子间主要的相互作用是()A.氢键;分子间作用力;非极性键B.氢键;极性键;非极性键C.氢键;极性键;分子间作用力D.分子间作用力;氢键;非极性键【考点】含有氢键的物质.【分析】根据液氨→氨气的过程为物理变化,破坏的是分子间作用力,主要是氢键,氨气→氮气和氢气→氮原子和氢原子是化学变化,破坏的是化学键,为极性键.【解答】解:液氨中含有氢键,当液氨→氨气主要是氢键被破坏,但属于物理变化,共价键没有破坏,氨气→氮气和氢气→氮原子和氢原子为化学变化,破坏的是极性共价键和非极性共价键,故选:B.7.下列说法不正确的是()①NaCl晶体中与每个Na+距离相等且最近的Na+共有12个②含有共价键的晶体一定具有高的熔、沸点及硬度③s﹣s σ键与s﹣p σ键的电子云形状相同④含有π键的化合物与只含σ键的化合物的化学性质不同⑤中心原子采取sp3杂化的分子,其立体构形不一定是正四面体⑥配位键在形成时,是由成键双方各提供一个电子形成共用电子对.A.①②⑤B.①④⑥C.②③⑤D.②③⑥【考点】原子轨道杂化方式及杂化类型判断;化学键.【分析】①根据氯化钠的晶胞确定每个Na+距离相等且最近的Na+个数;②分子晶体的熔沸点低,硬度小;③s﹣s σ键与s﹣p σ键的电子云形状不同;④π键和σ键的活泼性不同导致物质的化学性质不同;⑤中心原子采取sp3杂化的分子,VSEPR模型是正四面体,但其立体构形不一定是正四面体;⑥配位键形成时,一方提供空轨道,另一方提供孤对电子.【解答】解:①采用沿X、Y、Z三轴切割的方法知,氯化钠的晶胞中每个Na+距离相等且最近的Na+个数是12,故正确;②含有共价键的晶体不一定具有高的熔、沸点及硬度,如分子晶体的熔、沸点及硬度较低,故错误;③s能级电子云是球形,p能级电子云是哑铃型,所以s﹣s σ键与s﹣p σ键的电子云形状不同,故错误;④π键和σ键的活泼性不同导致物质的化学性质不同,含有π键的物质性质较活泼,所以含有π键的化合物与只含σ键的化合物的化学性质不同,故正确;⑤中心原子采取sp3杂化的分子,VSEPR模型是正四面体,但其立体构形不一定是正四面体,如:水和氨气分子中中心原子采取sp3杂化,但H2O是V型,NH3是三角锥型,故正确;⑥配位键形成时,一方提供空轨道,另一方提供孤对电子,成键双方各提供一个电子形成共用电子对形成共价键,故错误;故选D.8.有关金属晶体的说法不正确的是()A.金属Cu的晶体的配位数为12B.金属键是金属阳离子与自由电子间的相互作用C.金属的延展性可以用电子气理论解释D.金属Mg、Zn、Ti都是六方最密堆积,空间利用率是68%【考点】金属晶体.【分析】A.金属Cu的晶体为面心立方最密堆积;B.金属键是金属阳离子和自由电子间的相互作用;C.“电子气理论”把金属键描述为金属原子脱落下来的价电子形成遍布整快晶体的“电子气”,被所有原子所共有,从而把所有金属原子维系在一起;当金属晶体受到外力作用时,金属正离子间滑动而不断裂;D.简单立方堆积、配位数6、空间利用率52%;体心立方堆积、配位数8、空间利用率68%;六方最密堆积、配位数12、空间利用率74%;面心立方最密堆积、配位数12、空间利用率74%.【解答】解:A.金属Cu的晶体为面心立方最密堆积,配位数最大,配位数为12,故A正确;B.金属键是存在于金属阳离子和“自由电子”之间的强的相互作用,这些“自由电子”为所有阳离子所共用,其本质也是电性作用,故B正确;C.金属发生形变时,自由电子仍然可以在金属子离子之间流动,使金属不会断裂,所以能用电子气理论解释金属的延展性,故C正确;D.金属Mg、Zn、Ti都是六方最密堆积,空间利用率74%,故D错误;故选D.9.下列有关说法正确的是()A.水合铜离子的模型如图1所示,1个水合铜离子中有4个配位键B.CaF2晶体的晶胞如图2所示,每个CaF2晶胞平均占有4个Ca2+,4个F﹣C.H原子的电子云图如图3所示,H原子核外大多数电子在原子核附近运动D.原子堆积模型如图4,可表示Mg原子的堆积方式【考点】配合物的成键情况;晶胞的计算.【分析】A.水合铜离子中铜离子的配位数为4,配体是水,水中的氧原子提供孤电子对与铜离子形成配位键,据此答题;B.根据均摊法可知,在CaF2晶体的晶胞中,每个CaF2晶胞平均占有Ca2+个数为=4,据此答题;C.电子云密度表示电子在某一区域出现的机会的多少,H原子最外层只有一个电子,所以不存在大多数电子一说,只能说H原子的一个电子在原子核附近出现的机会较多,据此答题;D.根据晶胞图可知,原子分布在晶胞的顶点和面心上,Mg属于金属晶体,堆积方式是六方最密堆积.【解答】解:A.水合铜离子中铜离子的配位数为4,配体是水,水中的氧原子提供孤电子对与铜离子形成配位键,1个水合铜离子中有4个配位键,故A正确;B.根据均摊法可知,在CaF2晶体的晶胞中,每个CaF2晶胞平均占有Ca2+个数为=4,2个F ﹣,故B错误;C.电子云密度表示电子在某一区域出现的机会的多少,H原子最外层只有一个电子,所以不存在大多数电子一说,只能说H原子的一个电子在原子核附近出现的机会较多,故C错误;D.根据晶胞图可知,原子分布在晶胞的顶点和面心上,所以该金属晶体为面心立方最密堆积,而Mg的原子堆积叫六方最密堆积,故D错误;故选A.10.下列分子是极性分子的是()A.PCl3B.SO3C.BF3D.CS2【考点】极性分子和非极性分子.【分析】极性分子中正负电荷的中心不重合,具有一定的极性,极性分子是由极性键构成的结构不对称的分子;对于ABn型分子,若中心原子的化合价的绝对值等于原子的最外层电子数,则为非极性分子,据此判断.【解答】解:A、PCl3分子中P的最外层有5个电子,其化合价为+3,中心原子的化合价的绝对值不等于原子的最外层电子数,属于极性分子,故A选;B、SO3分子中S的最外层有6个电子,其化合价为+6,中心原子的化合价的绝对值等于原子的最外层电子数,属于非极性分子,故B不选;C、BF3分子中B的最外层有3个电子,其化合价为+3,中心原子的化合价的绝对值等于原子的最外层电子数,属于非极性分子,故C不选;D、CS2分子中C的最外层有4个电子,其化合价为+4,中心原子的化合价的绝对值等于原子的最外层电子数,属于非极性分子,故D不选.故选A.11.现有四种元素的基态原子的电子排布式如下:①[Ne]3s23p4;②1s22s22p63s23p3;③1s22s22p5.则下列有关比较中不正确的是()A.最高正化合价:③>②>① B.原子半径:②>①>③C.电负性:③>①>②D.第一电离能:③>②>①【考点】原子核外电子排布.【分析】由核外电子排布式可知,①[Ne]3s23p4为S元素,②1s22s22p63s23p3为P元素,③1s22s22p5为F元素.A.最高正化合价等于最外层电子数,注意F、O元素一般没有正化合价;B.同周期自左而右原子半径减小,同主族自上而下原子半径增大;C.同周期自左而右电负性增大,同主族自上而下电负性减小;D.同周期随原子序数增大,元素的第一电离能呈增大趋势,但P元素原子3p能级为半满稳定状态,第一电离能高于同周期相邻元素,同主族自上而下第一电离能减弱.【解答】解:由核外电子排布式可知,①[Ne]3s23p4为S元素,②1s22s22p63s23p3为P元素,③1s22s22p5为F元素.A.S元素最高正化合价为+6,P元素最高正化合价为+5,F没有正化合价,故最高正化合价:①>②,故A错误;B.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径P>S>F,即②>①>③,故B正确;C.同周期自左而右电负性增大,同主族自上而下电负性减小,故电负性③>①>②,故C 正确;D.同周期随原子序数增大,元素的第一电离能呈增大趋势,但P元素原子3p能级为半满稳定状态,第一电离能高于同周期相邻元素,同主族自上而下第一电离能减弱,故第一电离能F>P>S,即③>②>①,故D正确.故选:A.12.下面的排序正确的是()A.晶体熔点由低到高:CCl4<CBr4<CI4<CF4B.硬度由大到小:金刚石>晶体硅>碳化硅C.熔点由高到低:Na>Mg>AlD.晶格能由大到小:NaF>NaCl>NaBr>NaI【考点】晶体熔沸点的比较;用晶格能的大小衡量离子晶体中离子键的强弱.【分析】A.不含氢键的分子晶体中熔沸点与其相对分子质量成正比;B.都是原子晶体,化学键越强,硬度越大,原子半径越小,键长越大,化学键越强;C.金属晶体熔沸点与金属键成正比,金属键与原子半径成反比、与电荷成正比;D.离子晶体晶格能与离子半径成反比、与电荷成正比.【解答】解:A.四种分子晶体的组成和结构相似,分子的相对分子质量越大,分子间作用力越大,则晶体的熔沸点越高即晶体熔点由低到高:CF4<CCl4<CBr4<CI4,故A错误;B.原子半径Si>C,三者都为原子晶体,原子半径越大,共价键的键能越小,则硬度越小,即硬度大小顺序是金刚石>碳化硅>硅,故B错误;C.Na、Mg、Al原子半径依次减小,金属离子电荷逐渐增多,金属键逐渐增强,则熔点由高到低:Al>Mg>Na,故C错误;D.离子半径F﹣<Cl﹣<Br﹣<I﹣,故离子键强度NaF>NaCl>NaBr>NaI,故晶格能NaF>NaCl >NaBr>NaI,故D正确;故选D.13.向盛有硫酸锌水溶液的试管里加入氨水,首先形成难溶物,继续滴加氨水,难溶物溶解,得到透明溶液.下列对此现象说法不正确的是()A.反应后溶液中不存在任何沉淀,所以反应前后Zn2+的浓度不变B.沉淀溶解后,将生成配合离子[Zn(NH3)4]2+C.用硝酸锌溶液代替硫酸锌溶液进行实验,能观察到同样的现象D.在[Zn(NH3)4]2+离子中,NH3给出孤对电子,Zn2+提供空轨道。
湖北省四校襄州一中枣阳一中宜城一中曾都一中2018-2019学年高二数学上学期期中联考试卷理【经典版】.doc
湖北省四校(襄州一中、枣阳一中、宜城一中、曾都一中)2018-2019学年高二数学上学期期中联考试题 理分值:150分 命题老师:一、选择题(本大题共12道小题,每小题5分,共60分.在每小题给出的四个选项中,只有一个选项是符合题目要求的) 1.两个整数153和238的最大公约数是( )A. 153B. 119C. 34D. 172.已知与02:2=++ay x l 互相垂直,则实数a 的值为( ) A. 0 B . -2C. 0 或-2D. 23.总体由编号为01, 02,…,19, 20的20个个体组成,利用下面的随机数表选取5个个体,选取方法是从随机数表第1行的第7列和第8列数字开始由左到右依次选取两个数字,则选出来的第5个个体的编号为( )A. 01B. 02C. 07D. 084.若样本数据1021...,,x x x 均值为4,则数据12,...,12,121021---x x x 的均值为( ) A. 7 B . 8C. 4D. 165.阅读右边的程序框图,运行相应的程序,则输出S 的值为()A. 3 B . 1C. 0D. -16.已知点(1,0)和(3,0)在直线01:=-+y ax l 的两侧,则直线l 的倾斜角的范围为()A. )4,6(ππB. )65,43(ππC. )4,6()43,0(πππ D. )6,4(ππ- 7.已知圆方程为(x-2)2 + y 2 = 8,直线l 过P(3,2),被圆截得的线段长为72,则直线l 方程为( )A. 3x - 4y -1 = 0B. x = 3C. x = 3 或 3x - 4y -1 = 0D. x = 3 或 3x + 4y -1 = 08.在去年的足球甲A 联赛上,一队每场比赛平均失球数是1.5,全年比赛失球个数的标准差为1.1;二队每场比赛平均失球数是2.1,全年失球个数的标准差是0.4,你认为下列说法中正确的个数有()①平均来说一队比二队防守技术好;②一队比二队防守技术水平更稳定;③一队防守有时表现很差,有时表现又非常好;④二队很少不失球. A. 1个 B. 2个 C. 3个 D. 4个9.直线x + y + 2 = 0分别与x 轴,y 轴父于A ,B 两点,点P 在圆x 2+y 2-4x + 2 = 0上,则△ABP 面积的最大值是( ) A. 242 B. 6 C. 2D. 34210.从区间[0,2]随机抽取4n 个数n n y y y y x x x x 23212321,...,,,,,...,,,构成2n 个数对(x l ,y 1),(x 2,y 2),…,(x 2n ,y 2n ),其中两数的平方和小于4的数对有m 个,则用随机模拟的方法得到的圆周率疋的近似值为( ) A.n m 2 B. nm 2 C. n m 4 D. n m16 11.圆(x-1)2 +(y +1)2 = r 2上有且仅有四个点到直线4x+3y-11 = 0的距离等于23,则半径r 的取值范围为( )A. r>27B. r<27C.r >21 D. 21<r <2712.对于两条平行直线和圆的位置关系定义如下:若两直线中至少有一条与圆相切,则称该位置关系为“平行相切”;若两直线都与圆相离,则称该位置关系为“平行相离”;否则称为“平行相交”。
湖北省四校(襄州一中、枣阳一中、宜城一中、曾都一中)2018-2019学年高二上学期期中联考物理答案
1A 2 BC 湖北省四校(襄州一中 枣阳一中 宜城一中 曾都一中)2018-2019学年高二上学期期中联考物理参考答案一、选择题(每小题 5 分,共 50 分,选不全得 3 分,不选或选错 0 分)二、填空题11、(6 分)(在电流表位置正确的前提下,电流表、电压表、欧姆表每答对一种得两分)12、(9 分)(1)5.01(2 分)5.315(5.314~5.316 均正确)(2 分)U I - U I πD 2R (2) 1 2 2 1(3 分) (3) X(2 分)I 1 I 2 4L13.(10 分)设带电粒子在 B 点的速度大小为 v B 。
粒子在垂直于电场方向上的速度分量不变,即 v B sin30°=v 0sin60°① 2 分 由此得 v B = 3v 0② 设粒子的水平加速度为 a 则1 分 qE=ma ③2 分由速度公式得 v B c o s 30°=v 0cos60°+at ④ 3 分联立得 E =m υ0⑤ 2 分qt14、(10 分)根据C = εs 4πkd 可知, C BC = 1 C 2 AB= 1 ⨯10-2 μF = 5 ⨯10-3 μF (2 分) 2电容器 AB 的带电量, Q 1 = C AB ⋅U = 10-2⨯10-6⨯ 2C = 2 ⨯10-8C 其中A 板带负电,B 板带正电。
(2 分)电容器 B C 的带电量Q = C ⋅U = 5 ⨯10-3⨯10-6⨯ 2C = 1⨯10-8C 其中 B 板带正电, C 板带负电(2 分)所以 A 板板电荷量: Q = -Q = -2 ⨯10-8 C (1 分)B 板电荷量: Q B = Q 1 + Q 2 = 3 ⨯10-8C (2 分)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
曾都一中 枣阳一中 襄州一中 宜城一中 2018—2019学年下学期高二期中考试
理数试题 一、单选题(本大题共12小题,每小题5分,共60分.在每小题给出的四个选项中,只有一项是符合题目要求的). 1.设命题:,,则命题的否定为( )
A. , B. ,
C. , D. ,
【答案】A 【解析】 特称命题的否定为全称命题,所以命题:,的否定为,,故选A. 2.双曲线的实轴长是( )
A. B. C. 4 D. 【答案】B 【解析】 【分析】 双曲线化为标准方程为 ,即可求得实轴长 【详解】双曲线化为标准方程为
解得 即双曲线的实轴长为 故选B 【点睛】本题主要考查了双曲线的简单性质,解题的关键是将双曲线转化为标准方程,属于基础题。 3.如图所示,一圆形纸片的圆心为,是圆内一定点,是圆周上一动点,把纸片折叠使与重合,然后抹平纸片,
折痕为,设与交于点,则点的轨迹是( ) A. 椭圆 B. 双曲线 C. 抛物线 D. 圆 【答案】A 【解析】 考点:椭圆的定义. 分析:根据CD是线段MF的垂直平分线.可推断出|MP|=|PF|,进而可知|PF|+|PO|=|PM|+|PO|=|MO|结果为定值,进而根据椭圆的定义推断出点P的轨迹. 解:由题意知,CD是线段MF的垂直平分线. ∴|MP|=|PF|, ∴|PF|+|PO|=|PM|+|PO|=|MO|(定值), 又显然|MO|>|FO|, ∴根据椭圆的定义可推断出点P轨迹是以F、O两点为焦点的椭圆. 故选A 4.设,则“”是“”的( )
A. 充分不必要条件 B. 必要不充分条件
C. 充要条件 D. 既不充分也不必要条件
【答案】B 【解析】 【分析】 先解出不等式的解集,然后判断出结果 【详解】解不等式 可得 则“”是“”的必要不充分条件 故选B 【点睛】本题考查了必要不充分条件,在判定时根据范围的取值情况得到答案,较为基础 5.已知方程表示焦点在y轴上的椭圆,则实数k的取值范围是 A. B. C. D. 【答案】C 【解析】 解:因为方程表示焦点在y轴上的椭圆,因此2k-1>0,2-k>0,同时2k-1>2-k,这样解得为选项C 6.已知命题:不等式的解集是,命题“在中,是的充要条件”
则( ) A. 真假 B. 假 C. 真 D. 假真
【答案】C 【解析】 【分析】 解一元二次不等式即可判断出命题的真假,根据正弦定理的边角互化的推论,可以判定出命题的真假,对题目中的四个答案逐一进行判断,即可得到答案 【详解】命题:解不等式 ,可得,故命题是真命题; 命题:在中,等价于,即,故命题是真命题; 对于:假错误 对于:为真,故选项错误 对于,真错误 故四个选项中只有正确,故选 【点睛】本题是一道复合命题真假性的题目,解题的关键在于判定每一个命题的真假,属于基础题。 7.若是空间的一个基底,则下列各组中不能构成空间一个基底的是( )
A. B. C. D. 【答案】D 【解析】 【分析】 根据空间向量的共面定理,一组不共面的向量构成空间的一个基底,对选项中的向量进行判断即可。 【详解】对于,每组都是不共面的向量,能构成空间的一个基底, 对于:满足: ,是共面向量,不能构成空间的一个基底, 故选D 【点睛】本题主要考查了向量的相关知识,考查了空间向量共面的判断与应用问题,熟练掌握向量基底的定义以及判断条件是解题的关键,属于基础题。 8.已知向量,则下列向量中与成的夹角的是( ) A. B. C. D. 【答案】B 【解析】 【分析】 根据空间向量数量积的坐标公式,即可得到答案 【详解】根据夹角余弦值 对于A若则,而,故不符合条件 对于若则,而,故符合条件 对于若则,故不符合条件 对于若则,故不符合条件 故选B 【点睛】本题考查了向量的数量积,运用公式代入进行求解,较为简单 9.已知抛物线的准线过双曲线的一个焦点,且双曲线的一条渐近线方程为,
则该双曲线的方程为( ) A. B. C. D. 【答案】A 【解析】 【分析】 求出抛物线的准线方程,再根据题意求出的值,结合渐近线方程列出关于的方程,继而求出双曲线的方程 【详解】由抛物线可知准线为 由题意可得双曲线 的一个焦点为, 又双曲线的一条渐近线方程为, ,得到又由,故, 则双曲线为 故选A 【点睛】本题主要考查了双曲线的简单性质以及抛物线的简单性质,熟练运用公式来求解是解题的关键,较为基础。 10.已知空间三点坐标分别为A(4,1,3),B(2,3,1),C(3,7,-5),又点P(x,-1,3) 在平面ABC内,则x的值 ( ) A. -4 B. 1 C. 10 D. 11 【答案】D 【解析】 【分析】 利用平面向量的共面定理即可求出答案 【详解】在平面内 使得等式成立
,消去解得 故选D 【点睛】本题主要考查了空间向量的坐标运算,共面向量定理的应用,熟练掌握平面向量的共面定理是解决本题的关键,属于基础题。 11.以下四个关于圆锥曲线的命题, ①双曲线与椭圆有相同的焦点; ②在平面内,设为两个定点,为动点,且,其中常数为正实数,则动点的轨迹为椭圆; ③方程的两根可以分别作为椭圆和双曲线的离心率; ④过双曲线的右焦点作直线交双曲线于两点,若,则这样的直线有且仅有3条. 其中真命题的个数为( ) A. 4 B. 3 C. 2 D. 1 【答案】C 【解析】 【分析】 利用椭圆和双曲线的几何性质,焦点、离心率等知识来判定四个选项 【详解】①在双曲线中,,则双曲线的焦点坐标为,在椭圆中,,则椭圆的焦点坐标为,则它们的焦点不相同,故错误; ②在平面内,设为两个定点,为动点,且,其中常数为正实数,则动点的轨迹为椭圆,错误。当,则动点的轨迹为椭圆;当时,则动点的轨迹为线段,当时,则动点的轨迹不存在; ③方程的两根可以分别作为椭圆和双曲线的离心率,因为椭圆的离心率在内,双曲线的离心率大于1,故正确; ④当过右焦点垂直于轴的直线与双曲线的右支的交点为 ,, 所以与右支有两个交点时,只有一条直线; ,则过右焦点与双曲线左右支各一个交点时,满足此时有2条直线,一共有3条直线,故正确 综上真命题的个数为2个 故选C 【点睛】本题考查了椭圆与双曲线的几何性质,需要掌握焦点、离心率等知识,并能熟练运用进行判定,较为基础 12.已知双曲线C:的左、右顶点分别为,P为曲线C上一动点且直线的斜率的取值范围为,
则直线的斜率的取值范围为( ) A. B. C. D. 【答案】C 【解析】 【分析】 由已知条件设出点坐标,然后求出两条直线的斜率的取值范围,结合直线 的斜率求出结果 【详解】由双曲线可得左顶点,右顶点 设
则 记直线的斜率为,直线的斜率为, 则 直线的斜率范围是 则直线的斜率范围是 故选C 【点睛】本题考查了双曲线中直线斜率的取值范围问题,在求解过程中需要设出点坐标,然后结合已知条件进行求解,需掌握解题方法 二、填空题(本大题共4小题,每小题5分,共20分.) 13..某工厂为了对新研发的一种产品进行合理定价,将该产品事先拟订的价格进行试销,得到如下数据. 单价(元) 4 5 6 7 8 9 销量(件) 90 84 83 80 75 68
由表中数据求得线性回归方程,则元时预测销量为_________件. 【答案】62 【解析】 【分析】 计算样本中心,代入回归方程解出,得到回归方程,再计算时的预测值,进而得到答案 【详解】
则回归方程 当时,则 故答案为62 【点睛】本题主要考查了线性回归方程的性质,先求出线性回归方程,然后利用线性回归方程进行预测,属于基础题 14.如图所示,在空间四边形OABC中,,点在线段上,且,为中点,若
,则_____________ 【答案】 【解析】 【分析】 用表示 ,从而求出,即可求出,从而得出答案 【详解】点在上,且,为的中点
故 故答案为 【点睛】本题主要考查了平面向量的线性运算,运用向量的加法法则来求解,属于基础题 15.已知是抛物线:上一点,则点到直线的最短距离是____
【答案】 【解析】 【分析】 要求点到直线的最短距离,则过点作与直线的平行线,且与抛物线相切,然后求出两条平行线之间的距离 【详解】不妨设过点的直线与抛物线 相切 则 则 故直线为 点到直线的最短距离为两条平行线之间的距离, 点到直线的最短距离 故答案为 【点睛】本题考查了点到直线的距离最短问题,需要作出相切线,然后求出两条平行线之间的距离,考查了抛物线
