《外科植入 - 部分和全髋关节假体 第13部分带柄股骨部件
髋关节假体置换术后假体周围骨折的分型

谢谢
4.Johansson分型 根据骨折位置及假体稳定性分为3型
Ⅰ型:骨折线接近假体末端,假体柄仍 然在髓腔内。 Ⅱ型:骨折线从股骨干近端部分延伸至 假体远端以远,假体柄从远端髓腔脱出。 Ⅲ型:骨折线完全位于假体柄末端远端。
5.Cooke改良的Bethea分型 根据骨折位置、粉碎程度、假体及骨折稳定性分为4型
一、人工全髋关节置换术后的影像学评价分区
人工全髋关节置换术后 的影像学评价Engh改良 的Gruen分区 A.髋臼侧Delee分区 B.股骨侧Gruen分区
1.髋臼侧Delee分区 髋臼侧Ⅰ~Ⅲ区:以髋臼旋转中心为中点,
分别做骨盆的水平线和垂线,两条线以内的 区域为髋臼Ⅱ区,外侧的区域为髋臼Ⅰ区, 内侧的区域为髋臼Ⅲ区(图A)。
2.AAOS分型 根据骨丢失的位置及程度分为6型
Ⅰ型:节段性骨丢失。 ⅡA型:空腔性骨丢失。 ⅡB型:膨胀性空腔性骨丢失。 Ⅲ型:节段性骨丢失与空腔性骨丢失同时存在。
Ⅳ型:股骨对线不良。 Ⅴ型:股骨硬化。 Ⅵ型:股骨骨折位置及粉碎程度分为3型。
Ⅰ型:骨折位于假体末端。 Ⅱ型:骨折围绕假体呈螺旋状。 Ⅲ型:骨折围绕假体呈粉碎状。
Ⅰ型:假体柄周围粉碎骨折,假体柄松 动,骨折不稳定。 Ⅱ型:假体柄周围斜形或螺旋形骨折, 骨折稳定。 Ⅲ型:假体柄尖端横行骨折,骨折不稳 定,假体无松动。 Ⅳ型:骨折线完全位于假体远端。
6.Tower-Beals分型 根据骨折位置、骨折及假体稳定性分为4型
Ⅰ型:骨折累及股骨近端,常伴有大转子或小转子撕脱骨折。 Ⅱ型:骨折累及股骨干但未达假体尖端,假体常可保持骨折稳定。 ⅢA型:骨折累及假体柄尖端,但未向近侧延伸,少于25%的骨-假体界面被破坏。 ⅢB型:骨折累及假体柄尖端并向近侧延伸,大于25%的骨-假体界面被破坏。 ⅢC型:长柄假体尖端的股骨髁上骨折。 Ⅳ型:假体远侧远离假体尖端的股骨髁上骨折。
2_生物陶瓷在全髋关节置换中的应用_陈文_2007
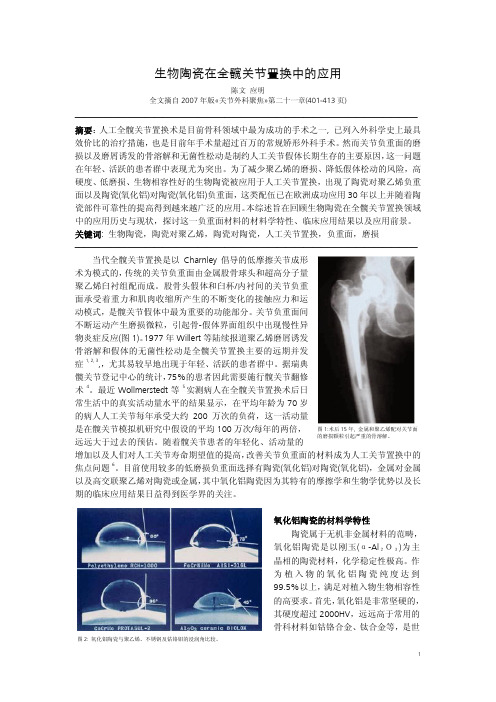
生物陶瓷在全髋关节置换中的应用陈文 应明全文摘自2007年版«关节外科聚焦»第二十一章(401-413页)——————————————————————————————————————— 摘要:人工全髋关节置换术是目前骨科领域中最为成功的手术之一, 已列入外科学史上最具效价比的治疗措施,也是目前年手术量超过百万的常规矫形外科手术。
然而关节负重面的磨损以及磨屑诱发的骨溶解和无菌性松动是制约人工关节假体长期生存的主要原因,这一问题在年轻、活跃的患者群中表现尤为突出。
为了减少聚乙烯的磨损、降低假体松动的风险,高硬度、低磨损、生物相容性好的生物陶瓷被应用于人工关节置换,出现了陶瓷对聚乙烯负重面以及陶瓷(氧化铝)对陶瓷(氧化铝)负重面,这类配伍已在欧洲成功应用30年以上并随着陶瓷部件可靠性的提高得到越来越广泛的应用。
本综述旨在回顾生物陶瓷在全髋关节置换领域中的应用历史与现状,探讨这一负重面材料的材料学特性、临床应用结果以及应用前景。
关键词: 生物陶瓷,陶瓷对聚乙烯,陶瓷对陶瓷,人工关节置换,负重面,磨损———————————————————————————————————————当代全髋关节置换是以Charnley 倡导的低摩擦关节成形术为模式的,传统的关节负重面由金属股骨球头和超高分子量聚乙烯臼衬组配而成。
股骨头假体和臼杯/内衬间的关节负重面承受着重力和肌肉收缩所产生的不断变化的接触应力和运动模式,是髋关节假体中最为重要的功能部分。
关节负重面间不断运动产生磨损微粒,引起骨-假体界面组织中出现慢性异物炎症反应(图1)。
1977年Willert 等陆续报道聚乙烯磨屑诱发骨溶解和假体的无菌性松动是全髋关节置换主要的远期并发症1, 2, 3,,尤其易较早地出现于年轻、活跃的患者群中。
据瑞典髋关节登记中心的统计,75%的患者因此需要施行髋关节翻修术4。
最近Wollmerstedt 等5实测病人在全髋关节置换术后日常生活中的真实活动量水平的结果显示,在平均年龄为70岁的病人人工关节每年承受大约200万次的负荷,这一活动量是在髋关节模拟机研究中假设的平均100万次/每年的两倍,远远大于过去的预估。
全膝关节假体注册指导原则

附件5全膝关节假体系统产品注册技术审查指导原则本指导原则旨在为注册申请人进行全膝关节假体系统产品的注册申报提供技术指导,同时也为医疗器械监督管理部门对注册申报资料的审评提供技术参考。
本指导原则系对全膝关节假体系统产品注册申报资料的一般要求,注册申请人应依据具体产品的特性确定其中的具体内容是否适用,并对注册申报资料的内容进行充实和细化。
本指导原则是对注册申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但是需要提供详细的研究资料和验证资料。
应在遵循相关法规和标准的前提下使用本指导原则。
本指导原则是在现行法规和标准体系以及当前认知水平基础上制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则相关内容也将进行适时的调整。
一、适用范围本指导原则涉及的产品适用于全膝关节假体置换术,包括股骨部件(股骨髁、股骨延长柄)、胫骨部件(胫骨衬垫、胫骨托、胫骨延长柄、紧固件)、髌骨部件(一体式髌骨、髌骨托/髌骨衬垫)、膝关节填充块、袖套等,由YY 0502《膝关节假体》标准(注:本指导原则中所列标准适用最新版本,下同)中已认可的—1 —金属材料、高分子材料、陶瓷材料和涂层材料制成。
本指导原则不包含对部分膝关节置换用假体、特殊设计或个性化定制的全膝关节假体的要求,但适用部分可参照本指导原则。
二、技术审查要点(一)产品名称的要求根据《医疗器械分类规则》(国家食品药品监督管理总局令第15号)、《医疗器械通用名称命名规则》(国家食品药品监督管理总局令第19号)等相关文件,按照申报产品的设计特征和适用范围,确定其管理类别、分类编码及规范性命名,并论述其确定依据。
(二)产品的结构和组成全膝关节假体系统通常包括股骨部件(股骨髁、股骨延长柄)、胫骨部件(胫骨衬垫、胫骨托、胫骨延长柄、紧固件)、髌骨部件(一体式髌骨、髌骨托/髌骨衬垫)、膝关节填充块、袖套等。
LINK公司classic骨水泥型髋关节假体介绍及手术操作

Classic plus 骨水泥型全髋关节置换假体系统描述-----------------------------------------------------------------------------2 产品特点--- -------------------------------------------------------------------------3 髋臼假体------------------------------------------------------------------------- 3 股骨柄假体--------------------------------------------------------------------------5 股骨头假体--------------------------------------------------------------------------6 手术适应证--------------------------------------------------------------------------6 主要技术参数--------------------------------------------------------------------------6 手术器械-----------------------------------------------------------------------------7 髋臼部分-----------------------------------------------------------------------------7 柄部分----------------------------------------------------------------------------9 术前准备---------------------------------------------------------------------------12 手术操作过程----------------------------------------------------------------------------13 体位摆放----------------------------------------------------------------------------14 操作过程--------------------------------------------------------------------------14 术后注意事项--------------------------------------------------------------------------24 临床资料--------------------------------------------------------------------------25Classic plus 骨水泥型全髋关节置换假体⏹系统描述在人工关节外科的发展史上,自60年代Charnley倡导的骨水泥作为人工关节的生物材料以来,人工关节置换术的临床效果大为提高,骨水泥固定假体至今仍在广泛使用。
关节置换植入物材料、设计与临床应用相关标准综述

ISO 14630 中规定了临床评价的途径,即:a)与植入物 相似,或可证明相似的植入物的安全性、性能、设计特性和 预期使用有关的科学和临床文献的鉴定回顾;或 b)临床 研究的结果;或c)由以上 a)和 b)提供的临床数据的结合; d)分析从临床研究中获得的信息资料。与临床研究相关 的 ISO 标准为 ISO 14155 。 [31] 该标准的第 1、2 部分就制定 研究计划、临床研究等做出了详细规定。我国行标 YY/T 0297[32]等同采用该标准 1996 版。 1.4.3 上市后的监督
与设计相关的 ISO 标准包括:ISO 7206[20]的第 1、2 部分 和 ISO 7207[21]的第 1、2 部分。
在 ISO 7206-1 和 ISO 7207-1 中,对髋、膝关节假体以及 其部件给出了定义,详细叙述了分类方法,对每一类型给 出了示意图和尺寸标注要求。为降低人体运动过程中关 节面部件之间的磨损,在 ISO 7206-2 中规定了髋关节假体 关节面的尺寸公差、表面粗糙度以及球形径向偏差等;在 ISO 7207-2 中,规定了膝关节假体关节面的表面粗糙度。 这些要求在行标 YY 0118 和 YY 0502 中采用。 1.4 设计评价
IDT
羟基磷灰石涂层
ISO 13779-2[15]
GB 23101.2[16]
IDT
2022全膝关节假体系统体外功能试验标准及评估方法介绍

2022全膝关节假体系统体外功能试验标准及评估方法介绍退行性骨关节病(又称骨关节炎)是最常见的关节疾病之一,常见于人体髋关节和膝关节。
随着人口老龄化加剧以及肥胖率上升,髋、膝骨关节炎的治疗需求大幅增加。
针对终末期髋、膝骨关节炎患者,人工全髋关节置换术和人工全膝关节置换术是较为经济有效的治疗手段。
目前,人工全膝关节的长期疗效已得到公认,植入物的翻修率和生存率均达到较好水平。
全膝关节假体系统包括股骨部件(股骨髁、股骨延长柄)、胫骨部件(胫骨衬垫、胫骨托、胫骨延长柄、紧固件)、髌骨部件(一体式髌骨、髌骨托/髌骨衬垫)、膝关节填充块、袖套等。
目前,针对上述相关产品的体外功能评价方法和国内外相关标准主要涉及各部件耐久性疲劳试验、部件连接可靠性试验、运动与约束研究的相关试验以及产品磨损试验等(详见表)。
相关部件动态疲劳试验即使全膝关节假体产品所用的原材料均符合相关国际、国家及行业标准,材料性能(如材料化学成分、显微组织、力学性能、内部质量等)均符合相关规定要求,但若产品的结构设计(如假体的限制程度)不合理、生产工艺(如铸造工艺稳定性)不达标等,人工全膝关节部件的使用寿命都会受到影响。
因此,对于全膝关节假体系统相关部件,注册申请人应采用动态疲劳试验进行评估,依据各部件在各项试验中的工况分别选取“最差情况”开展试验。
“最差情况”的选择应结合产品的预期性能、设计特点、相应测试方法等,采用有限元分析或其他已验证的方法进行。
根据相关文献报道,人工全膝关节的疲劳破坏形式主要包括胫骨托部件断裂、股骨髁部件断裂、凸轮立柱断裂等,相关部件动态疲劳试验评估方法如下。
胫骨托部件的疲劳性能胫骨托部件的疲劳性能试验应按照ISO14879-1标准规定的方法进行。
当采用有限元等仿真方法选取“最差情况”时,可参照ASTM F3334标准中的方法进行分析。
属于“最差情况”的5个同规格样件应在最大载荷900N和107次循环的条件下进行试验,且不发生失效,以确定其在相应的加载条件和循环载荷下的疲劳性能。
全膝关节假体系统产品注册技术审查指导原则
附件5全膝关节假体系统产品注册技术审查指导原则本指导原则旨在为注册申请人进行全膝关节假体系统产品的注册申报提供技术指导,同时也为医疗器械监督管理部门对注册申报资料的审评提供技术参考。
本指导原则系对全膝关节假体系统产品注册申报资料的一般要求,注册申请人应依据具体产品的特性确定其中的具体内容是否适用,并对注册申报资料的内容进行充实和细化。
本指导原则是对注册申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但是需要提供详细的研究资料和验证资料。
应在遵循相关法规和标准的前提下使用本指导原则。
本指导原则是在现行法规和标准体系以及当前认知水平基础上制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则相关内容也将进行适时的调整。
一、适用范围本指导原则涉及的产品适用于全膝关节假体置换术,包括股骨部件(股骨髁、股骨延长柄)、胫骨部件(胫骨衬垫、胫骨托、胫骨延长柄、紧固件)、髌骨部件(一体式髌骨、髌骨托/髌骨衬垫)、膝关节填充块、袖套等,由YY 0502《膝关节假体》标准(注:本指导原则中所列标准适用最新版本,下同)中已认可的—1 —金属材料、高分子材料、陶瓷材料和涂层材料制成。
本指导原则不包含对部分膝关节置换用假体、特殊设计或个性化定制的全膝关节假体的要求,但适用部分可参照本指导原则。
二、技术审查要点(一)产品名称的要求根据《医疗器械分类规则》(国家食品药品监督管理总局令第15号)、《医疗器械通用名称命名规则》(国家食品药品监督管理总局令第19号)等相关文件,按照申报产品的设计特征和适用范围,确定其管理类别、分类编码及规范性命名,并论述其确定依据。
(二)产品的结构和组成全膝关节假体系统通常包括股骨部件(股骨髁、股骨延长柄)、胫骨部件(胫骨衬垫、胫骨托、胫骨延长柄、紧固件)、髌骨部件(一体式髌骨、髌骨托/髌骨衬垫)、膝关节填充块、袖套等。
关节厂家比较
假体名称:Spectron EF component 制造公司:Smith & Nephew, Memphis, TN • 设计特点:cemented femoral stem combined with a cementless acetabular component, cross-linked polyethylene modular liner, and cobaltchrome modular femoral head.
Corail全表面羟基磷灰石涂层股骨假 体
• 适于身体状况好,活动性高,骨质条件好,无炎症性 骨关节病,并且股骨近端解剖特征适于近端固定,低 于60岁的年轻病人.是迄今为止最成功的羟基磷灰 尘石(HA)全涂层假体. • Corail柄的细微颗粒状的表面是等离子喷涂的羟基 磷灰石涂层。这一涂层是高度的骨传导介质,不 产生炎症反应。在假体表面的周围会出现一个新 层次的骨,在假体和骨之间有2mm的间隙把两者 连接起来形成完全的骨整合。这一过程能阻止纤 维组织的侵入并使微动最小化。避免近端的应力 遮挡和可能的撞击,确保长期的稳定性最终减少 大腿疼痛减少骨碎屑和潜在的骨溶解
• 设计特点::(1)关节界面由高碳钴—铬 合金制造;(2)髋臼假体非骨水泥固定; (3)股骨侧假体骨水泥固定
假体名称:伯明翰髋关节表面置换系统,BHR . (金属 对金属表面髋关节假体(mental on mental surface arthroplasty, MMSA))制造公司:施乐辉公司 (smith&nephew)
• 设计特点:陶瓷关节:陶瓷具有良好的生物相容性;在人体不释放金属 离子;浸润性好,在人体内能形成良好自润滑;非常坚硬(仅次于金 刚石),具有良好的耐磨性能,磨屑少,大大降低了磨屑诱导的骨溶 解风险。压配式球形臼杯的设计特点:外表面三半径轮廓的设计保证 了产品初期稳定性和长期稳定性。压配式防脱位衬及螺钉的设计特点 : 1. 衬的周围有4个凸台与臼杯的12缺口相匹配保证了防 脱位方向不 发生改变; 2. 臼衬内孔采用10°防脱位设计,大大降 低了髋臼假 体 脱位的发生率;3. 选用进口高品质超高分子量聚乙烯材料,具有良好 的耐磨性;4. 螺钉采用自攻设计方便拧入。钛合金股骨柄:1、选用 优质锻造钛合金材料(材料为Ti-6Al-4V)2、配合锥面技术要求通过了德 国标准的检测3、可以和国际通用的12/14陶瓷球头配合使用4、采用 无领设计保证了产品的植入稳定性 5、双锥面设计的直型柄不但容易 安装,而且有利于应力的分布和传递;6、矩形截面设计有利于降低 髓腔的压力,减少对 髓腔的损伤;7、表面利用真空等离子喷涂进行 粗糙面处理(可进 行钛喷涂或钛加羟基磷灰石喷涂) a.诱导骨长入 b. 阻止假体的金属离子进入邻近的骨组织8、近端特有的螺纹设计有利 于柄的安装和取出。
骨科医疗器械产品——人工关节假体行业分析报告2012
2012年骨科医疗器械人工关节假体行业分析报告2012年5月目录一、人工髋关节置换手术发展背景概述 (5)1.人工髋关节置换手术技术概述 (5)2.人工髋关节发展历程和现状 (5)(1)人工髋关节的早期探索阶段 (5)(2)人工髋关节的初步形成阶段 (6)(3)现代人工髋关节的发展阶段 (6)3.人工髋关节置换手术方法及产品简介 (7)(1)生物固定型髋关节置换手术方法和产品简介 (7)(2)骨水泥固定型髋关节置换术和假体简介 (8)4.人工髋关节置换术技术上的进展 (8)(1)假体的固定方式 (8)(2)摩擦界面的选择 (9)(3)髋关节翻修手术 (9)二、人工膝关节置换手术发展背景概述 (9)1.人工膝关节置换手术概述 (9)2.人工膝关节置换手术发展背景 (10)(1)早期探索阶段 (10)(2)形成阶段 (11)(3)成熟阶段 (11)3.我国人工膝关节置换术现状 (11)4.人工膝关节置换手术方法和产品简介 (12)5.人工膝关节置换术发展趋势 (12)三、行业监管情况 (13)1.行业主管部门及其职能 (13)2.行业监管体制 (14)3.国家相关产业政策 (14)四、我国骨科医疗器械市场发展概况 (17)1.我国骨科医疗器械市场现状 (18)2.三大骨科医疗器械细分领域简介 (21)五、我国人工关节行业情况 (21)1我国人工关节市场前景广阔 (22)(1)区域市场重心转移,我国人工关节行业将迎来高速增长 (22)(2)骨科医疗器械细分结构向国际靠拢,人工关节产品占比将持续扩大 (23)(3)需求释放带来稳定高速增长 (25)2我国人工关节市场格局 (27)(1)行业竞争格局及市场化程度 (27)(2)行业内的主要企业和主要企业的市场份额 (27)(3)行业利润水平及变动因素 (29)六、影响行业发展的有利和不利因素 (30)1有利因素 (30)(1)国家政策的大力支持 (30)(2)经济不断发展提供持续动力 (31)(3)中国正处于人口的快速老龄化阶段 (32)(4)医保全民覆盖,报销比例提升 (33)(5)人民健康意识和生活品质意识的提高 (35)(6)骨科医生手术技术日趋熟练 (36)2.不利因素 (36)(1)国外企业的竞争 (36)(2)进入者的威胁 (37)七、行业技术水平及行业特征 (38)1.行业技术水平及特点 (38)2.行业特有的经营模式 (39)3.行业的周期性、区域性或季节性因素 (39)(1)周期性 (39)(2)区域性 (40)(3)季节性 (40)八、上、下游行业之间的关联性及对行业的影响 (40)九、进入人工关节行业的主要障碍 (41)1.技术工艺障碍 (41)2.市场准入障碍 (41)4.人才障碍 (43)九、行业主要企业情况 (44)1.国外主要企业手简介 (44)(1)Zimmer (44)(2)DePuy (44)(3)Stryker (45)(4)Biomet (45)(5)Smith&Nephew (45)2.国内主要企业简介 (46)(1)北京市春立正达医疗器械股份有限公司 (46)(2)北京百慕航材高科技股份有限公司 (47)(3)北京蒙太因医疗器械有限公司 (47)(4)北京爱康宜诚医疗器材股份有限公司 (47)人工关节置换是一门综合性学科,人工关节学科的发展离不开解剖学、生物力学、材料学、机械学、组织工程学和康复学等多个领域专家的紧密配合与协作。
无源植入器械说明及无源植入器械
无源植入器械说明及无源植入器械一、范围本子目录包括无源植入类医疗器械,不包括眼科器械、口腔科器械和妇产科、辅助生育和避孕器械中的无源植入器械,不包括可吸收缝合线。
二、框架结构本子目录主要根据植入部位和植入器械特点分为11个一级产品类别;依据功能、用途或者结构特点进一步细化为66个二级产品类别,并列举191个品名举例。
本子目录包括2002版分类目录的《〈6846植入材料和人工器官〉(无源部分)》和《〈6877介入器材〉(部分)》,整合后将无源植入器械产品分别按照植入部位和植入器械特点进行分类。
此外,针对组织工程类新兴医疗器械产品,如:组织工程化同种异体皮肤、脱细胞异种神经修复材料、脱细胞异种神经修复材料等,本次修订将其设置为独立的一级产品类别,名为“组织工程支架材料”(其中不包含活细胞成分)。
该子目录中一级产品类别与2002版分类目录产品类别的对应关系如下:与2002版分类目录对应关系一级产品类别2002版产品类别备注13-01骨接合植入物6846-1植入器材中的骨板、骨钉、骨针、骨棒、聚髌器/13-02运动损伤软组织修复重建及置换植入物6846-1植入器材中的骨板、骨钉、骨针、骨棒/ 6846-2植入性人工器官中的人工肌腱13-03脊柱植入物6846-1植入器材中的骨棒、脊柱内固定器材/ 6846-2植入性人工器官中的人工椎体13-04关节置换植入物6846-2植入性人工器官中的关节/ 13-05骨科填充和修复材料6846-1植入器材中的骨蜡、骨修复材料/13-06神经内/外科植入物6846-1植入器材中的骨板、骨钉、脑动脉瘤夹、神经补片/ 6877-3 栓塞器材(神经内/外科用)13-07心血管植入物6846-1植入器材中的心脏或组织修补材料/ 6846-2植入性人工器官中的人工血管6846-4 支架中的血管支架6877-3 栓塞器材(心血管用)13-08耳鼻喉植入物/ 新增13-09整形及普通外科植入物6846-1植入器材中的整形材料/ 6846-2植入性人工器官中的义乳6846-4 支架中的前列腺支架、胆道支架、食道支架13-10组织工程支架材料6846-3 接触式人工器官中的人工皮肤/ 11其他/ 新增—1——13无源植入器械序号一级产品类别二级产品类别产品描述预期用途品名举例管理类别01 骨接合植入物01单/多部件金属骨固定器械及附件通常由一个或多个金属部件(如板、钉板、刃板)及金属紧固装置(如螺钉、钉、螺栓、螺母、垫圈)组成。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.1.1.1.1.2
《外科植入物 - 部分和全髋关节假体 第13部分:带柄股骨部件头
部固定抗扭转力矩的测定》行业标准编制说明
一、工作简况
任务来源:根据食药监办械管〔2017〕94号《总局办公厅关于印发2017年医疗器械行业
标准制修订项目的通知》,确定由天津市医疗器械质量监督检验中心(以下简称天津中心)
负责起草 “外科植入物 - 部分和全髋关节假体 第13部分:带柄股骨部件头部固定抗扭转
力矩的测定”(项目编号:N2017020-Q-TJ)行业标准。
任务下达后,天津中心对此项工作给予了高度重视,及时于2017年3月28日在武汉召开
2017年标准制订工作启动会,并公开征集标准参与单位。启动会上责成标准项目负责人就标
准的立项背景和意义、现有工作基础、项目工作安排做了详细介绍,并成立了标准起草工作
组。工作组成立后,迅速开展工作,按照任务分工,工作组于2017年4月至5月编写标准草案,
并组织相关人员对草案稿进行了校对,于2017年6月19日至21日在天津组织召开标准修订中
期会议,针对标准草案进行深入讨论,会后形成标准的征求意见稿。
二、编制原则和确定标准主要内容的依据
经过多年的临床实践,人工关节置换术的治疗效果已经得到充分的肯定并已经发展成为
一种可靠的治疗手段。根据保守估计,全世界每年有超过150万人接受人工关节置换术。而
随着社会人口老龄化、平均寿命的不断延长以及生活质量的进一步提高,对人工关节置换术
的医疗需求也在持续增长。我国这种需求则表现的更加突出。
人工髋关节植入人体后,在人体运动过程中球头与髋臼组成的关节面会承受摩擦及旋转
力矩的作用,若力矩超出球头跟股骨柄之间的固定力就会产生球头移位或脱位的情况。因此,
需要测定股骨球头与股骨柄之间的固定性能,之前技委会已经转化了ISO 7206-10,关于球
头和股骨柄之间抗拉拔力的试验方法,本标准是关于球头和股骨柄之间抗扭力试验方法,两
个标准结合将更加全面地评价球头和股骨柄之间的固定性能。
本标准的转化将作为髋关节假体行业标准有效的补充,对髋关节假体性能实施更加全面
的有效评价,为技术监管提供有效技术支撑。
本部分按照GB/T 1.1-2009《标准化工作导则 第1部分:标准的结构和编写》及GB/T
20000.2-2009《标准化工作指南 第2部分:采用国际标准》的要求进行编写。
本标准使用重新起草法修改采用国际标准ISO 7206-13:2016《外科植入物 - 部分和
全髋关节假体 第13部分:带柄股骨部件头部固定抗扭转力矩的测定》。
1.1.1.1.1.2
本部分的主要内容包括:
1) 范围
2) 规范性引用文件
3) 术语和定义
4) 试验原理
5) 设备
6) 步骤
7) 试样的处理
三、主要实验(或验证)的分析、综述报告、技术经济论证、预期的经济效果
本标准将对髋臼杯产品的抗变形性能进行试验验证。
YY 0118-2016《外科植入物 髋关节假体》将于2018年实施,标准中已经将该项试验作
为强制性项目进行要求。本方法标准的制定将配合YY 0118使用,更加全面对髋关节假体进
行性能评价。标准的修订将有利于更好地指导、促进企业依据标准规范产品生产、提高产品
质量。
四、采用国际标准和国外先进标准的程度,以及与国际、国外同类标准水平的对
比情况,或与测试的国外样品、样机的有关数据对比的情况。
本标准使用重新起草法修改采用国际标准ISO 7206-13:2016《外科植入物 - 部分和全
髋关节假体 第13部分:带柄股骨部件头部固定抗扭转力矩的测定》。
五、与有关的现行法令、法规和强制性国家标准、行业标准的关系。
YY 0118-2016《外科植入物 髋关节假体》将于2018年实施,标准中已经将该项试验作
为强制性项目进行要求。本方法标准的制定将配合YY 0118使用,更加全面对髋关节假体进
行性能评价。
六、重大分歧意见的处理经过和依据
无
七、行业标准作为强制性行业标准或推荐性行业标准的建议。
本标准按推荐性标准实施。
八、贯彻行业标准的要求和措施建议(包括组织措施、技术措施、过渡办法等内
容)
建议在标准实施前召开标准宣贯会。
1.1.1.1.1.2
九、废止现行有关标准的建议
无
十、其他应予说明的事项
无
《外科植入物 - 部分和全髋关节假体 第13部分:带柄股骨部件头部固定抗扭转力矩
的测定》标准编制小组
2017年6月
