兽药报批号盐酸多西环素批生产指令单
(医疗药品)假兽药清单假兽药清单

磺胺嘧啶钠注射液
扬州市动物药品厂
96
注射用青霉素钠
江苏润康药业有限公司
97
复方银黄注射液
镇江威特药业有限责任公司
98
脓病清
湖州天丝动物保健品厂
99
脓微灵
湖州康尔乐动物保健品有限公司
100
蚕用红霉素
湖州乐宝蚕药制造有限公司
101
安乃近注射液
上海申广动物保健品有限公司
102
青霉素钾
安徽牧王药业有限公司
15
子宫净化散
黑龙江省安达兽药厂
16
保尔康
哈尔滨兽研药品器械开发有限公司
17
圆环蓝毒康
哈尔滨丰力达动物保健品有限公司
18
复方胃复安注射液
黑龙江省哈尔滨博大兽药厂
19
10%水杨酸钠注射液
上海申亚动物保健品有限公司
20
硫酸卡那霉素注射液
上海新普兽药厂
21
盐酸吗啉双胍注射液
上海申广动物保健有限公司
22
维生素C饲料添加剂
148
洗胃精
国营天水陇原兽药厂
149
骨粉含硒生长素
国营天水陇原兽药厂
150
开胃健脾灵
甘肃省天水陇原兽药厂
151
天马强效土钙粉
甘肃武威天马制药厂
附件3
吊销兽药产品批准文号清单
序号
企业名称
产品名称
1
北京市华盛兽药厂
安痛定注射液
2
北京市万宁畜药研制开发有限公司
痢菌净散
3
哈尔滨文明兽药厂
酚磺乙胺注射液
4
哈尔滨双牧动物药品厂
郑州赛科药业科技有限公司
30
兽药国家标准及部分品种的停药期规定

兽药国家标准和部分品种的停药期规定
农业部第278号公告
为加强兽药使用管理,保证动物性产品质量安全,根据《兽药管理条例》规定,我部组织制订了兽药国家标准和专业标准中部分品种的停药期规定(附件1),并确定了部分不需制订停药期规定的品种(附件2),现予公告。
本公告自发布之日起执行。
以前发布过的与本公告同品种兽药停药期不一致的,以本公告为准。
附件1.兽药停药期规定
附件2.不需制订停药期的兽药品种
二○○三年五月二十二日
附件1:
停药期规定
附件2:
不需要制订停药期的兽药品种。
兽药产品批准文号的申报注意事项秦处

申请表第9项:
如申报已有国家标准的兽药(不包含生物 制品),则需申报单位所在地省级兽医行 政管理部门签署意见并盖章,并填写日期。 若未由申报单位所在地省级兽医行政管理 部门签署意见并未盖章和签署日期的,以 “未经申报单位所在地省级兽医行政管理 部门审查”为由退回此次申请。
❖ 标签说明书编写有误
编制标签说明书应严格按照所申请执行兽 药标准为主,不能擅自增加适应症、夸大疗效 或扩大适用动物等。
6.地标升国标转正标准第三册 (部1759 公告)
生物制品文号流程
❖大厅受理、所内资料三级审查、所内行文 、农业部审批、制作批件、大厅办结、信 息发布。
标准生产线一些生产范围
❖灭活疫苗:胚毒、细胞毒、细菌 ❖活疫苗:胚毒、细胞毒、细菌、球虫 ❖诊断试剂:在有本条线的前提下,根据其
抗原生产能力确定; ❖单独条件:猪瘟活疫苗、高致病性病原微
❖ (五)按进口兽药质量标准申报的,需提 供外资方授权书(农医药便函【2010年】 396号)。
❖关于实验动物问题 检验中需要使用动物:实验动物使用许可
证;委托书或者协议,对方的经过计量认 证资质证明及其可以检验的项目,检验报 告。
感谢大家耐心听讲!感谢对我处工作的理解 与支持!
期待多提宝贵意见!留下 您的建议!
申请表第6项:
“含量规格”项下的填写内容应与质量标准 中的相应内容一致,并与申报资料其他项 目中的含量规格一致;包装规格应与标签 和说明书中载明的包装规格一致。
注射液含量规格单位一般为ml: mg/g、ml:单 位 ; 溶 液 的 含 量 规 格 单 位 一 般 为 % 、 ml: mg/g等;预混剂或粉剂的含量规格单位一般 为g:g、%等;包装规格的单位一般g/瓶( 袋)、ml/支、支/盒、瓶/袋(箱)。
8.9 兽药产品批准文号申报与审查要点江西

部局药政处 审批15日 局长签发
部行政大厅 完成行政决定 寄、自取、系统点击
(三)比对试验产品申报流程与评审
申请者 网上申请
上传药学 研究资料
省级兽医主管部门或其委托部门 现场检查,抽样3批(其中1批在 线),数量足够检验、生物等效 或临床验证和以及消除试验应用
部审批大厅 受理
省级系统上传 检验比对方案 协议残留结果
农业部办公厅 2016年4月29日
二、批准文号审查依据
5农业部办公厅关于兽药产品批准文号核发有关工作的通知
农办医[2016]31号
根据新修订的《兽药产品批准文号管理办法》(以下简称“新《办法》”),我部组织开发了新的兽药产 品批准文号网上申报系统,并已于2016年5月1日开始运行。为做好兽药产品批准文号核发有关工作,现就 有关事项通知如下。
行政大厅办结 寄、取、点
二、批准文号审查依据
1.农业部令2015年第4号
《兽药产品批准文号管理办法》已 于2015年11月17日经农业部2015年 第11次常务会议审议通过,现予发 布,自2016年5月1日起施行。
部长
2015年12月3日
二、批准文号审查依据
2农业部办公厅关于做好兽药产品批准文号审查有关工作的通知 农办医[2016]14号
农办医[2016]41号
为做好《兽药产品批准文号管理办法》(农业部令2015年第4号,以下简称《办法》)实施工作,现就有关事宜通知如下。 一、关于2016年5月1日前送样检验的申请。2016年5月1日《办法》实施前,已送样至省级兽药检验机构进行检验但未在我
部网上申报系统申报的申请,省级兽药检验机构出具的检验报告有效,但需按照《办法》规定进行现场核查,并在2016年7 月29日(含)前将纸质申请资料送至我部行政审批办公大厅。各省级兽医管理部门应同时在网上申报系统中将申请提交至 我部行政审批办公大厅。 二、关于退回后再次申报的申请。同时符合以下条件的退回申请可按照原《兽药产品批准文号管理办法》(农业部令第45 号)规定再次申报:一是省级检验机构的复核检验报告符合要求(中化药类)或者自检报告合格(生物制品类);二是属于 换发产品批准文号的申请;三是属于2016年5月1日前受理的申请。此类申请应在2016年7月29日(含)前将纸质资料送至我 部行政审批办公大厅,各省级兽医管理部门应同时在网上申报系统中将申请提交至我部行政审批办公大厅。 三、关于兽药产品监督抽检数据有效性的认定。监督抽检数据有效性以农业部兽药产品质量监督抽检结果通报时间为准。 申请人可通过国家兽药基础信息查询系统中的“监督抽检数据库”查询本企业产品监督抽检情况。符合《办法》第十七条 规定、换发产品批准文号不需要复核检验的,应在申请中注明相关情况。 四、关于新兽药注册单位产品批准文号换发。按照《办法》第六条程序换发产品批准文号的,新兽药注册时的复核检验报 告不再适用,应提供最新的复核检验报告。符合《办法》第十七条规定不需要复核检验的,应在申请中注明相关情况。
全国兽药GMP证书的年份和编号编排
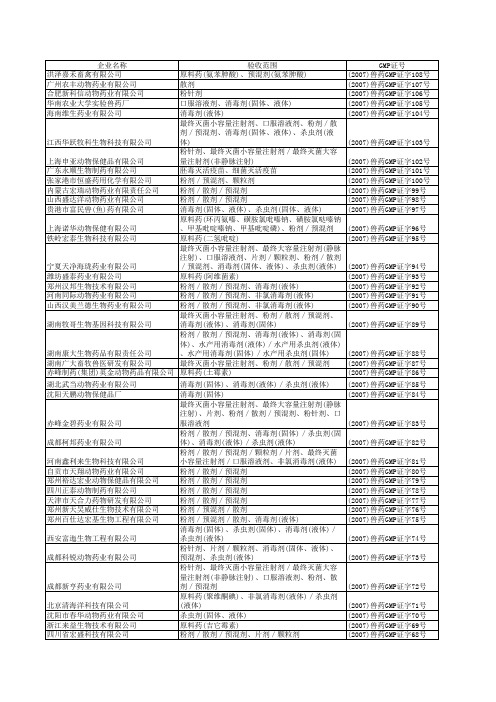
口蹄疫合成肽疫苗 粉剂/散剂/预混剂
(2007)兽药GMP证字60号 (2007)兽药GMP证字59号
乳房注入剂/子宫灌注剂/口服溶液剂
(2007)兽药GMP证字58号
消毒剂(固体、液体) 细胞毒活疫苗
(2007)兽药GMP证字57号 (2007)兽药GMP证字56号
粉剂/散剂/预混剂
(2007)兽药GMP证字55号
最终灭菌小容量注射剂、最终灭菌大容量注射剂 (非静脉注射剂)
口服溶液剂
(2007)兽药GMP证字11号 (2007)兽药GMP证字10号
最终灭菌小容量注射剂、片剂/颗粒剂/粉剂/
西安天星生物药业股份有限公司
散剂/预混剂
(2007)兽药GMP证字09号
河南省天合生物技术有限责任公司
粉剂/散剂/预混剂、口服溶液剂
口服溶液剂
(2007)兽药GMP证字44号
粉剂/散剂/预混剂、水产用消毒剂(固体)/水
产用杀虫剂(固体)、消毒剂(液体)/杀虫剂(液
体)
(2007)兽药GMP证字43号
消毒剂(固体) 杀虫剂(固体、液体) 粉剂/散剂/预混剂
(2007)兽药GMP证字42号 (2007)兽药GMP证字41号 (2007)兽药GMP证字40号
剂(液体)
(2007)兽药GMP证字25号
最终灭菌小容量注射剂、最终灭菌大容量注射剂 (非静脉注射)、粉剂/散剂/预混剂、口服溶液 剂、消毒剂(固体)、消毒剂(液体)/杀虫剂(液 体)
(2007)兽药GMP证字24号
江苏洪泽湖动物药业有限公司
粉剂/散剂/预混剂、水产用消毒剂(固体)/水
产用杀虫剂(固体)、消毒剂(液体)、
石家庄市永昌兽药有限公司 石家庄路通动物保健品有限公司 江西万佳动物保健品有限公司
申请兽药产品批准文号现场抽样单

申请兽药产品批准文号现场抽样单样单位。
填写说明1.编号:编号为10位数字,前4位为年份;随后2位为抽样单位编号:省所为00、郑州市为01、开封市为02、洛阳市为03、平顶山市为04、安阳市为05、鹤壁市为06、新乡市为07、焦作市为08、濮阳市为09、许昌市为10、漯河市为11、三门峡市为12、商丘市为13、周口市为14、驻马店市为15、南阳市为16、信阳市为17、济源市为18、巩义市为19、兰考县为20、汝州市为21、滑县为22、长垣县为23、永城市为24、鹿邑县为25、新蔡县为26、邓州市为27、固始县为28;最后4位为抽样流水号,每个抽样单位每年抽样从0001编起。
例如省所2016年抽取的第一个样品编号为2016000001、郑州市2016年抽取的第3个样品编号为2016010003等。
2.抽样日期:年份采用4位数字,月份和日期采用2位数字,例如:2016年06月14日。
3.规格:按兽药典或其他国家标准填写,原料药、散剂等样品划“/”。
4.包装:注射用针剂(粉针)/注射液(水针)填写X支(瓶)/盒、片剂填写X片/瓶(袋/盒)、粉剂/散剂/预混剂/原料药填写Xg/袋、消毒剂、口服液填写XmL/瓶或X支(瓶)/盒。
5.抽样数量:5.1复核检验每批抽样数量不少于以下规定:a) 注射用针剂(粉针):125瓶(支)b) 注射液(水针)规格:1~20 mL:125瓶(支)规格:50~100 mL:45瓶(支)规格:250~500 mL:45瓶(支)c)片剂:2瓶(袋/盒)d) 粉剂/散剂/预混剂:12袋e) 原料药:200gf)消毒剂、口服液规格:1~20 mL:125瓶(支)规格:50~100 mL:12瓶(支)规格:250~500 mL:12瓶(支)5.2在线抽样数量,根据每个品种具体情况而定。
农业部公告第513号批准21家兽药生产企业为兽药GMP企业
【发布单位】农业部【发布文号】农业部公告第513号【发布日期】2005-06-23【生效日期】2005-06-23【失效日期】【所属类别】政策参考【文件来源】农业部农业部公告第513号批准21家兽药生产企业为兽药GMP企业根据《兽药生产质量管理规范》的规定,依照《兽药生产质量管理规范检查验收办法》,经现场检查及审核,现批准哈尔滨维科生物技术开发公司等21家兽药生产企业为兽药GMP 企业,并颁发《兽药GMP企业证书》(见附件)。
特此公告二○○五年六月二十三日附件:兽药 GMP合格企业目录本内容来源于政府官方网站,如需引用,请以正式文件为准。
出师表两汉:诸葛亮先帝创业未半而中道崩殂,今天下三分,益州疲弊,此诚危急存亡之秋也。
然侍卫之臣不懈于内,忠志之士忘身于外者,盖追先帝之殊遇,欲报之于陛下也。
诚宜开张圣听,以光先帝遗德,恢弘志士之气,不宜妄自菲薄,引喻失义,以塞忠谏之路也。
宫中府中,俱为一体;陟罚臧否,不宜异同。
若有作奸犯科及为忠善者,宜付有司论其刑赏,以昭陛下平明之理;不宜偏私,使内外异法也。
侍中、侍郎郭攸之、费祎、董允等,此皆良实,志虑忠纯,是以先帝简拔以遗陛下:愚以为宫中之事,事无大小,悉以咨之,然后施行,必能裨补阙漏,有所广益。
将军向宠,性行淑均,晓畅军事,试用于昔日,先帝称之曰“能”,是以众议举宠为督:愚以为营中之事,悉以咨之,必能使行阵和睦,优劣得所。
亲贤臣,远小人,此先汉所以兴隆也;亲小人,远贤臣,此后汉所以倾颓也。
先帝在时,每与臣论此事,未尝不叹息痛恨于桓、灵也。
侍中、尚书、长史、参军,此悉贞良死节之臣,愿陛下亲之、信之,则汉室之隆,可计日而待也。
臣本布衣,躬耕于南阳,苟全性命于乱世,不求闻达于诸侯。
先帝不以臣卑鄙,猥自枉屈,三顾臣于草庐之中,咨臣以当世之事,由是感激,遂许先帝以驱驰。
后值倾覆,受任于败军之际,奉命于危难之间,尔来二十有一年矣。
先帝知臣谨慎,故临崩寄臣以大事也。
受命以来,夙夜忧叹,恐托付不效,以伤先帝之明;故五月渡泸,深入不毛。
兽药产品批准文号报批相关文件
兽药产品批准文号报批相关文件概述兽药产品批准文号是用于兽药产品的唯一标识,同时也是确定兽药合法性和规范性的必备证件。
由于兽药的研发和生产存在一定的风险,因此在国内兽药行业,药品管理部门对兽药的批准和监管非常重视。
本文将围绕兽药产品批准文号报批相关文件进行详细阐述。
一、兽药产品批准文号的含义兽药产品批准文号是管理部门对兽药产品所进行的批准,同时也是兽药产品唯一的标识和管理凭证。
兽药产品批准文号包括兽药注册号、进口兽药的进口药品注册证等,这些证件是保证兽药规范使用的重要凭证。
二、兽药产品批准文号的申请1. 申请条件(1)药品在临床使用以及过程中必要的安全性、有效性等方面符合相关法律法规的要求;(2)药品生产工艺符合规范,制品的质量控制符合国家要求;(3)药品使用说明符合国家规定;(4)已开展充分、完整的安全性、有效性实验和临床试验,证明兽药达到预期治疗效果并对动物的危害最小等要求。
2. 申请流程(1)根据《动物药品审批管理办法》的规定进行申请;(2)申请人按照清单要求提供申请资料;(3)申请人提交申请资料,由专业人员进行初审并制定初审报告;(4)省、市级以上兽药管理部门组织专家进行审核并制定审查报告;(5)省、市级以上兽药管理部门组织专家现场审查;(6)申请人按照审查结论及要求进行补正或修改申请文件;(7)省、市级以上药品监督管理部门审批。
三、兽药产品批准文号的使用兽药产品批准文号是对兽药品种进行有效管理的标志,是兽药的区别识别凭证。
兽药产品批准文号将在兽药的生产、销售和使用的各个环节发挥着重要的作用。
1. 兽药的生产环节在兽药的生产环节,兽药产品批准文号将用于生产批号、药品规格以及验收检验等环节。
2. 兽药的销售与宣传环节在兽药销售与宣传环节中,产品批准文号将作为兽药的规范标识,防止仿冒伪劣兽药的出现。
3. 兽药的使用环节在兽药的使用中,兽药产品批准文号不仅是确认兽药品种的重要凭证,同时还要对兽药剂量、使用方法等进行研究和规范,以保证兽药的安全有效使用。
农业部公告第1765号――关于批准2种兽药产品为新兽药的公告-农业部公告第1765号
农业部公告第1765号――关于批准2种兽药产品为新兽药的公告正文:---------------------------------------------------------------------------------------------------------------------------------------------------- 农业部公告(第1765号)根据《兽药管理条例》和《兽药注册办法》规定,经审查,批准北京康牧兽医药械中心制药厂等2家单位申报的复方达克罗宁滴耳液等2种兽药产品为新兽药,现核发《新兽药注册证书》,并发布产品试行规程、质量标准、说明书和标签,自发布之日起执行。
特此公告。
二〇一二年五月八日附件1:新兽药注册目录新兽药名称研制单位类别新兽药注册证书号备注复方达克罗宁滴耳液北京康牧兽医药械中心制药厂四类(2012)新兽药证字12号注册猪传染性胸膜肺炎二价蜂胶灭活疫苗(1型CD株+7型BZ株)山东华宏生物工程有限公司三类(2012)新兽药证字13号注册附件2.制造及检验试行规程(略)附件3:猪传染性胸膜肺炎二价蜂胶灭活疫苗(1型CD株+7型BZ株)等2种兽药产品质量标准、说明书和标签一、猪传染性胸膜肺炎二价蜂胶灭活疫苗(1型CD株+7型BZ株)质量标准、标签和说明书(一)猪传染性胸膜肺炎二价蜂胶灭活疫苗(1型CD株+7型BZ株)质量标准猪传染性胸膜肺炎二价蜂胶灭活疫苗(1型CD株+7型BZ株)Swine infectious pleuropneumonia propolis-adjuvant vaccine,inactivated(Type1,StrainCD+Type7,StrainBZ)Zhu Chuanranxingxiongmofeiyan Erjia Fengjiao Miehuoyimiao(1 Xing CD Zhu+7 Xing BZ Zhu)本品系用免疫原性良好的猪胸膜肺炎放线杆菌血清1型CD菌株、血清7型BZ菌株,分别接种适宜培养基培养,收获培养物,经甲醛溶液灭活后,与蜂胶佐剂混合乳化制成,用于预防由血清1型、7型猪胸膜肺炎放线杆菌引起的猪传染性胸膜肺炎。
兽药产品批准文号申请表
兽药产品批准文号申请表
申请单位(盖章):
申请日期:年月日受理日期:年月日
中华人民共和国农业部制
填表说明
1. 本表须用黑色钢笔、签字笔填写,也可以自制,用A4纸打印,一式二份。
字迹不清,项目填写不全者,不予受理。
一份表格仅限于一个品种的一个含量规格,不同品种、不同含量规格产品需另行填写。
2. 兽药类别表述为:“兽药添字”、“兽药生字”、“兽药字”。
3. 本表1~12栏由申请企业填写。
检验机构复核检验需要连续生产的三批产品检验结果,提供检验报告一式二份。
4. 13~14栏分别由农业部委托的检验机构和企业所在地省级畜牧兽医行政管理部门填写,并签字、盖章。
其中,兽用生物制品不经省级畜牧兽医行政管理部门审核。
5. 15~18栏由农业部填写。
6. 本表签章复印件无效。
申请编号:。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
兽药报批号盐酸多西环素批生产指令单
[产品名称]:盐酸多西环素
[产品规格]:XX克/支
[批准文号]:XXX
[生产工艺流程]
1.原料准备:收货验货,对符合质量要求的原材料进行按工艺配比计算、称量、混合。
2.生产操作:将准备好的原料,按照生产工艺的要求进行加水混合,搅拌均匀后进行制粒、干燥、过筛等工序。
3.包装操作:按照包装要求,对生产好的产品进行称重、打印生产信息、灭菌、包装等操作。
4.质检操作:对包装好的产品进行外观检查、检验与标准相符性、物化指标检验等操作。
5.成品入库:符合质量要求的产品,经质管部门验收后,入库并记录。
[生产要求]
1.生产环境要求清洁、温度适宜、通风良好。
2.使用原材料要求符合公司质量管理要求,验收时要逐批检验并盖章。
3.生产人员要经过公司内部培训并取得相应的操作技能证书。
4.生产设备要求定期维护、检修和保养,并严格按照工艺流程进行操作。
5.生产过程中发现异常情况要及时处理,并进行相应记录。
6.生产操作符合公司生产管理制度要求,并保持记录。
[生产记录要求]
1.原料进货验货记录、原材料检验记录、生产批次记录、质检记录、成品入库记录等要求真实、准确、完整和及时。
2.生产记录要求符合公司规定的记录格式、内容和保存时间,严禁随意更改记录内容。
3.生产记录必须于当次生产完毕后填写、审核、签字、归档。
[生产安全要求]
1.生产操作人员必须进行安全培训,并熟知各类危险源和应急处置措施。
2.严格执行操作规程,禁止私自更改操作步骤。
3.生产操作人员在使用生产设备时,必须戴上相应的防护用品。
4.班组长和厂务人员必须密切关注生产现场情况,及时采取应对措施。
[备注]
1.本产品生产过程严格遵循相关法律法规及公司各项内控制度。
2.生产记录、质检记录、原材料检验记录、成品入库记录等资料订阅公司存档备查。
3.本指令单经审核批准后,可供参考执行。
