高二化学水的电离平衡
水的电离和溶液的酸碱性典型例题及习题
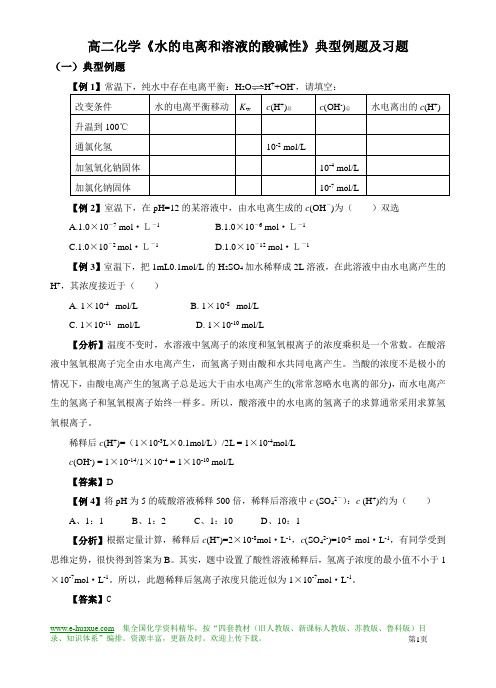
高二化学《水的电离和溶液的酸碱性》典型例题及习题(一)典型例题【例1】常温下,纯水中存在电离平衡:H+-,请填空:改变条件水的电离平衡移动K w c(H+)总c(OH-)总水电离出的c(H+) 升温到100℃通氯化氢10-2 mol/L加氢氧化钠固体10-4 mol/L加氯化钠固体10-7 mol/L【例2】室温下,在pH=12的某溶液中,由水电离生成的c(OH-)为()双选A.1.0×10-7 mol·L-1B.1.0×10-6 mol·L-1C.1.0×10-2 mol·L-1D.1.0×10-12 mol·L-1【例3】室温下,把1mL0.1mol/L的H2SO4加水稀释成2L溶液,在此溶液中由水电离产生的H+,其浓度接近于()A. 1×10-4 mol/LB. 1×10-8 mol/LC. 1×10-11 mol/LD. 1×10-10 mol/L【分析】温度不变时,水溶液中氢离子的浓度和氢氧根离子的浓度乘积是一个常数。
在酸溶液中氢氧根离子完全由水电离产生,而氢离子则由酸和水共同电离产生。
当酸的浓度不是极小的情况下,由酸电离产生的氢离子总是远大于由水电离产生的(常常忽略水电离的部分),而水电离产生的氢离子和氢氧根离子始终一样多。
所以,酸溶液中的水电离的氢离子的求算通常采用求算氢氧根离子。
稀释后c(H+)=(1×10-3L×0.1mol/L)/2L = 1×10-4mol/Lc(OH-) = 1×10-14/1×10-4 = 1×10-10 mol/L【答案】D【例4】将pH为5的硫酸溶液稀释500倍,稀释后溶液中c (SO42-):c (H+)约为()A、1:1B、1:2C、1:10D、10:1【分析】根据定量计算,稀释后c(H+)=2×10-8mol·L-1,c(SO42-)=10-8mol·L-1,有同学受到思维定势,很快得到答案为B。
水的电离与溶液pH关系

学生专用7月25日高二化学一、水的电离1、H2O + H2O H3O+ + OH- 简写: H2O H++ OH-2、 H2O的电离常数K电离==O)C(H)C(OH)C(H2-•+3、水的离子积25℃K W= c(H+)· c(OH-)= = 1.0×10-14。
4、影响因素:温度越高,Kw越大,水的电离度越大。
对于中性水,尽管温度升高Kw,增大,但仍是中性水,5、KW不仅适用于纯水,还适用于酸性或碱性的稀溶液,不管是哪种溶液均有:C(H+)H2O == C(OH―)H2OKW== C(H+)溶液·C(OH―)溶液6. K w揭示了在任何水溶液中均存在H+和OH-,只要温度不变,K w不变,H+和OH-浓度大小是一种“此消彼涨”的动态关系。
二、影响水的电离平衡的因素条件K w平衡移动水的电离程度c(H+)c(OH-)c(H+)c(OH-)相对大小溶液的酸碱性升温↑→↗↗↗相等中性通HCl(g)—←↘↗↘c(H+)较大酸性加NaOH(s)—←↘↘↗c(OH-)较大碱性加NaCl(s)—————相等中性(1) K w不仅适用于水,还适用于酸性或碱性的稀溶液。
不管哪种溶液均有c(H+)H2O=c(OH-)H2O。
(2) 水溶液的酸碱性取决于溶液中c(H+)和c(OH-)的相对大小。
练习1 纯水在10℃和50℃的H+浓度,前者与后者的关系是()A.前者大B.后者C.相等大D.不能确定练习2 .水的电离过程为H2O H+ + OH-,在不同温度下其离子积为KW25℃=1×10-14, KW35℃ =2.1 ×10-14。
则下列叙述正确的是:()A、c(H+)随着温度的升高而降低B、在35℃时,纯水中 c(H+) >c(OH-)C、水的电离常数K25 ℃>K35 ℃D、水的电离是一个吸热过程练习3 0.01mol/L盐酸溶液中,c(H+)、 c(OH-)分别为多少?由水电离出的 c(H+) H2O 、c(OH-) H2O分别是多少?练习4 0.01mol/L NaOH溶液中, c(H+) 、 c(OH-)分别为多少?由水电离出的c(H+) H2O、c(OH-) H2O分别是多少?练习5、判断正误:1)任何水溶液中都存在水的电离平衡。
312电离平衡常数-2023学年高二化学上学期同步精品课件(人教版2019选择性必修1)

第一节 电离平衡第二课时电离平衡常数第三章 水溶液中的离子反应与平衡1、构建电离平衡常数模型。
2、能应用模型解释弱电解质在水溶液中发生的变化。
在一定条件下,弱电解质的电离达到平衡时,溶液中弱电解质电离所生成的各种离子浓度的乘积,与溶液中未电离分子的浓度之比是个常数,这个常数称为电离平衡常数,简称电离常数。
一、电离平衡常数阅读课本P57,总结电离平衡常数的概念1、概念2、表达式本质上也是平衡常数,所以表示方法一样电离方程式电离常数表达式CH3COOH NH3·H2O CH3COOH ⇌ CH3COO- + H+Ka= c(H+)·c(CH3COO−)c(CH3COOH) NH3·H2O ⇌ NH4++ OH-K b = c(NH4+)·c(OH-)c(NH3·H2O)(1)一元弱酸、弱碱通常用K a、K b分别表示弱酸、弱碱的电离常数。
电离方程式电离常数表达式H2CO3 Cu(OH)2H2CO3 ⇌ H+ +HCO3−HCO3- ⇌ H+ +CO32−Ka1= c(H+)·c(HCO3−)c(H2CO3)Ka2= c(H+)·c(CO32−)c(HCO3−)Cu(OH)2 ⇌ Cu2+ + 2OH- Kb=c(Cu2+ )·c2(OH−)c[Cu(OH)2](2)多元弱酸、弱碱3、影响弱电解质电离常数的因素:内因:弱电解质的性质:电解质越弱,Ka(或Kb)越小,越难电离,酸 (碱)的酸(碱)性越弱。
外因:只与温度有关。
T越大, Ka(Kb)越大。
CH3COOH 25℃0℃电离平衡常数Ka=1.75×10-5Ka=1.65×10-525℃CH 3COOH HCN 电离平衡常数Ka=1.75×10-5Ka=4.9×10-10CH 3COOH 比HCN 酸性强4、电离平衡常数的意义H 3PO 4H + + H 2PO 4- Ka1=7.1H 2PO 4-H ++ HPO 42- Ka 2=6.2HPO 42-H + + PO 43- Ka 3=4.5多元弱酸的分步电离一步比一步难。
高二化学选修4 电离平衡

正向
移动。
问题引导下的再学习 CH3COOH
平衡 电离 改变条件 移动 程度 升高温度 正向 增大 加浓盐酸 逆向 减小
CH3COO- + H+ △H>0
C(CH3COOH) C(CH3
COO--)
+ C(H )
溶液 酸性
减小 增大 增大 减小
增大
减小 增大 增大 减小 增大
增大 增强 增大 增强
5. H+浓度相等的HCl和CH3COOH加水稀释 c(H+)
a b
V(H2O)
a CH3COOH
b HCl
问题引导下的再学习
6. 等体积c(H+)相等的HCl和CH3COOH中加入足量颗粒 大小相同的Zn粒
强酸 HCl① c(酸) 开始速率 反应过程中速 率下降快慢 过程中速率 生成V(H2)
CH弱酸 3COOH②
第一节
弱电解质的电离
电离平衡
第二课时
预习检测
1.化学平衡状态的特征? 逆、动、等、定、变 2.密闭容器中加入1mol N2、3mol H2,开始发生反应: N2+3H2 2NH3,画出建立化学平衡的v-t图。
3.勒夏特列原理的内容?适用范围?
4.Cl2+H2O=H++Cl-+HClO,加水稀释,平衡如何移动?
加 逆向 减小 CH3COONa
加NaOH 正向 增大
减小 减弱
减小 减弱
加水
正向 增大
减小
增大
减小 减弱
增大 增强
加冰醋酸 正向 减小
问题引导下的再学习 三、电离平衡移动的应用
1.比较1mol/L HCl①和1mol/L CH3COOH②中H+浓度 c(H+)= 1mol/L c(H+) < 1mol/L ① > ② 2.比较1mol/L HCl①和0.1mol/L HCl ②中H+浓度 ① > ② ① = 10×②
第三章 水溶液中的离子平衡 章末归纳与整理-高二化学(人教版选修4)

<7
c(H+)<c(OH-)
c(H+)<10-7mol·L-1
>7
pH=-lgc(H+) 常温下:①pH相同的酸(或碱),酸(或碱)越弱,其物质的量 浓度越大。②pH相同的强酸和弱酸溶液,加水稀释相同的 倍数时,强酸溶液的pH变化大。
2.酸碱中和滴定过程中的溶液的pH变化规律:在中和反应中,溶液
pH发生很大的变化,在滴定过程中会因pH突变而使指示剂发生颜色变
中和滴定
1.溶液的酸碱性规律:取决于溶液中c(H+)和c(OH-)的相对大小:
溶液 类别
中性 溶液 酸性 溶液 碱性 溶液 定义
规律
c(H+)与c(OH-)的 关系
室温(25 ℃)
数值
pH
c(H+)=c(OH-) c(H+)=c(OH-)=10-7mol·L-1 =7
c(H+)>c(OH-)
c(H+)>10-7mol·L-1
2.电离平衡的移动与电离平衡常数K、离子浓度的关系
实例 改变条件 加水稀释
CH3COOH CH3COO-+H+ ΔH>0
NH3·H2O
NH4++OH- H+)
c(OH-)
移动方 向
平衡常 数
c(OH-)
c(H+)
向右 不变 减小 增大 向右 不变 减小 增大
加HCl 加NaOH
盐的类别 溶液的酸碱性
原因
强酸 弱碱盐
强碱 弱酸盐
呈酸性, pH<7
呈碱性, pH>7
弱碱阳离子与H2O电离出的OH-结 水解实质:盐电
合,使c(H+)>c(OH-)
离出的阴离子、
弱酸根阴离子与H2O电离出的H+
阳离子与H2O电离 出的H+或OH-结
结合,使c(OH-)>c(H+)
鲁科版化学反应原理第三章《物质在水溶液中的行为》寒假复习学案及答案

《第三章物质在水溶液中的行为》寒假统考复习学案编辑人:高二化学组 2013.12.23一、水的电离:精确实验表明,水是一种极弱电解质,存在有电离平衡:在25℃时纯水中 ,[H+]=[OH-] = ,Kw = [H+][OH-] = mol-2·L-2[结论] 1、水的电离是个过程,故温度升高,水的Kw。
2、水的离子积是水电离平衡时的性质,它不仅适用于纯水,也适用于任何稀溶液。
即25℃时溶液中[H+][OH-] = 1.0× 10-14mol-2•L-23、在酸溶液中,[H+]近似看成是酸电离出来的H+浓度,[OH-]则来自于水的电离。
4、在碱溶液中,[OH-]近似看成是碱电离出来的OH-浓度,而[H+]则是来自于水的电离。
【练习】1.常温下,某溶液中由水电离出来的c(H+)=1.0×10-13mol·L-1,该溶液可能是( )①二氧化硫②氯化铵水溶液③硝酸钠水溶液④氢氧化钠水溶液A.①④B.①②C.②③D.③④2. 某溶液中水电离产生的C(H+)=10-3mol/L,,该溶液中溶质可能是()①Al2(SO4)3②NaOH ③NH4Cl ④NaHSO4 A、①②B、①③C、②③D、①④3. 25℃时,水的电离达到平衡:H 2O H++OH-;ΔH>0,下列叙述正确的是()A.将水加热,K W增大,溶液的pH增大B.向水中加入稀氨水,平衡正向移动,c(OH-)增加C.向水中加入少量固体硫酸氢钠,c(H+)降低,K W不变D.向水中加入少量固体CH3COONa,平衡正向移动,c(OH-)增加4. 能促进水的电离,并使溶液中C(H+)>C(OH—)的操作是()(1)将水加热煮沸(2)向水中投入一小块金属钠(3)向水中通CO2 (4)向水中通NH3(5)向水中加入明矾晶体(6)向水中加入NaHCO3固体(7)向水中加NaHSO4固体A、(1)(3)(6)(7)B、(1)(3)(6)C、(5)(7)D、(5)二、溶液的酸碱性和pH值1.溶液酸性、中性或碱性的判断依据是:看和的相对大小.在任意温度的溶液中:若c(H+)>c(OH-) c(H+)=c(OH-)c(OH-)>c(H+)溶液的pH值:氢离子浓度的负对数。
辽宁省建平县第二高级中学高二化学《第二节水的电离和溶液的酸碱性》课件
(3)PH为2 的盐酸和PH为12 的某碱等体积相混合,则混合 液PH_______
(4)PH为12 的NaOH溶液和PH为2的某酸溶液等体积相混 合,则混合液PH _____
(5)盐酸的PH值为X,NaOH溶液的PH为Y,体积相混合, 则混合液PH _____
溶液PH值 1.0
PH
12
10 8
6 4 2
0
10
19.96 20.00 20.04
4.0 7.0 10.0
30.00
12.3
反应终点
突
pH
变 范
围
20 30
40 V(NaOH ) / ml
指示剂选择
PH
酚酞
12
10 8
7
6 4 2
0
10
20 30
颜色突变范围
40 V(NaOH ) / ml
指示剂选择
7.判断下列说法是否正确:
(1)pH=7的溶液是中性溶液。
()
(2)H2S溶液中c(H+):c(S2-)=2:1 。
()
(3)0.1 mol/L的HAc中c(H+)是0.2 mol/L HAc中c(H+)
的1/2。
()
(4)0.1 mol/L的HAc中c(H+) c(HAc)大于0.01 mol/L
结论:1. pH1+ pH2<14的强酸强碱等体积混合后,pH混= pH酸+0.3
2. pH1+ pH2=14的强酸强碱等体积混合后,pH混= 7
3. pH1+ pH2>14的强酸强碱等体积混合后, pH混= pH碱-0.3
22人教版高中化学新教材选择性必修1--第一节 电离平衡
强电解质,电离平衡将向电离的反方向移动。
(4)化学反应:在弱电解质溶液中加入能与弱电解质电离产生的某种离子
反应的物质,电离平衡将向电离的方向移动。
3. 实例
当外界条件(如浓度、温度等)发生变化时,电离平衡就会发生移动。弱电
解质的电离平衡移动遵循化学平衡移动原理。以 CH3 COOH ⇌ CH3 COO− +
+
−
NH
⋅
H
O
⇌
NH
+
OH
3
2
4
③___________________________。
想一想1 NaHSO4 (溶于水)的电离方程式为 NaHSO4 = Na+ + H + + SO2−
4 ,
有的同学类比 NaHSO4 写出 NaHCO3 的电离方程式 NaHCO3 = Na+ + H + +
部分
2. 强电解质与弱电解质的比较
强电解质
概念
在水溶液中能⑧
全部
________________电离的电
解质
电解质在溶
液中的存在 只有阴、阳离子
形式
弱电解质
在水溶液中只能⑨
部分
________________电离的电解质
既有阴、阳离子,又有电解质分
子
续表
强电解质
弱电解质
a.多数盐(包括难溶性盐);
未电离分子的浓度
各种离子浓度的乘积
①______________________,与溶液中②___________________之比是一个
常数,这个常数叫做电离平衡常数,简称电离常数。
高二化学第二节 水的电离和溶液的pH教案 人民版
高二化学第二节水的电离和溶液的pH教案人民版【预习导航学案】(走进去,眼前一道美丽的风景)〖目标导入〗一、水的电离1、水是一种极弱的电解质,在水中水的电离形式为:,加入盐酸会水的电离(填“促进”、“抑制”),加入烧碱会水的电离(填“促进”、“抑制”);加入盐不一定影响水的电离,加入食盐则水的电离平衡移动。
2、水的离子积常数记做,其含义可以表示为:,常温下(250C)水所电离出的c(H+)=c(OH-)= ,所以常温下的K W= ,水的离子积常数只和因素有关,比如,已知在1000C时,K W=1×10-12,则此时纯水中c(H+)=c(OH-)= ,3、pH是描述溶液酸碱性强弱的一个数值,其计算式为:。
常温时纯水的pH= ;二、溶液的酸碱性4、由于任何溶液中都同时含有H+和OH-,故而判断溶液的酸碱性关键看H+和OH-的相对大小:在常温下(250C)时:酸性溶液:c(H+) c(OH-),其pH范围;中性溶液:c(H+) c(OH-),其pH范围;碱性溶液:c(H+) c(OH-),其pH范围;5、对于一个溶液,其pH 则酸性越强,其 pH 则碱性越强。
〖轻松鼠标〗一、1.H2O H++OH-抑制抑制不2.Kw Kw =c(H+)×c(OH-) 1×10-7mol/L1×10-14温度1×10-6mol/L3.pH= —lg c(H+)7二、4.> pH<7= pH<=7< pH>75.越小越大【互动研学课堂】(名师点拨,顺利走进互动学习快车道)〖教材串讲〗一、水的电离水是一种极弱的电解质, 它能微弱的电离,成水合氢离子和氢氧根离子,其电离的方程式为:H2O+H2O H3O++OH-或 H2O H++OH-这个过程是一个吸热过程, 升温, 水的电离平衡右移, 其电离程度增大。
1、精确的实验证明测得,在25℃(常温)时, 纯水中 c(H+) 和 c(OH-) 都等于1×10-7mol/L,即25 ℃时,kw=c(H+) · c(OH-) =1×10-14,kw 为水的离子积常数,〖例题解说〗【例1】1、下列物质溶于水时,会使水的电离平衡逆向移动的是()A. NaClB.NaOHC.HClD.乙醇答案:BC点拨:由水的电离H2O H++OH-,结合勒夏特列原理可以判断,加入NaOH 或HCl 后,相应增加溶液中OH-或 H+的浓度,故而使水的电离向逆向移动;而加入NaCl后,其电离出的Na+ 和Cl- 对水的电离不会产生任何影响;乙醇是非电解质,不会电离,故而对于谁的电离平衡也没有任何影响。
【高中化学电离平衡】电离平衡
高二化学备课组
第一节 弱电解质的电离平衡
▪ 一、强、弱电解质与结构的关系
单质
强电解质
纯净物
电解质
物质
化合物
弱电解质
混合物
非电解质
绝大部分盐
离子化合物 强碱
强电解质
化
某些金属氧化物
合
强极性共价化合
物
物(如强酸)
共价化合物
弱极性共 价化合物
弱酸 弱碱 弱电解质 水 大多有机物
大多非金属 非电解质 氧化物
▪ 4)多元弱碱的电离情况比较复杂,中学阶 段将其简单的认为是一步电离。如:
▪ Fe(OH)3≒Fe3++3OH-
▪ 5)酸式根离子只有HSO4-可以拆写。
▪ 6)注意物质的电离平衡与溶解平衡的区别。 ▪ Ca(OH)2(s)≒ Ca2++2OH▪ Ca(OH)2 = Ca2++2OH-
▪ 三、溶液的浓度与溶液中离子浓度的关系 ▪ 例:0.1mol/L的下列溶液中,所含c(H+)
▪ 若在纯水滴加冰醋酸,试分析一下所形成 的水溶液中发生哪些变化?
▪ 以醋酸为例,研究弱电解质的电离过程中 实质上包含着哪几个过程?
▪ 弱电解质的电离过程中包含:
▪ (1)分子电离成离子;
▪ (2)离子结合成分子。
二、弱电解质的电离平衡
电离平衡和化
v v电离
电离平衡
学平衡一样, 当外界条件改
v分子化
▪ 电离方程式书写跟离子方程式书写有哪些 差别?
▪ 1、电解质的强弱与其溶解度大小无关。
▪ 2、电解质导电的前提是电离;而电离的条 件是在水分子作用下或熔融状态下。
