长春理工材料科学基础习题答案
材料科学基础习题第四章答案与翻译
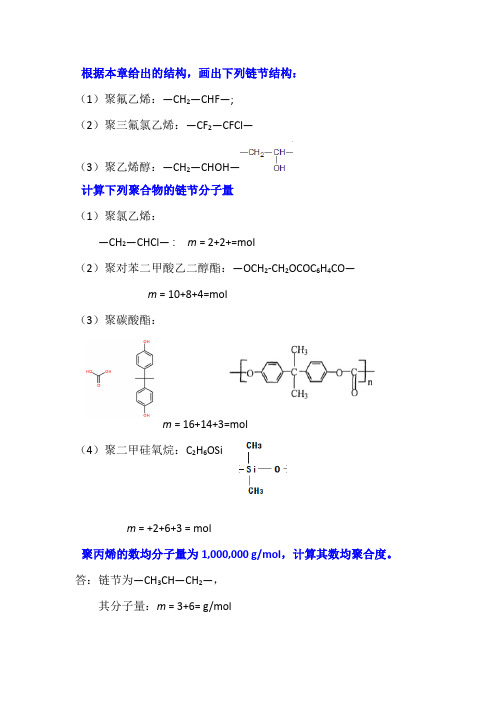
根据本章给出的结构,画出下列链节结构:(1)聚氟乙烯:—CH2—CHF—;(2)聚三氟氯乙烯:—CF2—CFCl—(3)聚乙烯醇:—CH2—CHOH—计算下列聚合物的链节分子量(1)聚氯乙烯:—CH2—CHCl— : m = 2+2+=mol(2)聚对苯二甲酸乙二醇酯:—OCH2-CH2OCOC6H4CO—m = 10+8+4=mol(3)聚碳酸酯:m = 16+14+3=mol(4)聚二甲硅氧烷:C2H6OSim = +2+6+3 = mol聚丙烯的数均分子量为1,000,000 g/mol,计算其数均聚合度。
答:链节为—CH3CH—CH2—,其分子量:m = 3+6= g/mol(a) 计算聚苯乙烯链节的分子量答:链节为CHC6H5CH2,分子量:m = 8+8=(b) 计算重均聚合度为25000的聚苯乙烯的重均分子量答:= 25000 g/mol = 2603800 g/mol下表列出了聚丙烯的分子量,计算(a) 数均分子量(b) 重均分子量(c) 数均聚合度(d) 重均聚合度x i w i 分子量分布(g/mol)8,00016,00016,00024,00024,00032,00032,00040,00040,00048,00048,00056,000答:(a)= 12000+20000+28000+36000+44000+52000 = 600+3200+6720+10080+8800+3640 = 33040 (g/mol)(b)= 12000+20000+28000+36000+44000+52000 = 240+2000+5600+10800+11880+10920 = 41440 (g/mol)(c)聚丙烯链节的分子量:m = g/mol(d)下表列出了某聚合物的分子量分布。
计算(a) 数均分子量(b) 重均分子量(c) 如果已知这一聚合物的重均聚合度为780,指出此聚合物为表所列聚合物中的哪一个为什么(d) 这一材料的数均聚合度为多少分子量分布(g/mol)x i w i15,00030,00030,00045,00045,00060,00060,00075,00075,00090,00090,000105,000105,000120,000120,000135,000答:(a)= 22500+37500+52500+67500+82500+97500+112500+127500 = 900+2625+8400+17550+19800+11700+9000+3825 = 73800 (g/mol)(b)= 22500+37500+52500+67500+82500+97500+112500+127500 = 225+1500+5775+16200+22275+15600+13500+ 6375 = 81450 (g/mol)(c)此聚合物为聚苯乙烯根据下面的分子量分布和重均聚合度为585的条件,判断是否为聚甲基丙烯酸甲酯均聚物分子量分布(g/mol)x i w i8,00020,00020,00032,00032,00044,00044,00056,00056,00068,00068,00080,00080,00092,000答:聚甲基丙烯酸甲酯链节分子式为:C5H8O2(—CH2CH3COOCH3C—);其分子量m = 5+8+2=mol重均分子量为:=14000+26000+38000+50000+62000+74000+86000=140+1300+4560+12500+16740+15540+7740=58520与条件相符,能形成均聚物高密度聚乙烯通过诱导氯原子随机取代氢而被氯化。
材料科学基础_习题与答案

材料科学基础_习题与答案材料科学基础作业习题§1 绪论1、仔细观察⼀下⽩炽灯泡,会发现有多少种不同的材料?每种材料需要何种热学、电学性质?2、为什么⾦属具有良好的导电性和导热性?3、为什么陶瓷、聚合物通常是绝缘体?4、铝原⼦的质量是多少?若铝的密度为2.7g/cm3,计算1mm3中有多少原⼦?5、为了防⽌碰撞造成纽折,汽车的挡板可有装甲制造,但实际应⽤中为何不如此设计?说出⾄少三种理由。
6、描述不同材料常⽤的加⼯⽅法。
7、叙述⾦属材料的类型及其分类依据。
8、试将下列材料按⾦属、陶瓷、聚合物或复合材料进⾏分类:黄铜钢筋混凝⼟橡胶氯化钠铅-锡焊料沥青环氧树脂镁合⾦碳化硅混凝⼟⽯墨玻璃钢9、 Al2O3陶瓷既牢固⼜坚硬且耐磨,为什么不⽤Al2O3制造铁锤?§2 晶体结构1、解释下列概念晶系、晶胞、晶胞参数、空间点阵、⽶勒指数(晶⾯指数)、离⼦晶体的晶格能、原⼦半径与离⼦半径、配位数、离⼦极化、同质多晶与类质同晶、正尖晶⽯与反正尖晶⽯、反萤⽯结构、铁电效应、压电效应.2、(1)⼀晶⾯在x、y、z轴上的截距分别为2a、3b、6c,求出该晶⾯的⽶勒指数;(2)⼀晶⾯在x、y、z轴上的截距分别为a/3、b/2、c,求出该晶⾯的⽶勒指数。
3、在⽴⽅晶系的晶胞中画出下列⽶勒指数的晶⾯和晶向:(001)与[210],(111)与[112],(110)与[111],(322)与[236],(257)与[111],(123)与[121],(102),(112),(213), [110],[111],[120],[321]4、写出⾯⼼⽴⽅格⼦的单位平⾏六⾯体上所有结点的坐标。
5、已知Mg2+半径为0.072nm,O2-半径为0.140nm,计算MgO晶体结构的堆积系数与密度。
6、计算体⼼⽴⽅、⾯⼼⽴⽅、密排六⽅晶胞中的原⼦数、配位数、堆积系数。
7、从理论计算公式计算NaC1与MgO的晶格能。
MgO的熔点为2800℃,NaC1为80l℃, 请说明这种差别的原因。
材料科学基础课后习题

材料科学基础课后习题课后习题第⼀章原⼦结构与结合键1.原⼦中⼀个电⼦的空间位置和能量可⽤哪四个量⼦数来决定?2.在多电⼦的原⼦中,核外电⼦的排布应遵循哪些个原则?3.在元素周期表中,同⼀周期或同⼀主族元素原⼦结构有什么共同特点?从左到右或从上到下元素结构有什么区别?性质如何递变?4.何谓同位素?为什么原⼦量不总为整数?5.铬的原⼦序数为24,共有四种同位数:4.31%的Cr原⼦含有26个中⼦,83.76%含有28个中⼦,9.55%含有29个中⼦,且2.38%含有30个中⼦。
试求铬的原⼦量?6.铜的原⼦序数为29,原⼦量为63.54,它共有两种同位素Cu63和Cu65,试求两种铜的同位素之含量百分⽐。
7.铟的原⼦序数为49,除了4f亚层之外其它内部电⼦亚层均已填满。
试从原⼦结构⾓度来确定铟的价电⼦数。
8.铂的原⼦序数为78,它在5d亚层中只有9个电⼦,并且在5f层中没有电⼦,请问在Pt的6s亚层中有⼏个电⼦?9.已知某元素原⼦序数为32,根据原⼦的电⼦结构知识,试指出它属于哪个周期?哪个族?并判断其⾦属性强弱。
10.原⼦间的结合键共有⼏种?各⾃特点如何?11.已知Si的原⼦量为28.09,若100g的Si中有5×1010个电⼦能⾃由运动,试计算:(a)能⾃由运动的电⼦占价电⼦总数的⽐例为多少?(b)必须破坏的共价键之⽐例为多少?12.S的化学⾏为有时象6价的元素,⽽有时却象4价元素。
试解释S这种⾏为的原因。
13.⾼分⼦链结构分为近程结构和远程结构。
他们各⾃包括内容是什么?14.按分⼦材料受热的表现分类可分为热塑性和热固性两⼤类,试从⾼分⼦链结构⾓度加以解释之。
15.分别绘出甲烷(CH4)和⼄烯(C2H4)之原⼦排列与键合。
16.下图1-1绘出三类材料——⾦属、离⼦晶体和⾼分⼦材料之能量与距离关系曲线,试指出它们各代表何种材料。
参考答案1.主量⼦数n、轨道⾓动量量⼦数li、磁量⼦数mi和⾃旋⾓动量量⼦数Si。
材料科学基础课后习题

材料科学基础课后习题第⼀章1. 作图表⽰⽴⽅晶体的晶⾯及晶向。
2. 在六⽅晶体中,绘出以下常见晶向等。
3. 写出⽴⽅晶体中晶⾯族{100},{110},{111},{112}等所包括的等价晶⾯。
4. 镁的原⼦堆积密度和所有hcp ⾦属⼀样,为0.74。
试求镁单位晶胞的体积。
已知Mg 的密度,相对原⼦质量为24.31,原⼦半径r=0.161nm 。
5. 当CN=6时离⼦半径为0.097nm ,试问:1) 当CN=4时,其半径为多少?2) 当CN=8时,其半径为多少?6. 试问:在铜(fcc,a=0.361nm )的<100>⽅向及铁(bcc,a=0.286nm)的<100>⽅向,原⼦的线密度为多少?7. 镍为⾯⼼⽴⽅结构,其原⼦半径为。
试确定在镍的(100),(110)及(111)平⾯上1中各有多少个原⼦。
8. ⽯英的密度为2.65。
试问:1) 1中有多少个硅原⼦(与氧原⼦)?2) 当硅与氧的半径分别为0.038nm 与0.114nm 时,其堆积密度为多少(假设原⼦是球形的)?9. 在800℃时个原⼦中有⼀个原⼦具有⾜够能量可在固体内移动,⽽在900℃时个原⼦中则只有⼀个原⼦,试求其激活能(J/原⼦)。
10. 若将⼀块铁加热⾄850℃,然后快速冷却到20℃。
试计算处理前后空位数应增加多少倍(设铁中形成⼀摩尔空位所需要的能量为104600J )。
()()()421,210,123[][][]346,112,021[][][][] []0121,0211,0110,0112,00013Mg/m 74.1=mg ρ+Na nm1246.0=Ni r 2mm ()2SiO 3Mg/m 3m 101091011. 设图1-18所⽰的⽴⽅晶体的滑移⾯ABCD 平⾏于晶体的上、下底⾯。
若该滑移⾯上有⼀正⽅形位错环,如果位错环的各段分别与滑移⾯各边平⾏,其柏⽒⽮量b ∥AB 。
1) 有⼈认为“此位错环运动移出晶体后,滑移⾯上产⽣的滑移台阶应为4个b ,试问这种看法是否正确?为什么?2) 指出位错环上各段位错线的类型,并画出位错运动出晶体后,滑移⽅向及滑移量。
材料科学基础课后习题答案1-4章

第一章原子结构与键合1. 主量子数n、轨道角动量量子数l i、磁量子数m i和自旋角动量量子数S i。
2. 能量最低原理、Pauli不相容原理,Hund规则。
3. 同一周期元素具有相同原子核外电子层数,但从左→右,核电荷依次增多,原子半径逐渐减小,电离能增加,失电子能力降低,得电子能力增加,金属性减弱,非金属性增强;同一主族元素核外电子数相同,但从上→下,电子层数增多,原子半径增大,电离能降低,失电子能力增加,得电子能力降低,金属性增加,非金属性降低;4. 在元素周期表中占据同一位置,尽管它们的质量不同,然它们的化学性质相同的物质称为同位素。
由于各同位素的含中子量不同(质子数相同),故具有不同含量同位素的元素总的相对原子质量不为正整数。
5. 52.0576. 73% (Cu63); 27% (Cu65)8. a:高分子材料;b:金属材料;c:离子晶体10.a) Al2O3的相对分子质量为M=26.98×2+16×3=101.961mm3中所含原子数为1.12*1020(个)b) 1g中所含原子数为2.95*1022(个)11. 由于HF分子间结合力是氢键,而HCl分子间结合力是范德化力,氢键的键能高于范德化力的键能,故此HF的沸点要比HCl的高。
第2章固体结构1.每单位晶胞内20个原子2.CsCl型结构系离子晶体结构中最简单一种,属立方晶系,简单立方点阵,Pm3m空间群,离子半径之比为0.167/0.181=0.92265,其晶体结构如图2-13所示。
从图中可知,在<111> 方向离子相接处,<100>方向不接触。
每个晶胞有一个Cs+和一个Cl-,的配位数均为8。
3.金刚石的晶体结构为复杂的面心立方结构,每个晶胞共含有8个碳原子。
金刚石的密度(g/cm3)对于1g碳,当它为金刚石结构时的体积(cm3)当它为石墨结构时的体积(cm3)故由金刚石转变为石墨结构时其体积膨胀4.]101[方向上的线密度为1.6. 晶面族{123}=(123)+(132)+(213)+(231)+(321)+(312)+)231(+)321(+)132(+)312(+)213(+)123(+)321(+)231(+)312(+)132(+)123(+)213(+)312(+)213(+)321(+)123(+)132(+)231(晶向族﹤221﹥=[221]+[212]+[122]+]212[+]122[+]221[+]122[+]212[+]221[+]122[+]221[+]212[7. 晶带轴[uvw]与该晶带的晶面(hkl)之间存在以下关系:hu+kv+lw=0;将晶带轴[001]代入,则h×0+k×0+l×1=0;当l=0时对任何h,k取值均能满足上式,故晶带轴[001]的所有晶带面的晶面指数一般形式为(hk0)。
材料科学基础试题及答案

材料科学基础试题及答案一、选择题(每题5分,共25分)1. 下列哪种材料属于超导材料?A. 铝B. 铜氧化物C. 镍D. 硅答案:B2. 下列哪种材料具有最高的弹性模量?A. 钢B. 石墨C. 玻璃D. 钛合金答案:B3. 下列哪种材料具有最佳的热稳定性?A. 硅酸盐B. 铝合金C. 聚乙烯D. 陶瓷答案:D4. 下列哪种材料主要用于制造光纤?A. 硅B. 石英C. 玻璃D. 聚合物答案:B5. 下列哪种材料具有最佳的耐腐蚀性?A. 钛B. 镍C. 铝D. 钢答案:A二、填空题(每题5分,共25分)6. 材料的力学性能主要包括______、______、______和______。
答案:强度、韧性、弹性、塑性7. 金属材料的熔点通常______于非金属材料的熔点。
答案:高于8. 陶瓷材料的硬度通常______于金属材料的硬度。
答案:高于9. 聚合物材料的疲劳寿命通常______于金属材料的疲劳寿命。
答案:低于10. 复合材料的主要优点是______、______和______。
答案:高强度、低密度、良好的耐腐蚀性三、判断题(每题5分,共25分)11. 金属材料的疲劳寿命与材料表面的光洁度无关。
()答案:错误12. 聚合物材料的热稳定性优于陶瓷材料。
()答案:错误13. 非晶态材料的性能介于晶态和非晶态材料之间。
()答案:正确14. 纳米材料的制备过程中,尺寸控制是关键因素。
()答案:正确15. 陶瓷材料的烧结过程是一种物理变化。
()答案:错误四、简答题(每题10分,共40分)16. 简述金属材料的强化方法。
答案:金属材料的强化方法主要包括以下几种:- 冷加工:通过冷加工(如冷轧、冷拔)改变材料的内部结构,提高其强度和硬度。
- 热处理:通过不同的热处理工艺(如淬火、退火、回火)改变材料的组织结构,提高其性能。
- 合金化:通过添加合金元素改变材料的化学成分,提高其性能。
- 表面处理:通过表面处理(如电镀、阳极氧化、涂层)改变材料的表面性能,提高其耐腐蚀性和耐磨性。
《材料科学与工程基础》习题和思考题及答案
《材料科学与工程基础》习题和思考题及答案《材料科学与工程基础》习题和思考题及答案第二章2-1.按照能级写出N、O、Si、Fe、Cu、Br原子的电子排布(用方框图表示)。
2-2.的镁原子有13个中子,11.17%的镁原子有14个中子,试计算镁原子的原子量。
2-3.试计算N壳层内的最大电子数。
若K、L、M、N壳层中所有能级都被电子填满时,该原子的原子序数是多少?2-4.计算O壳层内的最大电子数。
并定出K、L、M、N、O 壳层中所有能级都被电子填满时该原子的原子序数。
2-5.将离子键、共价键和金属键按有方向性和无方向性分类,简单说明理由。
2-6.按照杂化轨道理论,说明下列的键合形式:(1)CO2的分子键合(2)甲烷CH4的分子键合(3)乙烯C2H4的分子键合(4)水H2O的分子键合(5)苯环的分子键合(6)羰基中C、O间的原子键合2-7.影响离子化合物和共价化合物配位数的因素有那些?2-8.试解释表2-3-1中,原子键型与物性的关系?2-9.0℃时,水和冰的密度分别是1.0005g/cm3和0.95g/cm3,如何解释这一现象?2-10.当CN=6时,K+离子的半径为0.133nm(a)当CN=4时,半径是多少?(b)CN=8时,半径是多少?2-11.(a)利用附录的资料算出一个金原子的质量?(b)每mm3的金有多少个原子?(c)根据金的密度,某颗含有1021个原子的金粒,体积是多少?(d)假设金原子是球形(rAu=0.1441nm),并忽略金原子之间的空隙,则1021个原子占多少体积?(e)这些金原子体积占总体积的多少百分比?2-12.一个CaO的立方体晶胞含有4个Ca2+离子和4个O2-离子,每边的边长是0.478nm,则CaO的密度是多少?2-13.硬球模式广泛的适用于金属原子和离子,但是为何不适用于分子?2-14.计算(a)面心立方金属的原子致密度;(b)面心立方化合物NaCl的离子致密度(离子半径rNa+=0.097,rCl-=0.181);(C)由计算结果,可以引出什么结论?2-15.铁的单位晶胞为立方体,晶格常数a=0.287nm,请由铁的密度算出每个单位晶胞所含的原子个数。
材料科学基础习题1-答案-原子结构与键合
《材料科学基础》第一章习题——原子结构与键合1、2、a:高分子材料;b :金属材料;c :离子晶体3、对TiO2:IC=[1-e2)5.15.3)(25.0(--]×100=63.2% 对InSb :IC=[1-e 2)7.19.1)(25.0(--]×100=1.0% 4、由于HF 分子间结合力是氢键,而HCl 分子间结合力是范德瓦耳斯力,氢键的键能高于范德瓦耳斯力的键能,因此HF 的沸点要比HCl 的高。
5、6、热塑性:具有线性和支化高分子链结构,加热后会变软,可反复加工再形成;热固性:具有体型(立体网状)高分子链结构,不溶于任何溶剂,也不能熔融,一旦定型后不能再改变形状,无法再生。
7、官能度是指一个单体能与别的单体发生键合的数目。
要获得三维网状的高分子材料,其单体至少需要三个官能度。
8、数均相对分子质量n M =Σx i M i =21150;重均相对分子质量w M =Σωi M i =23200;而PVC 每链节系由2个C 原子、3个H 原子和1个Cl 原子所组成,C ,H 和Cl 的相对原子质量分别为12.01,1.008和35.45,因此每链节的质量m =2×12.01+3×1.008+35.45=62.50故数均聚合度n n =m M n=50.6221150=338线型高分子、支化高分子、交联高分子、三维网状高分子等四类高聚物能否溶于溶剂?加热过程中能否变成液态和气态? 结合键 高分子链结近程结构(一次结构):化学结构,分子链中的原子排列,结构单元的键接顺序,支化,交联等。
远程结构(二次结构):相对分子质量及分布,链的柔顺性及构象。
材料科学基础习题及答案word资料68页
第一章习题1.原子中一个电子的空间位置和能量可用哪四个量子数来决定?2.在多电子的原子中,核外电子的排布应遵循哪些原则?3.在元素周期表中,同一周期或同一主族元素原子结构有什么共同特点?从左到右或从上到下元素结构有什么区别?性质如何递变?4.何谓同位素?为什么元素的相对原子质量不总为正整数?5.铬的原子序数为24,它共有四种同位素:4.31%的Cr原子含有26个中子,83.76%含有28个中子,9.55%含有29个中子,且2.38%含有30个中子。
试求铬的相对原子质量。
6.铜的原子序数为29,相对原子质量为63.54,它共有两种同位素Cu63和Cu65,试求两种铜的同位素之含量百分比。
7.锡的原子序数为50,除了4f亚层之外其它内部电子亚层均已填满。
试从原子结构角度来确定锡的价电子数。
8.铂的原子序数为78,它在5d亚层中只有9个电子,并且在5f层中没有电子,请问在Pt的6s亚层中有几个电子?9.已知某元素原子序数为32,根据原子的电子结构知识,试指出它属于哪个周期?哪个族?并判断其金属性强弱。
10.原子间的结合键共有几种?各自特点如何?11.图1-1绘出三类材料—金属、离子晶体和高分子材料之能量与距离关系曲线,试指出它们各代表何种材料。
12.已知Si的相对原子质量为28.09,若100g的Si中有5×1010个电子能自由运动,试计算:(a)能自由运动的电子占价电子总数的比例为多少?(b)必须破坏的共价键之比例为多少?13.S的化学行为有时象6价的元素,而有时却象4价元素。
试解释S这种行为的原因。
14.A和B元素之间键合中离子特性所占的百分比可近似的用下式表示:这里x A和x B分别为A和B元素的电负性值。
已知Ti、O、In和Sb的电负性分别为1.5,3.5,1.7和1.9,试计算TiO2和InSb的IC%。
15.Al2O3的密度为3.8g/cm3,试计算a)1mm3中存在多少原子?b)1g中含有多少原子?16.尽管HF的相对分子质量较低,请解释为什么HF的沸腾温度(19.4℃)要比HCl的沸腾温度(-85℃)高?17. 高分子链结构分为近程结构和远程结构。
材料科学基础 习题2答案
习题2解答1、立方点阵单胞轴长为a,给出简单立方、体心立方、面心立方这三种点阵的每一个阵点的最近邻、次近邻的点数,求出最近邻、次近邻的距离。
2、某正交晶系单胞中,在如下位置有单原子存在:①(0, 1/2, 0),(1/2, 0, 1/2)两种位置都是同类原子;②([1/2, 0,0]),(0, 1/2, 1/2)上是A 原子,(0, 0, 1/2),(1/2, 1/2, 0)是B 原子。
问上两种晶胞各属于哪一种布喇菲点阵?3、Fig.1 shows a unit cell of a hypothetical metal. (a) To which crystal system does this unit cell belong? (b) What would this crystal structure be called? (c) Calculate the density of the material, given that its atomic weight is 141 g/mol.Fig.1 Fig. 2体心正方,=8.5×1034、The unit cell for uranium has orthorhombic symmetry, with a, b, and c lattice parameters of 0.286, 0.587 and 0.495 nm, respectively. If its density, atomic weight, and atomic radius are 19.05 g/cm3, 238.03 g/mol, and 0.1385 nm, respectively, compute the atomic packing factor(APF).=0.5365、Three different crystallographic planes for a unit cell of a hypothetical metal are shown in Fig.2. The circles represent atoms. (a) To what crystal system does the unit cell belong? (b) What would this crystal structure be called? (c) If the density of this metal is 18.91 g/cm3, determine its atomic weight.正交,面心正交,42.7g/mol。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
长春理工材料科学基础习题答案1.为什么没有五次轴和六次以上的轴?①因为五次和;数;每个C 原子周围有4个碳-碳原子之间形成共价键,所;二价阳离子A填充于四面体空隙,三价阳离子B填充于;4.萤石、反萤石;萤石:阳离子面心立方堆积,阴离子填充在阳离子构成;反萤石:结构与萤石完全相同,只是阴、阳离子的位置;2-二八面体:八面体以共棱方式相连,但八面体中的;2-三八面体:八面体以共棱方式相连,但1. 为什么没有五次轴和六次以上的轴?① 因为五次和高于六次的称轴的图形出现了中空的部位,这不符合晶体内部质点排列的结构特征,因而不可能存在。
② 另外,从基转角α来看,只有等于360°、180°、120°、90°、60°、0°才能整除360°,即n=360°/α为整数。
③ 正五边形上两平行行列的结点间距不等违反了空间格子规律,所以无五次轴。
2. 金刚石结构中C原子按面心立方排列,为什么其堆积系数仅为34%?每个C原子周围有4个碳-碳原子之间形成共价键,所以配位数是4,共价键有方向性和饱和性,1个C与4个C形成价键没有达到紧密堆积,结构内有空隙,堆积密度仅为34%而不是74.05%。
3. 正尖晶石、反尖晶石Page39二价阳离子A填充于四面体空隙,三价阳离子B填充于八面体空隙的叫正尖晶石。
(A)[B2]O4 二价阳离子A分布在八面体空隙中,而三价阳离子B一半填充四面体空隙,另一半在八面体空隙中称为反尖晶石。
(B)[AB] O44. 萤石、反萤石萤石:阳离子面心立方堆积,阴离子填充在阳离子构成的四面体空隙中。
CaF反萤石:结构与萤石完全相同,只是阴、阳离子的位置完全互换的晶体。
--碱金属氧化物5. 二八面体、三八面体2-二八面体:八面体以共棱方式相连,但八面体中的O离子只被其他两个阳离子所共用。
(2/3的八面体空隙被阳离子所填充)2-三八面体:八面体以共棱方式相连,但八面体中的O离子被其他三个阳离子所共用。
(全部的八面体空隙被阳离子所填充)6. 桥氧、非桥氧4+桥氧:在有限四面体群中连接两个Si离子的氧。
由于这种氧的电价已经饱和,一般不再与其他正离子配位,故桥氧也称非活性氧。
4+非桥氧:在有限四面体群中只有一侧与Si离子相近的氧。
另一侧可与其他阳离子配位,故非桥氧亦称活性氧。
7. 架状结构、层状结构、岛状结构Page44① 硅氧四面体之间通过四个顶角的桥氧连起来,向三维空间无限发展的骨架状结构称为架状结构。
② [SiO4]之间通过三个桥氧相连,在二维平面无限延伸构成的硅氧四面体层称层状结构。
③ 在硅酸盐晶体结构中,[SiO4]以孤立状态存在,[SiO4]之间通过其它阳离子连接起来,这种结构称为岛状结构。
8. 位移性转变、重建性转变Page50;Page67(旧书)位移性转变:不打开任何键,不改变原子最临近的配位数,仅仅使结构发生畸变,原子位置发生少许位移,所需的能量低,转变迅速快。
是高低温转变,可逆转变。
重建性转变:破坏原子间化学键,改变配位数,是晶体结构完全改变原样的一种多晶转变,所需能量高,转变速度慢,有些是不可逆转变。
9. 解释在AX型晶体结构中,NaCl型结构最多。
在AX型晶体结构中一般阴离子X的半径较大,而阳离子A半径较小,所以阴离子做紧密堆积,阳离子填充在其间隙中。
大多数AX型化合物的r+/r-比在0.414-0.732之间,应填充在八面体空隙中,即具有NaCl型结构,并且NaCl型晶体结构的对称性较高,所以AX型晶体结构中NaCl型结构最多。
10. TiO2的性质及应用。
Page50(旧书)⑴在光学性质上具有很高的折射率。
⑵在电学性质上具有高的介电系数。
⑶因此成为制备光学玻璃的原料,也是无线电陶瓷中需要的晶相。
⑷TiO2的纳米和介孔材料有催化净化效果,用于光催化下的净化功能。
11. 同质多晶和类质同晶现象?① 把同一化学组成在不同外界条件下(温度、压力、PH等),结晶成为两种以上不同结构的晶体的这一现象称为同质多晶或同质多象。
由此而产生的化学组成相同、结构不同的晶体称为变体。
② 化学组成相似或相近,在相同的热力学条件下形成的晶体具有相同的结构,这种现象称为类质同晶现象。
12. 分析说明高岭石、蒙脱石结构特点及其结构差异,并说明性质和结构的相关性。
高岭石:1:1层状结构,有解理性,层间为氢键。
因此可交换的阳离子容量小。
水分子不易进入单网层之间,晶体不会因为水含量增加而膨胀,故具有很好的可塑性。
蒙脱石:2:1层状结构,有解理性,层间为范氏键,易吸水,有膨润性。
具有很高的阳离子交换能力。
对Na、Ca、Mg、Al、H等正离子均有强的交换性。
13. 用晶体结构理论解释水泥原料石灰石中方解石的结构。
Page35水泥材料石灰石中方解石的结构可看成变了形的NaCl结构形式。
只要将NaCl 的三次轴竖立并加压使棱的夹角由2++2--2-4+2-90°变至101°55′。
然后以Ca代替Na,CO3代替Cl。
CO3中的C 在中心,三个O围绕C在一平面上成一等边三角2+形。
Ca的配位数为6。
14. 表征硅酸盐晶体的化学式方法有几种,分别是什么?并进行比较。
表征硅酸盐晶体的化学式方法有两种:一种是所谓的氧化物法,即把构成硅酸盐晶体的所有氧化物按一定比例和顺序全部写出来,先是+1价碱金属氧化物,其次是+2价,+3价的金属氧化物,最后是SiO2。
例如,钾长石的化学式写成K2O·Al2O3·6SiO2;另一种是无机络盐表示法,是把构成硅酸盐晶体所有离子按照一定比例和顺序全部写出来,再把相关的络阴离子3+4+2--用中括号[]括起来即可,先是+1价,+2价的金属离子,其次是Al和Si 的离子,最后是O或OH离子,如钾长石为K[AlSi3O8]。
比较:氧化物表示法的优点在于一目了然地反映出晶体的化学组成,可以按此组成配料来进行晶体的实验室合成。
无机络盐表示法则可以比较直观地反映出晶体所属的结构类型,进而可对晶体结构及性质做出一定程度的预测。
两种表示方法之间可以相互转换。
15. 影响形成置换固溶体的因素有哪些?Page73⑴离子尺寸因素的影响。
若以R1和R2分别表示溶剂或溶质离子的半径,则|R1?R2| R1<15%时,可能形成连续型固溶体,若在15%-30%时,可以形成有限型固溶体,大于30%时,不能形成固溶体⑵晶体结构类型的影响。
在1的条件下,两组份若具有相同的晶体结构类型,就易形成连续型固溶体⑶离子类型和键性。
化学键性质相近,即取代前后离子周围离子键性相近,则易形成固溶体。
⑷电价因素,形成固溶体时候,离子间可以等价置换,也可以不等价置换16. 形成固溶体后对晶体性质的影响。
1、稳定晶格:阻止某些晶型转变的发生;2、活化晶格:形成固溶体后,晶格结构有一定畸变,处于高能量的活化状态,有利于进行化学反应;3、固溶强化:固溶体的强度与硬度往往高于各组元,而塑性则较低,称为固溶强化。
1)间隙式溶质原子的强化效果一般要比置换式溶质原子更显著。
2)溶质和溶剂原子尺寸相差越大或固溶度越小,固溶强化越显著。
4、形成固溶体后对材料物理性质的影响:固溶体的电学、热学、磁学等物理性质也随成分而连续变化,但一般都不是线性关系。
固溶体的强度与硬度往往高于各组元,而塑性则较低。
5、催化剂:用锶、镧、锰、钴、铁等的氧化物间形成的固溶体消除有害气体很有效。
6、固溶体的电性能:固溶体形成对材料电学性能有很大影响,几乎所有功能陶瓷材料均与固溶体有关。
在电子陶瓷材料中制造出各种奇特性能的材料。
(1)超导材料(2)压电陶瓷7、透明陶瓷及人造宝石:利用加入杂质离子可以对晶体的光学性能进行调节或改变。
17. 写出缺陷反应及固溶体的化学式:⑴氧化钛固溶在氧化铝中⑵氧化钇固溶在氧化镁中⑶氯化钙固溶在氧化钾中⑷氧化钙固溶在氧化钍中⑸氧化铝固溶在氧化锆中⑴3TiO2—2Al2O3→3TiAl˙+VAl’’’+6OO Al4-3xTi3xO6⑵Y2O3—3MgO→2YMg˙+3OO+VMg’’Mg3-2xY2xO3⑶CaCl2—2KCl→CaK˙+VK’+2ClCl K2-xCaxCl2 ⑷CaO—ThO2→CaTh’’+OO +VO˙˙Th1-xCaxO2-x ⑸Al2O3—2ZrO2→2AlZr’+3OO+V O˙˙Zr2-2xAl2xO4-3x 18. 什么是弗伦克尔缺陷?其特征如何?Page55在晶格内原子热振动时,一些能量足够大的原子离开平衡位置后,进入晶格点的间隙位置,变成间隙原子,而在原来的位置上形成一个空位,这种缺陷称为弗伦克尔缺陷。
⑴空位和填隙原子成对出现,两者数量相等;⑵间隙——六方、面心立方密堆中的四面体和八面体空隙;⑶不需要自由表面;⑷晶体体积不发生变化;⑸一般情况下,离子晶体中阳离子比阴离子小,即正负离子半径相差大时,易形成弗伦克尔缺陷。
19. 什么是肖基特缺陷?其特征如何?Page55如果正常格点上的原子,热起伏过程中获得能量离开平衡位置,跳跃到晶体的表面,在原正常格点上留下空位,这种缺陷称为肖基特缺陷。
⑴只有空位没有填隙原子;⑵如果是离子晶体,阳离子空位和阴离子空位成对出现,两者数量相等,保持电中性;⑶需要有自由表面;⑷伴随新表面的产生,晶体体积增加;⑸正负离子半径相差不大时,肖基特缺陷为主。
20. 非化学计量缺陷及特点。
定义:指组成上偏离化学中的定比定律,所形成的缺陷。
它是由基质晶体与介质中的某些组分发生变换而产生。
特点:⑴产生及缺陷浓度与气氛性质、压力有关。
⑵可以看作是高价化合物与低价化合物的固溶体。
⑶缺陷浓度与温度有关,这一点可从平衡常数看出。
⑷非化学计量化合物都是半导体。
21. 为什么非计量化合物都是N型或P型半导体材料?N型半导体:阴离子空位的产生,束缚了自由电子,在电场的作用下,这些电子发生迁移,而形成电子导电,可以看作N型半导体。
P型半导体:结构中产生正离子空穴,引入电子空穴,在电场作用下运动而导电,可以看作P型半导体。
在非化学计量化合物中,有阴离子缺位型、阳离子填隙型,这两种缺陷都产生电子导电,所以是N型半导体材料。
还有阴离子间隙型、阳离子空隙型,这两种缺陷都产生电子空穴,在电场作用下运动而导电,所以是P型半导体材料。
22. 玻璃的分相。
Page93一个均匀的玻璃相在一定温度和固相组成内有可能分成两个互不溶解或部分溶解的玻璃相(或液相),并相互共存的现象称为玻璃的分相(或称液相不混溶现象)。
23. 形成氧化物玻璃的规则。
⑴网络中每个氧离子最多与两个网络形成离子相连。
⑵氧多面体中阳离子配位数必须是最小的即为4或3。
⑶一定是共顶连接,不能共棱或共面,使能量最低。
