化学镀铜废液的处理
氰镀铜废水处理

氰镀铜废水处理一、废水来源氰镀铜废水来源于电镀车间,主要为过滤过程中滴漏的镀液以及冲洗过滤机、过滤介质、渡槽等排放的废水,污染物的浓度高。
此外,渡槽排出残液以及老化报废的镀液、退镀液和污染严重的废弃槽液等,污染物的浓度很高。
还有车间的“跑、冒、滴、漏”排放的镀液。
二、设计依据:2.1 建设单位提供废水量及水质数据;2.2 环保部门对污染治理的指示与要求;2.3《室外排水设计规范》(GBJ14-87)有关规定;2.4《污水综合排放标准》(GB8978-1996)一级标准;2.5 环境工程手册《水污染防治卷》相关设计参数与技术要求。
三、设计原则:3.1 采用电解—反应—沉淀—过滤工艺,经处理后各项考察指标均可达到排放标准;3.2 采用低能耗处理工艺降低运行费用;3.3 采用构筑物组合化,减少占地面积。
四、废水水量、水质本工程主要处理生产中的漂洗废水,处理能力为含氰镀铜废水100 m3/ d。
该废水水质情况见下表:项目CN-PH Cu浓度mg/L10~40>720-80废水经过处理后出水可达到国家《污水综合排放标准》 (GB8978—96)一级标准,出水水质情况见下表:项 目CN-PH Cu浓度mg/L≤0.56~9≤0.5四、废水治理工艺氰镀铜过程中生产的含氰废水中除含有毒性大的游离氰化物外,尚有铜氰配合离子存在,所以破氰后重金属也将进入废水中。
为此在处理废水的同时要考虑重金属的处理。
经过考虑该废水的性质,不易使用生化处理,具体处理工艺为“电解—反应—沉淀—过滤”,该工艺具有去除污染物率高,大部分金属铜可以回收,出水稳定的特点,是当今比较成熟的处理工艺。
工艺流程图如下:工艺说明:氰镀铜废水流入调节池,使废水在此均质均量后由污水泵提升到电解槽,废水在电解槽中进行氧化还原反应,氰化物失去毒性,铜金属被回收,然后废水进入反应器,反应器内投加PAC、Ca2(OH)药剂产生混凝絮凝反应,使其废水中形成钒花,废水至此流入沉淀器进行沉淀,废水由出水堰流出,废水流入过滤池,废水经滤池底部进入,通过滤帽流过填料层,去除废水中的微粒物质和胶状物质,上清液经出水口达标排放。
PCB化学镀铜废液中铜的资源化回收工艺研究

PCB化学镀铜废液中铜的资源化回收工艺研究
梅以宁;魏喆;魏立安
【期刊名称】《电镀与涂饰》
【年(卷),期】2024(43)2
【摘要】[目的]化学镀铜废液含有高浓度重金属离子,属于危险废物,给环境保护带来巨大压力。
[方法]基于破络沉淀的原理处理化学镀铜废液,以回收其中的铜。
研究了不同促进剂、促进剂投加量、初始pH和反应时间对铜回收效果的影响,再进一步通过正交试验对回收工艺进行优化。
[结果]最优的工艺条件为:促进剂CAT-2投加量10 g/L,初始pH 14.0,反应时间48 h。
在该条件下处理后废液的总铜浓度由初始的3 680 mg/L降至1.00 mg/L,铜回收率达到99.97%。
[结论]采用破络沉淀法可实现对化学镀铜废液中铜的有效回收,有利于提高资源利用率,降低企业生产成本。
【总页数】6页(P149-154)
【作者】梅以宁;魏喆;魏立安
【作者单位】南昌航空大学环境与化学工程学院
【正文语种】中文
【中图分类】X703
【相关文献】
1.用磁场流化床从镀铜废液中回收铜
2.化学镀铜废液中回收酒石酸盐和铜的利用
3.溶剂萃取法从化学镀铜废液中回收铜
4.发泡铜阴极电沉积法回收酸性镀铜废液中的铜
5.PCB含铜三氯化铁废液置换除铜工艺中的影响因素研究
因版权原因,仅展示原文概要,查看原文内容请购买。
做完化学实验怎么处理废液

做完化学实验怎么处理废液一、废液处理原则对高浓度废酸、废碱液要经中和至中性时排放。
对于含少量被测物和其他试剂的高浓度有机溶剂应回收再用。
用于回收的高浓度废液应集中储存,以便回收;低浓度的经处理后排放,应根据废液性质确定储存容器和储存条件,不同废液一般不允许混合,避光、远离热源、以免发生不良化学反应。
废液储存容器必须贴上标签、写明种类、储存时间等。
二、废液处理方法含汞、铬、铅、镉、砷、酚、氰的废液必须经过处理达标后才能排放,实验室处理方法如下:1、含铜废液的处理实验用过的硫酸铜废液通过加适量铁粉回收金属铜,母液再经沉淀、过滤、稀释排放。
2、含汞废液的处理排放标准:废液中汞的最高容许排放浓度为0.05mg/L(以Hg计)。
处理方法:①硫化物共沉淀法:先将含汞盐的废液的pH值调至8-10,然后加入过量的Na2S,使其生成HgS沉淀。
再加入FeS04(共沉淀剂),与过量的S2-生成FeS沉淀,将悬浮在水中难以沉淀的HgS微粒吸附共沉淀.然后静置、分离,再经离心、过滤,滤液的含汞量可降至0.05mg/L以下。
②还原法:用铜屑、铁屑、锌粒、硼氢化钠等作还原剂,可以直接回收金属汞。
3、含镉废液的处理①氢氧化物沉淀法:在含镉的废液中投加石灰,调节pH值至10.5以上,充分搅拌后放置,使镉离子变为难溶的Cd(OH)2沉淀.分离沉淀,用双硫腙分光光度法检测滤液中的Cd离子后(降至0.1mg/L以下),将滤液中和至pH值约为7,然后排放。
②离子交换法:利用Cd2+离子比水中其它离子与阳离子交换树脂有更强的结合力,优先交换.4、含铅废液的处理在废液中加入消石灰,调节至pH值大于11,使废液中的铅生成Pb(OH)2沉淀.然后加入Al2(S04)3(凝聚剂),将pH值降至7-8,则Pb(OH)2与Al(OH)3共沉淀,分离沉淀,达标后,排放废液。
5、含砷废液的处理在含砷废液中加入FeCl3,使Fe/As达到50,然后用消石灰将废液的pH值控制在8-10。
含铜废水处理技术汇总

含铜废水处理铜的冶炼、加工以及电镀等工业生产过程中都会产生大量含铜废水,其含铜浓度高达几十mg/L,这种废水排入水体中,会严重影响水的质量,对环境造成污染。
水中铜含量达0.01mg/L 时,对水体自净有明显的抑制作用,超过3.0mg/L,会产生异味,超过15mg/L,就无法引用。
因此,工业废水必须经过处理才能达到环境要求。
本文介绍了几种常用的含铜废水处理方法。
1.化学沉淀法化学沉淀法是铜和大多数重金属的常规处理方法,一般酸性含铜污水经调整ph值后,再经沉淀过滤,能达到出水含铜<0.5mg/L。
化学法处理含铜镀废水具有技术成熟、投资少、处理成本低、适应性强、管理方便、自动化程度高等诸多优点,在适当的条件下,处理后的废水中铜离子的质量浓度显著低于国标规定的污水排放标准。
化学沉淀法不足之处在于产生含重金属污泥,若污泥没有得到妥善的处理还会产生二次污染,用化学法处理含铜废水,首先必须破除络合剂,使铜以离子形式存在于清洗废水中,否则会形成铜络合物,处理后的出水铜含量依然很高,其次固液分离效果对出水铜含量影响较大,所以设计处理工艺时要加重力澄清池和砂滤,这样占地面积就很大,此外,只有ph值控制适宜,澄清池设计合理,沉渣沉淀性能良好或用过滤进行三级处理,出水铜含量才能稳定达到0.5mg/L以下。
2.电解法电解法在处理硫酸盐镀铜废水中得到了广泛使用,特别是电解法—离子交换法组合,或是使用电解法----化学沉淀法组合。
3.吸附法吸附法是利用材料的物理吸附和化学吸附等作用去除废水中有害物质的方法,该法应用广泛,活性炭,沸石分子筛,粉煤灰,矿物等对铜离子的吸附作用及应用均有报道,吸附法处理含铜废水,吸附剂来源广泛,成本低,操作方便,吸附效果好,但吸附剂的使用寿命短,再生困难,难以回收铜离子。
4.离子交换法这种方法适用业含铜浓度在50~200mg/L的废水.浓度过高,废水PH势必较低,若用弱酸性阳离子交换树脂,很难吸附铜离子;若用强酸性阳离子交换树脂交换容量则较小,再生时要用较多的酸.用阳树脂处理含铜量较低废水,铁离子也会被树脂吸附,洗脱后难以分离.。
做完化学实验怎么处理

做完化学实验怎么处理做完化学实验怎么处理1、含铜废液的处理实验用过的硫酸铜废液通过加适量铁粉回收金属铜,母液再经沉淀、过滤、稀释排放。
2、含汞废液的处理排放标准:废液中汞的最高容许排放浓度为0.05mg/L(以Hg计)。
处理方法:硫化物共沉淀法:先将含汞盐的废液的pH值调至8-10,然后加入过量的Na2S,使其生成HgS沉淀。
再加入FeS04(共沉淀剂),与过量的S2-生成FeS沉淀,将悬浮在水中难以沉淀的HgS微粒吸附共沉淀.然后静置、分离,再经离心、过滤,滤液的含汞量可降至0.05mg/L以下。
还原法:用铜屑、铁屑、锌粒、硼氢化钠等作还原剂,可以直接回收金属汞。
3、含镉废液的处理氢氧化物沉淀法:在含镉的废液中投加石灰,调节pH值至10.5以上,充分搅拌后放置,使镉离子变为难溶的Cd(OH)2沉淀.分离沉淀,用双硫腙分光光度法检测滤液中的Cd离子后(降至0.1mg/L以下),将滤液中和至pH值约为7,然后排放。
离子交换法:利用Cd2+离子比水中其它离子与阳离子交换树脂有更强的结合力,优先交换.4、含铅废液的处理在废液中加入消石灰,调节至pH值大于11,使废液中的铅生成Pb(OH)2沉淀.然后加入Al2(S04)3(凝聚剂),将pH值降至7-8,则Pb(OH)2与Al(OH)3共沉淀,分离沉淀,达标后,排放废液。
5、含砷废液的处理在含砷废液中加入FeCl3,使Fe/As达到50,然后用消石灰将废液的pH值控制在8-10。
利用新生氢氧化物和砷的化合物共沉淀的吸附作用,除去废液中的砷。
放置一夜,分离沉淀,达标后,排放废液。
6、含酚废液的处理酚属剧毒类细胞原浆毒物,处理方法:低浓度的含酚废液可加入次氯酸钠或漂白粉煮一下,使酚分解为二氧化碳和水。
如果是高浓度的含酚废液,可通过醋酸丁酯萃取,再加少量的氢氧化钠溶液反萃取,经调节pH值后进行蒸馏回收.处理后的废液排放。
7、综合废液处理用酸、碱调节废液PH为3-4、加入铁粉,搅拌30min,然后用碱调节pH为9左右,继续搅拌10min,加入硫酸铝或碱式氯化铝混凝剂、进行混凝沉淀,上清液可直接排放,沉淀于废渣方式处理。
含铜废水处理

离子交换法:
该方法是铜离子与离子交换树脂发生交换 , 以达到富集铜离子、 消除或降低废水中铜离子的目的。离子交换法能有效地去除废水中 的铜离子,而且具有处理容量大、出水水质好等特点。工业处理过程 如下:混合废水→阳离子交换柱→阴离子交换柱→回用及排放。 采用离子交换法来处理含铜废水,具有占地少、不需对废水进行 分类处理、费用相对较低等许多优点;但存在投资大,对树脂要求高, 不便于控制管理等缺点。在实际应用时,如果原水的pH值过低,应先 进行pH调整,废水的Cu2+浓度过高时,应进行除铜预处理,否则树脂再 生会过于频繁。
石灰法能除去废水中大部分的铜等重金属离子 ,且方法简单,处理工 艺成本低、处理效果好 ,但处理后的净化水有较高的 pH值及钙硬度 ,净化 水有严重的结垢趋势,必须采用合适的水质稳定措施进行阻垢后才能实现 回用,而且不适于处理印刷电路板生产过程中的含铜铬合物废水。 硫化物沉淀法是利用添加Na2S、CaS 和 H2S等能与重金属形成比较稳 定的硫化沉淀物的原理,从而达到去除重金属的目的的一种方法。其工 艺为:含铜废水→硫化物沉淀处理→中和处理→排放。该法用于常规的中 和沉淀法,无法处理的铜络合物的废水。 硫化沉淀法简单、高效,但由于要加入大量的化学药剂 ,因此会存在 二次污染。
电解法:
电解法基本原理是当电流通过电解质溶液时,溶液中的阳离子 产生离子迁移和电极反应,即废水中的阳离子向阴极迁移,并在阴 极上产生还原反应,使金属沉积。电化学法处理含铜废水主要用于 硫酸铜镀铜废水等酸性介质的含铜废水,近年来通过试验研究也能 用于氰化镀铜、焦磷酸镀铜的废水处理。电解法处理含铜废水能直 接回收金属铜,处理设备投资和经营费用均不高,管理操作简单, 但在处理低浓度废水时电流效率较低。
铁氧体法:
含铜镍铬退镀液分解方法

含铜镍铬退镀液分解方法含铜、镍、铬退镀液是电镀过程中产生的废液,其中含有不同的金属离子。
为了达到环保要求,必须对这些废液进行处理和分解,回收其中的金属,并净化废液。
一种常见的含铜、镍、铬退镀液分解方法是电化学分解法。
该方法利用电解原理将金属溶液中的金属离子还原成金属,在阳极上发生氧化反应,金属离子转化为金属氧化物、氢氧化物或氧气析出;在阴极上发生还原反应,金属离子被还原成金属沉积在阴极上。
具体步骤如下:1.准备电解槽:选择合适的电解槽,一般使用陶瓷、塑料等不易导电的材料制成,槽内要安装有阳极和阴极。
2.准备阳极:根据需要将金属离子氧化为氧化物、氢氧化物或氧气,选择合适的阳极材料。
比如,在含铬退镀液中将铬离子氧化为铬酸钾,可以选择铁或不锈钢作为阳极。
在含铜退镀液中将铜离子氧化为氧气或氢氧化铜,可以选择铂、钛或钢作为阳极。
3.准备阴极:选择合适的阴极材料用于金属沉积。
一般情况下,使用不锈钢作为阴极。
4.进行电分解:将含铜、镍、铬退镀液倒入电解槽中,加入相应的电解剂(如硫酸、盐酸等)以调整溶液的酸碱度和离子浓度。
将阳极和阴极插入溶液中,接通电源开始电解过程。
阳极上发生氧化反应,金属离子转化为氧化物、氢氧化物或氧气析出;阴极上发生还原反应,金属离子被还原成金属沉积在阴极上。
5.分离和回收:经过一定时间的电分解,金属沉积在阴极上,形成金属膜。
可将金属膜从阴极上剥离,并进行后续的处理,如熔炼、再造等,以回收金属。
还可以将剩余的溶液再经过一系列的处理和分离步骤,以回收其他金属离子。
需要注意的是,在电分解过程中应控制电流密度、电解时间和电解温度,以提高分解效率和产品质量。
另外,在设计电解槽时应考虑电解液的搅拌,以保证溶液中的离子均匀分布,提高分解效果。
电化学分解法是一种常见且经济高效的含铜、镍、铬退镀液分解方法。
通过合理选择阳极和阴极材料,并精确控制电流密度和电解条件,可以实现废液中金属的高效分解和回收,同时达到环境保护的要求。
实验室废液的处理
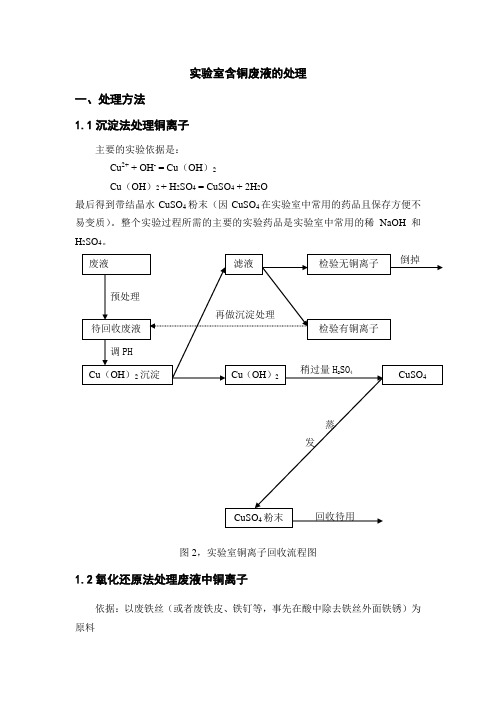
实验室含铜废液的处理一、处理方法1.1沉淀法处理铜离子主要的实验依据是:Cu 2+ + OH - = Cu (OH )2Cu (OH )2 + H 2SO 4 = CuSO 4 + 2H 2O最后得到带结晶水CuSO 4粉末(因CuSO 4在实验室中常用的药品且保存方便不易变质)。
整个实验过程所需的主要的实验药品是实验室中常用的稀NaOH 和H 2SO 4。
倒掉预处理再做沉淀处理调PH稍过量H 2SO 4蒸发回收待用图2,实验室铜离子回收流程图1.2氧化还原法处理废液中铜离子依据:以废铁丝(或者废铁皮、铁钉等,事先在酸中除去铁丝外面铁锈)为原料CuSO 4粉末 废液待回收废液Cu (OH )2沉淀 滤液 Cu (OH )2 检验无铜离子 检验有铜离子 CuSO 4Fe2O3+3H2SO4=Fe2(SO4)3+3H2OCu2++Fe=Cu+Fe2+铜是不活泼金属,不能与稀硫酸直接反应,所以先把同转化为氧化铜后再与稀硫酸反应2Cu+O2=2CuOCuO+H2SO4=CuSO4+H2O直接加H2SO4,过滤,滤渣为铜可直接回收,滤液加碱成氢氧化铁,加酸回收为Fe2(SO4)3二、实验2.1 氢气还原氧化铜实验的废液的处理实验药品与仪器:Zn片、稀H2SO4、碱石灰、CuO粉末、布氏漏斗、滤纸、玻璃棒、试剂瓶、中型坩埚、启普发生器、硬质管、酒精灯、U型管。
实验原理:Zn + H2SO4 = ZnSO4 + H2↑H2 + CuO = Cu + H2OCuO + H2SO4 = CuSO4 + H2O实验步骤:⑴检验启普发生器的气密性,按下图连接实验装置;⑵用托盘天平取CuO粉末10.0g,平铺在硬质管的中部,托盘天平称量硬质管的质量;⑶检验纯度后通入H2一段时间后点燃酒精灯,待黑色粉末消失时熄灭酒精灯,通H2到试管干燥冷却;⑷称量硬质管和以还原的CuO质量,记录数据;⑸还原产物倾入烧杯中并用稀H2SO4,冲洗硬质管壁,减压抽滤,用稀H2SO4洗涤固体Cu;⑹干燥固体Cu并称量,滤液在坩埚中蒸发至干并用分析天平称量,回收CuSO·5H2O4⑺把回收产品放入试剂瓶,整理实验设备。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学镀铜废液的处理张巧丽;郑帅;张照飞;刘炳泗【摘要】Wastewater from the chemical copper-plating process was treated by an economic and effective method. In order to decrease the cost, save the resource and protect the environment, copper and EDTA were recycled by oxidation-reduction and precipitation method, respectively;And seignette salt was removed by bleach. Then, the combined process of activated carbon, Fenton and ultrasonic was used to degrade other organic materials to make the chemical oxygen demand (COD) value reach the national discharge standard.%介绍了处理化学镀铜废液经济有效的方法。
采用氧化还原法和沉淀法回收金属铜和 EDTA,并利用漂白粉除去酒石酸钾钠。
之后的废液由活性碳-Fenton-超声联合降解其中的有机物,降低其COD值至国家排放标准,从而达到保护环境和节约成本的目的。
【期刊名称】《当代化工》【年(卷),期】2014(000)002【总页数】3页(P191-193)【关键词】化学镀铜;废液;处理【作者】张巧丽;郑帅;张照飞;刘炳泗【作者单位】天津大学化学系,天津 300072;天津大学化学系,天津 300072;天津大学化学系,天津 300072;天津大学化学系,天津 300072【正文语种】中文【中图分类】TQ153化学镀铜技术可以将铜离子均匀地沉积到非导体材料表面,形成的铜镀层厚度均匀,无明显的边缘效应,而且具有外观光亮、晶粒细、致密、孔隙率低等优点。
因此,化学镀铜技术广泛应用于电子元器件的制备和电磁干扰屏蔽罩的生产,大规模集成电路和超大规模集成电路的生产,塑料、玻璃和陶瓷的金属化,电子封装技术中陶瓷电路衬底的金属化以及纳米Cu-Al2O3复合粉体、ZnO-SnO复合材料的制备。
然而,由此产生的化学镀铜废液中含有大量的硫酸铜、EDTA、酒石酸钾钠等物质,这些废液排放于环境后不易分解,对环境造成污染。
据文献报道,回收废液中铜的方法主要有活性炭吸附法[1]、溶剂萃取法[2]、化学沉淀法[3]、膜分离法[4]等。
对于络合剂,主要是利用光降解法[5],微电解-Fenton-絮凝沉淀法[6]、电解法[7]等对其进行降解。
我们在参考有关文献的基础上,探索和研究了处理化学镀铜废液比较经济、有效的方法,使Cu和EDTA得以回收利用,并利用高级氧化法降低废液的COD值,达到国家排放标准[8]。
1 实验部分1.1 化学镀铜废液成分分析将化学镀铜后产生的废液收集起来进行成分分析[9],其中含有CuSO4•5H2O4.03 g/L,甲醛0.97 g/L,pH = 11.11 (T = 30 ℃)。
此外,溶液中还含有EDTA-Na2,酒石酸钾钠、乙醇等络合剂和稳定剂。
1.2 铜的回收在50 ℃下,按30~35 g/L的比例投加NaOH和一定量的铜粉,立即剧烈搅拌,30 min后停止加热,溶液中即有棕红色的铜析出,且上清液无色澄清透明。
1.3 EDTA的回收将上述滤液用H2SO4 (1∶1) 酸化,在室温下,调至pH = 1.4~1.6,剧烈搅拌5 min,有沉淀析出,静置1 h,沉淀析出完全,上清液澄清透明。
过滤,即得EDTA。
1.4 酒石酸钾钠的去除室温下,在上述滤液中逐渐加入漂白粉并不断搅拌,使溶液pH至6左右,即沉淀析出酒石酸钙。
1.5 活性碳-Fenton-超声联合降低废液COD在去除酒石酸钾钠后的废液中加入H2O2(质量分数30%)30 mL/L,FeSO4•7H2O 0.9 g/L以及活性炭1.38 g/L,在常温下超声1 h (40 kHz) 后过滤。
测定 COD[10]前,在滤液中加入适量的 MnO2去除剩余的 H2O2。
2 结果与讨论2.1 金属铜的形成机理及去除效果本实验回收铜的原理为利用废液中剩余的甲醛做还原剂,增加NaOH的量使废液发生自分解:其中,加入适量的铜粉是为了使其分散在废液中,成为废液分解的催化中心,减少NaOH的用量,使镀液分解更彻底。
陈世荣等[11]研究了利用还原法沉积铜的最佳实验条件,铜离子的去除率达到99.42%。
而本实验中加入碱的量是陈世荣实验量的1/3左右,废液中剩余的铜含量利用原子吸收光谱法测定后为3 mg/L,铜离子的去除率达99.7%以上。
2.2 金属铜的纯度及晶型分析将回收的铜粉进行了X射线衍射分析,结果如图1所示。
与铜的标准XRD谱图PDF#65-9743对照,可以确定图中衍射峰为金属铜的衍射峰,分别归属于金属铜的(111)、(200)晶面。
图中没有观察到杂质峰的存在,可知铜粉为纯净物。
用Scherrer方程:Dhkl= kl bcosq,可以计算粉末的晶粒尺寸。
其中常数k的值为0.89,X射线波长λ为0.1541 nm。
根据 Bragg方程: 2dsin q =nl得到晶面间距d。
由表1中所得数据可知,析出的铜粉为纳米铜。
图1 回收铜粉的XRD图谱Fig.1 XRD pattern of recovery copper powder表1 铜晶粒信息表Table 1 The information of copper grain项目数据1 数据2 2θ/(°) 43.865 51.016 hkl (111) (200)θ/(°) 21.932 5 25.508半高宽β (radians) 0.006 0 0.008 9晶粒尺寸D /nm 24.64 17.07晶面间距d /nm 0.206 3 0.178 92.3 EDTA的结构分析为了确定提取物质的结构,对其进行了红外测试,并与分析纯EDTA的红外谱图进行了对比,如图2所示。
其中,3 432 cm-1是H2O分子振动产生的吸收峰;3 017 cm-1是羧基中O-H伸缩振动产生的吸收峰;1 694 cm-1和1 392 cm-1分别是COO-非对称和对称伸缩振动产生的吸收峰;1 315 cm-1是COO-其他振动形式产生的吸收峰。
从图中的对比曲线可以看出,提取的物质和分析纯 EDTA 吸收峰的位置一致,只是在指纹区581 cm-1和468 cm-1处,峰形有些区别,说明提取物质是EDTA,并且其纯度很高。
图2 回收物质和分析纯EDTA的FT-IR谱图Fig.2 FT-IR spectra of (a) recovery material and (b)analytical pure EDTA图3 回收物质的1H NMRFig.3 1H NMR spectra of recovery material为了进一步确定回收物质的结构,还对其进行了核磁分析。
由图3可知,除去溶剂D2O的峰之外,图中还有两类质子峰。
由积分曲线计算得到这两类质子数的比例为2 : 1。
羧基上的H很活泼,在1H NMR中没有显示。
化学位移在3.52 ppm处的峰是与N相连的2个-CH2-上的H产生的;化学位移在3.89 ppm处的峰是与-COOH相连的4个-CH2-上的H产生的。
除此之外,图中并无其他类型的H 出现,由此,可进一步确定回收的物质确实是EDTA,并且其中几乎没有杂质,纯度很高。
2.4 废液最终的去除效果漂白粉中含有多种钙盐且廉价易得,因此本实验采用漂白粉去除酒石酸钾钠。
许景文[12]曾采用CaCl2、CaSO4·1/2H2O、Ca(OH)2等不同钙盐去除酒石酸钾钠,相比之下,使用漂白粉可以降低处理成本。
对于废液中剩余的有机物,采用活性碳-Fento n-超声联合法进行处理后,其COD 值由2 000 mg/L降至523 mg/L,基本上达到了国家最低排放标准。
3 结论本实验通过加入过量的 NaOH,破坏镀液稳定存在的条件,使其发生分解,得到了高纯度的纳米铜粉。
同时加入适量的铜粉做催化剂,镀液分解更快、更完全。
然后,利用EDTA不溶于水,将废液的pH调至酸性,EDTA-Na2转换成高纯度的EDTA析出。
最后,利用漂白粉使酒石酸呈钙盐除去,剩余的有机物利用活性碳-Fenton-超声联合降解,使废液的COD达到国家排放标准,达到消除污染,保护环境的目的。
【相关文献】[1]Wilson K, Yang H, Seo C W, et al. Select metal adsorption by activated carbon made from peanut shells[J]. Bioresource Technology, 2006, 97:2266-2270.[2]Li L Q, Zhong H, Cao Z F, et al. Recovery of copper and nickel from plating wastewater by solvent extraction[J]. Chinese Journal of Chemical Engineering, 2011, 19(6): 926-930.[3]Jiang S X, Fu F L, Qu J X, et al. A simple method for removing chelated copper from wastewaters: Ca(OH)2-based replacement-precipitation[J].Chemosphere, 2008, 73: 785-790.[4]Juang R S, Shiau R C. Metal removal from aqueous solutions using chitosan-enhanced membrane filtration[J]. Journal of Membrane Science, 2000, 165: 159–167. [5]Seshadri H, Chitra S, Paramasivan K, et al. Photocatalytic degradation of liquid waste containing EDTA[J]. Desalination, 2008, 232: 139–144.[6]Lan S H, Ju F, Wu X W. Treatment of wastewater containing EDTA-Cu(II) using the combined process of interior microelectrolysis and Fenton oxidation–coagulation[J]. Separation and Purification Technology, 2012, 89: 117–124.[7]孙华. 涂镀三废处理工艺与设备[M]. 北京: 化学工业出版社, 2006:170-171.[8]GB 8978-1996, 污水综合排放标准(国家)[S].[9]唐日芳. 化学镀铜废液中铜和甲醛的连续测定[J]. 电镀与精饰,2002, 24(4): 36-37.[10]GB 11914-89, 水质化学需氧量的测定:重铬酸盐法(国家)[S].[11]陈世荣, 郑伟强, 陈志传,等. 化学镀铜废液的回收利用研究[J].材料保护, 2004,36(9): 69-70. [12]许景文. 化学镀铜、镍中老化废液处理与回收[J]. 上海环境科学,1995, 14(12): 16-19.。
