GMP内审检查表-设备部
合集下载
最新的GMP审核验厂检查表完整版

2
0
0
Are there adequate environmental controls for the building?If the product under assessment requires environmental controls, ensure that the supplier has controlled and verified temperature at critical areas. If environmental control is inadequate, the answer is NO. If environmental control is not applicable to the production, the answer is N/A.
虫害控制程序是否合适?确保有外发的定期虫害控制合约,合约至少包括a)服务内容和所有材料b)鼠笼的安放位置图c)虫害防治公司的营业执照,检查12个月的虫害控制记录,鼠笼等设备有编号,可以追溯。鼠笼等设备合适安装并定期检查证据
3
0
0
Are the washrooms and toilets clean and in good working order?Clean, stocked with Antibacterial Soap and single use napkin/towel, running hot water.
工厂是否干净(评估的整个过程都要观察工厂清洁情况,工厂应该有定义清洁的环境要素并持续改善清洁状况)
2
0
0
Are there written procedures addressing the maintenance of the facility?Preventive Maintenance policies and schedules should be documented. Records should be available for review and should contain information regarding daily pre-operation equipment inspection, daily monitoring of equipment function, daily housekeeping activities, sanitation activities and any other necessary activities to maintain the safety and quality of product.有没有书面的厂房/设施维护程序?预防性维护的政策和程序。每日开机检查记录,每日设备功能检查记录,每日打扫卫生记录,以及其他所需的工作来保证产品的安全和质量……
0
0
Are there adequate environmental controls for the building?If the product under assessment requires environmental controls, ensure that the supplier has controlled and verified temperature at critical areas. If environmental control is inadequate, the answer is NO. If environmental control is not applicable to the production, the answer is N/A.
虫害控制程序是否合适?确保有外发的定期虫害控制合约,合约至少包括a)服务内容和所有材料b)鼠笼的安放位置图c)虫害防治公司的营业执照,检查12个月的虫害控制记录,鼠笼等设备有编号,可以追溯。鼠笼等设备合适安装并定期检查证据
3
0
0
Are the washrooms and toilets clean and in good working order?Clean, stocked with Antibacterial Soap and single use napkin/towel, running hot water.
工厂是否干净(评估的整个过程都要观察工厂清洁情况,工厂应该有定义清洁的环境要素并持续改善清洁状况)
2
0
0
Are there written procedures addressing the maintenance of the facility?Preventive Maintenance policies and schedules should be documented. Records should be available for review and should contain information regarding daily pre-operation equipment inspection, daily monitoring of equipment function, daily housekeeping activities, sanitation activities and any other necessary activities to maintain the safety and quality of product.有没有书面的厂房/设施维护程序?预防性维护的政策和程序。每日开机检查记录,每日设备功能检查记录,每日打扫卫生记录,以及其他所需的工作来保证产品的安全和质量……
内部审核检查表-监视和测量设备管理

校准的测量设备
测量设备的状态
7.1.5.2
测量设备保养状态
7.1.5.2
测量设备是否在有效期
7.1.5.2
测量设备是否有标识
7.1.5.2
测量设备维修记录
限用.封存.报废.是否有处 理记录
过程绩效:
周检及时率
内部质量体系审核检查表
顾客导向
过程COP
支持过程(SP)
及管理过程(MP)
组织的
场所
要审核的问题
适用
条款
参考
条款
对审核观察到的、证据、潜在或实际的发现
的描述(审核记录)
NR
需进一步调查
OFI
改进的
机会
NC不
合格Байду номын сангаас
SP
过程输入:
监视和测量设备管理
各相关部门
量具台账
7.1.5.1
过程控制/输出
校准测量设备时间记录单
测量设备的状态
7.1.5.2
测量设备保养状态
7.1.5.2
测量设备是否在有效期
7.1.5.2
测量设备是否有标识
7.1.5.2
测量设备维修记录
限用.封存.报废.是否有处 理记录
过程绩效:
周检及时率
内部质量体系审核检查表
顾客导向
过程COP
支持过程(SP)
及管理过程(MP)
组织的
场所
要审核的问题
适用
条款
参考
条款
对审核观察到的、证据、潜在或实际的发现
的描述(审核记录)
NR
需进一步调查
OFI
改进的
机会
NC不
合格Байду номын сангаас
SP
过程输入:
监视和测量设备管理
各相关部门
量具台账
7.1.5.1
过程控制/输出
校准测量设备时间记录单
新版GSP内审表-设施与设备

现场检查硬件条件是否符合要求
是□否□
随机抽查保管员访谈是否了解各专用场所的用途
是□否□
按企业设置的岗位职责要求,访谈各岗位职责、制度落实情况等
是□否□
检查结果:
风险描述:系统风险
风险等级:高风险
整改要求:
*05001
运输药品应当使用封闭式货物运输工具。
查看运输车辆是否为封闭式交通工具,是否可以保证安全和不受外界因素影响
第五节:设施与设备
检查员:
编号
条款
检查要点
检查结果、风险点、风险等级、整改要求
备注
*04301
企业应当具有与其药品经营范围、经营规模相适应的经营场所和库房。
查看仓库平面图,检查各个库房的位置、面积、布局是否合理;查看经营场所平面图,检查面积、布局是否合理;查看检查经营场所及库房的产权证明
是□否□
现场检查:各独立库区是否按平面图设置,各功能区的划分、标示是否清楚;库房面积是否与经营规模相适应;药品堆放是否拥挤
是□否□
检查结果:
风险描述:系统风险
风险等级:高风险
整改要求:
04501
药品储存作业区、辅助作业区应当与办公区和生活区分开一定距离或有隔离措施。
检查全部库区、周边环境;各装卸作业场所、车场是否符合要求
是□否□
随机分别询问2—3名保管员、装卸人员,1名库区门卫,有关储存作业、库区管理、装卸作业的情况,非物流办公活动与物流作业共用通道
是□否□
检查结果:
风险描述:系统风险
风险等级:一般风险
整改要求:
04401
库房的选址、设计、布局、建造、改造和维护应当符合药品储存的要求,防止药品的污染、交叉污染、混淆和差错。
是□否□
随机抽查保管员访谈是否了解各专用场所的用途
是□否□
按企业设置的岗位职责要求,访谈各岗位职责、制度落实情况等
是□否□
检查结果:
风险描述:系统风险
风险等级:高风险
整改要求:
*05001
运输药品应当使用封闭式货物运输工具。
查看运输车辆是否为封闭式交通工具,是否可以保证安全和不受外界因素影响
第五节:设施与设备
检查员:
编号
条款
检查要点
检查结果、风险点、风险等级、整改要求
备注
*04301
企业应当具有与其药品经营范围、经营规模相适应的经营场所和库房。
查看仓库平面图,检查各个库房的位置、面积、布局是否合理;查看经营场所平面图,检查面积、布局是否合理;查看检查经营场所及库房的产权证明
是□否□
现场检查:各独立库区是否按平面图设置,各功能区的划分、标示是否清楚;库房面积是否与经营规模相适应;药品堆放是否拥挤
是□否□
检查结果:
风险描述:系统风险
风险等级:高风险
整改要求:
04501
药品储存作业区、辅助作业区应当与办公区和生活区分开一定距离或有隔离措施。
检查全部库区、周边环境;各装卸作业场所、车场是否符合要求
是□否□
随机分别询问2—3名保管员、装卸人员,1名库区门卫,有关储存作业、库区管理、装卸作业的情况,非物流办公活动与物流作业共用通道
是□否□
检查结果:
风险描述:系统风险
风险等级:一般风险
整改要求:
04401
库房的选址、设计、布局、建造、改造和维护应当符合药品储存的要求,防止药品的污染、交叉污染、混淆和差错。
GMP内审检查表 (1)

实施后应对变更追踪确认。
需要经药品监督管理部门批准的变更应当在得到批准后方可实施。
10
偏差管理
有书面的偏差操作规程,规定偏差的报告、记录、调查、处理的程序。
有专人负责偏差的管理。
任何偏离生产工艺、物料平衡限度、质量标准、检验方法、操作规程等的情况均应当有记录。
应当评估偏差对产品质量的潜在影响,并进行分类。
对药品不良反应应及时向当地药品监督管理部门报告。
如发现药品生产企业出现生产失误、产品变质、不良反应或其它重大质量问题,在考虑采取相应措施时,应及时向当地药品监督管理部门报告,并考虑是否有必要从市场召回药品。
应当对投诉进行定期回顾分析,以便发现需要警觉、重复出现以及可能需要从市场召回药品的问题,并采取相应措施。
退货处理的过程和结果应当有相应记录。13不 Nhomakorabea格品管理
有不合格品管理相关规程。
不合格的物料、中间品、成品的每个包装容器上均应有清晰醒目的标志,并在隔离区妥善保存。
不合格原辅材料、中间品、成品的处理应经过质量管理部门批准。
不合格的中间品、成品不得进行重新加工。
不合格的中间品、成品一般不得进行返工,只有不影响产品质量、符合相应质量标准,且根据预定、经批准的操作规程以及对相关风险充分评估后,才能进行返工。返工应当有记录。
11
药品召回
应制定药品召回的书面管理程序,根据产品召回程序可迅速、有效地从市场召回任何一批存在安全隐患的产品。
专人负责管理。
产品召回负责人是否独立于销售和市场部门;是否向质量受权人通报召回处理情况。
产品召回负责人应当能够迅速查阅到药品销售记录。
销售记录应能追查到每批产品的售出情况,必要时能全部有效追回。销售记录内容应当包括:产品名称、规格、批号、数量、收货单位和地址、联系方式、发货日期、运输方式等。
需要经药品监督管理部门批准的变更应当在得到批准后方可实施。
10
偏差管理
有书面的偏差操作规程,规定偏差的报告、记录、调查、处理的程序。
有专人负责偏差的管理。
任何偏离生产工艺、物料平衡限度、质量标准、检验方法、操作规程等的情况均应当有记录。
应当评估偏差对产品质量的潜在影响,并进行分类。
对药品不良反应应及时向当地药品监督管理部门报告。
如发现药品生产企业出现生产失误、产品变质、不良反应或其它重大质量问题,在考虑采取相应措施时,应及时向当地药品监督管理部门报告,并考虑是否有必要从市场召回药品。
应当对投诉进行定期回顾分析,以便发现需要警觉、重复出现以及可能需要从市场召回药品的问题,并采取相应措施。
退货处理的过程和结果应当有相应记录。13不 Nhomakorabea格品管理
有不合格品管理相关规程。
不合格的物料、中间品、成品的每个包装容器上均应有清晰醒目的标志,并在隔离区妥善保存。
不合格原辅材料、中间品、成品的处理应经过质量管理部门批准。
不合格的中间品、成品不得进行重新加工。
不合格的中间品、成品一般不得进行返工,只有不影响产品质量、符合相应质量标准,且根据预定、经批准的操作规程以及对相关风险充分评估后,才能进行返工。返工应当有记录。
11
药品召回
应制定药品召回的书面管理程序,根据产品召回程序可迅速、有效地从市场召回任何一批存在安全隐患的产品。
专人负责管理。
产品召回负责人是否独立于销售和市场部门;是否向质量受权人通报召回处理情况。
产品召回负责人应当能够迅速查阅到药品销售记录。
销售记录应能追查到每批产品的售出情况,必要时能全部有效追回。销售记录内容应当包括:产品名称、规格、批号、数量、收货单位和地址、联系方式、发货日期、运输方式等。
GMP检查表

□Y□Nห้องสมุดไป่ตู้
7
叉车应该保持整洁,在车间行驶必须开警报灯。
□Y□N
5.虫害控制.
1
工厂周围的花草被定期修剪,没有昆虫迷藏。
□Y□N
2
工厂周围花园草地被定期进行杀虫。
□Y□N
3
工厂周围没有积水。
□Y□N
4
工厂周围灭鼠盒保存完好,安全有效。
□Y□N
5
仓库捕鼠盒保存完好,安全和有效。
□Y□N
6
外墙没有破洞,老鼠无法进入。
□Y□N
7
工具箱,工作台等物品按规定摆放,并整洁。
□Y□N
DM-QR-06-0005/B
8
工作台上保持文件为生产所需,且没有任何涂改现象。
□Y□N
3.机器设备
1
所有机器设备保持洁净,无灰尘,无油污。
□Y□N
2
运转中的机器设备上不必允许放任何其他物品(工具,零件,橡皮圈,到片)。工具必须放在工具箱内。
□Y□N
4
危险品区域,空压机房必须有明确标识和指示。
□Y□N
5
消防通道保持畅通,消防栓不能堆放其他物品。
□Y□N
6
确保应急灯的有效性。
□Y□N
7
工厂紧急出口有明确的标识,并保持随时畅通。
□Y□N
8
工作区域必须张贴有《紧急疏散图》。
□Y□N
9
所有电器盒、插座必须按规范安装。
□Y□N
10
没有裸露的电线和拖地的电线。
□Y□N
17
车间的垃圾桶必须远离生产区域,并加盖和标识。
□Y□N
2.员工规范
1
工厂区域不能发现任何人吸烟。
7
叉车应该保持整洁,在车间行驶必须开警报灯。
□Y□N
5.虫害控制.
1
工厂周围的花草被定期修剪,没有昆虫迷藏。
□Y□N
2
工厂周围花园草地被定期进行杀虫。
□Y□N
3
工厂周围没有积水。
□Y□N
4
工厂周围灭鼠盒保存完好,安全有效。
□Y□N
5
仓库捕鼠盒保存完好,安全和有效。
□Y□N
6
外墙没有破洞,老鼠无法进入。
□Y□N
7
工具箱,工作台等物品按规定摆放,并整洁。
□Y□N
DM-QR-06-0005/B
8
工作台上保持文件为生产所需,且没有任何涂改现象。
□Y□N
3.机器设备
1
所有机器设备保持洁净,无灰尘,无油污。
□Y□N
2
运转中的机器设备上不必允许放任何其他物品(工具,零件,橡皮圈,到片)。工具必须放在工具箱内。
□Y□N
4
危险品区域,空压机房必须有明确标识和指示。
□Y□N
5
消防通道保持畅通,消防栓不能堆放其他物品。
□Y□N
6
确保应急灯的有效性。
□Y□N
7
工厂紧急出口有明确的标识,并保持随时畅通。
□Y□N
8
工作区域必须张贴有《紧急疏散图》。
□Y□N
9
所有电器盒、插座必须按规范安装。
□Y□N
10
没有裸露的电线和拖地的电线。
□Y□N
17
车间的垃圾桶必须远离生产区域,并加盖和标识。
□Y□N
2.员工规范
1
工厂区域不能发现任何人吸烟。
GMP内审检查表
应当对偏差进行定期回顾分析,以便发现不良趋势,并采取相应措施。
11
药品召回
应制定药品召回的书面管理程序,根据产品召回程序可迅速、有效地从市场召回任何一批存在安全隐患的产品。
专人负责管理。
产品召回负责人是否独立于销售和市场部门;是否向质量受权人通报召回处理情况。
产品召回负责人应当能够迅速查阅到药品销售记录。
有专人负责变更控制。
应当评估变更对产品质量的潜在影响,并进行分类。
对产品质量影响较大的重大变更应经过验证、稳定性考察或必要的评估。
变更的实施有计划并明确实施职责,实施计划经批准。
变更实施时,应当确保与变更相关的文件均已修订。
变更的整个过程有相应的完整记录。应保存所有变更的文件和记录。
实施后应对变更追踪确认。
调查的深度和形式应当与风险的级别相适应。
相关信息应传递到质量受权人和预防问题再次发生的直接负责人。
根据调查结果制定纠正和预防措施,防止问题的再次发生。
纠正和预防措施实施前应通过相关管理人员的审核和批准。
应对纠正措施和预防措施进行回顾统计、分析,评估CAPA合理性、有效性和充分性,应能促进质量管理体系的持续改进。
质量管理部门对供应商的质量评估不受企业负责人及其他部门人员的干扰。
有专人负责物料供应商的管理,进行质量评估和现场质量审计,分发经批准的合格供应商名单。
改变物料供应商,应履行变更手续。
27196 6A3C樼#}`140506 9E3A鸺38805 9795鞕C
有合格供应商清单,内容至少包括物料名称、规格、质量标准、生产商名称和地址、经销商(如有)名称等。
文件分发、收回、撤销、复制、销毁应有记录。
分发、使用的文件应当为批准的现行文本。
11
药品召回
应制定药品召回的书面管理程序,根据产品召回程序可迅速、有效地从市场召回任何一批存在安全隐患的产品。
专人负责管理。
产品召回负责人是否独立于销售和市场部门;是否向质量受权人通报召回处理情况。
产品召回负责人应当能够迅速查阅到药品销售记录。
有专人负责变更控制。
应当评估变更对产品质量的潜在影响,并进行分类。
对产品质量影响较大的重大变更应经过验证、稳定性考察或必要的评估。
变更的实施有计划并明确实施职责,实施计划经批准。
变更实施时,应当确保与变更相关的文件均已修订。
变更的整个过程有相应的完整记录。应保存所有变更的文件和记录。
实施后应对变更追踪确认。
调查的深度和形式应当与风险的级别相适应。
相关信息应传递到质量受权人和预防问题再次发生的直接负责人。
根据调查结果制定纠正和预防措施,防止问题的再次发生。
纠正和预防措施实施前应通过相关管理人员的审核和批准。
应对纠正措施和预防措施进行回顾统计、分析,评估CAPA合理性、有效性和充分性,应能促进质量管理体系的持续改进。
质量管理部门对供应商的质量评估不受企业负责人及其他部门人员的干扰。
有专人负责物料供应商的管理,进行质量评估和现场质量审计,分发经批准的合格供应商名单。
改变物料供应商,应履行变更手续。
27196 6A3C樼#}`140506 9E3A鸺38805 9795鞕C
有合格供应商清单,内容至少包括物料名称、规格、质量标准、生产商名称和地址、经销商(如有)名称等。
文件分发、收回、撤销、复制、销毁应有记录。
分发、使用的文件应当为批准的现行文本。
GMP内审检查表【范本模板】

成品的质量标准应当包括:产品名称以及产品代码;对应的产品处方编号(如有);产品规格和包装形式;取样、检验方法或相关操作规程编号;定性和定量的限度要求;贮存条件和注意事项;有效期。
质量标准的内容应符合药品注册标准。
n22200 56B8 嚸24601 6019 怙934702 878E 螎
质量标准变更应履行变更手续。
3
质量标准
原辅料、包装材料、中间产品、成品应当有经批准的现行质量标准。
中间产品的检验结果用于成品的质量评价,应当制定与成品质量标准相对应的中间产品质量标准.
物料的质量标准一般应当包括:物料的基本信息(企业统一指定的物料名称和内部使用的物料代码;质量标准的依据;经批准的供应商;印刷包装材料的实样或样稿),取样、检验方法或相关操作规程编号;定性和定量的限度要求;贮存条件和注意事项;有效期或复验期。
24155 5E5B 幛39251 9953 饓jZ29790 745E 瑞@29428 72F4 狴
需要经药品监督管理部门批准的变更应当在得到批准后方可实施。
10
偏差管理
有书面的偏差操作规程,规定偏差的报告、记录、调查、处理的程序。
有专人负责偏差的管理。
任何偏离生产工艺、物料平衡限度、质量标准、检验方法、操作规程等的情况均应当有记录。
应当对偏差进行定期回顾分析,以便发现不良趋势,并采取相应措施。
11
药品召回
应制定药品召回的书面管理程序,根据产品召回程序可迅速、有效地从市场召回任何一批存在安全隐患的产品。
专人负责管理。
产品召回负责人是否独立于销售和市场部门;是否向质量受权人通报召回处理情况。
产品召回负责人应当能够迅速查阅到药品销售记录。
不合格原辅材料、中间品、成品的处理应经过质量管理部门批准。
质量标准的内容应符合药品注册标准。
n22200 56B8 嚸24601 6019 怙934702 878E 螎
质量标准变更应履行变更手续。
3
质量标准
原辅料、包装材料、中间产品、成品应当有经批准的现行质量标准。
中间产品的检验结果用于成品的质量评价,应当制定与成品质量标准相对应的中间产品质量标准.
物料的质量标准一般应当包括:物料的基本信息(企业统一指定的物料名称和内部使用的物料代码;质量标准的依据;经批准的供应商;印刷包装材料的实样或样稿),取样、检验方法或相关操作规程编号;定性和定量的限度要求;贮存条件和注意事项;有效期或复验期。
24155 5E5B 幛39251 9953 饓jZ29790 745E 瑞@29428 72F4 狴
需要经药品监督管理部门批准的变更应当在得到批准后方可实施。
10
偏差管理
有书面的偏差操作规程,规定偏差的报告、记录、调查、处理的程序。
有专人负责偏差的管理。
任何偏离生产工艺、物料平衡限度、质量标准、检验方法、操作规程等的情况均应当有记录。
应当对偏差进行定期回顾分析,以便发现不良趋势,并采取相应措施。
11
药品召回
应制定药品召回的书面管理程序,根据产品召回程序可迅速、有效地从市场召回任何一批存在安全隐患的产品。
专人负责管理。
产品召回负责人是否独立于销售和市场部门;是否向质量受权人通报召回处理情况。
产品召回负责人应当能够迅速查阅到药品销售记录。
不合格原辅材料、中间品、成品的处理应经过质量管理部门批准。
内部审核检查表(设备工程处)

审核内容
●文件发布是否受 控? ●本部门适用的文 件有哪些?有无适 用文件清单?
审核办法
●部门负责人交 谈 ●查看文件清单. ●查文件是否为 有效版本, 有无丢 失和损坏.是否有 更改、修改记录
审 核 记 录
1
Q4.2.4 E4.5.4 S4.5.3
2
Q5.3 E4.2 S4.2
3
●是否设置了标准 要求的必要记录? 有无记录清单? ●对记录的管理是 否规定了不同的保 存期限? ●记录是否按规定 进行标识?标识是 否清晰并具有可追 溯性? ●记录的填写是否 真实、及时、清楚、 正确? ●公司的管理方针 是什么? ●各层次员工是否 对组织管理方针充 分沟通、 理解, 并有 效贯彻? ●采用什么措施传 达管理方针?
三标一体化管理体系内部审核检查表(二次)
日期: 2005 年 8 月 17 日 号:LYQG-028 表格编
受审核部门 审 核 依 据 序 号 规范 摘要
Q4.2.3 E4.4.5 S4.4.5
设备工程处
内 审 员
GB/T19001 质量管理体系、GB/T24001 环境管理体系、GB/T28001 职业健康安全管理体系、 公司管理手册、程序文件、作业文件及国家有关适用法律法规。
审核办法
●与部门负责人交谈 ● 询问 员工 . 查看 危 险源辨识、评价控制 表,有无新危险源, 是 否得 到控 制 . 抽 查 生产现场
审 核 记 录
12
E4.3.2 S4.3.2
●法律、法规获 取、识别、更新的 目的? ●本公司获取的 法律、法规途径有 哪些?是否充 分? ●本部门适用的 法律法规有哪 些?执行情况如 何?
●与部门负责人交 谈,抽查员工了解情 况. ●查看法律法规和其 他要求清单. ●查看评价记录. ●查看管理方案,运 行记录 ●查看受控文件登记 表
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
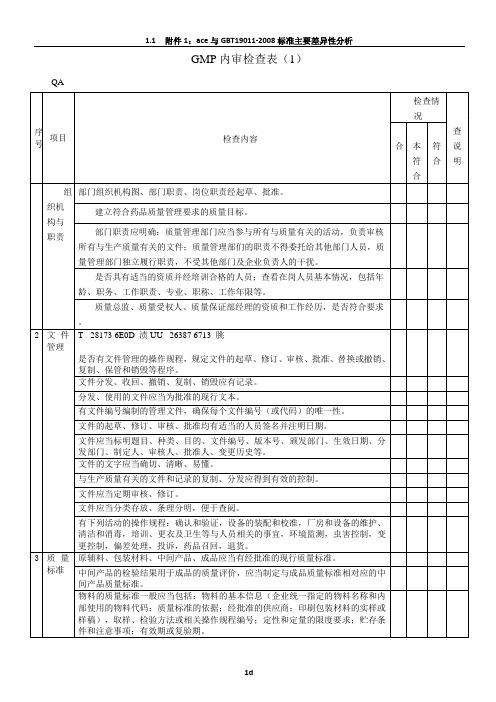
内审现场检查表-设备部
受审部门:设备部负责人:审检查说明
符合
基本符合
不符合
1
组织机构与职责
部门组织机构图、岗位职责经起草、审批,进行了岗位职责培训。
在岗人员基本情况,包括年龄、职务、工作职责、专业、职称、工作年限、培训情况等。
2
文件管理
专人负责部门文件管理,有文件目录台帐,文件再次分发有记录,可根据需要收回文件。
•HVAC应经过验证(DQ/OQ/IQ/PQ)和定期再验证:
•HVAC应根据清清规程定期清洁和灭菌。
有烟雾试验的录像或其他证据证明气流方式不会导致污染风险。
单向流系统在其工作区域必须均匀送风,风速为0.36-0.54m/s。
应设置送风机组故障的报警系统。
无菌生产车间空气净化系统应当保持连续运行,维持相应的洁净度级别。因故停机再次开启空气净化系统,应当进行必要的测试以确认仍能达到规定的洁净度级别要求。
生产用模具的采购、验收、保管、维护、发放及报废应当制定相应操作规程,设专人专柜保管,并有相应记录。
经改造或重大维修的设备应当进行再确认,符合要求后方可用于生产。
4
.厂房设施预防维修
有厂房设施预防维修管理程序,有厂房设施预防维修管理网络。
有年度预防维修计划,并按计划执行。预防维修计划及计划的变更应有审批。
12
自检
有部门的年度GMP自检计划、实施计划,按计划组织实施。
针对自检中出现的问题及时组织培训。
有检查总结或报告、问题整改措施及整改措施有效性的跟踪检查。
有维修记录、总结及预防维修计划执行情况年度回顾。
厂房设施应经过验证和定期再验证。
5
计量校验管理
所有的计量器具清单、分布图、校验计划、台帐、记录及证书档案资料.
所有的计量器具应在效期内使用。
6
公用系统
有明显的状态标识,标明公用系统设备状态。
主要固定管道应当标明内容物名称和流向。
蒸汽发生、供应管线、供应点网络图,蒸汽输出总管有无过滤器。
•贮水罐应密闭,援的通气口安装不脱落纤维的疏水性除菌滤器:
•水系统在运行时不能有渗漏现象。
有纯水系统、注射用水生产流得图,标注取样点,并有审批签字。定期监测各取样点水质,有管理程序、记录(或报告、台帐)。
纯化水采用循环,注射用水采用70℃以上保温循环。
贮水罐和输水管道应定期清洗、消毒,并有完整记录,有微生物污染的纠偏限度。出现偏差应办理偏差于续并追踪产品质量,采取有效措施避免重复发生。
文件应分类存放、条理分明,便于查阅。
有完整的文件系统支持管理及操作行为,及时补充和完善部门文件体系。
现场使用均为现行版文件。
3
设备管理、预防维修
有设备管理相关规程。
有设备预防维修管理程序。
设备应有DQ/IQ/OQ/PQ确认。验证符合要求后才能使用,应定期再验证。
设备应定期校验或确认,并在校验有效期内。
自证明设备身份的标志,标明设备名称、型号、编号等。
灭菌设备用于监测或记录的温度探头与用于控制的温度探头应当分别设置,设置的位置应当通过验证确定。
有设备预防维修卡,确定各设备的维修项目和周期。
有年度预防维修计划,并按计划执行。预防维修计划及计划的变更应有审批。
有维修记录、月度维修总结、预防维修计划执行情况年度回顾。
在洁净区内进行设备维修时,如洁净度或无菌状态遭到破坏,应当对该区域进行必要的清洁、消毒或灭菌,待监测合格方可重新开始生产操作.
定期监测温度、湿度、尘埃、微生物、风向、压差、换气次数等(程序、记录),监测结果应记录存档。发生偏差时应及时办理偏差手续,并采取有效措施。
应有预防维修计划及实施记录,如过滤器的更换周期及依据。
有公司厂房总体平面布局图开及时更新。
11
培训
有部门负责人批准的职工年度培训计划,培训内容至少包括:药品管理法律、法规:GMP:SOPs、卫生知识、微生物学基础知识、洁净作业知识、特种作业专业知识、岗位职责、岗位技能等。
有完整的培训记录。
新聘人员、转岗人员有部门负责人批准的专门培训方案,培训考核合格后方可上岗。有培训记录及考核记录。
应当对制药用水及原水的水质进行定期监测,并有相应的记录。
系统应有预防维修计划及实施记录,计划及计划变更应审批。
各取样点应有状态标志。
系统应有书面的操作程序及记录。
应有水系统的运行记录。
有水、蒸汽、压缩空气、空调等系统使用的过滤器档案及台帐,包括型号、材质、清洗、消毒、完整性试验、更换等基本信息。
9
过滤器管理
如有变更应履行变更手续,必要时重新进行验证。
8
纯化水、注射用水
基本要求:
•系统产量、质量能满足生产要求;
•应有系统的IQ/OQ/PQ验证,并定期再验证;
•纯化水、注射用水的制备、储存和分配应能防止微生物的滋生和污染:
•如有变更应履行变更于续,必要时重新进行验证;
•管路系统的表面、接缝平整光滑,无毒、耐腐蚀,管道的设计和安装避免死角、盲管。系统应易清洁、灭菌及排放:
有过滤器清洗、消毒、完整性试验、更换记录。有相应的管理及操作程序。
生产、检测及公用系统设备应建立完整的设备档案并及时更新。
10
档案管理
设备应有编号。
有生产厂房、库房、QC检测室的设备平面布置图、人流物流图、空调系统送回风图等并及时更新。房间应统一编号。
有厂房、公用设施、固定管道建造或改造后的竣工图纸。
直接接触药品的压缩空气、其它工艺用气供应网络图,并标明使用口位置、过滤器似否。
气体总管出口有过滤装置。
水压、电压、气压不在规定范用出现偏差有无调查、分析及采取纠偏措施和记录
有压力容器管理程序,管理符合规定。
有各个系统的生产、运行记录
7
HVAC
基本要求: .
•HVAC的设计应符合规范要求:
•应有该系统的操作程序;
受审部门:设备部负责人:审检查说明
符合
基本符合
不符合
1
组织机构与职责
部门组织机构图、岗位职责经起草、审批,进行了岗位职责培训。
在岗人员基本情况,包括年龄、职务、工作职责、专业、职称、工作年限、培训情况等。
2
文件管理
专人负责部门文件管理,有文件目录台帐,文件再次分发有记录,可根据需要收回文件。
•HVAC应经过验证(DQ/OQ/IQ/PQ)和定期再验证:
•HVAC应根据清清规程定期清洁和灭菌。
有烟雾试验的录像或其他证据证明气流方式不会导致污染风险。
单向流系统在其工作区域必须均匀送风,风速为0.36-0.54m/s。
应设置送风机组故障的报警系统。
无菌生产车间空气净化系统应当保持连续运行,维持相应的洁净度级别。因故停机再次开启空气净化系统,应当进行必要的测试以确认仍能达到规定的洁净度级别要求。
生产用模具的采购、验收、保管、维护、发放及报废应当制定相应操作规程,设专人专柜保管,并有相应记录。
经改造或重大维修的设备应当进行再确认,符合要求后方可用于生产。
4
.厂房设施预防维修
有厂房设施预防维修管理程序,有厂房设施预防维修管理网络。
有年度预防维修计划,并按计划执行。预防维修计划及计划的变更应有审批。
12
自检
有部门的年度GMP自检计划、实施计划,按计划组织实施。
针对自检中出现的问题及时组织培训。
有检查总结或报告、问题整改措施及整改措施有效性的跟踪检查。
有维修记录、总结及预防维修计划执行情况年度回顾。
厂房设施应经过验证和定期再验证。
5
计量校验管理
所有的计量器具清单、分布图、校验计划、台帐、记录及证书档案资料.
所有的计量器具应在效期内使用。
6
公用系统
有明显的状态标识,标明公用系统设备状态。
主要固定管道应当标明内容物名称和流向。
蒸汽发生、供应管线、供应点网络图,蒸汽输出总管有无过滤器。
•贮水罐应密闭,援的通气口安装不脱落纤维的疏水性除菌滤器:
•水系统在运行时不能有渗漏现象。
有纯水系统、注射用水生产流得图,标注取样点,并有审批签字。定期监测各取样点水质,有管理程序、记录(或报告、台帐)。
纯化水采用循环,注射用水采用70℃以上保温循环。
贮水罐和输水管道应定期清洗、消毒,并有完整记录,有微生物污染的纠偏限度。出现偏差应办理偏差于续并追踪产品质量,采取有效措施避免重复发生。
文件应分类存放、条理分明,便于查阅。
有完整的文件系统支持管理及操作行为,及时补充和完善部门文件体系。
现场使用均为现行版文件。
3
设备管理、预防维修
有设备管理相关规程。
有设备预防维修管理程序。
设备应有DQ/IQ/OQ/PQ确认。验证符合要求后才能使用,应定期再验证。
设备应定期校验或确认,并在校验有效期内。
自证明设备身份的标志,标明设备名称、型号、编号等。
灭菌设备用于监测或记录的温度探头与用于控制的温度探头应当分别设置,设置的位置应当通过验证确定。
有设备预防维修卡,确定各设备的维修项目和周期。
有年度预防维修计划,并按计划执行。预防维修计划及计划的变更应有审批。
有维修记录、月度维修总结、预防维修计划执行情况年度回顾。
在洁净区内进行设备维修时,如洁净度或无菌状态遭到破坏,应当对该区域进行必要的清洁、消毒或灭菌,待监测合格方可重新开始生产操作.
定期监测温度、湿度、尘埃、微生物、风向、压差、换气次数等(程序、记录),监测结果应记录存档。发生偏差时应及时办理偏差手续,并采取有效措施。
应有预防维修计划及实施记录,如过滤器的更换周期及依据。
有公司厂房总体平面布局图开及时更新。
11
培训
有部门负责人批准的职工年度培训计划,培训内容至少包括:药品管理法律、法规:GMP:SOPs、卫生知识、微生物学基础知识、洁净作业知识、特种作业专业知识、岗位职责、岗位技能等。
有完整的培训记录。
新聘人员、转岗人员有部门负责人批准的专门培训方案,培训考核合格后方可上岗。有培训记录及考核记录。
应当对制药用水及原水的水质进行定期监测,并有相应的记录。
系统应有预防维修计划及实施记录,计划及计划变更应审批。
各取样点应有状态标志。
系统应有书面的操作程序及记录。
应有水系统的运行记录。
有水、蒸汽、压缩空气、空调等系统使用的过滤器档案及台帐,包括型号、材质、清洗、消毒、完整性试验、更换等基本信息。
9
过滤器管理
如有变更应履行变更手续,必要时重新进行验证。
8
纯化水、注射用水
基本要求:
•系统产量、质量能满足生产要求;
•应有系统的IQ/OQ/PQ验证,并定期再验证;
•纯化水、注射用水的制备、储存和分配应能防止微生物的滋生和污染:
•如有变更应履行变更于续,必要时重新进行验证;
•管路系统的表面、接缝平整光滑,无毒、耐腐蚀,管道的设计和安装避免死角、盲管。系统应易清洁、灭菌及排放:
有过滤器清洗、消毒、完整性试验、更换记录。有相应的管理及操作程序。
生产、检测及公用系统设备应建立完整的设备档案并及时更新。
10
档案管理
设备应有编号。
有生产厂房、库房、QC检测室的设备平面布置图、人流物流图、空调系统送回风图等并及时更新。房间应统一编号。
有厂房、公用设施、固定管道建造或改造后的竣工图纸。
直接接触药品的压缩空气、其它工艺用气供应网络图,并标明使用口位置、过滤器似否。
气体总管出口有过滤装置。
水压、电压、气压不在规定范用出现偏差有无调查、分析及采取纠偏措施和记录
有压力容器管理程序,管理符合规定。
有各个系统的生产、运行记录
7
HVAC
基本要求: .
•HVAC的设计应符合规范要求:
•应有该系统的操作程序;
