分离分析化学3-1溶剂萃取法
萃取法一般用于哪些用途

萃取法一般用于哪些用途萃取法是一种通过物质间的分配行为分离纯化物质的化学分析技术。
它广泛应用于不同领域,包括化学、生物、制药、环境科学等。
以下是萃取法一般用途的一些例子:1. 分离和纯化天然产物:许多天然产物(如植物提取物、动物组织)中的药物和化合物具有广泛的应用潜力。
通过萃取法可以将这些复杂的混合物分离为纯化的单一化合物,以便进一步研究和应用。
2. 制药工业:在制药过程中,需要将药物成分从复杂的混合物(如植物提取物或合成反应混合物)中分离出来,并纯化为药物产品。
萃取法被广泛应用于药物的提取、纯化和分析。
3. 环境分析:萃取法可用于从环境样品(如水、土壤、空气)中提取和富集有机化合物,以便进行分析和评估环境污染。
例如,水体中的有机污染物可以通过溶剂萃取分离出来,然后进行测定和定量。
4. 食品和饮料分析:萃取法可用于从食品和饮料样品中提取和富集目标化合物。
例如,咖啡中的咖啡因可以通过溶剂萃取和纯化提取出来,从而分析咖啡中的咖啡因含量。
5. 分析化学:萃取法是分析化学中常用的样品前处理技术。
它可以用于分析化学方法的样品前处理步骤中,从复杂的样品基质中分离出目标分析物,以便进行进一步的定量或定性分析。
6. 药物代谢研究:在药物代谢研究中,萃取法可用于分离和纯化药物及其代谢物,以便进行代谢产物的分析和鉴定。
通过将药物代谢产物从生物样品(例如血液、尿液)中提取出来,可以进一步了解药物代谢转化的路径和机制。
7. 油脂提取:萃取法可以用于从植物种子、坚果和种子中提取和纯化植物油。
这些油脂在食品加工和化妆品制造中具有重要的应用价值。
总之,萃取法是一种广泛应用于不同领域的化学分析技术。
通过它,可以分离和纯化复杂混合物中的目标化合物,进行进一步的分析、定量和定性研究。
它在制药工业、环境科学、食品分析、药物代谢研究等领域中起着重要的作用。
第九章 重量分析中常用的分离方法和一般步骤

第九章定量分析中常用的分离方法和一般步骤本章教学目的:1、了解定量分析中常用的分离方法和一般步骤。
2、掌握萃取分离方法的原理,能够进行萃取率的计算。
3、理解分配系数、分配比、交联度、交换容量和比移值的物理意义。
4、了解液相色谱法分离原理和操作技术。
5、掌握试样的制备和分离方法。
6、理解定量分析方法的选择。
教学重点与难点:1、萃取分离方法的原理及相关计算。
2、掌握试样的制备及分离方法。
教学内容:第一节定量分析中常用的分离方法教学目的:1、了解定量分析中常用的分离方法和一般步骤。
2、掌握萃取分离方法的原理,能够进行萃取率的计算。
3、理解分配系数、分配比、交联度、交换容量和比移值的物理意义。
教学重点与难点:萃取分离方法的原理及相关计算。
教学内容:一、沉淀分离法沉淀分离法是利用沉淀反应使待测组分与干扰组分分离的方法。
这是一种经典的分离方法,主要依据是溶度积原理。
以下讨论几种重要的沉淀分离方法。
1、常量组分的分离(1) 氢氧化物沉淀分离利用氢氧化物沉淀溶解度的差异,控制酸度使某些金属离子彼此分离。
通常可采用氢氧化钠、ZnO悬浊液和有机碱等方法控制溶液的pH。
金属离子分离最适宜的pH范围与计算值常会有出人,因此,必须由实验确定。
(2) 硫化物沉淀分离硫化物沉淀是根据金属硫化物的溶度积相差比较大的特点,通过控制溶液的酸度改变S2-的浓度,使金属离子分离。
H2S是常用的沉淀剂,在进行分离时,大多用缓冲溶液控制酸度。
硫化物沉淀分离法的选择性不高,它主要用于分离除去某些重金属离子。
其他常用的无机沉淀剂有SO42-,CrO42-,PO43-,Cl-等。
有机沉淀剂有草酸、铜铁试剂和8-羟基喹啉等。
2、微量组分的共沉淀分离和富集在分离方法中,常利用共沉淀现象来分离和富集微量组分,即加入某种离子,与沉淀剂生成沉淀作为载体,将微量组分定量地沉淀下来,将沉淀分离后溶解在少量溶剂中,以达到分离和富集的目的。
例如,自来水中痕量Pb2+的测定,首先加入Na2CO3使水中的Ca2+以CaCO3沉淀下来,利用共沉淀作用使Pb2+全部沉淀下来,将所得沉淀溶于尽可能少的酸中,这样Pb2+的浓度就会明显提高,达到与其他元素分离并得到富集的目的。
第十一章分离和富集

9/21/2019 12:59 AM
3. 形成三元配合物的萃取体系
具有选择性好、灵敏度高的特点。 例:萃取 Ag+。使 Ag+与邻二氮杂菲配合成配阳离子,
并与溴邻苯三酚红的阴离子缔合成三元配合物:
斑点中心移动距离 R f 溶剂前缘移动距离
Rf值与溶质在固定相 和流动相间的分配系数有 关。在一定条件下,某组 分的Rf值一定。可以进行 定性鉴定。
简单、方便,在药物、染料等的分析方面较多应用。
9/21/2019 12:59 AM
13.3.2 薄层色谱法
比纸色谱具有速度快、分离清晰、灵敏度高、可以采 用各种方法显色等特点。
如何萃取难溶于有机溶剂的无机离子?
水中加入某种试剂(萃取剂),使被萃取物与试剂结 合成不带电荷的、难溶于水而易溶于有机溶剂的分子. 萃取体系:形成内络盐的萃取体系
形成离子缔合物的萃取体系 形成三元配合物的萃取体系
9/21/2019 12:59 AM
1. 形成内络盐的萃取体系
最为广泛的萃取体系。 萃取剂:8-羟基喹啉、二硫腙、乙酰丙酮、丁二Байду номын сангаас肟 N-亚硝基苯胲铵(铜铁试剂)。 例:8-羟基喹啉与Mg2+螯合:
分配色谱一般是用极性展开剂处理极性化合物。 例如:蒽醌磺酸薄层色谱中的展开剂,是用极性溶剂 正丁醇、氨水、水按2:1:1配成的。 分配色谱是利用试样中各组分在流动相和固定相中溶 解度的不同,在两相间不断进行分配而达到分离目的。展 开剂是流动相,吸附在吸附剂中的少量水分是固定相。
在pH=7的缓冲溶液中, 用硝基苯萃取,然后就在溶剂 相中用光度法进行测定。
分析化学-样品的采集与处理

体的集合体称之为样品。
采样(sampling):从总体中抽取样品的操作过程。
一 样品采集的原则 1.代表性
液体样品: 应充分混匀后再进行采集。
固体样品: 需按不同部位取出少量样品, 将其混合均匀后再用四分法 进行缩分得到代表性样品。
2.典型性 根据检测目的,采集能充分说明此目的
的典型样品。 3.适时性
可利用超声波进行清洗、干燥、杀菌、雾化及 无损检测等。
(五)膜分离法 (membrane separation) 过滤:用滤纸将沉淀从溶液中分离出来。 膜分离: 采用具有渗透性的膜作为分离材料,利
用外界能量或化学位差(浓度差、压力差等)为动 力,使组分从膜的一侧渗透至另一侧。
膜分离方法
分离动力 浓度差 压力差 电位差
E% coVo 100% coVo cwVw
E% D 100% D Vw / Vo
萃取百分率与分配比和萃取剂的体积比有关。 提高萃取率的方法:
✓ 提高萃取剂的分配比 ✓ 进行多次萃取或连续萃取
多次萃取后,水相中剩余物质的质量:
mn
m0 (
Vw DVo Vw
)n
例1:有100.0ml含I210.00mg的水溶液,用90.00ml CCl4萃取,萃取效率为97.50%,求此时的分配比?若 每次用30.00ml CCl4分三次萃取,萃取效率又是多少?
水、酸性水溶液、碱性水溶液、有机溶剂。
(三)分解法(decomposition)
破坏样品中的有机物,使之分解或呈气体逸出, 将被测物转化为离子状态,故又称为无机化处理法。
适用于被测组分为结合状态的无机成分的测定。 常用分解法:干灰化法、干灰化法、微波溶样法
1.干灰化法(dry ashing) (1)高温灰化
分析化学中常用的分离和富集方法及小结

3. 其它无机沉淀剂
H2SO4,H3PO4,HF or NH4F,HCl
稀HCl:Ag Hg22+ Pb→白↓( Ⅰ组阳离子)
HCl
AgCl,Hg2Cl2,PbCl2
NH3
溶于热水
Ag(NH3)2+ Pb(OH)2 HgNH2Cl(白)+Hg(黑)
13
(白)
灰黑
无机沉淀剂: 易产生共沉淀, 选择性不高; 应首先沉淀微量组分.
UO22+,Al3+,Sn4+,Bi3+等。
21
无机共沉淀剂选择性差, 干扰下一步测定。
2、有机共沉淀剂(选择性高,应用广)
丹宁,辛可宁,动物胶等,可灼烧除去。
例1:分离微量H2WO4
HNO3介质中, H2WO4-辛可宁。
带负电胶粒,
不易凝聚
胶体凝聚
例2:分离微量cd
R h C B 2 4 d (IR)2 h CB 2 4 d I
氢氧化物:NaOH、NH3 硫化物:H2S 有机沉淀剂:H2C2O4,丁二酮肟
分
离子交换分离
阳离子交换树脂 阴离子交换树脂
气液分离:挥发和蒸馏 克氏定氮法,Cl2预氧化I-法
离
螯合物萃取
萃取分离 离子缔合物萃取
方 液液分离
法
膜分离
三元络合物萃取 支撑型液膜 乳状液型液膜
生物膜
气固分离——超临界流体萃取
离子)(氨水沉淀分离法中常加入大量NH4+盐,其作 用是什么?)
10
3 控制pH=5-6
① ZnO悬浊液法
高价离子Fe3+,Al3+,Cr3+,Th4+等定量↓ ቤተ መጻሕፍቲ ባይዱi2+,Co2+,Mn2+,Mg2+,Ca2+,Sr2+不↓
分析化学中常用的分离和富集方法
3 溶于CHCl3
亲水 水合离子的正电性被中 和,亲水的水分子被疏 水有机大分子取代
疏水
8-羟基喹啉
萃取剂
CHCl3
溶剂
3.反萃取
Back extraction
萃取的反过程(将组分从有机溶液中萃取到水溶液中)
如:8-羟基喹啉铝螯合物中加入1mol/L HCl
12
4. 分配系数与分配比 分配系数 partition coefficient HA (w) HA (o)
常用分离方法
沉淀分离法 溶剂萃取分离法
Precipitation Solvent extraction Ion exchange
离子交换分离法
色谱分离法
挥发和蒸馏分离法
Chromatography
Volatilization and distillation
11.3沉淀分离与富集 ——依据溶度积分硫酸盐、卤化物、磷酸盐等 有机沉淀剂:草酸、铜铁试剂、铜试剂、丁二酮肟、苦杏仁酸等
例如常见阳离子的两酸两碱分离
分组 组试剂 Ⅰ HCl Ag Hg (I) (Pb) Ⅱ H2SO4 Ca Sr Ba Pb Ⅲ NH4Cl - NH3 Ⅳ NaOH Ⅴ 可溶组* Na K Zn NH4+
萃取分离法 在含有被分离物质的水溶液中,加入 萃取剂和与水不相混溶的有机溶剂,
震荡,利用物质在两相中的分配不同
的性质,使一些组分进入有机相中, 使另一些组分仍留在水相中,从而达
到分离的目的。
梨形分液漏斗
例:I2的萃取
11.4.1 萃取分离的基本原理
1. 萃取分离的依据 hydrophilic 物质 hydrophobic 亲水性 离子型化合物 极性
分析化学中常用的分离方法(pdf 10)
对回收率的要求随组分含量不同而不同
含量
回收率
1%以上
99.9%
0.01-1%
99%
0.01% 以下
90%-95%
常用的分离方法:
沉淀 溶剂萃取 离子交换 色谱分离 挥发和蒸馏
§6-2 沉淀分离法
一. 常量组分的分离 1. 利用生成氢氧化物
(1) NaOH 法: 以 NaOH 做沉淀剂,将两性与非两性氢氧化物分开
使高价离子与一、二价离子分离。
Ag+,Cd2+,Cu2+,Co2+,Zn2+,Ni2+ 生 成 络 合 物 , Mg2+,Ca2+,Sr2+,Ba2+成离子状态,Mn2+会有部分沉淀。
加 NH+4 的作用:
控制溶液的 pH 8-9,防止 Mg(OH)2 沉淀生成。 NH+4 作抗衡离子,减小氢氧化物对其它金属离子的吸附。 电解质促进胶状沉淀的凝聚。
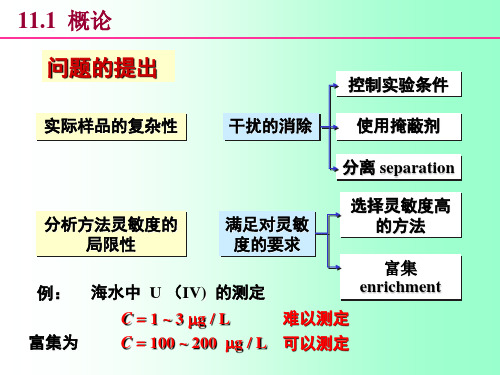
第六章 分析化学中常用的分离方法
§6-1 概 述
干扰组分指样品中原有杂质(溶解)或加入试剂 引入的杂质,当杂质量少时可加掩蔽剂消除干扰,量 大或无合适掩蔽剂时可采用分离的方法。
分离完全的含义 (1)干扰组分小到不干扰 (2)被测组分损失可忽略不计。
完全与否用回收率表示
分离后测得的量
回收率=
原始含量 ×100%
,非两性氢氧化物沉淀下来,两性的留于溶液中。
Pb2+,Al3+,Zn2+,Cr3+不沉淀(以含氧酸根形式 存在),其它的沉淀。
NaOH 含CO2-3 , 使部分Ca2+,Sr2+,Ba2+ 碳酸盐 沉淀。
分析化学第十二章分析化学中的常用分离方法
分析化学第十二章分析化学中的常用分离方法第十二章定量分析中的分离方法(1~2学时)在络合滴定一章中讨论过用掩蔽方法消除干扰问题。
在实际工作中,单用掩蔽的方法有时难以消除干扰离子的影响,此时,需要选用适当的分离方法使待测组分与干扰组分分离;对于微量或痕量组分的测定,常需要富集后才能测定。
对于常量组分的分离和痕量组分的富集,总的要求是分离、富集要完全,即待测组分回收率要符合一定的要求。
对于含量大于1%的常量组分,回收率应接近100%;对于痕量组分,回收率可在90~110%之间,在有的情况下,例如待测组分的含量太低时,回收率在80~120%之间亦属符合要求。
§12-1沉淀分离法沉淀分离法是利用反应使待测组分与干扰离子分离的方法。
常用的沉淀分离方法有:1氢氧化物沉淀分离法使离子形成氢氧化物沉淀[如Fe(OH)3等]或含水氧化物(如SiO2·H2O等)。
常用的沉淀剂有NaOH、氨水、ZnO等。
⑴NaOH溶液:通常用它可控制pH值≥12,常用于两性金属离子和非两性金属离子的分离。
⑵氨和氯化铵缓冲溶液:它可将pH值控制在9左右,常用来沉淀不与NH3形成络离子的许多种金属离子,亦可使许多两性金属离子沉淀成氢氧化物沉淀。
⑶利用难溶化合物的悬浮液来控制pH值:例如ZnO悬浮液就是较常用的一种,ZnO在水中具有下列平衡:ZnO+H2O[Zn2+][OH]2=Kp[OH]=--Zn(OH)2Zn2++2OH-Kp[Zn]2-当加ZnO悬浮液于酸性溶液中,ZnO溶解而使[OH]达一定值时,溶液pH值就为一定的数值。
例如[Zn]=0.lmol·L2+-1时,[OH]=-1.21017-=1.1某1060.1而当[Zn2+]改变时,pH值的改变极其缓慢。
一般讲,利用ZnO悬浮液,可把溶液的pH值控制在5.5~6.5。
其他如CaCO3、MgO等的悬浮液都可用以控制一定的pH值。
氢氧化物沉淀分离法的选择性较差。
分析化学中的掩蔽和分离
(3)溶液酸度 按萃取体系的要求来控制酸度 (4)干扰离子的消除
控制酸度;加掩蔽剂 (5)盐析作用
加入盐析剂(水合能力强的盐类)
水相中自由水分子浓度↓ 提高D↑、E↑
第五节
离子交换分离法
离子交换法(ion exchange)
R-SO3H + Na+ R-SO3Na+ H+
nAm(水)
mAn(有)
平衡时
[An]有m [Am]水n
=KD
(2)浓度高时
有·[A]有
有
a有/a水 = 水·[A]水 = 水 ·KD
(3)该定律适用于理想萃取体系 (无离解、缔合等化学反应发生)
(2)分配比(被萃取物在两相中存在多种型体)
c有 D= c水
C有(C水): 萃取物在有机相(水相)中 各型体浓度之和
2、结构 强酸型阳离子:
对苯乙烯与二乙烯苯共聚物再磺化制得
二乙烯苯称为交联剂
交联度:交联剂在树脂内的百分含量 一般 4%—12%
▲交联度 交联剂
大
多
小
小
分子结构 孔穴
紧密
小
疏松
大
分离物 较小物质
较大物质
SO3H
HO3S HO3S
SO3H
SO3H
SO3H SO3H
SO3H SO3H
SO3H HO3S
图13-5 三组分试样在柱上离子交换色谱分离过程示意图
(固) 溶液
(固)
利用离子交换剂与溶液之间 所发生的固相 -液相间带相同电荷离 子的交换进行分离的方法
带相反电荷,带相同电荷或性质相近的无机离子分离 痕量组分的富集 结构复杂、性质相近的有机化合物的分离
关于萃取的知识点总结
关于萃取的知识点总结一、萃取的原理1.1 分配定律分配定律是萃取原理的基础,它描述了在两种不相溶的溶液之间,溶质在两相之间的分配比例是恒定的。
具体表达式如下:\[K = \frac {C_{2}}{C_{1}}\]其中,K为分配系数,\(C_{1}\)为溶质在溶剂1中的浓度,\(C_{2}\)为溶质在溶剂2中的浓度。
1.2 萃取的原理在进行萃取时,通过控制溶剂和混合物的接触时间、温度、pH值等条件,使得目标物质按照其在两种相中的亲和性进行转移,达到目标成分的分离和富集。
1.3 萃取的类型萃取可以分为固相萃取、液液萃取、液固萃取等不同类型。
其中,液液萃取是最常见的一种,通过两种不相溶的液体来实现萃取分离。
1.4 萃取的影响因素萃取效果受到多种因素的影响,包括溶剂的选择、pH值、温度、混合物中其他成分的影响等。
二、萃取的方法2.1 溶剂萃取溶剂萃取是常见的一种萃取方法,通过选择具有亲和性的溶剂来使目标成分从混合物中分离出来。
溶剂萃取分为分离漏斗法、蒸馏法等不同方法。
2.2 固相萃取固相萃取是一种利用固相吸附剂来进行萃取分离的方法,包括固相萃取柱、固相微萃取等不同形式。
固相萃取具有分离效率高、操作简便的优点。
2.3 超临界流体萃取超临界流体萃取是一种基于超临界流体的化学分离技术,具有温和条件、高效率、环保等优点。
2.4 萃取的自动化技术随着化学分析技术的进步,萃取技术也在不断发展。
自动化萃取系统可以实现自动化、高通量的样品处理,提高了分析效率。
三、萃取的应用3.1 化学工业中的应用在化工生产中,萃取是一种重要的分离技术,被广泛应用于原料提纯、产品分离、废水处理等方面。
3.2 生物医药领域的应用在药物制备和生物样品分析中,萃取是一种关键的预处理步骤,可以实现对目标分子的富集和净化。
3.3 环境分析中的应用在环境监测和分析中,萃取技术可以实现对环境样品中有害物质的检测和定量分析。
3.4 食品安全领域的应用在食品安全监测中,萃取技术可以实现对食品中有害残留物质的检测,保障食品质量和食品安全。
