肿瘤免疫治疗假性进展判断(精).doc
肿瘤免疫治疗的临床效果评估和监测方法

肿瘤免疫治疗的临床效果评估和监测方法肿瘤免疫治疗是一种新兴的治疗癌症的方法,它利用人体自身的免疫系统来攻击和杀死癌细胞。
然而,如何评估和监测肿瘤免疫治疗的临床效果是一个关键的问题。
本文将介绍肿瘤免疫治疗的临床效果评估和监测方法的相关内容。
首先,一种常见的方法是通过观察病人的临床症状和体征来评估治疗效果。
在接受肿瘤免疫治疗的病人中,可能会出现一些与免疫系统激活相关的症状,如疲劳、发热、纳差等。
此外,一些肿瘤标志物的变化也可作为评估的指标,如癌胚抗原(CEA)和癌胎抗原(AFP)等。
然而,这些方法的局限性在于它们主要反映的是肿瘤本身的变化,而不是治疗效果的直接指标。
其次,肿瘤免疫治疗的临床效果评估中,一种常见的方法是采用影像学检查来评估病人的肿瘤负荷。
例如,通过计算机断层扫描(CT)和磁共振成像(MRI)等技术,我们可以观察肿瘤的大小、形状和位置的变化。
此外,正电子发射断层扫描(PET)结合18氟-脱氧葡萄糖(FDG)示踪剂的使用,可以提供更详细的代谢信息,帮助评估治疗效果。
然而,影像学检查往往需要较长的时间间隔才能检测到肿瘤的变化,并且可能受到其他因素的干扰。
血液中循环的肿瘤标志物也可以用来衡量肿瘤免疫治疗的效果。
许多肿瘤细胞会释放特定的蛋白质进入血液中,这些蛋白质可以作为肿瘤的标志物。
通过检测血液中的肿瘤标志物水平的变化,我们可以评估治疗的效果。
例如,CSF-1R、PD-L1和IDO等免疫检查点标志物的表达水平可以用来评估免疫治疗的响应。
然而,血液中的肿瘤标志物受到许多因素的干扰,如炎症、感染和其他肿瘤的影响,因此需要谨慎解读。
最后,检测免疫细胞的活性和功能也是评估肿瘤免疫治疗效果的重要方法。
通过检测血液中的免疫细胞的类型和数量,如淋巴细胞、巨噬细胞、树突状细胞等,可以了解治疗对免疫系统的影响。
此外,也可以通过检测免疫细胞的表面标志物和功能蛋白来评估其活性和功能是否被激活。
例如,通过流式细胞术可以检测到免疫细胞表面的CD8+T细胞和CD4+T细胞的变化,并用于评估治疗效果。
肿瘤免疫检测方法快速诊断进展

肿瘤免疫检测方法快速诊断进展肿瘤是世界范围内一种严重的健康威胁,每年都有数百万人因肿瘤导致的疾病和死亡。
为了更好地预防和治疗肿瘤,科学家们一直在努力寻找快速准确的肿瘤诊断方法。
近年来,肿瘤免疫检测方法的研究取得了重要的进展,为快速诊断肿瘤提供了新的希望。
肿瘤免疫检测方法是通过检测人体的免疫反应来判断是否存在肿瘤细胞。
在正常情况下,人体的免疫系统会识别和攻击异常的细胞,包括肿瘤细胞。
然而,肿瘤细胞可以通过多种途径逃避免疫系统的攻击,导致肿瘤的发展和扩散。
因此,通过检测人体的免疫反应来判断是否存在肿瘤细胞,是一种非常有前景的方法。
目前,在肿瘤免疫检测方法中,最常用的技术是检测肿瘤标志物。
肿瘤标志物是一种在肿瘤细胞中产生的特殊蛋白质,可以在血液或尿液中进行检测。
通过测量血液或尿液中的肿瘤标志物水平,可以初步判断是否存在肿瘤细胞。
然而,由于肿瘤标志物的特异性有限,这种方法可能存在误诊的风险。
为了提高肿瘤免疫检测方法的准确性和敏感性,科学家们研究出了一种新的技术,即免疫测序。
免疫测序是利用高通量测序技术对人体的免疫系统进行全面分析,以了解其对肿瘤细胞的响应情况。
通过对免疫测序的结果进行数据分析和计算,可以准确地判断肿瘤细胞的存在与否,并提供关于肿瘤的详细信息,如肿瘤的类型、分级和分子特征等。
这种方法不仅可以提高肿瘤的早期诊断率,还可以帮助医生选择最合适的治疗方案,提高治疗效果。
另外,肿瘤免疫检测方法中的一项新技术是流式细胞术。
流式细胞术是一种通过激光和流式细胞术仪器对细胞进行分析的技术。
通过标记肿瘤细胞上的特定抗原,科学家可以使用流式细胞术仪器对样本中的细胞进行快速检测。
这种方法可以检测肿瘤细胞的数量、大小和表面蛋白的表达情况,从而快速诊断肿瘤。
流式细胞术具有高效、准确和可重复性的特点,已经在临床实践中取得了成功应用。
当然,肿瘤免疫检测方法还面临一些挑战和限制。
首先,虽然肿瘤标志物的检测简单方便,但由于其特异性有限,可能存在误诊的情况。
肿瘤免疫治疗疗效评价标准

肿瘤免疫治疗疗效评价标准
肿瘤免疫治疗疗效评价标准主要包括以下几个方面:
1. 肿瘤缩小程度:通过影像学检查,评估肿瘤的缩小程度。
常用的评估标准有RECIST(Response Evaluation Criteria in Solid Tumors)标准和irRC(Immune-related Response Criteria)标准。
2. 生存期延长:评估患者的总生存期或无进展生存期延长。
通过比较治疗组和对照组的生存期,评估治疗的疗效。
3. 免疫细胞变化:评估免疫细胞的活性和数量变化,如
CD8+T细胞、肿瘤浸润淋巴细胞(TILs)等。
可以通过免疫组织化学、流式细胞术等技术进行评估。
4. 肿瘤标志物:评估治疗后肿瘤标志物的变化,如癌胚抗原(CEA)、前列腺特异抗原(PSA)等。
一些肿瘤标志物的变化可以作为治疗效果的指标。
5. 免疫脱离反应:监测患者是否出现免疫脱离反应,即治疗后肿瘤再次生长或出现转移。
以上是常见的肿瘤免疫治疗疗效评价标准,具体的评价标准根据不同的肿瘤类型和治疗方案可能会有所不同。
因此,在进行肿瘤免疫治疗时,医生会根据具体情况选择适合的评价标准进行疗效评估。
肿瘤免疫治疗疗效评价标准

肿瘤免疫治疗疗效评价标准
(实用版)
目录
1.肿瘤免疫治疗的意义
2.评价肿瘤免疫治疗疗效的标准
3.存在的问题和挑战
4.未来发展方向
正文
一、肿瘤免疫治疗的意义
肿瘤免疫治疗作为一种革命性的治疗方法,正在改变着肿瘤治疗的格局。
与传统的化疗和放疗不同,免疫治疗通过激活患者自身的免疫系统,来攻击和消灭肿瘤细胞。
这种方法具有疗效持久、副作用较小等优点,已被广泛应用于各种实体瘤的治疗中。
二、评价肿瘤免疫治疗疗效的标准
目前,评价肿瘤免疫治疗疗效的主要标准有两个,分别是实体瘤治疗疗效评价标准(RECIST)和免疫相关生物标志物。
1.实体瘤治疗疗效评价标准(RECIST):这是一个常用的评价肿瘤疗效的标准,主要通过测量肿瘤的大小和数量来评估疗效。
但是,这种方法存在一些缺陷,例如:它只能反映局部的疗效,而不能反映整体的治疗效果;它只能反映近期的疗效,而不能反映长期的疗效;它忽视了肿瘤负荷的变化,而这往往最能反映出患者的生活质量和生存时间。
2.免疫相关生物标志物:这些标志物可以反映患者免疫系统的激活程度,因此可以作为评价免疫治疗疗效的重要指标。
目前,常用的免疫相关生物标志物包括 PD-L1 表达、T 细胞浸润、免疫球蛋白等。
三、存在的问题和挑战
尽管肿瘤免疫治疗疗效评价标准已经取得了一定的进展,但仍然存在一些问题和挑战,例如:如何选择最适合的生物标志物;如何将生物标志物与传统的评价标准相结合;如何解决生物标志物的检测方法和标准化问题等。
第1页共1页。
肺癌免疫治疗超进展(2020完整版)

肺癌免疫治疗超逬展(2020完整版)摘要免疫检查点抑制剂通过恢复有效的T细胞反应发挥抗肿瘤作用。
但在肿瘤免疫治疗过程中,部分患者出现病情进展,该反应模式不同于假性进展,称之为免疫治疗超进展。
目前,免疫治疗超进展尚无明确而统一的定义,发病原因和机制尚不清楚,可能与患者年龄、性别、基因组学异常等相关。
免疫治疗超进展严重影响肿瘤患者的预后,深入探讨免疫治疗超进展的预测因素、发病机制和防治措施有助于为肺癌患者制定适宜的免疫治疗方案。
近年来,免疫治疗在肿瘤学上取得了重大突破,发展了以细胞毒性T淋巴细胞相关抗原 4 ( cytotoxic T-lymphocyte-associated antigen 4 , CTLA-4 )和程序性细胞死亡蛋白1 ( programmed cell death protein 1 , PD-1 )或其配体程序性细胞死亡配体(programmed cell death ligand , PD-L ) 1和2为靶点的免疫检查点抑制剂(immune checkpoint inhibitors , ICIs ) [ 1 J>目前临床广泛应用的免疫治疗可提高黑色素瘤和非小细胞肺癌(non-small cell lung carcinoma , NSCLC )等多种晚期实体瘤的总生存率(overall survival ,OS ),但在fl中瘤免疫治疗过程中ICIs 在通过恢复有效T细胞反应发挥抗肿瘤作用的同时,也导致部分患者出现一种新的反应模式;即免疫治疗超进展(hype中rogressive disease ,HPD)o—、HPD的定义目前,国际上HPD尚无统一的定义。
Ferrara等[2 ]在一项回顾性队列研究中对免疫治疗前后(至少间隔2周行胸部CT扫描)的肿瘤生长率(tumor growth rate , TGR )进行比较z将HPD定义为第一次评估时病情进展指标的治疗前后TGR差异(ATGR )超过50%。
免疫超进展
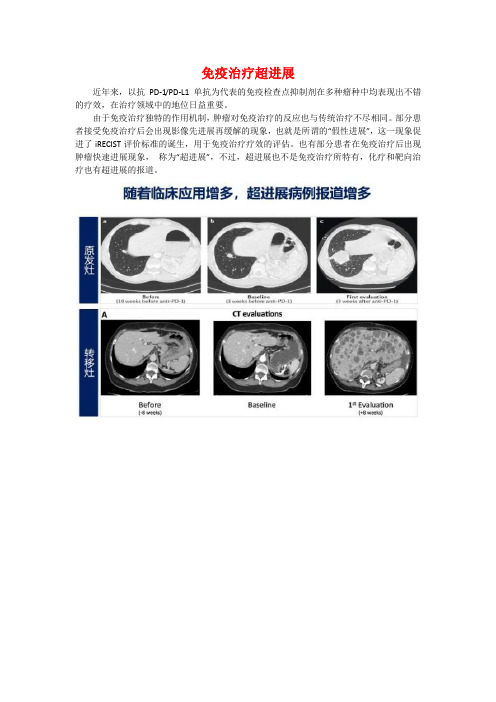
免疫治疗超进展近年来,以抗PD-1/PD-L1单抗为代表的免疫检查点抑制剂在多种瘤种中均表现出不错的疗效,在治疗领域中的地位日益重要。
由于免疫治疗独特的作用机制,肿瘤对免疫治疗的反应也与传统治疗不尽相同。
部分患者接受免疫治疗后会出现影像先进展再缓解的现象,也就是所谓的“假性进展”,这一现象促进了iRECIST评价标准的诞生,用于免疫治疗疗效的评估。
也有部分患者在免疫治疗后出现肿瘤快速进展现象,称为“超进展”,不过,超进展也不是免疫治疗所特有,化疗和靶向治疗也有超进展的报道。
超进展的定义在2016年欧洲肿瘤内科学会年会(ESMO)会议上,免疫超进展的研究首次被报道,当时一份不太显眼的壁报提出“Paradoxical progressive disease”(PPD)这一概念,并使用肿瘤生长速率(TGR)>50%来定义PPD,TGR则主要通过免疫治疗前后CT扫描测量的肿瘤大小改变,以及发生这些变化所用时间来进行计算。
随后古斯塔夫·鲁西研究院的Champiat团队明确提出了超进展(HPD)这一概念,在这之后,很多学者都对超进展现象进行了报道,并将其定义进行补充和完善。
目前,比较全面的超进展定义如下,在免疫治疗后肿瘤进展满足以下三个条件:①在免疫治疗中,肿瘤进展时间小于两个月;②肿瘤负荷相比于基线期增长超过50%;③免疫治疗后肿瘤生长速度超过之前速度2倍以上。
超进展的发生率及预后超进展的发生率在不同的肿瘤类型及不同报道中有较大差异,目前报道在4%~29%之间,该差异除了与瘤种有关,可能还与研究中超进展的定义不同有关。
非小细胞肺癌(NSCLC)免疫治疗超进展发生率最大样本量的研究,来自古斯塔夫·鲁西研究院的Ferrara团队,该团队回顾分析了法国8家中心的406例免疫治疗患者,发现NSCLC患者免疫治疗超进展的发生率为14%(56/406),是化疗组患者超进展发生率的3倍(5%,3/59)。
肿瘤免疫抗体治疗进展PPT课件
目前已有许多关于联合治疗的研究正在进行中,如免疫抗体 与细胞毒性药物的联合、免疫抗体与放疗的联合等,以期为 肿瘤患者提供更多有效的治疗方案。
新药研发与临床试验
新药研发进展
随着免疫学和分子生物学技术的 不断发展,新的免疫抗体药物不 断涌现,为肿瘤治疗提供了更多 选择。
临床试验的重要性
挑战案例一:免疫治疗在结直肠癌中的困境
总结词
疗效有限、耐药性问题
详细描述
尽管免疫治疗在许多肿瘤中取得了显著进展,但在结直肠癌中的疗效却相对有限。部分患者对免疫治 疗无反应,且存在耐药性问题,使得免疫治疗在结直肠癌中的应用面临困境。
挑战案例二
总结词
疗效不明显、潜在的毒副作用
详细描述
胰腺癌是一种恶性程度较高的肿瘤,目前的治疗方法包括手术、放疗和化疗等。尽管免 疫治疗在某些肿瘤中取得了显著进展,但在胰腺癌中的疗效并不明显。此外,免疫治疗 还可能带来一些潜在的毒副作用,如免疫相关不良反应等。然而,随着免疫治疗研究的
不断深入,仍有可能为胰腺癌的治疗带来新的突破和机遇。
感谢您的观看
THANKS
HER2抗体
针对HER2受体的单克隆抗体是乳腺癌免疫抗体治 疗中的一种药物,通过抑制HER2受体的信号转导 ,达到抑制肿瘤细胞生长的目的。
联合治疗
乳腺癌免疫抗体治疗可以与其他治疗方法联合应 用,如化疗、放疗和内分泌治疗等,以提高治疗 效果。
其他肿瘤的免疫抗体治疗
其他肿瘤免疫抗 体治疗概述
除了肺癌、肝癌和乳腺癌外 ,免疫抗体治疗在其他肿瘤 治疗中也有广泛应用。如黑 色素瘤、结直肠癌和肾癌等 。
肿瘤免疫抗体治疗通过激活患者自身的免疫系统来对抗肿瘤,为肿瘤治疗开辟了新 的途径,具有重要的科学价值和临床意义。
胃癌免疫治疗研究年度进展2024版.docx
胃癌免疫治疗研究年度进展2024年版2023年3月,国家癌症中心发布了最新一期全国癌症统计数据,我国整体癌症粗发病率仍持续上升,癌症所带来的实际疾病负担沉重。
作为传统高发肿瘤,胃癌在我国的发病率和死亡率均居高不下,位列我国癌症死亡的第三位。
另一研究报告指出,在中国,2010至2014年期间,胃癌患者的5年净生存率仅为35.9%,明显低于同期亚洲国家韩国(68.9%)和日本(60.3%)的水平。
这表明我们面临着巨大的挑战,亟需在胃癌领域取得更大的进步。
令人鼓舞的是,根据2023年的数据,有6项中国肿瘤研究成果发表于Lancet杂志,其中两项研究专注于胃癌领域,并且涉及免疫联合治疗,取得了显著的疗效。
这些成果为未来的胃癌治疗提供了新的希望和方向,也凸显了免疫治疗在改善胃癌患者预后方面的重要性,需要更多的关注。
目前,针对胃癌应用最广泛的免疫治疗包括免疫检查点抑制剂(IClS)、过继细胞治疗(ACT),嵌合抗原受体T细胞免疫(CAR-T)疗法以及癌症疫苗等。
一些ICIS,如帕博利珠单抗、信迪利单抗、替雷利珠单抗和伊匹木单抗,已经获批用于晚期或局部进展期胃癌的一线系统治疗,相关前瞻性临床试验也证实了免疫治疗在胃癌治疗中的有效性和安全性。
本文旨在突出2023年度胃癌免疫治疗中的前沿进展及焦点问题,特别关注围手术期患者的免疫治疗、晚期或进展期胃癌患者的免疫治疗,以及“双免治疗”及“靶免化联合”治疗策略的最新进展,为未来的研究提供展望。
一、胃癌围手术期免疫治疗研究进展(一)方兴未艾:胃癌围手术期免疫治疗的探索对于可切除的胃癌或胃食管交界部腺癌(GEJAC)患者,标准治疗方案是手术+围手术期含粕化疗。
然而,对于错配修复缺陷(dMMR)/微卫星不稳定性高(MSI-H)的胃癌/GEJAC腺癌患者,围手术期免疫治疗的效益仍存在争议。
NEONlPlGA试验是一项H期研究,也是胃癌新辅助治疗领域具有里程碑意义的研究,评估了局部晚期可切除的dMMR∕MSlTI胃癌/GEJAC患者采用纳武单抗联合伊匹木单抗的新辅助治疗,继以手术和纳武单抗辅助治疗的疗效。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
什么是假性进展?
在免疫治疗过程中,部分患者(1%-10%)出现免疫相关反应(肿瘤病灶初始大小增大或新病灶出现)。
活检证实为坏死或炎性细胞浸润,随后肿瘤负荷减轻,这被认为是假性进展。
具体机制尚无定论,普遍认为由于大量T细胞和免疫调控细胞涌入肿瘤细胞造成的病灶区影像增大。
2018-9CT 原发灶大小4.6×2.7(一名假性进展患者影像)
2018-11CT(用药两个月后评估5.1*4.2)
2019-1(用药3个月后评估3.7×2.6)
2019-2(用药4个月后评估2.1*2.1)
通常假性进展出现在免疫治疗的初期,而免疫治疗起效通常为2-4个月!
所以如何准确分辨免疫治疗是否有效,稳定还是假性进展,超进展至关重要!
目前影像学免疫治疗的评价标准有:免疫治疗相关评价标准(irRC)、一维免疫治疗相关RECIS 标准(irRECIST)和免疫RECIST 标准(iRECIST)。
在影像学评估ICIs 假性进展方面,比较推荐的标准是irRECIST。
当然,影像学诊断假性进展具有一定的局限性,血液指标或病理组织学指标进行进一步的诊断。
指标一IL-8:
IL-8是一种趋化性细胞因子,可以促进炎症细胞趋化和诱导细胞增殖,并在癌组中高表达。
研究者发现在假性进展过程中影像学评估的靶病灶大小增加,但血清IL-8水平下降,并在之后的影像学评估时持续低于基线水平。
之后,当患者发展为进行性疾病时,血清IL-8水平又稳步升高。
指标二:ctDNA:
ctDNA是游离于血液中的肿瘤细胞DNA。
来源于坏死的肿瘤细胞;凋亡的肿瘤细胞;循环肿瘤细胞;
假性进展患者ctDNA 快速、显著下降,而真实进展的患者ctDNA 明显升高
指标三:PET-CT上SUV(标准摄取值)改变。
目前SUV已被广泛用于肿瘤良恶性鉴别及疗效评价,预后预测。
一般我们在CT上看到了一个肿物,很难判断这个肿物是什么性质的(是良性的?还是恶性的?是炎症?肿瘤?还是结核?)通过PET-CT上SUV值的大小,就可以帮助我们判断,比如SUV值超过了10,那肯定是肿瘤了,如果小于2,那么多半是炎症了。
多数学者将SUV 2.5作为良恶性鉴别界限,SUV>;2.5考虑为恶性肿瘤,SUV介于2.0~2.5之间,为临界范围,SUV<;2.0可以考虑为良性病变。
指标四:除影像学和血液学检测外,病理组织学检查更为直观和准确,是假性进展诊断的金标准。
如果活检检测出来是癌细胞,考虑是真进展;如果是大量浸润的淋巴细胞、免疫细胞,高度怀疑是假进展。
临床经验:
1、假如体内原本存在的多个病灶同时“进展”,则考虑假进展的可能新较大。
这是因为人体的免
疫系统几乎遍布全身,因此免疫细胞被激活后,很有可能同时进攻体内的肿瘤细胞。
2、假性进展通常不伴随体重或者体能下降,患者的自我感觉会有所改善。
