第三章 酶
生物化学I 第三章 酶学

根据国际生化协会酶命名委员会的规定,每一个酶都用 四个打点隔开的数字编号,编号前冠以EC(酶学委员会缩 写),四个数字依次表示该酶应属的大类、亚类、亚亚类 及酶的顺序号,这种编码一种酶的四个数字即是酶的标码。
例如:EC1.1.1.27(乳酸脱氢酶) 酶
乳酸:NAD+氧化还原
u u u u
第一大类 氧化还原酶 第一亚类 —CHOH被氧化 第一亚亚类 氢受体为NAD+ 排序 顺序号为27
4. 1878年, Kü hne赋予酶统一的名称 “Enzyme”, 其意思为“在酵母中”。
Enzyme 酶
德国生物化学家
5. 1930~1936年,Northrop和Kunitz先后得到了胃蛋 白酶、胰蛋白酶和胰凝乳蛋白酶结晶,并用相应方法 证ቤተ መጻሕፍቲ ባይዱ酶是蛋白质。
为此, Northrop和Kunitz于1949年共同 获得诺贝尔奖。
(1)旋光异构专一性:
(2)顺反异构专一性:
例如:不同的酶有不同的活性中心,故对底物有严格的特异性。例如乳 酸脱氢酶是具有立体异构特异性的酶,它能催化乳酸脱氢生成丙酮酸 的可逆反应:
A、B、C分别为LDH活性中心的三个功能基团
消化道内几种蛋白酶的专一性
氨肽酶
(芳香) (硷性)
羧肽酶 羧肽酶
(丙)
Ser
His 活性中心重要基团: His57 , Asp102 , Ser195
Asp
(4)酶的活性中心与底物形状不是正好互补的。
(5)酶的活性中心是位于酶分子表面的一个裂 缝(Crevice)内。
(6)底物通过次级键较弱的作用力与酶分子结 合,这些次级键为:氢键、离子键(盐键)、 范德华力和疏水相互作用。 (7)酶的活性中心具有柔性或可运动性。
第三章 酶 第四章维生素与辅酶

第三章酶第四章维生素和辅酶本章教学要求:1、了解酶的基本概念、化学本质、酶促反应特点和酶命名与分类原则。
2、牢记与酶组成、结构、功能有关的基本概念。
如酶蛋白、辅因子、酶活性中心、必需基团、同工酶等。
3、掌握影响酶促反应速度的几种因素及动力学特点。
熟记米氏方程和米氏常数的意义。
4、结合酶促反应动力学掌握酶活性测定的基本原则,熟记酶活力单位概念。
5、熟记水溶性维生素和辅酶的化学本质、活性方式、代谢功能。
同时了解缺乏维生素的相应缺乏病。
一、填空题:1. 对于服从米氏方程的酶来说,当[S]为Km,V为35μmol/min时,酶促反应的Vmax是。
2. 能催化蛋白质降解的酶叫做。
3. 下面缩写符号的中文名称分别是:NAD+,FAD ,TPP 。
4. 酶分子上与活性有关的具有特定三维结构的小区域叫做酶的,活性部位基团按功能分为和。
5. 酶作用的特异性分为和。
6. 影响酶促反应速度的因素主要有、、和。
7. 与一般催化剂比较,酶最显著的两个特点是和。
8. 有非竞争性抑制剂存在时,酶促反应的Km ,Vmax 。
9. 如果一个酶对A、B、C、三种底物的米氏常数分别为Kma、Kmb、和Kmc,且Kma>Kmb>Kmc,则此酶的最适底物是,与酶亲和力最小的底物是。
10. 根据酶促反应类型,酶可以分为、、、、和六大类。
11. EC 4.1.1.11应为酶类。
12. 酶量的多少常用表示,酶的纯度常用表示。
13. L-精氨酸酶只催化L-精氨酸反应,而对D-精氨酸无作用,此酶具有专一性。
14. 若使酶促反应的速度达到最大反应速度的90%,底物浓度应是此酶Km值的倍?15. 丙二酸是酶的抑制剂。
16. 全酶由和组成。
二、判断题:1. 酶的活力愈高,其纯度亦愈高。
2. 当[S] >>Km时,酶催化反应的速度与底物浓度成正比。
3. FAD和FMN都含有腺苷酸。
4. 当缺乏维生素B1时,丙酮酸脱氢酶复合物和α—酮戊二酸脱氢酶复合物均无活性。
生物化学与分子生物学—酶
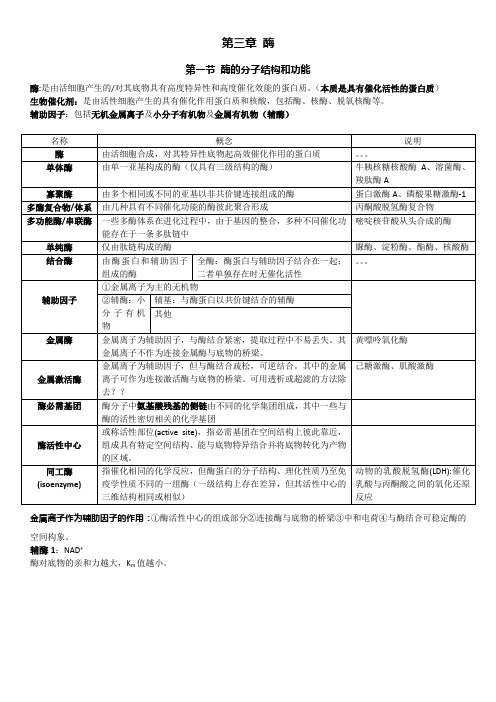
第三章酶第一节酶的分子结构和功能酶:是由活细胞产生的/对其底物具有高度特异性和高度催化效能的蛋白质。
(本质是具有催化活性的蛋白质)生物催化剂:是由活性细胞产生的具有催化作用蛋白质和核酸,包括酶、核酶、脱氧核酶等。
辅助因子:包括无机金属离子及小分子有机物及金属有机物(辅酶)金属离子作为辅助因子的作用:①酶活性中心的组成部分②连接酶与底物的桥梁③中和电荷④与酶结合可稳定酶的空间构象。
辅酶1:NAD+酶对底物的亲和力越大,K m值越小。
酶的活性中心是酶分子执行其催化功能的部位辅助因子常参与酶活性中心的组成。
酶的活性中心具有三维结构,往往形成裂缝或凹陷。
这些裂缝或凹陷由酶的特定空间构象所维持,深入到酶分子内部,且由氨基酸残基的疏水基团组成,形成疏水“口袋”。
单纯酶与结合酶的活性中心酶单纯酶(分子结构仅由氨基酸组成)结合酶(conjugated enzyme )酶蛋白(决定酶促反应的特异性及其催化机制)辅助因子(决定酶促反应的性质和类型)金属离子为主的无机物辅酶coenzyme (小分子有机物)辅基(与酶蛋白以共价键结合的辅酶,不能用透析或超滤的方法去除。
)其他必需基团活性中心内的结合基团(识别与结合底物和辅酶,形成酶-底物过渡态复合物)催化基团(影响底物中的某些化学键的稳定性,催化底物发生化学反应)活性中心外的不参与催化作用。
维持酶活性中心的空间构象和(或)作为调节剂的结合部分所需。
第二节酶的工作原理(一)酶促反应的特点1.极高的效率:降低反应的活化能,但不改变反应的平衡点2.高度的特异性①绝度的专一性:仅作用于特定结构的底物,进行一种专一的反应,生成一种特定的产物。
如脲酶和琥珀酸脱氢酶。
②相对的专一性:作用于一类化合物或一种化学键。
如脂肪酶、磷酸酶、蛋白酶等。
3.酶促反应的可调节性①酶量调节②酶的活性调节③改变底物浓度进行调节(二)酶促反应机制的诱导契合假说酶与底物接近时二者相互诱导、相互形变、相互适应。
生物化学 第3章 酶

生物化学第3章酶生物化学第3章酶第3章酶自学建议1.掌握酶及所有相关的概念、酶的结构与功能的关系、酶的工作原理、酶促反应动力学特点、意义及应用。
2.熟识酶的分子共同组成与酶的调节。
3.了解酶的分类与命名及酶与医学的关系。
基本知识点酶是对其特异底物起高效催化作用的蛋白质。
单纯酶是仅由氨基酸残基组成的蛋白质,融合酶除所含蛋白质部分外,还所含非蛋白质辅助因子。
辅助因子就是金属离子或小分子有机化合物,后者称作辅酶,其中与酶蛋白共价紧密结合的辅酶又称辅基。
酶分子中一些在一级结构上可能相距很远的必需基团,在空间结构上彼此靠近,组成具有特定空间结构的区域,能与底物特异结合并将底物转化为产物,这一区域称为酶的活性中心。
同工酶就是指催化剂相同化学反应,酶蛋白的分子结构、化学性质乃至免疫学性质相同的一组酶,就是由相同基因编码的多肽链,或同一基因mRNA分解成的相同mrna所译者的相同多肽链共同组成的蛋白质。
酶促反应具有高效率、高度特异性和可调节性。
酶与底物诱导契合形成酶-底物复合物,通过邻近效应、定向排列、表面效应使底物容易转变成过渡态。
酶通过多元催化发挥高效催化作用。
酶促反应动力学研究影响酶促反应速率及其影响因素,后者包括底物浓度、酶浓度、温度、ph、抑制剂和激活剂等。
底物浓度对反应速率的影响可用米氏方程表示。
v?vmax[s]km?[s]其中,km为米氏常数,其值等同于反应速率为最小反应速率一半时的底物浓度,具备关键意义。
vmax和km需用米氏方程的双倒数作图去求得。
酶在拉沙泰格赖厄县ph和拉沙泰格赖厄县温度时催化活性最低,但拉沙泰格赖厄县ph和拉沙泰格赖厄县温度不是酶的特征性常数,受到许多因素的影响。
酶的抑制作用包含不可逆遏制与对称遏制两种。
对称遏制中,竞争抑制作用的表观km值减小,vmax维持不变;非竞争抑制作用的km值维持不变,vmax增大,反竞争抑制作用的km值与vmax均增大。
在机体内酶活性与含量的调节是代谢调节的重要途径。
第三章酶的化学修饰

第三章酶的化学修饰第一节酶的分子修饰一、酶的化学修饰原因1、稳定性2、酶反应的最适条件3、酶的专一性4、米式常数过大5、临床应用的特殊要求6、酶种类的限制改变酶特性有两种主要的方法:1)通过分子修饰的方法来改变已分离出来的天然酶的活性。
2)通过基因工程方法改变编码酶分子的基因而达到改造酶的目的。
二、酶分子修饰通过各种方法使酶分子的结构发生某些改变,从而改变酶的某些特性和功能的技术过程称为酶分子修饰。
即在体外将酶分子通过人工的方法与一些化学基团(物质),特别是具有生物相容性的物质,进行共价连接,从而改变酶的结构和性质。
三、酶分子修饰的意义⏹提高酶的活力⏹增强酶的稳定性⏹降低或消除酶的抗原性⏹研究和了解酶分子中主链、侧链、组成单位、金属离子和各种物理因素对酶分子空间构象的影响化学修饰效果举例用纤维蛋白的专一性单克隆抗体修饰尿激酶,使其溶血栓性提高了100倍。
用乙醛酸修饰胰凝乳蛋白酶的表面氨基,形成亲水性的α-NHCH2COOH后,该酶对60℃热处理的稳定性增高了1000倍。
超氧化物歧化酶(SOD)、L-谷氨酰胺酶、L-天门冬酰胺酶、尿酸酶等用PEG(聚乙二醇)修饰后,完全消除了酶的抗原性和免疫原性,减慢了它们在动物血液循环中被清除的速度,酶的活力可以保存15%-45%。
四、酶化学修饰的基本原理1、如何增强酶天然构象的稳定性与耐热性修饰剂分子存在多个反应基团,可与酶形成多点交联。
使酶的天然构象产生“刚性”结构。
2、如何保护酶活性部位与抗抑制剂大分子修饰剂与酶结合后,产生的空间障碍或静电斥力阻挡抑制剂,“遮盖”了酶的活性部位。
3、如何维持酶功能结构的完整性与抗蛋白水解酶酶化学修饰后通过两种途径抗蛋白水解酶:A 大分子修饰剂产生空间障碍阻挡蛋白水解酶接近酶分子。
“遮盖”酶分子上敏感键免遭破坏。
B 酶分子上许多敏感基团交联上修饰剂后,减少了受蛋白水解酶破坏的可能性。
4、如何消除酶的抗原性酶蛋白氨基酸组成的抗原决定簇,与修饰剂形成了共价键。
第三章 酶化学

第三章酶化学1.试比较酶与非酶催化剂的异同点。
2.解释酶作用专一性的假说有哪些?各自的要点是什么?3.酶的习惯命名法的命名原则是什么?5.已知丙氨酸是某酶的底物结合部位上的一个氨基酸;一次突变丙氨酸转变为甘氨酸,但酶活性没有受到影响。
在另一次突变时,丙氨酸变成了谷氨酸,使该酶的活性明显丧失,请分析原因。
6.在一酶促反应中,若底物浓度为饱和,并有一种抑制剂存在,问:1)继续增加底物浓度,2)增加抑制剂浓度,反应速度将如何变化?为什么?8.何谓共价调节酶?举例说明其如何通过自身活性的变化实现对代谢的调节。
10.举例说明酶的专一性及其研究意义是什么?12.下表数据是在没有抑制剂存在或有不同浓度的抑制剂存在时测得的反应速度随底物浓度变化的情况:1)无抑制剂存在时,反应的最大速度和Km是多少?2)若有2mmol的抑制剂存在,反应的最大速度和Km又是多少?该抑制剂属于何种类型的抑制作用?EI复合物的解离常数是多少?3)若有100mmol的抑制剂存在,最大反应速度和Km又是多少?该种抑制剂属于何种类型的抑制作用?EI复合物的解离常数是多少?13.举例说明酶的竞争性抑制作用及其研究意义。
16.酶原及酶原激活的生物学意义是什么?17.为什么吸烟者患肺气肿的可能性较大?18.从一级结构看,胰蛋白酶含有13个赖氨酸和2个精氨酸,为什么胰蛋白酶不能水解自身?20.以E.coli天冬氨酸转氨甲酰酶(ATCase)为例说明变构酶的结构特征及其在代谢调节中的作用?21.虽然凝血酶和胰蛋白酶的性质有许多相似之处,但胰蛋白酶原经自身催化可转变为胰蛋白酶,而凝血酶原不能,为什么?22.何谓同工酶?举例说明其分子结构的特征及研究意义?23.胰蛋白酶原的第2,3,4,5位氨基酸都是天门冬氨酸,这一结构特征的意义是什么?24.为什么胰脏酶原激活过程中产生的肽链的C一末端氨基酸一般是精或赖氨酸?27.为什么说N一磷乙酰基L一天门冬氨酸(PALA)是研究天门冬氨酸转氨甲酸酶(AT -Case)性质的特异性试剂?28.碱性磷酸酶水解1一磷酸葡萄糖产生葡萄糖和磷酸。
第三章酶与酶的促反应

第三章酶与酶的促反应名词解释全酶对于大多数化学本质为蛋白质的酶来说,按照化学组成可分为单纯酶和结合酶两大类。
全酶(又称结合酶)除了蛋白质组分外,还含有对热稳定的小分子物质。
前者称为酶蛋白,后者称为辅因子。
酶蛋白和辅因子单独存在时,均无催化活力。
只有二者结合成完整的分子时,才具有活力。
此完整的酶分子称为全酶。
全酶=酶蛋白+辅因子酶的辅助因子:主要包括金属离子和小分子有机化合物,在酶促反应中主要决定反应的种类和性质,在反应中起到传递电子、原子或某些化学基团的作用。
辅酶和辅基:辅酶是指以非共价键和酶蛋白结合的小分子有机物质,通过透析或超滤等物理方法可以除去。
辅基是指以共价键和酶蛋白结合的小分子有机物质,不能通过透析或超滤的方法除去酶的活性中心是指酶分子能与底物特异性结合并将底物转化为产物,具有特定空间结构的区域。
使酶分子执行其催化功能的部位同工酶催化相同的化学反应,而酶蛋白的分子结构,理化性质及免疫学性质不同的一组酶(5种乳酸脱氢酶同工酶)变构调节变构调节(也叫别构调节)是指一些代谢物与某些酶分子活性中心以外的某一部位可逆的结合(非共价结合),引起酶构象变化、从而改变酶的催化活性,此种调节方式叫做变构调节。
共价修饰调节在其他酶的催化作用下,某些酶蛋白肽链上的一些基因可与某种化学基因发生可逆的共价结合,从而改变酶的活性,此过程成为共价修饰。
抑制剂凡能是酶的催化活性下降而不引起酶蛋白变性的物质称为酶的抑制剂。
Km米氏常数(Km)的含义是酶促反应达最大速度(Vm)一半时的底物(S)的浓度。
竞争性抑制抑制剂的结构与底物结构相似,能与底物竞争结合在酶的活性中心,从而降低或抑制酶活性这种抑制作用称竞争性抑制剂,这种抑制作用称竞争性抑制作用。
底物浓度增大,抑制下降。
Km增大,亲和力下降,Vm不变非竞争性抑制有些抑制剂可与酶活性中心以外的必需基团结合,不影响酶与底物的结合,抑制剂和底物可同时结合在酶分子上,形成酶-底物-抑制剂复合物,不能释放出产物,使酶活性丧失,这种抑制剂称为非竞争性抑制剂,这种抑制作用称为非竞争性作用。
酶工程 第三章酶的发酵生产 第三节发酵工艺条件及控制

第三节 发酵工艺条件及控制
无机元素是通过添加无机盐来提供的,一般采用水溶 性的硫酸盐、磷酸盐或盐酸盐等。有时也使用硝酸盐,在 提供无机氮的同时,提供无机元素。
4.生长因素 生长因素是指细胞生长繁殖所必不可缺的微量有机化 合物主要包括各种氨基酸、嘌呤、嘧啶、维生素,以及动 植物生长激素等。各种氨基酸是蛋白质和酶的组分;嘌呤 和嘧啶是核酸和某些辅酶的组分;维生素主要起辅酶作用; 动植物生长激素则分别对动物细胞和植物细胞的生长、分 裂起调节作用。有的细胞能够自己合成各种生长因素,而 有的细胞则缺少合成一种或多种生长因素的能力,需由外 界供给,才能正常生长繁殖,这样的细胞称为营养缺陷型。
第三节 发酵工艺条件及控制
在酶的发酵生产中,通常在培养基中加进玉米浆、酵 母膏等,以提供各种必需的生长因素。有时,也加进纯化 的生长因素,以供细胞生长繁殖之需。
现举例几种酶发酵培养基: (1)枯草杆菌BF7658α—淀粉酶发酵培养基:玉米粉 8%,豆饼粉4%,磷酸氢二钠0.8%,硫酸铵0.4%,氧化钙 0.2%,氯化铵0.15%。 (2)枯草杆菌AS1.398中性蛋白酶发酵培养基:玉米 粉4%,豆饼粉3%,麸皮3.2%,米糠1%,磷酸氢二钠0.4%, 磷酸二氢钾0.03%。 (3)黑曲霉糖化发酵培养基:玉米粉10%,豆饼粉4%, 麸皮1%(PH4.4—5.0)。
第三节 发酵工艺条件及控制
不同细胞生长繁殖的最适PH有所不同。一般细胞和放 线菌的生长最适PH为中性或微碱性(PH6.5—8.0);霉菌 和酵母的生长最适PH为偏酸性(PH4.0—6.0);植物细胞 生长的最适PH为5—6。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第三章酶一、选择题【单选题】1.关于酶,下列叙述哪项正确A.所有蛋白质都是酶B.酶由活细胞产生,在体外无催化活性C.所有酶都有辅酶或辅基D.酶的化学本质是蛋白质E.酶的化学本质是核酸2.酶高度的催化效率是因为它能A.改变化学反应的平衡点B.增加反应的活化能C.降低反应的活化能D.升高反应温度E.催化热力学上允许催化的反应3.决定酶特异性的是A.辅酶B.酶蛋白C.金属离子D.辅基E.辅助因子4.全酶是指A.结构完整的酶 B.酶蛋白与辅助因子的结合物C.酶与抑制剂的复合物 D.酶与变构剂的复合物E.酶与激动剂的复合物5.辅酶与辅基的主要区别是A.化学本质不同B.分子量大小不同C.溶解度不同D.与酶蛋白结合的紧密程度不同E.理化性质不同6.有关酶活性中心的叙述哪项正确A.酶活性中心都含辅基或辅酶B.酶都有活性中心C.酶活性中心都有调节部位和催化部位D.抑制剂都作用于酶活性中心E.位于酶分子核心7.以酶原形式分泌的酶是A.组织细胞内的脱氢酶B.淀粉酶C.消化管内的蛋白酶D.转氨酶E.脂肪酶8.酶原没有催化活性是因为A.作用的温度不合适B.由于周围有抑制剂C.活性中心没有形成或暴露D.辅助因子的脱落E.反应环境的酸碱度不合适9.同工酶具有下列何种性质A.催化功能相同B.酶蛋白分子结构相同C.免疫学性质相同D.理化性质相同E.酶蛋白分子量相同10.维生素B1在体内的活性形式是A.硫胺素B.CoA C.TPP D.FAD E.NAD+11.生物素是下列哪种酶的辅酶A.脱羧酶B.脱氢酶C.转氨酶D.羧化酶E.羟化酶12.下列哪个酶含有BıA.丙酮酸脱氢酶系B.乳酸脱氢酶C.异柠檬酸脱氢酶D.谷氨酸脱氢酶E.苹果酸脱氢酶13.下列酶中含有VitB2的是A.琥珀酸脱氢酶B.乳酸脱氢酶C.6—磷酸葡萄糖脱氢酶D.苹果酸脱氢酶E.异柠檬酸脱氢酶14.下列哪些是VitB6的辅酶形式A.VitB6B.磷酸吡哆醛C.吡哆胺D.吡哆醛吡哆醇15.一碳单位转移酶的辅酶是A.NADPH + H+B.FH4 C.CoA D.FMN E.FH2 16.下列哪个维生素参与辅酶A的组成A.尼克酰胺B.泛酸C.钴胺素D.生物素E.叶酸17.激活胰蛋白酶原的物质是A.HCl B.胆汁酸C.肠激酶D.端粒酶E.胃蛋白酶18.下列哪项不是酶促反应特点?A.酶有敏感性B.酶的催化效率极高C.酶能加速热力学上不可能进行的反应D.酶活性可调节E.酶有高度的特异性19.胰液中的蛋白水解酶最初以酶原形式存在的意义是A.抑制蛋白酶的分泌B.促进蛋白酶的分泌C.保护自身组织D.保证蛋白质在一定时间内发挥消化作用E.以上都不对20.诱导契合学说是指A.酶原被其他酶激活B.酶的绝对特异性C.酶改变底物构象D.酶改变抑制剂构象E.底物与酶相互诱导,改变构象21.关于竞争性抑制作用叙述正确的是A.抑制剂与活性中心以外的部位结合B.抑制剂结构与底物的不相似C.增加底物浓度对抑制作用无影响D.Km增大,Vmax不变E.Vmax与Km均不变22.关于关键酶的描述,下列哪项错误A.关键酶常位于代谢途径的第一个反应或分支处B.关键酶的活性最高,对整个代谢途径的速度起决定性作用C.关键酶常受变构调节D.关键酶也可受化学修饰调节E.受激素调节的酶常是非关键酶23.关于变构调节的叙述错误的是A.变构调节是一种迟缓调节B.变构剂结合于调节部位C.变构调节有酶蛋白构象改变D.变构酶多为寡聚酶E.酶变构后活性发生改变24.关于酶的化学修饰调节正确的是A.调节过程消耗ATP,但是经济有效B.调节过程无共价键改变C.调节过程无逐级放大作用D.甲基化为最常见的修饰方式E.此调节不需要消耗能量25.细胞水平的调节通过下列机制实现,但下列哪项应除外A.化学修饰B.变构调节C.酶含量调节D.激素调节E.同工酶调节26.真核细胞内酶分布特点是A.全部酶都集中在细胞核内B.全部酶都在线粒体内C.全部酶都分布在细胞液内D.各酶有一定的布局,相互有关的酶多集中分布在某一部位E.以上都不对27.底物对酶含量的影响,通常是A.诱导酶蛋白的合成B.阻遏酶蛋白的合成C.抑制酶蛋白的降解D.促进酶蛋白的降解E.以上全不是28.在代谢途径中成为限速酶可能性最小的是A.在细胞内催化反应接近平衡状态的酶B.代谢途径的起始或分支点上的酶C.催化不可逆反应的酶D.具有高Km值而活性低的酶E.反应速度很慢的酶29.磺胺类药物是下列哪个酶的抑制剂A.二氢叶酸合成酶B.二氢叶酸还原酶C.四氢叶酸合成酶D.四氢叶酸还原酶E.一碳单位转移酶30.乳酸脱氢酶加热后活性大大降低的原因是A.酶蛋白与辅酶分离B.酶蛋白变性C.亚基解聚D.辅酶失去活性E.酶活性受抑制31.有机磷杀虫剂对胆碱酯酶的抑制作用是A.可逆性抑制B.竞争性抑制C.非竞争性抑制D.不可逆抑制E.以上都不是32.唾液淀粉酶对淀粉起催化作用,对蔗糖不起作用这一现象说明了酶有A.高度的催化效率B.高度的特异性C.高度的敏感性D.可调节性E.以上都不对33.急性肝炎时血中转氨酶升高是由于A.酶排泄受阻B.组织受损伤或细胞通透性增加C.酶活性受抑D.酶合成量减少E.酶合成增加34.严重肝病时血清凝血酶原降低是由于A.酶排泄受阻B.组织受损伤或细胞通透性增加C.酶活性受抑D.酶合成量减少E.酶合成增加35.酶蛋白与辅助因子组成的全酶称A.必需基团B.活性中心C.催化基团D.结合基团E.结合酶36.与酶活性密切相关的基团称A.必需基团B.活性中心C.催化基团D.结合基团E.结合酶37.凡能使酶蛋白变性的物质是A.抑制剂B.激活剂C.蛋白变性剂D.竞争性抑制剂E.非竞争性抑制剂38.使酶原转变为酶的物质是A.抑制剂B.激活剂C.蛋白变性剂D.竞争性抑制剂E.非竞争性抑制剂39.增加底物可解除抑制作用的是A.抑制剂B.激活剂C.蛋白变性剂D.竞争性抑制剂E.非竞争性抑制剂40.酶促反应速度最快A.0℃~40℃B.大于80℃C.最适温度D.小于0℃E.以上都不是【多选题】41.酶促反应特点是A.高度的催化效率B.高度的特异性C.高度的不稳定性D.酶活性的可调节性E.改变化学反应的平衡点42.酶的辅助因子可以是A.某些小分子有机化合物B.各种无机和有机化合物C.金属离子D.维生素E.非金属元素43.关于酶活性中心的叙述错误的是A.是酶分子表面的一个区域B.其空间构象改变酶活性不变C.具有催化基团和调节基团D.底物在此转变为产物E.辅助因子存在于此处44.初分泌时以酶原形式存在的是A.胰淀粉酶B.胰蛋白酶C.胃蛋白酶D.凝血酶E.纤溶酶45.关于LDH1和LDH5的描述正确的是A.均催化乳酸与丙酮酸之间的化学反应,但生理意义不同B.对同一底物Km相同C.对同一底物Km不同D.可用电泳法分离它们E.两者在心肌和骨骼肌分布不同46.核黄素参与组成的辅酶有A.NAD+ B.FMN C.FAD D.NADP+E.CoA47.下列哪些辅酶中含有腺苷酸A.NAD+ B.FMN C.FAD D.NADP+ E.CoA48.可用于治疗巨幼红细胞性贫血的维生素有A.维生素D B.维生素B12 C.叶酸D.维生素K E.维生素C49.关于维生素的描述,正确的有A.维生素是一类小分子有机化合物B.维生素是构成机体组织细胞的成分C.维生素的生理功能包括氧化供能D.维生素在人体内不能合成或合成量不足E.较多的维生素参与构成了酶的辅助因子50.属于水溶性维生素的有A.维生素D B.维生素B12 C.泛酸D.维生素K E.维生素C51.下列哪些维生素不作为辅酶形式A.维生素B6 B.维生素A C.维生素DD.硫胺素 E.钴氨素52.影响酶促反应速度的因素有A.酶浓度B.底物浓度C.温度D.pH E.抑制剂53.测定酶活性的理想条件应该有A.最适温度B.含有激动剂C.最适pHD.底物浓度过量E.含有抑制剂54.关于Km的意义正确的是A.1/Km越小,酶与底物的亲和力越大B.Km单位是mol/LC.Km越小,反应速度越大D.当v=1/3Vmax时,Km=[S]E.Km不是酶的特征性常数55.pH对酶促反应速度的影响主要是由于A.改变必需基团的解离状态B.改变酶蛋白空间结构C.改变介质分子的解离状态D.改变辅酶的结构E.影响酶—底物复合物的解离状态56.下列哪些物质在体内可引起竞争性抑制作用A.丙二酸B.哇巴因C.磺胺类药物D.5-FU E.草酰乙酸57.由于体内酶的缺陷导致的疾病有A.蚕豆病B.白化病C.糖尿病D.苯丙酮尿症E.佝偻病58.变构调节的特点是A.变构剂通常是体内某些代谢物B.多有调节亚基和催化亚基C.使酶蛋白构象发生改变,从而改变酶活性D.变构调节都产生正效应,即加快反应速度E.变构剂与酶分子上的非催化部位特异结合59.酶的化学修饰特点是A.有放大效应B.消耗能量C.这类酶存在有活性与无活性两种形式D.引起酶蛋白发生共价变化E.化学修饰变化是一种酶促反应60.关于变构调节的正确描述是A.变构调节是生物体内快速调节酶活性的主要方式B.变构酶常有两个以上的亚基C.单体酶、寡聚酶都可有变构调节现象D.变构剂都是酶的底物或酶促反应的终产物E.酶的变构作用表现为酶分子亚基发生聚合、解聚和(或)构象发生改变二、名词解释1.酶2.酶的特异性3.酶的活性中心4.酶原5.酶原的激活6.辅酶7.辅基8.同工酶9。
水溶性维生素10.米氏常数11.不可逆性抑制12.变构调节13.化学修饰调节14.最适温度15.最适pH 16.酶的竞争性抑制17.酶的非竞争性抑制三、填空题1.酶促反应特点为、、、.2.酶有高度的催化效率是因为,这一效应可用学说来解释。
3.结合酶类必需由和相结合后才具有活性,前者的作用是,后者的作用是。
4.酶活性中心的必需基团可分为、两种。
5.维生素PP在体内的活性形式有及.6.维生素B1的活性形式为,它是及的辅酶.7.叶酸在体内的活性形式为,它是的辅酶.8.甲基钴胺素是的辅酶,当其缺乏时可引起。
9.维生素B6的活性形式为、,它是及的辅酶。
10.维生素B2的活性形式为、,它是的辅酶。
11.Km是酶的常数,它与有关,而与无关。
不同的酶,Km ;同一种酶有不同的底物时,其Km值。
12.抑制剂不改变酶的Km;抑制剂不改变酶的Vmax。
13.酶结构的调节分为和调节。
14.别构酶的结构中有位和部位;酶最常见的化学修饰方式是和修饰.15.低温保存酶制剂、疫苗和菌种的机制是。
使酶促反应速度最快时的环境温度称为。
16.磺胺类药物抑制某些细菌的生长,是竞争性抑制细菌体内的从而妨碍了的合成。
17.高等生物代谢调节在、、三种不同水平上进行.18.细胞水平的调节实质上是,是最基本的调节方式,包括和的调节,其中快速调节又可分为和两种调节方式。
