实验六EDTA标准溶液的标定及水硬度的测定
edta标准溶液的标定实验报告

edta标准溶液的标定实验报告 EDTA 标准溶液的标定实验报告一、实验目的1、掌握 EDTA 标准溶液的配制和标定方法。
2、学会用络合滴定法测定金属离子的含量。
3、熟悉酸式滴定管、移液管和容量瓶的正确使用方法。
二、实验原理EDTA(乙二胺四乙酸)是一种很强的络合剂,能与许多金属离子形成稳定的 1:1 络合物。
在一定条件下,以二甲酚橙为指示剂,用锌标准溶液标定 EDTA 溶液的浓度。
锌离子与 EDTA 反应的化学方程式为:\Zn^{2+}+ H_{2}Y^{2-}= ZnY^{2-}+ 2H^{+}\二甲酚橙在 pH < 60 时呈紫红色,在 pH > 63 时呈黄色。
在滴定过程中,当溶液由紫红色变为亮黄色时,即为滴定终点。
三、实验仪器与试剂1、仪器酸式滴定管(50 mL)、移液管(25 mL)、容量瓶(250 mL)、锥形瓶(250 mL)、烧杯(250 mL)、玻璃棒、电子天平。
2、试剂(1)乙二胺四乙酸二钠盐(EDTA):分析纯。
(2)氧化锌(基准试剂):在 800℃灼烧至恒重。
(3)盐酸(1:1):浓盐酸与水等体积混合。
(4)氨水溶液(1:1):浓氨水与水等体积混合。
(5)氯化铵氨水溶液:将 20 g 氯化铵溶于水,加 100 mL 氨水,用水稀释至 1 L。
(6)二甲酚橙指示剂(02%):称取 02 g 二甲酚橙,溶于 100 mL 水中。
四、实验步骤1、配制 002 mol/L EDTA 标准溶液(1)称取约 4 g EDTA 二钠盐于小烧杯中,加入约 200 mL 水,温热溶解后,转入容量瓶中,用水稀释至刻度,摇匀。
(2)将配制好的 EDTA 溶液转移至试剂瓶中,贴上标签。
2、配制锌标准溶液(1)准确称取 042 g 左右已在 800℃灼烧至恒重的基准氧化锌于小烧杯中。
(2)用少量水湿润,盖上表面皿,从杯嘴边逐滴加入 1:1 盐酸,至氧化锌完全溶解。
(3)将溶液转入 250 mL 容量瓶中,用水冲洗表面皿和烧杯内壁数次,一并转入容量瓶中,用水稀释至刻度,摇匀。
自来水中总硬度的测定标准

自来水中总硬度的测定标准一、实验原理水中总硬度是指水中钙离子和镁离子的总量,是评价水质的重要指标之一。
测定自来水中总硬度的方法常采用EDTA络合滴定法,其原理是:在pH=10的氨缓冲溶液中,以铬黑T为指示剂,EDTA与钙、镁离子形成稳定的络合物,用已知浓度的EDTA标准溶液滴定,根据消耗的EDTA标准溶液体积计算出水样中钙、镁离子的总量。
二、实验材料与设备1. 实验试剂:0.025M EDTA标准溶液,铬黑T指示剂,1+9氨缓冲溶液。
2. 实验设备:滴定管、容量瓶、三角瓶、电子天平、pH计。
三、实验步骤1. 准备工作:首先打开自来水水源,将自来水注入容量瓶中,等待30分钟,以便水中悬浮物沉淀。
2. 滴定:用滴定管取一定体积的自来水水样,加入铬黑T指示剂和1+9氨缓冲溶液,然后用已知浓度的EDTA标准溶液滴定至终点。
记录消耗的EDTA标准溶液体积。
3. 空白试验:用蒸馏水代替自来水水样,按照步骤2进行空白试验,记录消耗的EDTA标准溶液体积。
4. 样品测定:按照步骤2和步骤3进行自来水水样的测定,计算自来水中总硬度。
四、实验结果分析根据实验结果,可以得到自来水中总硬度以及钙、镁离子的含量。
通常自来水中钙、镁离子的含量在100-500mg/L之间,如果超过这个范围,说明水质可能存在问题。
此外,还可以通过比较不同时间段的水样测定结果,判断水质是否有变化。
五、实验结论通过EDTA络合滴定法测定自来水中总硬度,可以了解自来水中钙、镁离子的含量,从而评估水质的质量。
实验结果表明,自来水中总硬度在一定范围内,但不同地区和水源的水质可能存在差异。
通过比较不同时间段的水样测定结果,可以判断水质是否有变化。
实验结果可以为相关部门提供参考,以便制定合适的政策和措施来保护和改善水质。
六、实验注意事项1. 在实验过程中要保证实验环境的清洁度,避免干扰实验结果。
2. 使用铬黑T指示剂时要注意安全,避免直接接触皮肤和眼睛。
3. 在滴定过程中要控制好滴定速度,使滴定过程稳定而缓慢。
EDTA滴定

络合滴定法——EDTA测定水中总硬度指导老师:康晓红组员:陈安强 10273032董锦洋 10273034高兴 10273037赵小龙 10273061周超 10273062目录一.EDTA简介--------------------------------------------------------------2 二.EDTA用途--------------------------------------------------------------3 三.水总硬度---------------------------------------------------------------4 四.实验室水的硬度测定(EDTA配位滴定法)----------------------------------4 五.各种测定条件对总硬度影响的讨论-----------------------------------------51.溶液 pH值的影响----------------------------------------------------52.滴定溶液的温度的影响------------------------------------------------53.缓冲溶液的影响------------------------------------------------------64.水样的影响----------------------------------------------------------65.滴定时间及速度的影响------------------------------------------------76. 6.溶液中CO2 的影响-------------------------------------------------77.铬黑T的影响--------------------------------------------------------------------------------------------8六.参考文献---------------------------------------------------------------8一EDTA简介品名:乙二胺四乙酸(Ethylene Diamine Tetraacetic Acid)简称:EDTA俗名:依地酸(特别是它的钙盐络合物,医学上称为依地酸钠钙)分子量:292.248(注:EDTA二钠为372.2)。
EDTA标准溶液的配制与标定实验报告

EDTA标准溶液的配制与标定实验报告实验目的:掌握EDTA标准溶液的配制与标定方法,了解其在分析化学中的应用。
实验仪器与试剂:仪器:电子天平、移液枪、PH计试剂:EDTA二钠盐、亚硝酸钠、硫酸、标准氯化钙溶液、指示剂(甲基橙)实验步骤:一、EDTA标准溶液的配制1. 准备称量瓶和电子天平,称取一定质量的EDTA二钠盐,记录质量。
2. 将称取的EDTA二钠盐转移至250mL容量瓶中,加入适量甲基橙指示剂。
3. 加入适量去离子水,溶解EDTA二钠盐,摇匀使溶液均匀。
4. 加入水至刻度线,摇匀使溶液充分混合,得到EDTA标准溶液。
二、EDTA标准溶液的标定1. 准备一定体积的标准氯化钙溶液(约20mL),记录体积。
2. 将标准氯化钙溶液转移至250mL锥形瓶中。
3. 加入适量硫酸,以调节溶液的酸度。
4. 使用PH计测定溶液的酸碱度,记录PH值。
5. 加入适量甲基橙指示剂,使溶液颜色明显。
6. 使用移液枪,滴加EDTA标准溶液至溶液颜色的变化由红橙逐渐变为橙黄色。
7. 继续滴加EDTA标准溶液,溶液颜色由橙黄逐渐转变为黄色。
8. 当溶液颜色由黄色转变为蓝色时,停止滴加。
9. 记录滴加的EDTA标准溶液体积。
实验结果与计算:1. 记录EDTA标准溶液的质量为m1 g。
2. 记录标准氯化钙溶液体积为V1 mL。
3. 记录滴加的EDTA标准溶液体积为V2 mL。
4. 根据反应方程:Ca2+ + EDTA2- → CaEDTA,计算出标准氯化钙中Ca2+的摩尔浓度C1。
5. 根据滴定反应的化学方程:Ca2+ + EDTA2- → CaEDTA + 2Na+,计算出EDTA标准溶液的摩尔浓度C2。
6. 计算出EDTA标准溶液的质量浓度:C = C2 × M2,其中M2为EDTA二钠盐的摩尔质量。
讨论与分析:根据实验步骤中的操作,我们成功配制并标定了EDTA标准溶液。
通过实验结果计算,我们可以得到EDTA标准溶液的质量浓度,这是我们进一步分析和应用该溶液的基础。
EDTA标准溶液的标定

EDTA标准溶液的标定1.实验目的(1)掌握络合滴定的原理,了解络合滴定的特点;(2)学习EDTA标准溶液的配制和标定方法;(3)了解金属指示剂的特点,熟悉二甲酚橙、钙黄绿素指示剂的使用及终点颜色的变化。
2.实验原理乙二胺四乙酸(简称EDTA),难溶于水,通常用EDTA二钠盐,并采用间接法配制标准溶液。
标定EDTA溶液的基准物有Zn、ZnO、CaCO3、Cu 、MgSO4·7 H2O等。
用于测定Pb2+、 Bi3+含量的EDTA溶液可用ZnO或金属Zn作为基准物进行标定。
以二甲酚橙作指示剂,在pH=5~6的溶液中,二甲酚橙指示剂(XO)本身显黄色,而与Zn2+的络合物呈紫红色。
EDTA与Zn2+形成更稳定的络合物,当用EDTA溶液滴至近终点时。
EDTA会把与二甲酚橙络合的Zn2+置换出来而使二甲酚橙游离,因此溶液由紫红色变为黄色。
其变色原理可表达如下:XO(黄色)+ Zn2+__ZnXO(紫红色)ZnXO(紫红色)+EDTA__ZnEDTA(无色)+XO(黄色)EDTA溶液若用于测定石灰石或白云石中CaO、MgO的含量及测定水的硬度,最好选用CaCO3做基准物标定。
这样基准物和被测组分含有相同的组分,使得测定条件一致,可以减少误差。
首先将CaCO3用盐酸溶解后,制成Ca2+标准溶液,调节酸度至pH>12.5时,以钙黄绿素-百里酚酞作混合指示剂,用EDTA标准溶液滴至由绿色荧光色消失。
3.仪器和药品仪器:电子天平、酸式滴定管、移液管、锥形瓶、容量瓶、烧杯、试剂瓶。
药品:(1)以ZnO为基准物时所用试剂:ZnO(A.R)、乙二胺四乙酸二钠(A.R)、六次甲基四胺:20%(m/v)、二甲酚橙指示剂(0.2%)、盐酸(1+1)。
(2)以CaCO3为基准物时所用试剂:碳酸钙:固体,一级试剂(G.R);盐酸(1+1);钙黄绿素-百里酚酞混合指示剂(1g钙黄绿素和1g百里酚酞与50g固体硝酸钾(A..R)磨细,混匀后,贮于小广口瓶中);氢氧化钾溶液:20%(m/v);乙二胺四乙酸二钠(A..R);4.实验步骤(1)0.015mol/LEDTA标准溶液的配制称取5.6g乙二胺四乙酸二钠(A.R)置于400ml烧杯中,加入约200mL水及2小片氢氧化钠(A..R)加热溶解(必要时过滤),冷却后,用水稀释至1L,摇匀;(2)以ZnO为基准物标定EDTA溶液Zn2+标准溶液的配制准确称取ZnO基准物0.35~0.5g于150mL烧杯中,用数滴水润湿后,盖上表面皿,从烧杯嘴中滴加10mL1+1盐酸,待完全溶解后冲洗表面皿和烧杯内壁,定量转移至250mL容量瓶中,加水稀释至刻度,摇匀,计算其准确浓度。
分析化学实验思考题

实验五混合碱的分析(双指示剂法)思考题:1.用双指示剂法测定混合碱组成的方法原理是什么?答:测混合碱试液,可选用酚酞和甲基橙两种指示剂。
以HCl标准溶液连续滴定。
滴定的方法原理可图解如下:2.采用双指示剂法测定混合碱,判断下列五种情况下,混合碱的组成?(1)V1=0 V2>0(2)V1>0 V2=0(3)V1>V2(4)V1<V2(5)V1=V2①V1=0 V2>0时,组成为:HCO3-②V1>0 V2=0时,组成为:OH-③V1>V2时,组成为:CO32-+ OH-④V1<V2时,组成为:HCO3- +CO32-⑤V1=V2时,组成为:CO32-实验六EDTA标准溶液的配制与标定思考题:1.络合滴定中为什么加入缓冲溶液?答:各种金属离子与滴定剂生成络合物时都应有允许最低pH值,否则就不能被准确滴。
而且还可能影响指示剂的变色点和自身的颜色,导致终点误差变大,甚至不能准确滴定。
因此酸度对络合滴定的影响是多方面的,需要加入缓冲溶液予以控制。
2. 用Na2CO3为基准物。
以钙指示剂为指示剂标定EDTA浓度时,应控制溶液的酸度为多大?为什么?如何控制?答:用Na2CO3为基准物质,以钙指示剂为指示剂标定EDTA浓度时,因为钙指示剂与Ca2+在pH=12~13之间能形成酒红色络合物,而自身呈纯蓝色,当滴定到终点时溶液的颜色由红色变纯蓝色,所以用NaOH控制溶液的pH为12~13。
4.络合滴定法与酸碱滴定法相比,有那些不同点?操作中应注意那些问题?答:络合滴定法与酸碱滴定法相比有下面两个不同点:①络合滴定中要求形成的配合物(或配离子)要相当稳定,否则不易得到明显的滴定终点。
②在一定条件下,配位数必须固定(即只形成一种配位数的配合物)。
实验七水的总硬度的测定思考题:2.为什么滴定Ca2+、Mg2+总量时要控制pH≈10,而滴定Ca2+分量时要控制pH为12~13?若pH>13时测Ca2+对结果有何影响?答:因为滴定Ca2+、Mg2+总量时要用铬黑T作指示剂,铬黑T在pH为8~11之间为蓝色,与金属离子形成的配合物为紫红色,终点时溶液为蓝色。
分析化学实验水硬度的测定(配位滴定法)

实验二水总硬度的测定(配位滴定法)实验日期:实验目的:1、学习EDTA标准溶液的配制方法及滴定终点的判断;2、掌握钙、镁测定的原理、方法和计算。
一、水硬度的表示法:一般所说的水硬度就是指水中钙、镁离子的含量。
最常用的表示水硬度的单位有:1、以度表示,1o=10 ppm CaO,相当10万份水中含1份CaO。
2、以水中CaCO3的浓度(ppm)计相当于每升水中含有CaCO3多少毫克。
M CaO—氧化钙的摩尔质量(56.08 g/mol),M CaCO3—碳酸钙的摩尔质量(100.09 g/mol)。
二、测定原理:测定水的总硬度,一般采用配位滴定法即在pH=10的氨性溶液中,以铬黑T作为指示剂,用EDTA标准溶液直接滴定水中的Ca2+、Mg2+,直至溶液由紫红色经紫蓝色转变为蓝色,即为终点。
反应如下:滴定前:EBT +Me(Ca2+、Mg2+)=Me-EBT(蓝色) pH=10 (紫红色)滴定开始至化学计量点前:H2Y2- + Ca2+= CaY2- + 2H+H2Y2- + Mg2+= MgY2- + 2H+计量点时:H2Y2- + Mg-EBT = MgY2- + EBT +2H+(紫蓝色)(蓝色)滴定时,Fe3+、Al3+等干扰离子用三乙醇胺掩蔽,Cu2+、Pb2+、Zn2+等重金属离子可用KCN、Na2S或巯基乙酸掩蔽。
三、主要试剂1、0.02mol/LEDTA2、NH3-NH4Cl缓冲溶液3、铬黑T:0.5%4、三乙醇胺(1:2)5、Na2S溶液 2%6、HCl溶液 1:17、CaCO3固体A.R.四、测定过程1、EDTA溶液的标定准确称取在120度烘干的碳酸钙0.5~ 0. 55g 一份,置于250ml 的烧杯中,用少量蒸馏水润湿,盖上表面皿,缓慢加1:1HCl 10ml,加热溶解定量地转入250ml容量瓶中,定容后摇匀。
吸取25ml,注入锥形瓶中,加20ml NH3-NH4Cl缓冲溶液,铬黑T指示剂2~3滴,用欲标定的EDTA溶液滴定到由紫红色变为纯蓝色即为终点,计算EDTA溶液的准确浓度。
水硬度测定
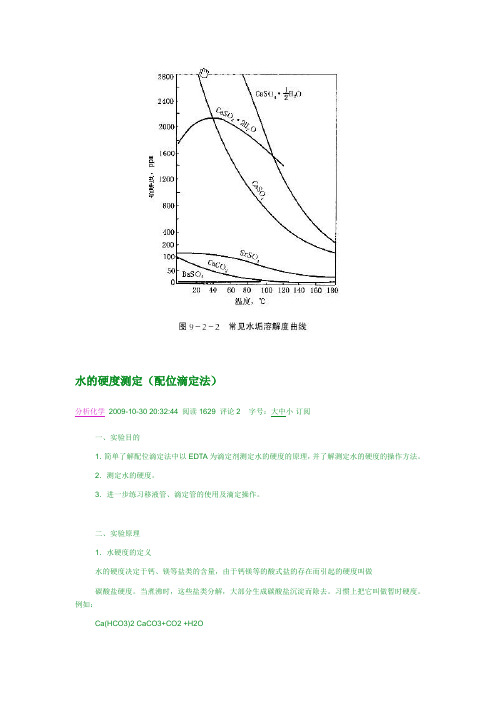
水的硬度测定(配位滴定法)分析化学2009-10-30 20:32:44 阅读1629 评论2 字号:大中小订阅一、实验目的1.简单了解配位滴定法中以EDTA为滴定剂测定水的硬度的原理,并了解测定水的硬度的操作方法。
2.测定水的硬度。
3.进一步练习移液管、滴定管的使用及滴定操作。
二、实验原理1.水硬度的定义水的硬度决定于钙、镁等盐类的含量,由于钙镁等的酸式盐的存在而引起的硬度叫做碳酸盐硬度。
当煮沸时,这些盐类分解,大部分生成碳酸盐沉淀而除去。
习惯上把它叫做暂时硬度。
例如:Ca(HCO3)2 CaCO3+CO2 +H2O由钙、镁的氯化物、硫酸盐、硝酸盐等引起的硬度叫做非碳酸盐硬度。
由于这些盐类不可能借煮沸生成沉淀而除去,因此习惯上把它叫做永久硬度。
碳酸盐硬度和非碳酸盐硬度之和就是水的总硬度。
硬水不适宜于工业上使用,如锅炉里用了硬水,经长期烧煮后,能生成锅垢,既浪费燃料,又易阻塞管道,造成重大事故。
有几种常用的硬度单位:一种是以每dm3水中所含Ca2+(或相当量Mg2+)的毫摩尔数表示的,以1 dm3水中含有0.5毫摩尔Ca2+为l度;一种是以1 dm3水中含10毫克CaO为1度,称为德国硬度,以DH表示。
8DH以下为软水,8~10DH为中等硬水,16~30DH为硬水,硬度大于30DH的属于很硬的水;另外也有以每升水中所含的钙、镁化合物换算成CaCO3的毫克数表示的。
本实验采用德国硬度表示水的硬度。
2.配位滴定法测定水的硬度。
配位滴定法是以配位反应为基础的滴定分析方法,螯合物又是目前该方法中应用最广的一类配位化合物。
因为它的稳定性强,适当控制就能得到所需的配位化合物,有的螫合剂对金属离子有选择性。
乙二胺四乙酸是具有羧基和氨基的螯合剂,能与许多阳离子形成稳定的螯合物,因此被广泛用作配位滴定法中的滴定剂。
乙二胺四乙酸简称EDTA或EDTA酸,用H4Y表示。
通常把它的溶解度较大的二钠盐也称EDTA,实际使用中常用H2Y2-表示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验六EDTA标准溶液的标定及水硬度的测定
1.实验目的
通过对于EDTA标准溶液的标定,学习其使用方法,并且通过对于水样的处理,测试出水样的水硬度。
2.实验器材
酸度计,计量瓶,滴定管,分液漏斗,洗耳球,比色皿,滴定管
3.实验步骤
1)实验前准备
(1)洗净比色皿,清洗后用纯水反复漂洗干净,晾干。
将洗净的比色皿保存在洁净环境中。
(2)洗净测量用具,使用纯水清洗瓶、试管、玻璃棒等器材。
(3)将酸度计调至批准盐酸的pH,待数据稳定后标定。
标定后将得出的结果进行记录。
2)EDTA标准溶液制备
(1)将2g EDTA溶于200mL纯水中,并加入20mLpH 10.0氢氧化钠溶液,溶液加热至60℃,充分振荡。
(2)将溶液冷却,并用纯水调节至1000mL。
(1)取样超过50mL的未知样品,滴入0.01mol/L HCl直到pH 2.0,再滴入酚酞,充分溶解(颜色一般为鲜红)。
(2)滴入0.01mol/L EDTA标准溶液直到溶液呈现纯粉色为止。
(3)根据滴定时所用的EDTA标准溶液量,计算出未知样品的水硬度值。
4.实验结果
通过实验,我们得到了EDTA标准溶液的标定结果以及水样的水硬度结果。
结果如下表。
表一:EDTA标准溶液的标定结果
试验次数 | 容量(mL) | 浓度(mol/L)
1 | 23.5 | 0.00475
表二:未知水样水硬度测试结果
滴定时刻 | EDTA标准溶液用量(mL) | 水硬度值(mg/L)
2 | 19.9 | 191.6
5.实验分析
水硬度的大小主要因水样中钙、镁离子含量的多少而有所不同。
水硬度越大,代表水样中钙、镁离子的含量越高,水的质量也越差,反之则代表水的质量越好。
在饮用水的制备过程中,我们必须要注意水的硬度以及其他的水质指标。
通过此次实验,我们学习了如何制备EDTA标准溶液以及如何使用EDTA标准溶液进行水硬度测试。
同时,我们对于饮用水的水质指标有了更加深入的了解,为后续的饮用水制备提供了一定的基础支持。
