离子键离子晶体与离子极化IONICBONDIONICCRYSTALANG

8.1离子键、离子晶体与离子极化
IONIC BOND, IONIC CRYSTAL ANG IONIC POLARIZATION
8.1.1离子键
1.离子键形成:阴阳离子在静电吸引力作用下相互靠近,使体系能量大大降低,达到某一距离时处于相对最稳定的状态,这时阴阳离子间的作用力就是离子键.
2.离子键本质: 阴阳离子间的静电引力.
无方向性:
3.离子键特征: 离子电场具有球形对称;
无饱和性:
离子电场力无方向性.
8.1.2离子特征
1.离子的电荷: 原子在形成离子化合物过程中失去或得到的电子数.
2.离子的电子构型:
所有简单阴离子具有8 电子构型.如:F-、Cl-、S2-等.
阳离子电子构型较复杂.
3.离子半径:
阴阳离子两个原子核之间的平均距离为阴阳离子有效半径之和.
阳离子电子构型 外电子层电子排布式 实例
2 1s2 Li+,Be2+
8 ns2np6 Na+,Mg2+,Al3+,Sc3+
9~17 ns2np6nd1~9 Cr3+,Mn2+,Fe2+,3+,Cu2+
18 ns2np6nd10 Cu+,Zn2+,Cd2+,Hg2+
18+2 (n-1)s2(n-1)p6(n-1)d10ns2 Sn2+,Pb2+,Sb3+,Bi3+
离子半径变化规律:
同元素r±随Z增大而减小;
如: S(Ⅱ)、S(Ⅳ)、S(Ⅵ)
184 37 29(pm)
同周期不同元素r±随Z增大而减小;
如: Na+、Mg2+、Al3+
95 65 50(pm)
同族元素Z相同的r±随周期数增大而增大.
如:Li+、Na+、 K+
60 95 133(pm)
8.1.3离子晶体
1.晶体特征:
一定的几何构型(非晶体:无定形体); (微晶体)
固定的熔点(非晶体:无固定熔点);
具有各向异性(非晶体:各向同性).
2.晶体结构:
(1)结点: 晶体中规则排列的微粒抽象为几何上的点.
(2)晶格: 将结点沿一定的方向,按某种规则连接所得到的晶体的空间格子.
BaCO 3微晶体 ZnO 微晶体
(3)晶胞: 晶格中能表现出其结构一切特征的最小部分. 3.晶体种类:
按晶体生长和堆积分:
单晶体: 一个晶核各向均匀生长而形成. 多晶体: 很多单晶颗粒杂乱地聚结而成. 按晶格结点上粒子种类及粒子间结合力分:
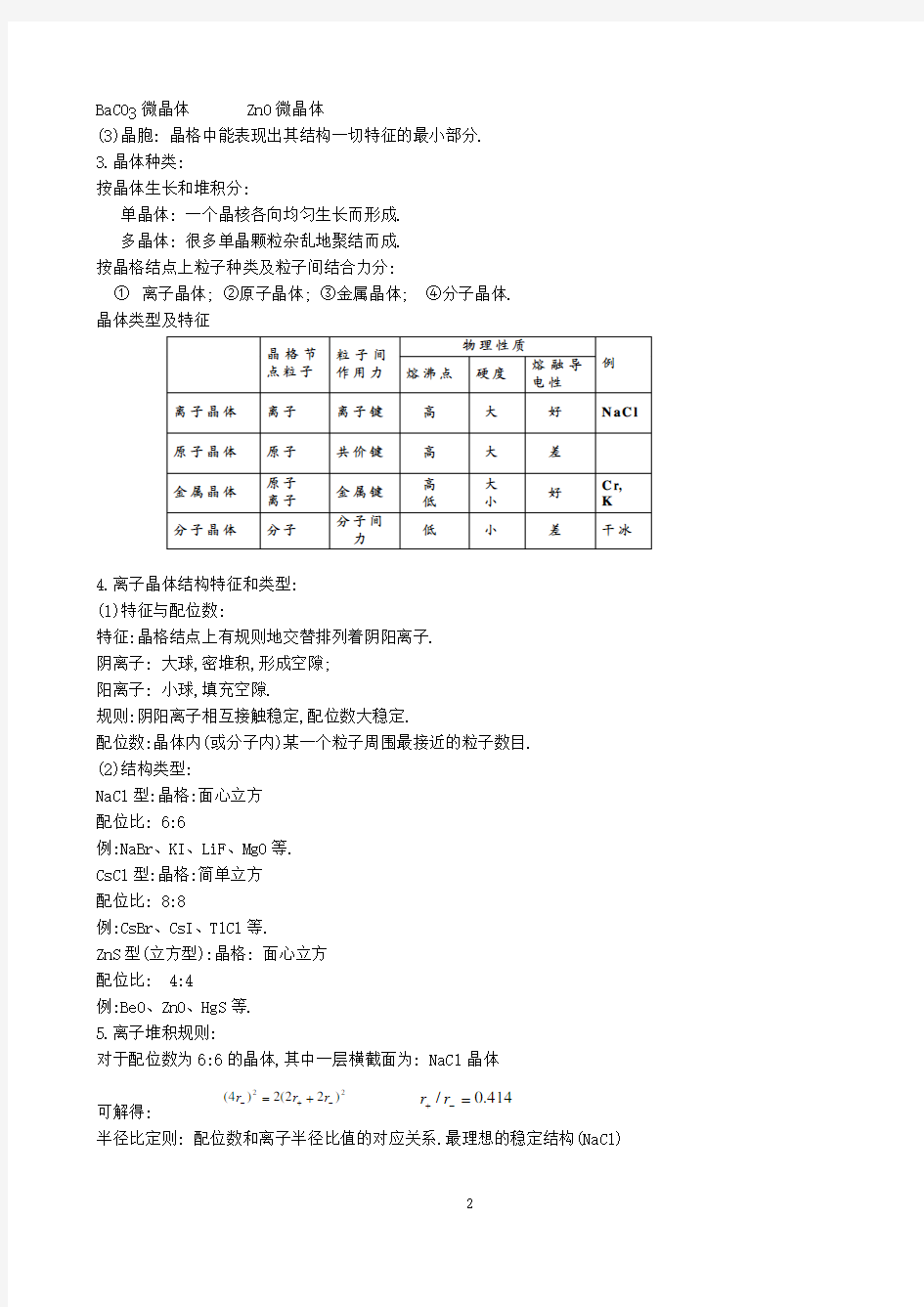
① 离子晶体; ②原子晶体; ③金属晶体; ④分子晶体. 晶体类型及特征
4.离子晶体结构特征和类型: (1)特征与配位数:
特征:晶格结点上有规则地交替排列着阴阳离子. 阴离子: 大球,密堆积,形成空隙; 阳离子: 小球,填充空隙.
规则:阴阳离子相互接触稳定,配位数大稳定.
配位数:晶体内(或分子内)某一个粒子周围最接近的粒子数目. (2)结构类型:
NaCl 型:晶格:面心立方 配位比: 6:6
例:NaBr、KI、LiF、MgO 等. CsCl 型:晶格:简单立方 配位比: 8:8
例:CsBr、CsI、TlCl 等. ZnS 型(立方型):晶格: 面心立方 配位比: 4:4 例:BeO、ZnO、HgS 等. 5.离子堆积规则:
对于配位数为6:6的晶体,其中一层横截面为: NaCl 晶体 414
.0/=?+r r 2
2)22(2)4(?+?+=r r r 可解得:
半径比定则: 配位数和离子半径比值的对应关系.最理想的稳定结构(NaCl)
6.离子晶体稳定性:
(1)晶格能:由无限远离的气态正负离子,形成1mol 离子晶体时所放出的热量. D r H y m Na +(g) + Cl -(g) → NaCl(s)
D r H y
m = -788.1kJ ·mol -1 U = 788.1kJ ·mol -1
(2)晶格能的计算: 利用Born-Haber 循环. K(s) + 1/2Br 2(l) = K(s) + 1/2Br 2(l) KBr(s) (3)影响晶格能的因素:
①离子电荷: Z↑,U↑ 例:U(NaCl)
(4)晶格能对离子晶体物理性质的影响: MgO CaO SrO BaO r 小 大 U 大 小 熔点 高 低 硬度 大 小 8.1.4离子的极化 1.离子的极化:
(1)离子的极化:离子在外电场作用下产生诱导偶极的过程.
(2)诱导偶极:外电场作用下,离子的原子核及电子发生相对位移,造成离子的变形而形成的偶极. 离子极化的强弱主要取决于离子的极化力以及离子的变形性 2.离子的极化力与离子的变形性:
(1)离子的极化力: 某离子使异电荷离子产生变形的能力. (2)影响离子极化力(f)的主要因素: 离子电荷; 离子半径; 离子的电子构型 一般来说: Z 高,r +小,f 大 Z 相同, r + 相近,与电子构型有关:
18,(18+2)以及2电子构型具强极化力,如Cu +,Pb 2+,Li +等 8电子构型离子极化力最弱,如Na +, Ca 2+等. 其它电子构型极化力中等. (3)离子变形性:
离子在外电场作用下,外层电子与核发生相对位移的性质. 常用离子的极化率(a )来衡量 (4)离子变形性一般规律: ①正离子a 小,负离子a 大; ②负离子r -大,a 大;
③r 相近,但电荷不同时: 负离子: Z -大,a 大; 正离子: Z +大,a 小.
④r相近,Z相同时,与电子构型有关.
离子变形性主要取决于离子半径的大小.
3.离子极化的一般规律:
① 阴离子r- 相同时,阳离子Z+越大,阴离子越易被极化;
② 阳离子Z+相同时,阳离子r+越大,阴离子越不易被极化;
③ 阳离子Z+相同,大小相近时,阴离子越大越易被极化;
④ 附加极化作用:当阳离子与阴离子一样,也易变形时,它们会相互极化,使诱导偶极增大 .
离子晶体中,每个离子总极化力是离子固有极化力与附加极化力之和.
4.离子极化对物资结构和性质的影响:
离子极化的结果会导致物质键型以及晶型的变化,这些变化必然会使物质的性质发生相应的改变. AgF AgCl AgBr AgI
物键型 离子键
晶体类型 NaCl型
溶解度 大
化合物颜色 浅浅浅浅深
电导率 小 大
金属光泽 弱 强
8.2共价键及分子的几何构型
COVALENT BOND AND GEOMETRIC CONFIGURATION
8.2.1键参数
1.键能:在一定温度和标准压下断裂1mol化学键所需要的能量.
离子键的键能为晶格能
金属键的键能为内聚能.
共价键的键能为离解能或多次离解能的平均值.
离解能: 在一定温度和标准压下将1mol理想气态分子离解成理想气态原子所需要的能量.
键能是衡量键强度的参数.
键能的大小主要与键的性质、成键原子以及键长等因素有关.
2.键长:
分子内成键两原子核间的平均距离,可用L b表示.
一种键的性质主要取决于成键原子的本性.
在两个确定的原子之间,若形成不同的化学键,其键长越短,键能就越大
键能和键长可以解释一些化合物的性质.
3.键角:
分子中两个相邻化学键之间的夹角.
键长和键角是描述分子几何构型的两要素.
分子式 键长/pm(实验值) 键角a(实验值) 几何构型
H2S 134 92o 角型
CO2 116.2 180o 直线型
NH3 101 107o18’ 三角锥型
CH4 109 109o28’ 正四面体型
8.2.2价键理论与共价键
1.价键理论(VB法)要点:键合双方各提供自旋方向相反的未成对电子.键合双方原子轨道应尽可能最大程度地重叠(最大重叠原理).
2.共价键形成与本质:
形成:
本质: 也是电性的.
3.共价键特征:
饱和性: 一个原子形成共价键的能力是有限的
方向性: 一般成键电子的原子轨道只有沿着轨道伸展方向进行重叠才能实现最大限度的重叠.
4.共价键的类型:
(1)原子轨道的重叠:
对称性原则:只有当原子轨道对称性相同的部分重叠, 才能形成化学键
共价键的方向性:对称性相同指产生重叠的两个原子轨道符号相同(即波函数相加).
重叠类型: 同符号部分重叠.
正重叠(有效重叠)
不同符号部分重叠(或认为波函数相减).
负重叠(无效重叠)
同号重叠部分与异号重叠部分正好抵消.
零重叠(无效重叠)
(2)共价键分类:
按极性大小:
1)极性键 强极性键: 如H2O,HCl中的共价键
弱极性键: 如H2S,HI中的共价键
2)非极性键: 如N2,H2中的共价键
按原子轨道重叠部分所具有的对称性分:
s键: 对键轴呈圆柱形对称(头碰头)
s电子:形成s键的电子.
p键:对键轴所在的某一特定平面具反对称性(肩并肩)
p电子:形成p键的电子.
s键: s-s s-p
s键: p-p
p键:在具有双键或叁键的两个原子之间,常既有s键又有p键.
特殊共价键:配位键
形成条件:成键原子一方有孤对电子;
另一方有空轨道.
8.2.3杂化轨道理论与分子的几何构型
1.杂化轨道理论基本要点:
成键时能级相近的价电子轨道相混杂,形成新的价电子轨道—杂化轨道;
杂化前后轨道数目不变.
杂化后轨道伸展方向,形状发生改变.
2.杂化类型与分子几何构型:
(1)sp3杂化: CH4空间构型:
(2)sp2杂化: BF3 :
BF3的形成:三个sp2杂化轨道:
(3)sp杂化: BeCl2 : BeCl2的形成:
两个sp杂化轨道:
(4)不等性sp3杂化:不等性杂化:产生不完全等同轨道的杂化.
NH3的形成:
H2O的形成:
小结:杂化轨道的类型与分子的空间构型
杂化轨道类型 SP SP2 SP3 不等性SP3
参加杂化的轨道 S+P S+(2)P S+(3)P S+(3)P
杂化轨道数 2 3 4 4
成键轨道夹角 180o 120o 109o28’ 90o< q <109o28’ 分子空间构型
实例 BeCl2 BF3 CH
4 NH3 H2O
HgCl2 BCL
3 SiCI
4 PH3 H2S
中心原子
8.2.4分子轨道理论
分子轨道:描述分子中电子运动的波函数.
1.分子轨道理论(MO法)基本要点:
电子是在整个分子范围内运动;
分子轨道由成键原子轨道组合而成;
电子逐个填入分子轨道,填充规则与填入原子轨道所遵循的规则相同;
原子轨道要有效组成分子轨道必须符合三个成键原则.
1.分子轨道形成:
(1)s-s原子轨道的组合:
(2)p-p原子轨道的组合: “头碰头”方式:
“肩并肩”方式:
p2
PY 与p
2PZ
、p
2PY
*与p
2PZ
*轨道的形状以及能量都相同.
3.分子轨道的能级:
第二周期同核双原子分子:B2(B,C,N)
即:s1s < s1s*< s2s< s2s*< p2p y = p2p z< s2p x< p2p y* = p2p z*< s2p x*
第二周期同核双原子分子:O2(O,F)
即:s1s < s1s*< s2s< s2s*< s2p x < p2p y = p2p z < p2p y* = p2p z*< s2p x*
第二周期同核双原子分子:B2 (B,C,N)
第二周期同核双原子分子:O2 (O,F)
4.分子轨道理论的应用:
(1)推测分子的存在和阐明分子的结构:
推测分子是否能稳定存在首先可以根据分子轨道理论判断形成分子体系能量的变化来确定. 其次还可以根据键级的多少来判断分子能否存在以及分子的结构稳定性.
键级:分子中净成键电子数(成键轨道的电子数-反键轨道的电子数)的一半
一般键级越大键能相应也越大,分子结构就越稳定.键级为零,则分子不可能存在. 如:He2和He2+能否存在?
He2: (s1s) (s1s*) 键级 = (2-2)/2 = 0. 不能稳定存在.
He2+ (s1s) (s1s*) 键级不为零,能稳定存在.
(2)预言分子的顺磁与反磁性:
凡有未成对电子的分子就具顺磁性,否则就是反磁性的.
如:O2 KK (s2s) (s2s*) (s2p x) (p2p y) (p2p z) (p2p y*) (p2p z*)
其中有一个s键、两个三电子p键.有两个未成对电子,故据顺磁性
8.3分子间力和氢键
INTERMOLECULAR FORCE AND HYDROGEN BOND
8.3.1分子的极性和变形性
1.分子的极性:分子是否有极性取决于整个分子正负电荷中心是否重合.
分子极性主要与 键极性 分子几何构型 有关
键的极性主要与构成键的两原子电负性的相对大小有关.
分子极性的大小常用分子的偶极矩来衡量.
偶极矩:分子中电荷中心点上的电荷量q与正负电荷中心距离l的乘积, m = q·l m的单位为库·米;式中l又称为偶极长度.
偶极矩越大,分子的极性就越强.
偶极矩还可以用来验证和推断某些分子的几何构型.
2.分子的变形性:
分子在外电场的作用下也会发生变形.
对于分子变形性的大小同样可以用极化率来衡量.
在一定强度的电场作用下,分子越大,极化率越大,分子的变形性也就越大.
极性分子的偶极:
固有偶极加诱导偶极.
极性分子的极化:分子的定向极化以及诱导极化
非极性分子:诱导偶极
8.3.2分子间力
1.分子间相互吸引作用:
(1)非极性分子间:
瞬时偶极:电子云和原子核之间发生的瞬时相对位移.
色散力:分子间由于瞬时偶极而产生的作用力.
色散力的大小主要与分子的变形性有关.
分子的极化率越大,色散力就越强.
(2)非极性分子与极性分子间:
同样存在色散力.
诱导力:由于诱导偶极而产生的分子间相互作用.
诱导力的大小 极性分子的极性强弱有关
非极性分子的变形性
极性分子的偶极矩越大,非极性分子的极化率越大,诱导力也就越大.
(3)极性分子间:
极性分子间也存在色散力,诱导力.
取向力:因极性分子的取向而产生的分子间吸引作用.
取向力的大小 分子的极性强弱 温度 有关
分子的偶极矩越大,取向力越强;温度越高,分子取向越困难.
2.分子间力的特点:
电性作用力;作用范围一般几百皮米;作用能一般几到几十千焦每摩;无方向性和饱和性;
一般色散力是分子间的主要作用力;三种力相对大小为:
色散力? 取向力 >诱导力
3.分子间力对物质物理性质的影响:
He Ne Ar Ke Xe
分子量 小 大
a色散作用 小 大
分子间力 小 大
沸点熔点 低 高
水中溶解度 小 大
8.3.3氢键
氢化物沸点变化规律:
氢化物沸点变化规律:
(1)形成:如H–F分子间氢键
氢键: 强极性键(X-H)上的氢核与电负性很大含有孤对电子并带有部分负电荷的原子之间的静电吸引力. 不仅同种分子之间可以形成氢键,不同分子之间也可以形成氢键。
例如氨分子与水分子间: 或
氢键通式:X?H Y
式中:X、Y代表F、O、N等电负性大而原子半径较小的非金属原子.X、Y可以是相同,也可以是不同的元素.
(2)形成氢键条件:
要有一个与电负性很大的元素(X)形成强极性键的氢原子;
要有一个电负性很大,含有孤对电子并带有部分负电荷的原子(Y);
X,Y的原子半径都要小.
2.氢键特点和分类:
特点: 键长特殊,H Y,X?H Y;
键能小,25~40kJ;
具有饱和性和方向性.
氢原子半径小;
要使X、Y两电子云斥力小.
分类: 分子间氢键;
分子内氢键.
4.氢键的形成对物质性质的影响:
使物质的熔点、沸点升高,溶解度,粘度增大,密度改变.
氢化物的熔、沸点;
多羟基化合物的粘度;
例如:甘油,硫酸,磷酸等.
水的密度(分子缔合与缔合分子).
冰的结构:
8.4非离子型晶体与实际晶体
NON-IONIC CRYSTAL AND REALISTIC CRYSTAL
8.4.1原子晶体,分子晶体,金属晶体以及过渡型晶体
1.原子晶体:晶格结点上排列的是原子,原子与原子之间以共价键相连.
例如金刚石,晶格结点上排列的是碳原子,每个碳原子均采取sp3杂化 形式成键.
2.分子晶体:晶格结点上排列的是分子,分子之间靠分子间力(有时还可能有氢键)结合.
例如干冰以及大多数有机化合物
sp3杂化:
3.金属晶体:
晶格结点上排列的是金属原子,金属原子之间靠金属键相结合.
金属键:金属原子,金属离子以及自由电子之间的作用力.
自由电子:从某个金属原子上脱离下来的电子为整个晶体内的金属原子,金属离子所共有,并能在它们之间自由运动
金属晶体的结构: 六方密堆积.
面心立方密堆积.
体心立方堆积.
4.过渡型晶体(混合型晶体):
晶体中同时存在若干种不同的作用力,具有若干种晶体的结构和性质.
类型:
(1)层状结构晶体; 例如:石墨、云母、黑磷等晶体
(2)链状结构晶体. 例如:纤维状石棉
六方密堆积:配位数: 12
面心立方密堆积:配位数: 12
体心立方堆积:配位数: 8
石墨晶体:
平面层:每个碳原子采取sp2杂化,另还剩一个 2p轨道.
具有 s键 大p 键
形成平面网状结构.
有多个原子所形成的p 键
层与层: 相当于分子间力.
因此,石墨晶体中具有多种作用力存在.
8.4.2实际晶体及其对物质性质的影响
1.晶体缺陷类型与非化学计量化合物
晶体缺陷的类型:
化学计量与非化学计量化合物:
2.晶体缺陷的影响:
晶体缺陷的产生对物质的光、电、磁、声、力、热学等物理性质以及化学活性等有一定的影响. 例如:TiO2电导率10-10W-1·cm-1,TiO1.9995电导率10-1 W-1·cm-1.
晶体缺陷产生光活化点、催化活性中心等.
离子键离子晶体
第二单元离子键离子晶体(1) 主备人:彭贞珍审核人:熊爱军 [学习目标] 1.加深对离子键的认识,理解离子键没有方向性、没有饱和性的特点 2.能大致判断离子键的强弱,知道晶格能的概念,了解影响晶格能的因素 3.晶格能对离子晶体硬度和熔沸点的影响,能预测晶体熔点高低顺序 4.能运用电子式表示离子化合物的形成过程 教学过程: 【课前导学】 1、钠原子与氯原子是如何结合成氯化钠的?你能用电子式表示氯化钠的形成过程吗? 2、根据元素的金属性和非金属性差异,你知道哪些原子之间能形成离子键? 【质疑讨论】 一、离子键的形成 1、离子键的定义:使阴、阳离子结合成离子化合物的静电作用 2. 离子键的形成过程 1)电子转移形成离子:一般达到稀有气体原子的结构 2)判断依据:元素的电负性差要比较大 元素的电负性差要比较大,成键的两元素的电负性差用△X表示,当△X > 1.7, 发生电子转移, 形成离子键;当△X < 1.7, 不发生电子转移, 形成共价键. 【小结】: 1、活泼的金属元素(IA、IIA)和活泼的非金属元素(VIA、VIIA)形成的化合物。 2、活泼的金属元素和酸根离子(或氢氧根离子)形成的化合物 3、铵根和酸根离子(或活泼非金属元素离子)形成的盐。 二、用电子式表示离子化合物的形成 【练习】1、写出下列微粒的电子式: (1)Na+、Mg2+、Cl-、O2-、 (2)NaCl MgO MgCl 2、用电子式表示NaCl、K2S的形成过程 三、离子键的实质 实质是 四、离子键的特征 (1). 离子键无方向性
(2). 离子键无饱和性 五、 离子键的强度——晶格能 (1)晶格能(符号为U ): (2)影响离子键强度的因素——离子的电荷数和离子半径 【思考】由下列离子化合物熔点变化规律 ,分析离子键的强弱与离子半径、离子电荷有什么关系? 1) 离子电荷数的影响:电荷高,晶格能大,离子晶体的熔沸点高、硬度大。 2) 离子半径的影响:半径大, 导致离子间距大, 晶格能小,离子晶体的熔沸点低、硬度小。 【小结】离子电荷数越大,核间距越小,晶格能越大,离子键越牢,离子晶体的熔、沸点越高,硬度越大。 【反馈矫正】 1.离子化合物 LiCl 、NaCl 、KCl 、RbCl 和CsCl 熔点由高到底的顺序是 ________________________________________________。 2. A . ①>②>③ B. ③>①>② C. ③>②>① D. ②>①>③ 【巩固迁移】 1.下列各组数值表示有关元素的原子序数,其中所表示的各组原子能以离子键结合成稳定化合物的是( ) A .1与6 B .2与8 C .9与11 D .8与14 2.某主族元素A 的外围电子排布式为n s 1,另一主族元素B 的外围电子排布为n s 2n p 4, 两者形成的离子化合物的化学式可能为 A .A B B .A 2B C .AB 2 D .A 2B 3 3.下列说法不正确的是 ( ) A .离子晶体的晶格能越大离子键越强 B .阳离子的半径越大则可同时吸引的阴离子越多 C .通常阴、阳离子的半径越小,电荷越大,该阴、阳离子组成的离子化合物的晶格能 越大 D .拆开1mol 离子键所需的能量叫该离子晶体的晶格能 4.离子化合物①NaCl 、②CaO 、③NaF 、④MgO 中,晶格能从小到大顺序正确的是( ) A .①②③④ B .①③②④ C .③①④② D .④②①③ 5.下列热化学方程中,能直接表示出氯化钠晶体晶格能的是_________。 A .Na +(g)+Cl -(g)=NaCl(s);△H B .Na(s)+21Cl 2(g)=NaCl(s);△H 1 C .Na(s)=Na(g);△H 2 D .Na(g)-e -=Na +(g);△H 3
高中化学选修物质结构与性质教案-3.2离子键离子晶体5-苏教版
基于问题驱动的核心概念构建 ——《离子晶体》教学设计 自然界中元素的种类并不多,物质世界丰富性的因素之一在于物质结构的多样性和复杂性。以苏教版必修二专题1第三单元“离子晶体”为教学内容,带领学生认识物质,解剖物质。本节课结合学生密切相关的生活现象,以问题中心理论和建构主义理论为基础,将教学目标隐含在问题中,通过创设情景,构建模型,充分挖掘教材,引导学生自主探究,设计出解决问题的路径和策略,帮助学生认识和初步掌握物质结构的知识,在科学探究过程中,培养学生创新能力,提升化学素养。 1 教学设计的前端分析 1.1教材解读和学情分析 物质是微观粒子的聚集体,物质的结构和性质是若干粒子的综合表现。虽然我们无法真切地看见微观粒子,但是我们可以通过宏观辨识和微观探析的研究方式,透视物质的内部结构。本节课是一节核心概念的构建课。从教学内容层面分析,涉及离子晶体的概念、结构特点、物理性质等内容,学科认知难度较大;从教材特点分析,注重知识的类比、迁移、提升,突出模型在概念结构中的引领作用;从教学实践层面分析,学生是本节课的主体,他们的空间概念薄弱。因此,以NaCl、CsCl 晶胞为载体,以问题驱动形式,引发学生思维,在构建模型、动画引导基础上,为学生铺设学习台阶,通过观察、分析、交流等手段自主建构离子晶体的核心知识和规律,深化对离子晶体这一知识点的理解。 1.2教学目标 (一)宏观辨识与微观探析 1.理解离子键、离子晶体的概念,能判断离子键强弱及离子晶体类型; 2.认识NaCl、CsCl典型的离子晶体,掌握离子晶体的物理性质,能预测离子晶体熔沸点高低顺序。 (二)变化观念与平衡思想 1.能通过空间模型均摊法,解决晶胞中微粒个数问题; 2.依据离子晶体价键强弱,判断物质硬度、溶解度大小。 (三)证据推理与模型认知 1.能利用实物、史实、数据、模型等证据,加深对晶体结构的认识; 2.能结合已学物质性质,围绕问题,构建空间模型,将微观结构宏观化。
极化作用和变形性
极化作用和变形性 桂耀荣 离子极化指的是在离子化合物中,正、负离子的电子云分布在对方离子的电场作用下,发生变形的现象。离子极化理论认为,当正离子和负离子相互结合形成离子晶体时,如果相互间无极化作用,则形成的化学键应是纯粹的离子键。 事实上正、负离子之间将发生程度不同的相互极化作用,这种相互极化作用将导致电子云发生变形,即负离子的电子云向正离子方向移动,同时正离子的电子云向负离子方向移动,也就是说正、负离子的电子云发生了重叠。相互极化作用越强,电子云重叠的程度也越大,则键的极性也越减弱。从而使化学键从离子键过渡到共价键。 一种离子使导电离子极化而变形的作用称为该离子的“极化作用”。被异号离子极化而发生离子电子云变形的性能称为该离子的“变形性”。一般来说有阳离子极化作用占主要及阴离子变形占主要。 一、极化作用和变形性的规律以及相互极化和反极化作用 1.阴离子的变形性 (1)电子层结构相同的阴离子负电荷越大,变形性越大。 (2)电子层结构相同的阴离子的半径越大,变形性越大。 (3)复杂阴离子变形性通常不大,而且中心原子氧化数越高,变形性越小。 2.阳离子极化作用 (1)离子正电荷越大,半径越小,极化作用越强。 (2)就离子的外壳电子结构而论,离子极化作用依次为: 8电子<9—17电子<18电子和18+2电子 这是因为有18电子电子层结构的离子,其最外层中的d电子对原子核有较小的屏蔽作用之故。 (3)对于外壳电子层结构相同的离子,电子层数越多,半径愈大,变形性越大。 3.相互极化(附加极化) 虽然正离子和负离子都有极化作用和变形性两方面的性能,但负离子在正离子的极化作用下更易变形。所以正离子主要表现为对负离子的极化作用,负离子主要表现为电子云的变形。因此在讨论正、负离子间的相互极化时,往往着重的是正离子的极化作用及负离子的变形性。但是当正离子的电子层构型为非稀有气体构型时,正离子也容易变形,此时要考虑正离子和负离子之间的相互极化作用。正、负离子相互极化的结果,导致彼此的变形性增大,产生诱导偶极矩加大,从而进一步加强了它们的极化能力,这种加强的极化作用称为附加极化作用。离子的外层电子构型对附加极化作用的大小有很重要的影响,一般是最外层含有d 电子的正离子容易变形而产生附加极化作用,而且所含d电子数越多,这种附加极化作用越大。 4.反极化作用 H+的反极化作用指氢离子对极性键的削弱作用。反极化作用一般常见于含氧酸及含氧酸盐中。 二、离子极化对化合物的性质的影响 1.使化合物的熔点降低 由于离子极化,使化学键由离子键向共价键转变,化合物也相应由离子型向共价型过渡,其熔点、沸点也随共价成分的增多而降低。
高中化学 专题3 第2单元 离子键 离子晶体教案 苏教版选修3
第二单元离子键离子晶体 [核心素养发展目标] 1.理解离子键的本质,能结合离子键的本质和晶格能解释离子晶体的性质,促进宏观辨识与微观探析学科核心素养的发展。2.认识常见离子晶体的结构模型,理解离子晶体的结构特点,预测其性质,强化证据推理与模型认知的学科核心素养。 一、离子键的形成 1.形成过程 2.特征 阴、阳离子球形对称,电荷分布也是球形对称,它们在空间各个方向上的静电作用相同,在各个方向上一个离子可同时吸引多个带相反电荷的离子,故离子键无方向性和饱和性。 (1)离子键的实质是“静电作用”。这种静电作用不仅是静电引力,而是指阴、阳离子之间静电吸引力与电子与电子之间、原子核与原子核之间的排斥力处于平衡时的总效应。 (2)成键条件:成键元素的原子得、失电子的能力差别很大,电负性差值大于1.7。 (3)离子键的存在 只存在于离子化合物中:大多数盐、强碱、活泼金属氧化物(过氧化物如Na2O2)、氢化物(如NaH和NH4H)等。 例1具有下列电子排布的原子中最难形成离子键的是( ) A.1s22s22p2B.1s22s22p5 C.1s22s22p63s2D.1s22s22p63s1 答案 A 解析形成离子键的元素为活泼金属元素与活泼非金属元素,A为C元素,B为F元素,C为Mg元素,D为Na元素,则只有A项碳元素既难失电子,又难得电子,不易形成离子键。 例2下列关于离子键的说法中错误的是( ) A.离子键没有方向性和饱和性 B.非金属元素组成的物质也可以含离子键 C.形成离子键时离子间的静电作用包括静电吸引和静电排斥 D.因为离子键无饱和性,故一种离子周围可以吸引任意多个带异性电荷的离子
江苏省苏教版高中化学学案 选修3 3.2离子键 离子晶体(第二课时)
江苏省苏教版高中化学学案选修3 3.2离子键离子晶体(第二课时)
————————————————————————————————作者:————————————————————————————————日期:
教学目标: 1、通过复习钠与氯形成氯化钠的过程,使学生理解离子键的概念、形成过程和特点。 2、理解离子晶体的概念、构成及物理性质特征,掌握常见的离子晶体的类型及有关晶胞的计算。 教学重点: 1、离子键的概念、形成过程和特点 2、离子晶体的类型及有关晶胞的计算。 教学过程: 【复习巩固】 1.什么是离子键?作用力的实质是什么? 2、什么是晶格能?影响因素有哪些? 3、晶格能的大小与离子晶体的熔沸点、硬度的关系怎样? 1.指出下列物质中的化学键类型。 KBr CCl4 N2 CaO NaOH 2.下列物质中哪些是离子化合物?哪些是只含离子键的离子化合物?哪些是既含离子键又含共价键的离子化合物? KCl HCl Na2SO4 HNO3 NH4Cl O2 Na2O2 【过渡】大多数离子化合物在常温下以晶体的形式存在。 【板书】§3-2-2 离子晶体 一、离子晶体 1、定义:离子间通过离子键结合而成的晶体 【思考】离子晶体能否导电,主要的物理共性有哪些? 2、特点:(1)、晶体不导电,在熔融状态或水溶液中导电,不存在单个分子 (2)、硬度较高,密度较大,难压缩,难挥发,熔沸点较高 【思考】:判断下列每组物质的熔沸点的高低,影响离子晶体的熔沸点高低的因素有哪些? (1)NaF NaCl NaBr NaI (2) MgO Na2O 3、离子晶体熔沸点高低的影响因素:离子所带的电荷(Q)和离子半径(r) Q越大、r越小,则晶格能(U)越大,离子键越强,熔沸点越高,硬度越大. 【思考】:哪些物质属于离子晶体? 4 、物质的类别:强碱、部分金属氧化物、绝大部分盐类属于离子晶体。 【过渡】离子晶体也有一定的空间结构 【板书】二、离子晶体的空间结构 【讲解】:离子晶体有多种晶体结构类型,其中氯化钠型和氯化铯型是两种最常见的离子晶体结构类型。首先看NaCl的晶胞:
离子晶体教学设计
离子晶体教学设计 摘要:通过阅读与探究学习离子晶体。本节介绍了氯化钠和氯化铯晶胞,离子晶体的物理性质。在科学探究的基础上,通过多媒体演示和学生的自主探究学习,进一步理解离子晶体的结构特点,通过具体数据的的对比说明晶格能的大小与晶体性质的关系。 三维目标: 知识与技能 1、了解离子晶体的构成微粒及微粒间的作用力,能根据离子化合物的结构特征解释其物理 性质 2、了解晶格能的应用,知道晶格能的大小可以衡量晶体中离子键的强弱 过程与方法 观察离子晶体的晶胞模型,和已学过的分子晶体、原子晶体、金属晶体充分对比来认识离子晶体的组成、结构和性质 情感态度与价值观 通过离子晶体的学习,进一步体会和树立“结构决定性质,性质反映结构”,这一学习化学的基本理念 教学重点: 1、离子晶体的物理性质的特点 2、离子晶体的配位数及其影响因素 3、晶格能的定义和应用 教学难点: 1、离子晶体配位数的影响因素 2、晶格能的定义和应用 教学过程: 【复习巩固】 【投影】晶体比较 【学生活动】以提问的方式由学生完成表格 【展示结论、点评】 【过度】以上复习了三种晶体,我们今天来学习第四种晶体类型—离子晶体。请大家预习课本,对比上面的表格对离子晶体做一个初步了解。
【学生活动】阅读课本,查找离子晶体相关内容 【点评、总结】 【板书】一、离子晶体 1、概念:由阳离子和阴离子通过离子键结合而形成的晶体 2、构成微粒:阳离子、阴离子 3、微粒间的作用:离子键 4、离子晶体的物理性质:硬而脆;具有较高的熔、沸点,难挥发;晶体不导电,熔融或水溶液中可以导电。 5、常见的离子晶体:强碱、活泼金属氧化物,绝大多数盐。例NaOH、Na2O、NaCl等 【讲述】通过以上学习我们对离子晶体有了初步了解,总结了其物理性质,明确离子晶体与其他三种晶体的不同,那么离子晶体为什么这样的性质特点? 【展图观察】NaCl、CsCl晶体模型。 图1 NaCl晶胞图2 CsCl晶胞 【思考1】1、NaCl晶胞中有几个Na+ ,几个Cl- ?CsCl晶胞中几个Cs+几个Cl-? 2、NaCl、CsCl晶体中有无单个个分子,“NaCl”、“CsCl”是否代表分子组成呢? 【学生讨论、回答】 【点评、强调】1、NaCl晶胞中有4个Na+ 4个Cl- ,CsCl晶胞中,1个Cs+1个Cl. 2、在NaCl晶体或CsCl晶体中,都不存在单个的NaCl分子或单个的CsCl 分子。因在这两种晶体里阴、阳离子的个数比都是1∶1,所以,NaCl和CsCl是表示离子晶体中离子个数比的化学式,而不是表示分子组成的分子式。 【思考】在NaCl晶体中,每个Na+周围有几个Cl-?每个Cl-周围有几个Na+?在CsCl晶体中,每个Cs+周围有几个Cl-?每个Cl-周围有几个Cs+? 【投影】 图3 NaCl型晶体结构图4 CsCl型晶体结构 【板书】二、离子晶体中离子键的配位数
人教版高中化学3.4 离子晶体 实用教案
离子晶体 学习目标: 1、复习离子键概念,能推导并解释离子晶体的相关性质。 2、了解常见典型离子晶体氯化钠、氯化铯的结构特征。 3、知道阴、阳离子的电荷比与配位数的关系。 4、知道晶格能的大小可以衡量离子晶体中离子键的强弱。 能力培养: 1、通过复习离子键的相关知识,学会利用“知识迁移”的学习方法去学习离子晶体,培养自学能力。 2、通过动手制作模型了解典型晶体的结构特征。通过观察分析,动手制作的过程的学习离子晶体的配位数的找法,培养自学能力。 3、通过对晶胞中离子配位数的计算与分析,培养空间想象能力以及懂得利用跨学科知识的学习能力。 教学过程: 【复习引入】 什么是离子键?离子键的本质是什么?离子键的特征? 什么是离子化合物?离子化合物的构成微粒?微粒间的作用力? 【思考】 离子化合物常温常压下的状态如何?(图片导入)---离子晶体(板书) 【对比学习】 通过离子化合物分析离子晶体的1、概念 2、构成微粒 3、微粒间的作用力 【学生活动】 离子晶体能否导电,是否存在单个分子?主要的物理共性有哪些?(熔沸点高低,硬度大小) 4、离子晶体的物理性质 (1)、晶体不导电,在熔融状态或水溶液中导电, 不存在单个分子 (2)、具有较高的熔、沸点;硬而脆; 【学生自主阅读】课本P39 我们知道:在金属晶体中金属的熔沸点高低用金属键强弱来决定。离子晶体的熔沸点的高低由谁决定? 5、衡量离子键强弱的物理量----晶格能 ○1定义:拆开1mol离子晶体使之形成气态阴离子和气态阳离子所吸收的能量。 ○2符号:U 单位:kJ.mol-1 ○3两者的关系:晶格能越大,离子键越牢固 【交流讨论】:分析课本40页表格3-2回答问题
离子极化理论
离子极化理论 离子极化(Ionic polarization)由法扬斯(Fajans)首先提出。离子极化指的是在离子化合物中,正、负离子的电子云在对方离子的电场作用下,发生变形的现象。离子极化理论是离子键理论的重要补充。离子极化理论认为:离子化合物中除了起主要作用的静电引力之外,诱导力起着很重要的作用。离子本身带电荷,阴、阳离子接近时,在相反电场的影响下,电子云变形,正、负电荷重心不再重合,产生诱导偶极,导致离子极化,致使物质在结构和性质上发生相应的变化。 一、离子的极化作用和变形性 离子极化作用的大小决定于离子的极化力和变形性。离子使异号离子极化而变形的作用称为该离子的“极化作用”;被异号离子极化而发生离子电子云变形的性能称为该离子的“变形性”。虽然异号离子之间都可以使对方极化,但因阳离子具有多余的正电荷,半径较小,在外壳上缺少电子,它对相邻的阴离子起诱导作用显著;而阴离子则因半径较大,在外壳上有较多的电子容易变形,容易被诱导产生诱导偶极。所以,对阳离子来说,极化作用应占主要地位,而对阴离子来说,变形性应占主要地位。 1.影响离子极化作用的主要因素 (1)离子壳层的电子构型相同,半径相近,电荷高的阳离子有较强的极化作用。例如:Al3+ > Mg2+ > Na+ (2)半径相近,电荷相等,对于不同电子构型的阳离子,其极化作用大小顺序如下: 18电子和18+2电子 构型以及氦型离子。 如:Ag+、Pb2+、Li +等>9—17电子构型的 离子。如:Fe2+、 Ni2+、Cr3+等> 离子壳层为8电子 构型的离子。如: Na+、Ca2+、Mg2+ 等 (3)离子的构型相同,电荷相等,半径越小,离子的极化作用越大。 但由于阳离子半径相互差别不大,所以,阳离子的电荷数越大,极化力越大。为了衡量阳离子极化力,曾有许多人将正电荷数和半径综合起来找出统一的标度。例如,卡特雷奇(G·H·Cartledge)以离子势φ=Z/r 为标度;徐光宪以静电势能Z2/r 为标度…等等。这些都是经验公式,由于影响极化作用的因素较多,所以这些公式不能对所有离子都适用,还有许多例外。 根据上边规则可以判断,在所有离子中,氢离子(H+)的极化作用最强。
高中化学选修三离子晶体 教案
第三章第四节离子晶体 内容分析: 学生具备了离子键、离子半径、离子化合物等基础知识,本节直接给出氯化钠、氯化铯晶胞,然后在科学探究的基础上介绍影响离子晶体结构的因素,通过制作典型的离子晶体模型来进一步理解离子晶体结构特点,为学习晶格能作好知识的铺垫。 课时划分: 一课时。 教学目标: 1.了解晶格能的应用,知道晶格能的大小可以衡量离子晶体中离子键的强弱。 2.知道离子化合物的热稳定性与阴、阳离子的半径和电荷有关。 3.能说出分子晶体与原子晶体、离子晶体、金属晶体的结构基元以及物理性质方面的主要区别。 教学重点、难点: 了解晶格能的应用,知道晶格能的大小可以衡量离子晶体中离子键的强弱。 教学方法: 分析、归纳、讨论、探究、应用 探究建议: ①制作典型的离子晶体结构模型。②比较氯化钠、氯化铯等离子晶体的结构特征。③实验探究:熔融盐的导电性。④实验探究:明矾或铬钾矾晶体的生长条件。⑤设计探究碱土金属碳酸盐的热稳定性实验方案。⑥查阅资料:晶格能与岩浆晶出规则。 教学过程: [复习] 1、什么是离子键?什么是离子化合物? 2、下列物质中哪些是离子化合物?哪些是只含离子键的离子化合物? Na2O NH4Cl O2Na2SO4NaCl CsCl CaF2 3、我们已经学习过几种晶体?它们的结构微粒和微粒间的相互作用分别是什么? [过渡] 在晶体中,若微粒为离子,通过离子键形成的晶体为离子晶体,今天我们来研究离子晶体。 [板书] 第三章第四节离子晶体 一、离子晶体定义:由阳离子和阴离子通过离子键结合而成的晶体
[解析] (1)结构微粒:阴、阳离子 (2)相互作用:离子键 (3)种类繁多:含离子键的化合物晶体:强碱、活泼金属氧化物、绝大多数盐 (4)理论上,结构粒子可向空间无限扩展 [讨论] 下列物质的晶体,哪些属离子晶体?离子晶体与离子化合物之间的关系是什么?干冰、NaOH、H2SO4、K2SO4、NH4Cl、CsCl [板书] 二、离子晶体的物理性质及解释 [讲述] 在离子晶体中,离子间存在着较强的离子键,使离子晶体的硬度较大、难于压缩;而且,要使离子晶体由固态变成液态或气态,需要较多的能量破坏这些较强的离子键。因此,一般地说,离子晶体具有较高的熔点和沸点,如NaCl的熔点为801℃,沸点为l 413℃;CsCl的熔点为645℃,沸点为l290℃。离子晶体的溶解性有较大差异:如NaCl、KNO3、(NH4)2SO4易溶,BaSO4、CaCO3难溶。 [板书] 硬度较大、难于压缩、较高的熔点和沸点。 [讲述] 离子晶体种类繁多,结构多样,图3—27给出了两种典型的离子晶体的晶胞。我们来研究晶体中的配位数(在离子晶体中离子的配位数(缩写为C N)是指一个离子周围最邻近的异电性离子的数目)。 [板书] 三、离子晶体中离子键的配位数(C.N.) 1、定义:是指一个离子周围邻近的异电性离子的数目 [投影]NaCl和CsCl的晶胞: [板书] 2、决定离子晶体结构的主要因素:
3.4离子晶体教案
普通高中课程标准实验教科书—化学选修3[人教版] 3.4 离子晶体教案 教学目标: 1.了解晶格能的应用,知道晶格能的大小可以衡量离子晶体中离子键的强弱。 2.知道离子化合物的热稳定性与阴、阳离子的半径和电荷有关。 3.能说出分子晶体与原子晶体、离子晶体、金属晶体的结构基元以及物理性质方面的主要区别。 教学重点、难点:了解晶格能的应用,知道晶格能的大小可以衡量离子晶体中离子键的强弱。 探究建议:①制作典型的离子晶体结构模型。②比较氯化钠、氯化铯等离子晶体的结构特征。③实验探究:熔融盐的导电性。④实验探究:明矾或铬钾矾晶体的生长条件。⑤设计探究碱土金属碳酸盐的热稳定性实验方案。⑥查阅资料:晶格能与岩浆晶出规则。 课时划分:一课时。 教学过程: [复习]分子晶体、原子晶体、金属晶体的有关理论。 [过渡]在晶体中,若微粒为离子,通过离子键形成的晶体为离子晶体,今天我们来研究离子晶体。 [板书]第四节离子晶体 一、离子晶体:由阳离子和阴离子通过离子键结合而成的晶体。 [讲述]离子晶体种类繁多,结构多样,图3—27给出了两种典型的离子晶体的晶胞。我们来研究晶体中的配位数(在离子晶体中离子的配位数(缩写为C N)是指一个离子周围最邻近的异电性离子的数目)。 [投影 [科学探究] 1、CsCl、NaCl的阳离子和阴离子的比例都是l:l,同属AE型离子晶体。参考图3—27、图 [
[讲述显而易见,NaCl和CsCl是两种不同类型的晶体结构。晶体中正负离子的半径比(r+/r-)是决定离子晶体结构的重要因素,简称几何因素。 [板书]1、几何因素:晶体中正负离子的半径比(r+/r-)。 [讲解] 上面两例中每种晶体的正负离子的配位数相同,是由于正负离子电荷(绝对值)相同,于是正负离子的个数相同,结果导致正负离子配位数相等,如在NaCl中,Na+扩和C1-的配位数均为6。如果正负离子的电荷不同,正负离子的个数必定不相同,结果,正负离子的配位数就不会相同。这种正负离子的电荷比也是决定离子晶体结构的重要因素,简称电荷因素。例如,在CaF2晶体中,Ca2+和F-的电荷比(绝对值)是2:l,Ca2+和F-的个数比是l:2,如图3—29所示。Ca2+的配位数为8,F-的配位数为4。此外,离子晶体的结构类型还取决于离子键的纯粹程度( [板书]2、电荷因素:正负离子的电荷比。 3、键性因素:离子键的纯粹程度。 [讲述] 在离子晶体中,离子间存在着较强的离子键,使离子晶体的硬度较大、难于压缩;而且,要使离子晶体由固态变成液态或气态,需要较多的能量破坏这些较强的离子键。因此,一般地说,离子晶体具有较高的熔点和沸点,如NaCl的熔点为801℃,沸点为l 413℃;ClCl的熔点为645℃,沸点为l290℃。 [板书]4、离子晶体特点:硬度较大、难于压缩、较高的熔点和沸点。 [自学]科学视野—复杂离子的晶体 碳酸盐在一定温度下会发生分解,如大家熟悉的碳酸钙煅烧得到石灰(CaO),这是由于碳酸钙受热,晶体中的碳酸根离子会发生分解,放出二氧化碳。实验证明,碳酸盐的阳离子 碳酸盐 MgCO3 CaCO3 SrCO3 BaCO3热分解温度/℃ 402 900 1 172 1 360 阳离子半径/pm 66 99 112 135 [板书]二、晶格能 [讲解] 最能反映离子晶体稳定性的数据是它们的晶格能。离子晶体的品格能的定义是气态离子形成l摩离子晶体释放的能量,通常取正值,表3—8给出了某些离子晶体的晶格能
离子极化理论参考资料
薀离子极化 螇离子的极化(Ionic polarization)由法扬斯(Fajans)首先提出。离子极化指的是在离子化合物中,正、负离子的电子云分布在对方离子的电场作用下,发生变形的现象。离子极化能对金属化合物性质的影响 螅简介 羁离子极化 莁在离子化合物中,正、负离子的电子云分布在对方离子的电场作用下,发生变形的现象。离子极化使正、负离子之间在原静电相互作用的基础上又附加以新的作用,它是由离子在极化时产生的诱导偶极矩μ引起的。μ与电场强度E的比值μ/E称为极化率,它可作为离子可极化性大小的量度。正、负离子虽可互相极化,但一般说,由于正离子半径小,电子云不易变形,可极化性小,主要作为极化者;负离子恰好相反,是被极化者。离子极化的结果使离子键成分减少,而共价键成分增加,从而产生一定的结构效应,影响化合物的物理、化学性质。离子极化可使键力加强、键长缩短、键的极性降低以至结构型式变异,从离子晶体的高对称结构向层型结构过渡。 薅离子的极化 袃a.离子在外电场或另外离子的影响下,原子核与电子云会发生相对位移而变形的现象,称为离子的极化。 蒀b.极化作用(polarization power) 离子使异号离子极化的作用,称为极化作用。
肁c.极化率(或变形性)(polarizability) 被异号离子极化而发生电子云变形的能力,称为极化率或变形性。 蚆(2) 无论是正离子或负离子都有极化作用和变形性两个方面,但是正离子半径一般比负离子小,所以正离子的极化作用大,而负离子的变形性大。负离子对正离子的极化作用(负离子变形后对正离子电子云发生变形),称为附加极化作用。 芆(3) 离子的极化作用可使典型的离子键向典型的共价键过渡。这是因为正、负离子之间的极化作用,加强了“离子对”的作用力,而削弱了离子对与离子对之间的作用力的结果。 膃离子极化作用的规律 薇a.正离子电荷越高,半径越小,离子势φ(Z/ r)越大,则极化作用越强; 蚈b.在相同离子电荷和半径相近的情况下,不同电子构型的正离子极化作用不同:8电子构型 < 9-17电子构型 < (18,18+2) 电子构型 莄例如: r(Hg)= 102pm, r(Ca)= 100pm,但Hg的极化作用大于Ca 薃解释:(i) 由于d态电子云空间分布的特征,使其屏蔽作用小 芈(ii) 由于d态电子云本身易变形,因此d电子的极化和附加极化作用都要比相同电荷、相同半径的8电子构型的离子的极化和附加极化作用大。 蒅c.负离子的电荷越高,半径越大,变形性越大 蒂例如:F
《离子晶体》教学设计
第四节离子晶体 [学习目标] [知识梳理] 1.构成离子晶体的粒子是,粒子之间的相互作用是,这些粒子在晶体中(能或不能)自由移动,所以离子晶体(能或不能)导电. 2. 离子晶体中的配位数是指___________________________________________________. 3.___________________________________是决定离子晶体结构的重要因素.此外, 离子晶体的结构还取决于____________________________. 4. 离子晶体的晶格能的定义是________________________________________________.离子晶体的晶格能是最能反映_____________________的数据. 5. 晶格能越大,形成的离子晶体_________________________,而且熔点_______________,硬度______________.典型的离子晶体,晶格能的大小与离子所带的电荷和离子半径的关系一般是:离子电荷高,晶格能,离子半径大,晶格能。 [方法导引] 1.离子晶体、原子晶体、分子晶体和金属晶体的比较
2.物质熔沸点的比较 ⑴不同类晶体:一般情况下,原子晶体>离子晶体>分子晶体 ⑵同种类型晶体:构成晶体质点间的作用大,则熔沸点高,反之则小。 四种晶体熔、沸点对比规律 ①离子晶体:结构相似且化学式中各离子个数比相同的离子晶体中,离子半径小(或阴、阳离子半径之和越小的),键能越强的熔、沸点就越高。如NaCl、NaBr、Nal;NaCl、KCl、RbCl等的熔、沸点依次降低。离子所带电荷大的熔点较高。如:MgO熔点高于NaCl ②分子晶体:在组成结构均相似的分子晶体中,式量大的分子间作用力就大熔点也高。如:F2、Cl2、Br2、I2和HCl、HBr、HI等均随式量增大。熔、沸点升高。但结构相似的分子晶体,有氢键存在熔、沸点较高。 ③原子晶体:在原子晶体中,只要成键原子半径小,键能大的,熔点就高。如金刚石、金刚砂(碳化硅)、晶体硅的熔、沸点逐渐降低。 ④金属晶体:在元素周期表中,主族数越大,金属原子半径越小,其熔、沸点也就越高。如ⅢA的Al,ⅡA的Mg,IA的Na,熔、沸点就依次降低。而在同一主族中,金属原子半径越小的,其熔沸点越高。 ⑶常温常压下状态 ①熔点:固态物质>液态物质 ②沸点:液态物质>气态物质 3.均摊法确定晶体的化学式 在学习晶体时和在一些考试中,我们会遇到这样一类试题:题目中给出晶体的—部分(称为晶胞)的图形,要求我们确定晶体的化学式.求解这类题,通常采用均摊法. 均摊法是先求出给出的图形(晶胞)中平均拥有的各种粒子(离子或原子)的数目,再计算各种粒子数目的比值,从而确定化学式. 均摊法有如下规则,以NaCl的晶胞为例:
第九章离子键和离子晶体
第九章离子键和离子晶体 教学重点: 1.了解离子晶体的结构特征与某些物 理性质的关系; 2.离子晶体的晶格能。 3.了解离子极化的概念及其应用; 第一节离子键 一、离子键的形成 (一)氯化钠离子键形成过程的玻恩-哈伯循环 1.形成条件:电负性相差较大(>1.7)
的金属和非金属元素,可通过电子得失,形成正、负离子。正、负离子间由于静电引力相互靠近,达到一定距离后体系出现能量最低点,形成离子键。 2.形成过程: Na(s)+1/2Cl 2(g)→NaCl(s) △f H NaCl =-392kJ/mol Na(s) +12Cl 2NaCl(s)Na(g)+ Cl(g)Na (g)+Cl (g)-+NaCl(g)△ H 1△2△ H 3△ H 4
上述过程实际上是多个过程的总结果,从而过程的能量变化是多个过程的能量变化的累加。 这个循环包括下列步骤: (1)固态金属钠变成气态的钠原子,需要供给升华热S;氯分子变成气态氯原子需要供给解离能D,对一个Cl原子只需1/2D,这一步变化是吸热的。△H1=S+1/2D=230kJ/mol (2)气态原子间发生电子转移形成离子。
△H2=I+E=495.8-348.8=147kJ/mol I是电离能,E是电子亲合势 ∵∣I∣>∣E∣,∴需供给能量。(3)气态离子结合成气态离子型化合物,即是气态Na+与Cl-结合成气态NaCl,这是由于正负离子间强烈的相互吸引而成,是高度的放热过程。 △H3=-526kJ/mol (4)气态的离子化合物转变为固态的离子晶体,这也是放热过程。 △H4=-243kJ/mol
高中化学优质教案 离子晶体(第1课时)选修三
第四节离子晶体 第一课时 教学内容分析: 学生具备了离子键、离子半径、离子化合物等基础知识,本节直接给出氯化钠、氯化铯晶胞,然后在科学探究的基础上介绍影响离子晶体结构的因素,通过制作典型的离子晶体模型来进一步理解离子晶体结构特点,为学习晶格能作好知识的铺垫。 教学目标设定: 1.掌握离子晶体的概念,能识别氯化钠、氯化铯、氟化钙的晶胞结构。 2.学会离子晶体的性质与晶胞结构的关系。 3.通过探究知道离子晶体的配位数与离子半径比的关系。 4、通过碳酸盐的热分解温度与阳离子半径的自学,拓展学生视野。 教学重点难点: 1、离子晶体的物理性质的特点 2、离子晶体配位数及其影响因素 教学方法建议:分析、归纳、讨论、探究 教学过程设计: [引入] 1、什么是离子键?什么是离子化合物? 2、下列物质中哪些是离子化合物?哪些是只含离子键的离子化合物? Na2O NH4Cl O2Na2SO4NaCl CsCl CaF2 3、我们已经学习过几种晶体?它们的结构微粒和微粒间的相互作用分别是什么?[板书]一、离子晶体
[展示] NaCl 、CsCl晶体模型 [板书]阴、阳离子通过离子键形成离子晶体 1、离子晶体定义:由阳离子和阴离子通过离子键结合而成的晶体 注: (1)结构微粒:阴、阳离子 (2)相互作用:离子键 (3)种类繁多:含离子键的化合物晶体:强碱、活泼金属氧化物、绝大多数盐(4)理论上,结构粒子可向空间无限扩展 [思考]下列物质的晶体,哪些属离子晶体?离子晶体与离子化合物之间的关系是什么? 干冰、NaOH、H2SO4、K2SO4、NH4Cl、CsCl [投影] 2、离子晶体的物理性质及解释 离子晶体溶解性差异较大:NaCl、KNO3、(NH4)2SO4_______ BaSO4、CaCO3_______ [板书]3、离子晶体中离子键的配位数(C.N.) (1)定义:是指一个离子周围邻近的异电性离子的数目
2020高中化学离子晶体教案
2020高中化学离子晶体教案 离子晶体一般硬而脆,具有较高的熔沸点,熔融或溶解时可以导电。接下来是职场为大家的2020高中化学离子晶体教案,希望大家喜欢! 《离子晶体》 教材分析:关于离子晶体,教材以离子键的知识为基础,以学生比较熟悉的NaCl晶体为例子,介绍了离子晶体的结构模型,并对一些性质作了解释。教材还通过举例归纳一些离子晶体的溶解性,使教材与初中内容衔接,帮助学生复习初中学过的知识。该部分内容理论性较强,比较抽象,教材除了选择学生易接受的知识和使用通俗的语言外,还选配了较多的插图,以帮助学生理解知识,并提高兴趣。 学生分析:学生在高一曾学习了物质结构和元素周期律、离子键、共价键等知识,在此基础上,再学习离子晶体,不但可使学生对有关知识有更全面的了解,也可使学生进一步深化对所学知识的认识。但由于该内容抽象,离子晶体的化学式所表示的含义,学生不易理解,均摊法求晶体的化学式也是对学生来说也是一大难点。 设计思路:
1、为了加强直观教学,尽可能把复杂问题简单化,抽象问题具体化,降低学生理解知识的难度,激发学生的兴趣,我利用3D动画把离子晶体的空间结构充分展示给学生,关于均摊法求化学式也就由难变易,有效地突破了难点; 2、这节课我大胆 ___,是一节学生自主学习课,全部的课程内容都在课件中体现,无须教师讲解,学生只要操作电脑就可以把本节内容学习,并配有课堂练习、趣味化学等,使学生的学习不局限在书本上,教师只起到引导、适时点拔的作用。(该课件在哈市课件大赛上获一等奖) 教学目标知识与技能了解离子晶体的晶体结构模型及其性质的一般特点; 理解离子晶体的晶体类型与性质的关系; 学会确定离子晶体化学式的方法。过程与方法培养学生提出问题,通过观察模型分析问题、解决问题的能力情感态度与价值观培养学生敢于质疑、勤于思索、勇于创新、积极实践的科学态度,体验发现的乐趣。教学重点离子晶体的结构模型教学难点均摊法求离子晶体的化学式教学策略诱导、分析、推理、归纳相结
离子极化
离子极化对化合物性质的影响 离子极化对化合物性质的影响 曲江县曲仁一中许少生 离子极化理论是离子键理论的重要补充。离子极化理论认为:离子化合物中除了起主要作用的静电引力之外,诱导力起着很重要的作用。离子本身带电荷,阴、阳离子接近时,在相反电场的影响下,电子云变形,正、负电荷重心不再重合,产生诱导偶极,导致离子极化,致使物质在结构和性质上发生相应的变化。 一、离子的极化作用和变形性 离子极化作用的大小决定于离子的极化力和变形性。离子使异号离子极化而变形的作用称为该离子的“极化作用”;被异号离子极化而发生离子电子云变形的性能称为该离子的“变形性”。虽然异号离子之间都可以使对方极化,但因阳离子具有多余的正电荷,半径较小,在外壳上缺少电子,它对相邻的阴离子起诱导作用显著;而阴离子则因半径较大,在外壳上有较多的电子容易变形,容易被诱导产生诱导偶极。所以,对阳离子来说,极化作用应占主要地位,而对阴离子来说,变形性应占主要地位。 1.影响离子极化作用的主要因素 (1)离子壳层的电子构型相同,半径相近,电荷高的阳离子有较强的极化作用。例如:Al3+ > Mg2+ > Na+ (2)半径相近,电荷相等,对于不同电子构型的阳离子,其极化作用大小顺序如下:18电子和18+2电子 构型以及氦型离子。如:Ag+、Pb2+、Li+等> 9—17电子构型 的离子。如:Fe2+、 Ni2+、Cr3+等 > 离子壳层为8电子 构型的离子。如: Na+、Ca2+、Mg2+等 (3)离子的构型相同,电荷相等,半径越小,离子的极化作用越大。 但由于阳离子半径相互差别不大,所以,阳离子的电荷数越大,极化力越大。为了衡量阳离子极化力,曾有许多人将正电荷数和半径综合起来找出统一的标度。例如,卡特雷奇(G·H·Cartledge)以离子势φ=Z/r为标度;徐光宪以静电势能Z2/r为标度…等等。这些都是经验公式,由于影响极化作用的因素较多,所以这些公式不能对所有离子都适用,还有许多例外。 2.影响离子变形性的主要因素 (1)离子的电子层构型相同,正电荷越高的阳离子变形性越小。例如: O2- > F- > Ne > Na+ > Mg2+ > Al3+ > Si4+ (2)离子的电子层构型相同,半径越大,变形性越大。例如: F- < Cl- < Br- < I- (3)若半径相近,电荷相等,18电子层构型和不规则(9—17电子)构型的离子,其变形性大于8电子构型离子的变形性。例如: Ag+ > K+;Hg2+ > Ca2+ (4)复杂阴离子的变形性通常不大,而且复杂阴离子中心原子氧化数越高,其变形性越小。例如: ClO4- < F- < NO3- < H2O < OH- < CN- < Cl- < Br- < I- SO42- < H2O < CO32- < O2- < S2- 从上面的影响因素看出,最容易变形的离子是体积大的阴离子(如I-、S2-等)和18电子
鲁科版化学选修3离子晶体word教案
第2节金属晶体与离子晶体 第二课时离子晶体 【教学目标】 1. 使学生认识几种常见的AB型离子晶体(NaCl、CsCl、ZnS)的结构,了解其配位数情况。 2. 能用“切割法”计算一个给定的简单离子晶体晶胞中实际拥有的阴、阳离子个数。 3. 了解晶格能的概念,知道离子晶体的熔、沸点等性质决定于晶格能的大小;知道晶格能的大小与离子晶体的结构型式和阴、阳离子所带电荷以及阴、阳离子的间距有关。 【教学重点、难点】离子晶体的空间堆积方式,离子晶体的结构特点 【教学方法】借助模型课件教学 【教师具备】制作课件 【教学过程】 【复习引入】 1. 晶体有哪些类型? 2. 什么叫离子晶体? 【回答】 1. 金属晶体,离子晶体,分子晶体和原子晶体。 2.离子晶体是阴、阳离子通过离子键结合,在空间呈现有规律的排列所形成的晶体。 那么,离子晶体的结构是怎样的,有什么特点呢?我们这节课就来学习离子晶体的结构。【板书】二、离子晶体 我们先来探讨NaCl晶体的内部结构 【提出问题】请同学们观察NaCl晶体的堆积模型,思考以下问题: 1. NaCl晶体采取哪种堆积方式? 2. 像NaCl这样的离子晶体采取密堆积的原因是什么? 【回答】 1. NaCl晶体中的Cl-采取A1型密堆积,Na+填在Cl-所形成的空隙中,整体是采取不等径圆球的密堆积。 2. 离子晶体微粒间的作用力为离子键,离子键无方向性和饱和性,因此离子晶体尽可能采取密堆积,以使得体系能量降低,达到稳定状态。
【过渡】我们知道晶体中最小的结构重复单元称为晶胞,将一个个晶胞上、下、前、后、左右并置起来,就构成整个晶体结构,那么NaCl晶胞是怎样的呢? 【展示】NaCl的堆积模型请同学们观察NaCl晶胞,思考以下几个问题: 1.NaCl晶体中Na+和Cl-的配位数分别为多少? 2. NaCl晶体中在Na+周围与它最近且距离相等的Na+共有几个? 3.一个NaCl晶胞中含有的Na+和Cl-各是多少? 4.“NaCl”这一化学式表示什么含义? 学生看到屏幕上NaCl晶胞中体心上的Na+,6个面心上的Cl-不停地闪烁 【回答】 1.在NaCl晶体中,每个Na+同时吸引6个Cl-,每个Cl-同时吸引6个Na+,所以Na+、Cl-配位数均为6 2.12个 3.Na+:12ⅹ1/4+1=4Cl-:8ⅹ1/8+6ⅹ1/2=4 4.离子晶体中,并不存在单独的“NaCl”分子,在整个晶体Na+与Cl-的个数比为1:1,因此,“NaCl”这一化学式表示的只是氯化钠的组成。 【过渡】通常哪些物质为离子化合物呢? 【答案】强碱、大部分金属氧化物和盐 请同学们观察课本80页介绍的几种常见的AB型离子晶体:NaCl型、CsCl型、Zn S型,根据CsCl、ZnS的晶胞找出它们的配位数和每个晶胞中含有的阴、阳离子的个数。 学生通过简单计算,迅速给出答案,然后教师简单总结: CsCl配位数:8:8ZnS配位数:4:4 CsCl晶胞中Cs+:1个Cl-:1个 ZnS晶胞中Zn2+:4个S2-:4个 【过渡】我们知道,离子晶体中阴阳离子通过离子键相互结合,因此离子晶体的熔点和离子晶体的稳定性与离子键的强弱有关。离子键的强弱在一定程度上可以用离子晶体的晶格能来衡量。 请同学们自学81页到872页,通过交流研讨,弄清楚以下几个问题: 1.什么叫晶格能? 2.结构相似的离子晶体,晶格能的大小与哪些因素有关? 【回答】
