3教材习题参考答案-第三章自由基聚合.doc
高分子化学-第3章 自由基聚合
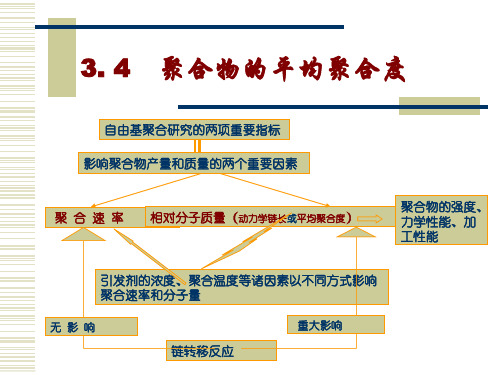
3. 4
聚合物的平均聚合度
1、动力学链长和聚合度
(1)动力学链长υ (kinetic chain length)的定义
每个活性种从引发阶段到终止阶段所消耗单体分子数。无 链转移时,动力学链长为增长速率和引发速率的比。 依据稳态时引发速率等于终止速率,则动力学链长可表 示为增长速率与终止速率的比: 即为单体消耗速率与
自由基产生(或消失) 速率之比
3. 4
聚合物的平均聚合度
如将稳态时的自由基浓度 入上式,可得下式:
,代
3. 4
聚合物的平均聚合度
若自由基聚合反应由引发剂引发时,
引发速率Ri = 2 f kd[I],则:
3. 4
聚合物的平均聚合度
可知动力学链长与引发速率存在以下关系:
1) 动力学链长与单体浓度的一次方成正比,与 引发剂浓度平方根成反比。 2) 说明了在自由基聚合体系中,增加引发剂用 量虽然可以提高聚合速率,但又使聚合物相对分子 质量降低。由此说明引发剂在自由基聚合中的重要
(1)温度对聚合速率的影响
总聚合速率常数k与温度T(K)遵循Arrhenius经验公式: 由前面推导可知: k=Ae-E/RT
k=kp(kd/kt)1/2
因此:
3.5 影响自由基聚合反应的因素
从而可知,总活化能E=(Ep-Et/2)+Ed/2
由Ep、 Et和Ed的大小可以得到总活化能E约为83 kJ/mol,为正值,表明温度升高,速率常数增大k增大。
3.5 影响自由基聚合反应的因素
1. 链自由基的双基终止过程的三步曲:
1) 链自由基的平移;
2) 链段重排,使活性中心靠近;
3) 双基相互反应而使链终止。
第二步(链段重排)是 控制步骤,受体系粘度 影响显著。
第三章 自由基聚合
外,如1,1-二苯乙烯不能聚合。
9
③、1,2双取代的烯类化合物,因结构对称,极化程度低,位阻 效应大,一般不能聚合。但有时能与其他单体共聚,如马 来酸酐能与苯乙烯共聚。 ④、三取代、四取代的烯类化合物一般不能聚合,但氟代乙烯 例外。例如:氟乙烯、1,1-二氟乙烯、1,2-二氟乙烯、三氟 乙烯、四氟乙烯均可聚合。 不论氟代的数量和位置,均极易聚合。
22
(2)共轭效应
一些取代基对单体的双键具有共轭稳定作用,使单体能 级降低,而在聚合后所形成的大分子中便不存在这种共轭稳 定作用,因此单体与聚合物之间的能级差降低,聚合热也
相应减少。
(3)取代基的电负性
取代基的电负性大,使得单键的键能增大值高于双键, 有利于聚合热的升高。例如氯乙烯(-5.8kJ/mol)、 硝基乙烯(-90.8kJ/mol)等。
23
(4)氢键和溶剂化作用
氢键和溶剂化作用都使得聚合物分子运动受阻,内 能增加,对聚合物影响不大。因此聚合热降低。
3.3.3 聚合上限温度 3.3.3.1 聚合上限温度的概念
理论上,任何聚合反应都存在逆反应。但因多数单体 聚合热较大,在一般聚合温度下逆反应速率很低,可忽
略。而在高温下,TΔS变得很大,逆反应不可忽略。
24
当单体与聚合物处于平衡状态时,ΔG = 0,即
G H TS 0
因此:
ΔH Tc ΔS
Tc称为聚合上限温度。高于Tc时聚合无法进行。 3.3.3.2 聚合上限温度与单体浓度的关系 链增长反应和解聚反应为一对竞争反应。
kp Mn + M kdp Mn+1
25
两者的速率方程为:
4
自由基聚合是至今为止研究最为透彻的高分子合 成反应。其聚合产物约占聚合物总产量的60%以上。 特点:单体来源广泛、生产工艺简单、制备方法 多样。
第三章 自由基聚合

20
3.4 自 由 基 聚 合 机理
(3)共轭双烯烃聚合
共轭双烯烃聚合时可以进行1,2-和1,4-加成得到相应 的1,2-和1,4-加成高分子。如丁二烯:
R H2C C H C H C H2 RCH 2 C H C H C H2
C H2C H CH C H2 1,2-加成
C H2 C C H
C H2 H
8
3.2
连锁聚合的单体
H R CH2 C X
(ii) X为吸电子基团(Electron-withdrawing Substituent)
H2C CH X
降低电子云密度,易 与富电性活性种结合
分散负电性,稳定活性中心
由于阴离子与自由基都是富电性的活性种,因此带吸电子基 团的烯类单体易进行阴离子与自由基聚合,如X = -CN, -COOR,-NO2等。 但取代基吸电子性太强时一般只能进行阴离子聚合。如同时含 两个强吸电子取代基的单体:CH2=C(CN)2等
第三章 自由基聚合
1
3.1 引言(链 式 聚 合 反 应 概 述)
本章内容
掌握单体对不同连锁聚合机理的选择性;
自由基聚合反应机理及其特征; 主要热引发剂种类、引发机理和引发剂分解动力学; 自由基聚合反应动力学及影响自由基聚合反应速率和 分子量的因素; 掌握引发效率、稳态、自由基等活性理论、自动加速 、动力学链长、聚合度、链转移、阻聚及缓聚等基本概 念。
ktr CH2 CH2 + S X
ktr CH CH + SH X
24
3.4
自 由 基 聚 合 机理
3.4.3自由基反应的特征 (1)反应包括链引发、增长、终止、转移等基元反应;引 发速率最小,控速。概括为慢引发、快增长、速终止。 (2)只有链增长反应使DP增加,反应混合物仅存在单体和 聚合物,在聚合全过程中,DP变化极小。 (3)聚合过程中,单体浓度逐渐降低,聚合物浓度升高。 延长反应时间主要是提高转化率。 (4) 少量阻聚剂(0.01~0.1%)可使自由基反应终止.
第三章自由基习题

比较logt1/2=A/T-B与上式得 A=(Ed loge)/R,B= log(Ad/ln2)
(2)当t1/2=10h时,logt1/2=A/T-B=log10=1 得 A/T (t1/2=10h)-B=1
kd AeE/RT
lnkdlnAEd/RT 以lnkd对1/T作图,斜率为-Ed/R,截距为 lnA
引发剂的半衰期与聚合时间相当,聚合有效
以lnkd对1/T作图,得
Ed /R15116
lnkd3.3 931 651/T16
Ed=8.314×15116=125.7kJ/mol
当t=40℃=313.15K时
解:
由教材P64上表3-3中查得:
甲基丙烯酸甲酯△H=-56.5kJ/mol, △S =-117.2J/mol K
由公式:lnM []e
1(HS) RT
求得平衡单体浓度: T=77℃=350.15K,4.94×10-3mol/L T=127℃=400.15K,0.0558mol/L T=177℃=450.15K,0.368mol/L T=227℃=500.15K,1.664mol/L 从热力学上判断,甲基丙烯酸甲酯在77℃、127℃、177℃ 下可以聚合,在227℃上难以聚合。因为在227℃时平衡单
ln [ M ]
t
k
( fk d )1 / 2 ([ I ] e k d t )1 / 2 dt
[M ]
0p k
0
0
t
k
(
fk d
)1/ 2
2[ I ]1/ 2 0
第三章 自由基聚合.
图3-1
图3-2
26
四 引发剂(Initiator)
引发剂(initiator)——分子结构上具有弱键、易分解 产生自由基、能引发单体聚合的化合物(或物质)
• 引发剂 在聚合过程中逐渐被消耗、残基连接在大分子末端、不 能再还原成原来的物质 • 催化剂 仅在反应中起催化作用、加快反应速度、不参与反应、 反应结束仍以原状态存在于体系中的物质
G 0
根据 H 的大小,判别单体聚合倾 向的大小,这是从热力学判断。
11
2.3 聚合上限温度(Tc)
根据 G H TS
在某临界温度Tc下,聚合和解聚处于平衡状态
G 0 通常 H < 0, S < 0, 要使 G 0 ,就要控制 使T < Tc
12
Mn + M
• DP与链自由基中的单元数相同。
• 每个大分子只有一端为引发剂残基,另 一端为饱和或不饱和(两者各半)。
22
链终止特点: •双分子反应,双基終止(偶合、歧化) •Et很低,8-21kJ/mol •終止速率快, Kt>Kp •双基终止受扩散控制
终止方式与单体种类和聚合条件有关 St(styrene):偶合终止为主; MMA(methyl methacrylate): > 60℃,歧化终止为主, < 60℃,两种终止方式均有。
•引发、增长、終止是自由基聚合的三个基元反应, 链引发速率是控制整个聚合速率的关键。
24
4) 链转移(chain transfer):
活性种从一条大分子链转移给另一分子,形成新的活 性种继续增长,而原来的大分子終止,称为链转移反应
第三章 自由基连锁聚合反应

第三章 自由基连锁聚合反应1.解释下列名词:诱导期,引发效率,诱导分解,笼蔽效应,自动加速作用,动力学链长,乳液聚合2.判别下列有机化合物,哪些易发生自由基加成聚合反应,哪些不易,并说明原因。
3.自由基聚合有哪些引发方法?哪一种引发方法最重要,为什么?4.试写出以过氧化苯甲酰为引发剂,以四氯化碳为溶剂,苯乙烯单体聚合成聚苯乙烯的基本反应及可能出现的副反应。
简述发生副反应的原因。
5.在自由基聚合反应中,调节分子量的措施有哪些?试以氯乙烯悬浮聚合、苯乙烯本体聚合、醋酸乙烯酯溶液聚合和丁二烯乳液聚合中分子量调节方法为例来讨论。
6.氧的存在对高聚物的生产过程(自由基聚合反应)有什么影响?如何去排除这些影响?7.在100毫升无阻聚剂存在的甲基丙烯酸甲酯中,加入0.0242克过氧化苯甲酰,并在60 o C 下聚合。
反应1.5小时后得到聚合物3克,用渗透压法测得其分子量为831500。
以知60 o C 下过氧化苯甲酰的半衰期为48小时,引发效率为0.81,C I 为0.02,C M 为0.1×10-4,甲基丙烯酸甲酯的密度为0.930克/毫升,试求(1)甲基丙烯酸甲酯在60 o C 的kp 2/kt ;(2)在该温度下歧化和偶合终止所占比例。
8.以过氧化二特丁基作引发剂,在60 o C 下研究苯乙烯聚合。
苯乙烯溶液浓度为1.0 mol/l ,过氧化物0.01 mol/L ,引发和聚合的初始速率分别为4.0×10-11和1.5×10-7 mol/l s 。
试计算(fk d ),初期聚合度,初期动力学链长。
计算时采用下列数据和条件:C I =3.2×10-4,C M =8.0×10-5,Cs=2.3×10-6,60 o C 下苯乙烯密度为0.887 g/ml ,苯的密度为0.839 g/ml ,设苯乙烯-苯体系为理想溶液。
CH 2=CHCOOC 2H 51)CH 2=CHCl 2)3)CH 2=CHOCH(CH 3)2CH 2=CH-4)5)CH 2=CHCH 2CH 3CH 2=CH(CN)26)7)8)N CH=CH 29)ClCH=CHCl10)CH 2=CHNO 211)CH 2=C(Cl)2。
第三章 自由基聚合
2
I. 自由基聚合机理
自由基的活性与反应 单体结构与聚合类型 自由基聚合的基元反应
自由基聚合反应特征
3
自由基的活性与反应性
只要存在有未成对电子(孤电子),都可构 成自由基
如果只有一个未成对电子,称为单(自由)基 有两个未成对电子时,称为双(自由)基
4
各种自由基
原子自由基
21
判定单体聚合类型的原则
强吸电子基团的单体倾向于负离子聚合, 而弱的适合于自由基聚合
介于两者之间的,则既可进行负离子聚 合,又可进行自由基聚合 卤原子的诱导效应是吸电子,而共轭效 应却有供电性,但两者均较弱。
22
共轭烯烃
苯乙烯、丁二烯和异戊二烯等共轭烯 烃,由于π电子的离域性较大,易诱导 极化,能进行上述四种类型的聚合
39
IV.
链转移反应
自由基可从单体、引发剂、溶剂或大分子上夺取一个
原子而终止,将电子转移给失去原子的分子而成为新
的自由基,继续新的链增长。
向单体转移 向溶剂(或分子量调节剂)转移 向引发剂转移 向大分子转移
40
① 向单体转移
CH2 CH + CH2 = C CH2 CH + CH2 = CH X X
一般都不能聚合
但取代基为氟原子的例外 氟原子半径很小,故氟代乙烯、直到四 氟乙烯都能很好地聚合
F C F F F C C F F
CH F
28
自由基聚合的基元反应
自由基聚合是链式聚合 至少由三个基元反应组成
链引发
链增长 链终止 还可能伴有链转移等反应
29
I.
聚合度不随聚合时间变化 没有聚合度递增的中间产物 延长时间提高转化率,不大影 响分子量 放热反应
第三章 自由基聚合反应-3
不足
反应热不易导出、易局部过热。
措施
降低反应温度 分段聚合 强化传热 控制在一定的转化率 ……
3、应用实例
可广泛用于各种链锁聚合、逐步聚合等。
表3 本体聚合工业生产实例
聚合物
聚甲基丙 烯酸甲酯
引发
BPO AIBN
BPO 热引发 过氧化乙 酰基磺酸 微量氧
工艺过程
第一段预聚到转化率10%左右的 粘稠浆液,浇模升温聚合,高温 后处理,脱模成材。 第一段于80~90OC预聚到转化率 30~35%,流入聚合塔,温度由 160OC递增至225OC聚合,最后 熔体挤出造粒。 第一段预聚到转化率7~11%, 形成颗粒骨架,第二阶段继续沉 淀聚合,最后以粉状出料。
第九节 分子量和链转移反应 一、无链转移时的分子量
1、动力学链长和聚合度 定义:每个活性中心从引发开始到终止所消耗的单体 分子数
v
Rp k p [M ][M ]
Rp Ri
Rp Rt
k p [M ] 2kt [M ]
[M ] (Ri / 2kt )1/ 2
v
k p 2 [ M ]2 2 kt R p
[M ] v 1/ 2 1/ 2 (2kt ) Ri
kp
Ri 2 fkd [ I ]
[M ] v 1/ 2 1/ 2 2( fkd kt ) [ I ]
kp
无链转移反应时,动力学链长与聚合度的关系: 双基偶合终止:Xn=2v;歧化终止: Xn=v
Xn Rp Rtc / 2 Rtd
110 ~ 130 OC 130 ~ 180 OC 180 ~ 225 OC
后处理
二、溶液聚合
1、体系组成
第三章 自由基聚合反应 (3-4)
3
4
动力学链长:
k
p
1/ 2 k p M I
:与动力学链长相关的综合动 力学常数。
动力学链长的影响因素: (1)单体浓度 (2)引发剂浓度 (3)反应条件:温度、溶剂等
5
动力学链长和聚合度的区别
6
二、无链转移时的聚合度
双基歧化终止:
42
三、自由基聚合物分散度增加的原因 1、自由基聚合与缩聚比较,在聚合反应的 各个阶段大分子生成的条件完全不同;
2、自加速使相对分子质量大大升高;
3、自加速和向大分子的链转移反应是使自 由基聚合物分散度增加的主要原因。 4、自由基聚合反应中的链转移反应与缩聚 反应中的链裂解反应对聚合度的影响不同。
30
四、烯丙基类单体的自动阻聚作用
烯丙基自由基 的共振式
31
五、氧的阻聚和引发作用
100℃以下:
氧分子具有双自由基特性对聚合起阻聚作 用
100℃以上:
过氧键不稳定,分解产生自由基起引发 剂的作用。
32
六、阻聚剂在引发反应速率测定中的应用
33
3.10 相对分子质量控制、分布和影响因素
一、相对分子质量的控制及影响因素
18
一、自加速过程产生的原因和结果
1.体系粘度随着转化率的升高而升高是产 生自加速过程的根本原因。
19
100 80
60
40 10
20
2.自加速过程产生的结果
21
二、不同聚合反应类型的自加速过程
1、良溶剂型聚合——如苯乙烯的本体聚合自加速过 程出现较晚,较温和。
2、非良溶剂型聚合——如甲基丙烯酸甲酯的本体聚 合,自加速过程出现较早,也较严重。
第三章自由基共聚习题
1 何谓竞聚率?它有何物理意义?
2 说明两种单体进行理想共聚、恒比共聚和交替共聚的 必要条件。 3 苯乙烯(M1)与丁二烯(M2)进行自由基共聚, r1=0.64, r2=1.38。已知苯乙烯和丁二烯的均聚链增长速 率常数分别为49和25 l/mol.s,求: (1)共聚时的反应速率常数 (2)比较两种单体和两种自由基的反应活性大小 (3)做出此共聚反应的F1-f1曲线 (4)要制备组成均一的共聚物需要采用什么措施?
8
9解: 设共聚物组成为:
[ CH2 CH ] [ CH m C6H5 Cl CH CH CH2 ] n
则每m个苯乙烯链节内含有8m个C原子,每n个氯丁二烯 链节内含4n个C原子和n个氯原子: 所以 C%=(8m+4n)12/(104m+88.5n) Cl%=35.5n/(104m+88.5n) 将已知的Cl%和C%代入上式中,即可求得m/n之比。即共 聚物两种链节的摩尔比,结果如下:
6
5解: r1=1.68 r2=0.23 M1=62.5 M2=86 要合成含氯乙烯重量分数为80%的氯-醋共聚物,此中含氯乙 烯摩尔分数F1=0.846,按共聚物组成微分方程计算,相应的 f1=0.75 在该共聚反应中,氯乙烯活性大于醋酸乙烯,所以随着反应 进行,剩余物料中氯乙烯比例下降,f1逐渐下降。所以要合 成氯乙烯80%(重量比)可采用f1=0.75的配比投料,过程补 加氯乙烯单体以维持体系中单体配比保持在0.75。
4
1解: 竞聚率是单体链增长和共聚链增长速率常数之比。即 r1=k11/k12它表征两单体的相对活性,根据r值可估算两单体 共聚的可能性和判断共聚物的组成情况。 2解: (1)r1r2=1时可进行理想共聚,此时k11/k12=k21/k22,活性 链对单体无选择性。如丁二烯(r1=1.39)和苯乙烯(r2=0.78) r1r2=1.08属于此类。此时F1=f1 (2)r1<1 r2<1 可进行有恒比点的共聚,在恒比点有 F1=f1=(1-r2)/(2-r1-r2) 如苯乙烯(r1=0.41) 丙烯腈 (r2=0.04) (3) r1<<1, r2<<1, 或r1=r2=0时 交替共聚 此时F1=1/2 如马来酸酐(r1=0.04) 苯乙烯(r2=0.015)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
教材习题参考答案 第三章自由基聚合 思考题 1.烯类单体家具有下列规律: ①单取代和1,1-双取代烯类容易聚合, 而1,2-双取代烯类难聚合;②大部分烯类单体能自由基聚合,而能离子聚合的烯类单体却很少,试说明原因。
2. 下列烯类单体适于何种机理聚合?自由基聚合、阳离子聚合还是阴离子聚合?并说明原因。 CH2=CHCl CH2=CCl2 CH2=CHCN CH2=C(CN)2 CH2=CHCH3 CH2=C(CH3)2 CH2=CHC6H5 CF2=CF2 CH2=C(CN)COOR CH2=C(CH3)-CH=CH2
答:CH2=CHCl:适合自由基聚合,Cl原子是吸电子基团,也有共轭效应,但均较弱。
CH2=CCl2:自由基及阴离子聚合,两个吸电子基团。 CH2=CHCN:自由基及阴离子聚合,CN为吸电子基团。 CH2=C(CN)2:阴离子聚合,两个吸电子基团(CN)。 CH2=CHCH3:配位聚合,甲基(CH3)供电性弱。 CH2=CHC6H5:三种机理均可,共轭体系。 CF2=CF2:自由基聚合,对称结构,但氟原子半径小。 CH2=C(CN)COOR:阴离子聚合,取代基为两个吸电子基(CN及COOR) CH2=C(CH3)-CH=CH2:三种机理均可,共轭体系。 3. 下列单体能否进行自由基聚合,并说明原因。 CH2=C(C6H5)2 ClCH=CHCl CH2=C(CH3)C2H5 CH3CH=CHCH3
CH2=CHOCOCH3 CH2=C(CH3)COOCH3 CH3CH=CHCOOCH3 CF2=CFCl
答:CH2=C(C6H5)2:不能,两个苯基取代基位阻大小。 ClCH=CHCl:不能,对称结构。 CH2=C(CH3)C2H5:不能,二个推电子基,只能进行阳离子聚合。 CH3CH=CHCH3:不能,结构对称。 CH2=CHOCOCH3:醋酸乙烯酯,能,吸电子基团。 CH2=C(CH3)COOCH3:甲基丙烯酸甲酯,能。 CH3CH=CHCOOCH3 :不能,1,2双取代,位阻效应。 CF2=CFCl:能,结构不对称,F原子小。
第三章 自由基聚合
计算题 1. 甲基丙烯酸甲酯进行聚合,试由和来计算77℃、127℃、177℃、227℃时的平衡单体浓度,从热力学上判断聚合能否正常进行。 解:由教材P64上表3-3中查得:甲基丙烯酸甲酯=-56.5kJ/mol,=-117.2J/mol K
平衡单体浓度: T=77℃=350.15K,4.94*10-3mol/L T=127℃=400.15K,0.0558mol/L T=177℃=450.15K,0.368mol/L T=227℃=500.15K,1.664mol/L 从热力学上判断,甲基丙烯酸甲酯在77℃、127℃、177℃下可以聚合,在227℃上难以聚合。因为在227℃时平衡单体浓度较大。 2. 60℃过氧化二碳酸二环己酯在某溶剂中分解,用碘量法测定不同时间的残留引发剂浓度,数据如下,试计算分解速率常数(s-1)和半衰期(h)。 时间 /h 0 0.2 0.7 1.2 1.7
DCPD浓度 /(molL-1) 0.0754 0.0660 0.0484 0.0334 0.0
288 解:过氧化二碳酸二环己酯的分解反应为一级反应,引发剂浓度变化与反应时间的关系为:
通过以对t作图,利用最小二乘法进行回归得一条直线,斜率为-kd。 得到:kd=0.589h-1=1.636*10-4s-1
半衰期: 3. 在甲苯中不同温度下测定偶氮二异丁腈的分解速率常数,数据如下,求分解活化能。再求40℃和80℃下的半衰期,判断在这两温度下聚合是否有效。 温度 /℃ 50 60.5 69.5
分解速率常数 /s-1 2.6410-6 1.1610-5 3.7810
-5
解:分解速率常数、温度和活化能之间存在下列关系: ,以对作图,斜率为,截距为。 采用最小二乘分法进行回归,得: Ed=8.314*15116=125674.4=125.7kJ/mol 当t=40℃=313.15K时
当t=80℃=353.15K时 以此可见,在40℃下聚合时引发剂的半衰期太长,聚合无效,而在80℃下聚合是有效的。 4. .引发剂的半衰期与温度之间的关系式中的常数A,B与指前因子、活化能有什么关系?文献经常报道半衰期为1h和10h的温度,这有什么方便之处?过氧化二碳酸二异丙酯半衰期为1h和10h的温度分别为61℃和45℃,试求A,B值和56℃的半衰期。 解:t1/2=0.693/kd kd=Adexp(-Ed/RT)
lg t1/2=lg0.693-lgAd+Ed/RTlge 联立:lg t1/2=A/T-B 得:A= (Ed/R)lge B= lgAd- lg0.693 对于过氧化二碳酸二异丙酯
Lg10=A/318.2-B ① Lg1=A/334.2-B ② 解之得A=6646.4 B=19.89
6. 苯乙烯溶液浓度0.20 molL-1, 过氧类引发剂浓度为4.010-3molL-1, 在60℃下聚合,如引发剂半衰期44h, 引发剂效率f=0.80,kp=145 L(mols)-1,kt=7.0107 L(mols)-1, 欲达到50%转化率,需多长时间?
解: 当引发剂浓度随时间不变时:
7. 过氧化二苯甲酰引发某单体聚合的动力学方程为:Rp=kP[M](fkd/kt)1/2[I]1/2,假定各基元反应的速率常数和f都与转化率无关,[M]0=2 molL-1,[I]=0.01 molL-1,极限转化率为10%。若保持聚合时间不变,欲将最终转化率从10%提高到20%,试求: (1)[M]0增加或降低多少倍?(2)[I]0增加或降低多少倍?[I]0改变后,聚合速率和聚合度有何变化? (3)如果热引发或光引发聚合,应该增加或降低聚合温度? Ed、Ep、Et分别为124、32 和8 kJmol-1。 解:(题意有修改) 低转化率下聚合动力学方程:
令 (1)当聚合时间固定时,C与单体初始浓度无关,故当聚合时间一定时,改变不改变转化率。 (2)当其它条件一定时,改变,则有:
,即引发剂浓度增加到4.51倍时,聚合转化率可以从10%增加到20%。 由于聚合速率,故增加到4.51倍时,增加2.12倍。 聚合度,故增加到4.51倍时,下降到原来0.471。即聚合度下降到原来的1/2.12。 (3)引发剂引发时,体系的总活化能为:
热引发聚合的活化能与引发剂引发的活化能相比,相当或稍大,温度对聚合速率的影响与引发剂引发相当,要使聚合速率增大,需增加聚合温度。 光引发聚合时,反应的活化能如下:
上式中无项,聚合活化能很低,温度对聚合速率的影响很小,甚至在较低的温度下也能聚合,所以无需增加聚合温度 8.以过氧化二苯甲酰做引发剂,苯乙烯聚合时各基元反应活化能为Ed=125kJ·mol-1,Ep=32.6kJ·mol-1,Et=10kJ·mol-1,试比较50℃增至60℃以及从80℃增至到90℃聚合速率与聚合度有何变化。光引发的情况又如何? 解: 1)50℃~60℃时速率常数变化 1111=E32.6125.61090.4/2222pdtEEEKJmol总
12
2735032327360333TKTK
23190.411exp()2.968.310323333KK
80℃~90℃时速率常数变化 212.34KK
2)50℃~60℃时Xn变化
1111=E32.6125.61035.2/2222nptdXEEEKJmol
2251135.211exp()0.6758.310323333nn
XK
KX 80℃~90℃时Xn变化 2251135.211exp()0.7198.310353363nn
XK
KX
3) 光引发时50℃~60℃时速率常数及Xn变化 0dE
1132.61027.522ptEEE
nRX
EE
50℃~60℃时 22112111exp()1.39nP
Pn
XRE
RRTTX
80℃~90℃时 22112111exp()1.30nP
Pn
XRE
RRTTX
9. 以过氧化二苯甲酰为引发剂,在60℃进行苯乙烯聚合动力学研究,数据如下: a. 60℃苯乙烯的密度为0.887 gcm-3;b. 引发剂用量为单体重的0.109%;c. Rp=0.25510-4 mol(Ls)-1;d.聚合度=2460;e. f=0.80;f. 自由基寿命=0.82 s。试求kd、kp、kt,建立三常数的数量级概念,比较 [M]和[M]的大小,比较RI、Rp、Rt的大小。
解:
偶合终止:C=0.77,歧化终止:D=0.23。
