气体摩尔体积练习题及答案解析

气体摩尔体积
1.标准状况下两个容积相等的贮气瓶,一个装有O 2,另一个装有CH 4,两瓶气体具有相同的( ) A.质量 B.原子总数 C.密度 D.分子数
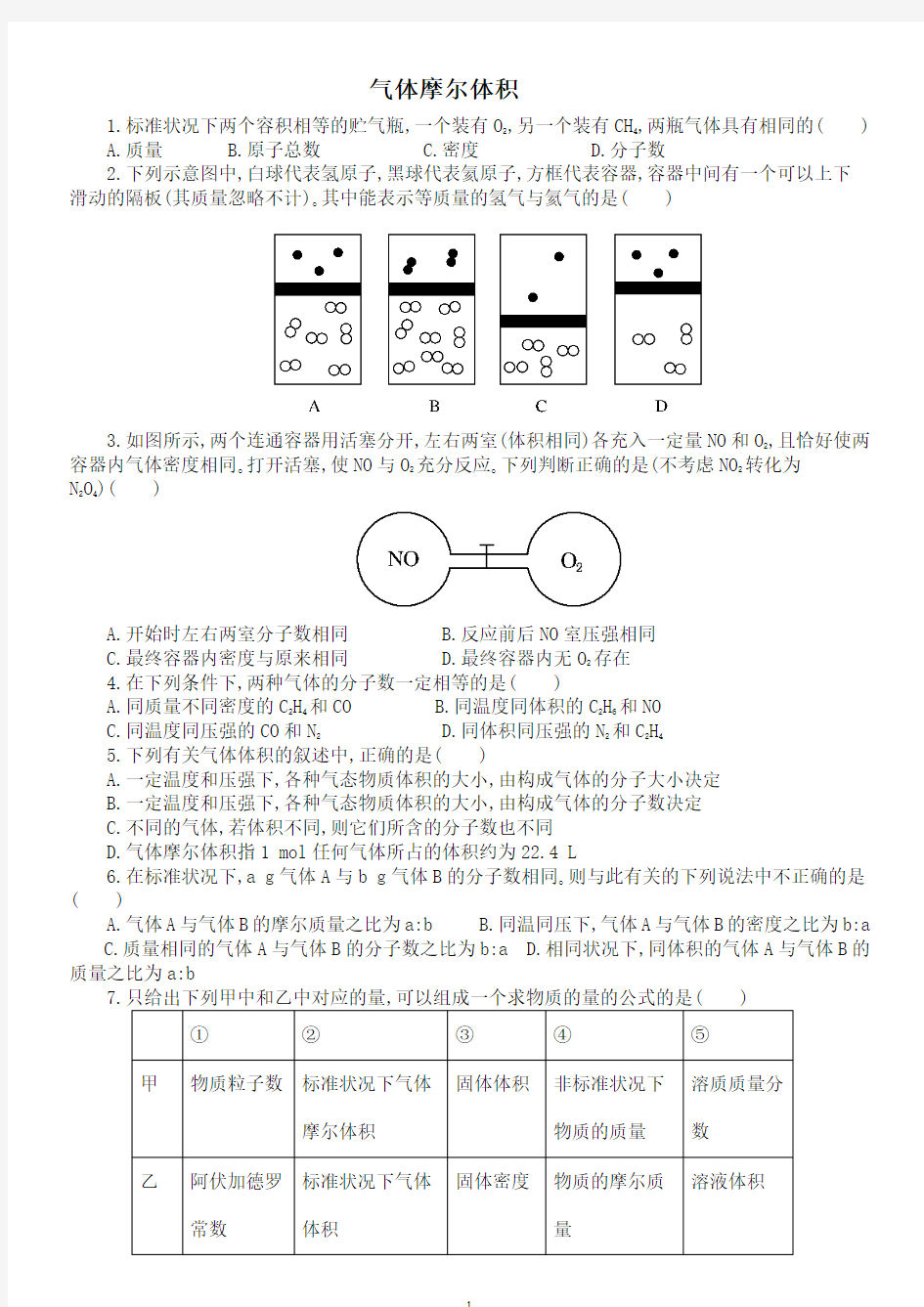
2.下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计)?其中能表示等质量的氢气与氦气的是
( )
3.如图所示,两个连通容器用活塞分开,左右两室(体积相同)各充入一定量NO 和O 2,且恰好使两容器内气体密度相同?打开活塞,使NO 与O 2充分反应?下列判断正确的是(不考虑NO 2转化为N 2O 4
)( )
A.开始时左右两室分子数相同
B.反应前后NO 室压强相同
C.最终容器内密度与原来相同
D.最终容器内无O 2存在 4.在下列条件下,两种气体的分子数一定相等的是( )
A.同质量不同密度的C 2H 4和CO
B.同温度同体积的C 2H 6和NO
C.同温度同压强的CO 和N 2
D.同体积同压强的N 2和C 2H 4 5.下列有关气体体积的叙述中,正确的是( )
A.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子大小决定
B.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子数决定
C.不同的气体,若体积不同,则它们所含的分子数也不同
D.气体摩尔体积指1 mol 任何气体所占的体积约为22.4 L
6.在标准状况下,a g 气体A 与b g 气体B 的分子数相同?则与此有关的下列说法中不正确的是( )
A.气体A 与气体B 的摩尔质量之比为a:b
B.同温同压下,气体A 与气体B 的密度之比为b:a
C.质量相同的气体A 与气体B 的分子数之比为b:a
D.相同状况下,同体积的气体A 与气体B 的质量之比为a:b
7.
A.①②
B.①②③
C.①②④
D.①②⑤
8.(2010·全国卷Ⅱ)在一定的温度?压强下,向100 mL CH 4和Ar 的混合气体中通入400 mL O 2,点燃使其完全反应,最后在相同条件下得到干燥气体460 mL,则反应前混合气体中CH 4和Ar 的物质的量之比为( )
A.1:4
B.1:3
C.1:2
D.1:1 9.(2010·全国卷Ⅰ)一定条件下磷与干燥氯气反应,若0.25 g 磷消耗掉314 mL 氯气(标准状况),则产物中PCl 3与PCl 5的物质的量之比接近于( )
A.3:1
B.5:3
C.2:3
D.1:2
10.(2010·福建卷)N A 表示阿伏加德罗常数,下列判断正确的是( ) A.在18 g 18O 2中含有N A 个氧原子 B.标准状况下,22.4 L 空气含有N A 个单质分子 C.1 mol Cl 2参加反应转移电子数一定为2N A
D.含N A 个Na +的Na 2O 溶解于1 L 水中,Na +的物质的量浓度为1 mol\5L -1 11.(2010·上海卷)N A 表示阿伏加德罗常数,下列叙述正确的是( )
A.等物质的量的N 2和CO 所含分子数均为N A
B.1.7 g H 2O 2中含有的电子数为0.9 N A
C.1 mol Na 2O 2固体中含离子总数为4 N A
D.标准状况下,2.24 L 戊烷所含分子数为0.1 N A 12.(2010·江苏卷)设N A 为阿伏加德罗常数的值,下列叙述正确的是( ) A.常温下,1 L 0.1 mol\5L -1的NH 4NO 3溶液中氮原子数为0.2 N A B.1 mol 羟基中电子数为10 N A
C.在反应KIO 3+6HI =KI+3I 2+3H 2O 中,每生成3 mol I 2转移的电子数为6N A
D.常温常压下,22.4 L 乙烯中C —H 键数为4 N A
13.在标准状况下,由CO 和CO 2组成的混合气体6.72 L,质量为12 g ?此混合物中CO 和CO 2物质的量比是________,CO 的体积分数是________,CO 的质量分数是________,C 和O 原子个数比是________,混合气体的平均相对分子质量是________,对氢气的相对密度是________?
14.(1)在标准状况下,8.96 L 的甲烷和一氧化碳的混合气体的质量为7.6 g,混合气体平均摩尔质量为________,混合气体中的甲烷的体积为________,一氧化碳的质量为________?
(2)上述混合气体与标准状况下16.8 L 的氧气混合点燃完全反应后,冷却至标准状况,反应后混合气体的平均摩尔质量为________?
15.某气体的摩尔质量是M g\5mol -1,分子数为X,在标准状况下所占的体积是V L,质量为m g ?某元素原子的摩尔质量是A g\5mol -1,原子个数是Y ?阿伏加德罗常数为N A ,试说明下列各式表示的意义?
(1)A M N ____________________ ? (2)A
Y N ____________________ ?(3)
m
V
____________________ ? (4) m M ____________________ ?(5)A
MX VN ____________________ ?
1. 解析:本题需要联系化学基本原理和基本概念?阿伏加德罗定律?物质的量与微粒数目?气体体积之间的关系等方面分析,较易?相同条件下,体积之比等于物质的量之比等于所构成物质的分子数之比,因为体积相等,所以分子数?物质的量都相等,但是构成分子的原子数目不同,一个氧分子由2个原子构成,一个甲烷分子由5个原子构成,所以构成的原子总数不同;根据公式m=nM,两者的摩尔质量不等,所以质量也不相等;根据密度公式ρ=m/V,两者的质量不同,体积相等,所以密度不同? 答案:D
2. 解析:等质量的He 与氢气的物质的量之比为1:2,则H 2的体积是He 的2倍,H 2的分子个数是He 的2倍,且氢气为双原子分子,而He 为单原子分子? 答案:A
3. 解析:由左右两室体积相同,两容器内气体密度相同可知,两容器中气体的质量一定相等,而NO 和O 2的摩尔质量不相等,故其物质的量不相等,开始时左右两室分子数不相同,故A 错误?由于反应前后NO 室的气体物质的量要减小,故压强要减小,B 错误?由于NO 与O 2反应,O 2过量,故最终容器内有O 2存在,D 错误? 答案:C
4. 解析:C 2H 4和CO 的相对分子质量相等,同质量的两种气体的物质的量相等,即分子数相等,A 正确;B 项未指明压强,故错误;C 项未指明体积关系,故错误;D 项未指明温度,故错误? 答案:A
5. 解析:由于气体分子间距离很大,分子本身的大小可以忽略,一定温度和压强下,气态物质体积的大小,由构成气体的分子数决定,故A 错,B 正确;C 项没有指明条件,故错误;气体摩尔体积在不同条件下数值也不同,D 项错? 答案:B
6. 解析:对于分子数相同的气体,其摩尔质量之比等于质量之比,A ?D 对;同温同压下,A 与B 的密度之比应等于其摩尔质量之比a:b,B 项错;质量相同的气体的分子数之比等于摩尔质量的反比,C 项对? 答案:B
7. 解析:①中A
N n N =
正确;②m
V n V =
也正确;③中由固体的ρ和V 只能求得固体的质量;④中m n M
=
正确;⑤由w 和V(aq)无法
求n.因为n=cV(aq)? 答案:C
8. 解析:本题考查混合气体计算,意在考查考生的计算能力?根据CH 4+2O 2=CO 2+2H 2O,利用差量法,1 mL CH 4完全燃烧生成干燥的CO 2时,混合气体体积缩小2 mL,现混合气体缩小了40 mL,则CH 4为20 mL,Ar 为80 mL ?答案:A
9. 解析:本题考查化学计算,意在考查考生对化学计算基本方法的应用能力?0.25 g 磷的物质的量为
0.250.008,31/g
mol g mol
=标
准状况下314 mL 氯气的物质的量为
0.3140.014,22.4/L
mol L mol
=则n(P):n(Cl)=0.008:(0.014×2)=2:7,设PCl 3
?PCl 5
的物质的量
分别为x,y,则(x+y):(3x+5y)=2:7,x:y=3:1,A 项正确? 答案:A
10. 解析:本题考查阿伏加德罗常数,意在考查考生对物质的量与物质结构?元素化合物等相结合的计算能力?18 g 18
O 2所含氧原子数为
18
2,36
A A N N ??=A 项正确;空气由N 2
?O 2
?CO 2
?惰性气体等组成,由于空气中含有CO 2
等非单质物质,因此标准状况下22.4 L 空气中所含单质分子的数目小于N A ,B 项错误;氯气与水?NaOH 溶液的反应中,氯气既作氧化剂又作还原剂,1 mol Cl 2参加反应转移电子数为N A ,C 项错误;含N A 个Na +
的Na 2O 溶解于1 L 水中,溶液的体积不是1 L,则Na +
的物质的量浓度不是1 mol ·L -1
,D 项错误? 答案:A 11.解析:本题考查阿伏加德罗常数,意在考查考生对物质结构的分析能力和对阿伏加德罗常数的计算能力?等物质的量的N 2和CO 所含分子数相同,只有二者均为1 mol 时,所含分子数才为N A ,A 项错误;1个H 2O 2中含有电子数为1×2+8×2=18,故1.7 g H 2O 2中含有的电子数为
1.7
34
×18×N A =0.9 N A ,B 项正确;1 mol Na 2O 2中含有2 mol Na +和1 mol O 2-2,离子总数为3 N A ,C 项错误;标准状况下戊烷为液体,2.24 L 戊烷的物质的量不为0.1 mol,所含分子数不为0.1 N A ,D 项错误? 答案:B
12.解析:本题考查阿伏加德罗常数知识,意在考查考生的综合计算能力?A 项,正确;B 项,1 mol 羟基中的电子数为9 N A ,不正确;C 项,每生成3 mol I 2,转移的电子数为5 N A ,不正确;D 项,常温常压下,22.4 L 乙烯中C —H 键数小于4 N A ,不正确? 答案:A
13解析:根据题意列方程组为21
112
6.72()()0.322.428()44()12L n CO n CO mol L mol
g mol n CO g mol n CO g ---?
+==????+?=? 解之得:n(CO)=0.075 mol,n(CO 2
)=0.225 mol,则:
2()0.0751
?()0.2253
n CO mol n CO mol == CO 的体积分数等于CO 的物质的量分数,即
113+×100%=25% 128
()128344
w CO ?=
?+?×100%=17.5%, n(C):n(O)=(1+3):(1+3×2)=4:7,
1(128344)40,(13)g M g mol mol -?+?=
=+ 即平均相对分子质量为40?对氢气的相对密度240
20()2
M D M H ===。
答案:1:3 25% 17.5% 4:7 40 20
14解析:(1)标准状况下,8.96 L 混合气体的物质的量为0.4 mol,所以混合气体的平均摩尔质量为
7.619/;0.4g
g mol mol
=
44()()0.4,()16/()28/7.6n CH n CO mol
n CH g mol n CO g mol g
+=??
?+?=? 解得n(CH 4)=0.3 mol,n(CO)=0.1 mol, 所以V(CH 4)=6.72 L,m(CO)=2.8 g ? (2)根据反应的化学方程式4
2222CH 2O CO 2H O,2CO O +???→++点燃
点燃
2CO 2,推知0.3 mol CH 4和0.1 mol
CO 在16.8 L O 2(0.75 mol)中能完全燃烧生成0.4 mol CO 2,剩余0.1 mol O 2,因此反应后混合气体的平均摩尔质量
为:
0.444/0.132/41.6/0.40.1mol g mol mol g mol
g mol mol mol
?+?=+。
答案:(1)19 g/mol 6.72 L 2.8 g (2)41.6 g/mol
15答案:(1)一个气体分子的质量 (2)原子的物质的量 (3)气体的密度(4)气体的物质的量(5)气体的密度
物质的量气体摩尔体积练习题及答案
物质的量气体摩尔体积 练习题及答案 Document number:PBGCG-0857-BTDO-0089-PTT1998
1.下列关于物质的量和摩尔质量的叙述,正确的是() A.水的摩尔质量是18 g B.0.012 kg 12C中含有×1023个碳原子 C.1 mol水中含有2 mol氢和1 mol氧 D.1 mol任何物质都含有×1023个分子 解析:选B。A选项,摩尔质量的单位是g·mol-1,A选项错误;B选项,碳是由原子构成的,根据规定,0.012 kg 12C中所含的碳原子数即为阿伏加德罗常数,近似为×1023mol-1,B选项正确;在使用“摩尔”作为物质的量的单位时,应该用化学式指明粒子的种类,而不使用该粒子的中文名称,而且选项C中表示水的组成时,氢、氧的含义也不具体,C选项错误;D选项,构成物质的基本粒子有分子、原子和离子,并非任何物质都是由分子构成的,D 选项错误。 2.下列关于阿伏加德罗常数的说法中正确的是() A.×1023叫做阿伏加德罗常数 B.12 g碳-12含有的碳原子数就是阿伏加德罗常数 C.含有阿伏加德罗常数个微粒的物质是1摩尔 D.1摩尔氯含有×1023个氯分子 解析:选BC。摩尔的基准是0.012 kg 12C所含碳原子数,每摩尔物质含有阿伏加德罗常数个微粒。阿伏加德罗常数为×1023mol-1,而不是×1023。用摩尔来表示粒子时应指明具体微粒。如1 mol Fe、1 mol H+、1 mol e-等,不能说1摩尔氯。 3.(2010年南充高一检测)在标准状况下,与12 g H2的体积相等的N2的() A.质量为12 g B.物质的量为6 mol C.体积为22.4 L D.物质的量为12 mol 解析:选B。12 g H2的物质的量为6 mol,因二者体积相等,所
高中化学气体摩尔体积的练习题和答案
高中化学气体摩尔体积的练习题和答案 一、选择题(本题包括8小题,每小题6分,共48分) 1.(2010南充高一检测)在标准状况下,与12 g H2的体积相等的N2的( ) A.质量为12 g B.物质的量为6 mol C.体积为22.4 L D.物质的量为12 mol 解析:n(H2)=12 g2 g/mol=6 mol,则标准状况下n(N2)也应为6 mol,6 mol N2的质量为6 mol×28 g/mol=168 g,在标准状况下的体积为6×22.4 L. 答案:B 2.(2011广东韶关市高一检测)NA代表阿伏加德罗常数,下列说法正确的是( ) A.在同温同压下,相同体积的任何气体单质所含的分子数目相同 B.17 g氨气所含电子数目为10NA C.在常温常压下,11.2 L氮气所含的原子数目为NA D.2 g氢气所含原子数目为NA 解析:在同温同压下,相同体积的任何气体单质所含的分子数目相同,故A 正确;在标准状况下,11.2 L氮气所含的原子数目为NA,常温常压下,气体摩尔体积增大,所含的原子数目小于NA,故C不正确;2 g氢气所含原子数目为2NA,故D不正确. 答案:AB 3.(2011徐州师大附中检测)用NA表示阿伏加德罗常数的值,下列叙述正确的是( ) A.含有NA个氦原子的氦气在标准状况下的体积约为11.2 L B.25℃,1.01×105 Pa,64 g SO2中含有的原子数为3NA C.在常温常压下,11.2 L Cl2含有的分子数为0.5 NA
D.标准状况下,11.2 L H2O含有的分子数为0.5 NA 解析:A项,He为单原子分子,NA个He在标准状况下的体积均为22.4 L.B 项,64 g SO2的物质的量为1 mol,原子数为3 NA,与气体所处状况无关,B项正确.C项条件应为标准状况,D项,标准状况下,H2O不是气体. 答案:B[ 4.(2010曲靖高一检测)标准状况下,下列物质占体积的是( ) A.98 g H2SO4 B.6.02×1023个CO2 C.44.8 L HCl D.6 g H2 解析:A中H2SO4为液态,体积较小;B中n(CO2)=1 mol,体积为22.4 L;D 中n(H2)=3 mol,体积为3×22.4 L. 答案:D 5.(2011运城高一检测)常温常压下,用等质量的CH4、CO2、O2、SO2分别吹出四个气球,其中气体为CH4的是( ) 解析:等质量时,摩尔质量最小的CH4的物质的量,同温同压下气体体积. 答案:D 6.(2010芜湖高一检测)如图两瓶体积相等的气体,在同温同压时瓶内气体的关系一定正确的是( ) A.所含原子数相等 B.气体密度相等 C.气体质量相等 D.摩尔质量相等 解析:同温同压时,体积相等的两气体,具有相同的分子数,因为都是双原子分子,故所含原子数相等,由于N2和O2的比例不固定,故两瓶气体的质量不一定相等,密度和摩尔质量也不一定相等. 答案:A 7.如果a g某气体中含有该气体的分子数为b,则c g该气体在标准状况下的
高一化学气体摩尔体积练习题及答案A
一、气体摩尔体积 〔引入〕前面我们学习了物质的量的有关知识,请同学们回忆物质的量与质量、粒子数目之间有什么关系?物质的量是怎样把宏观质量与微观粒子数联系起来的? 〔思考〕 1. 物质的量(n )、微粒数(N )和阿伏加德罗常数(N A )之间有什么关系? 2. 物质的量(n )、质量(m )和摩尔质量(M )之间有什么关系? (学生回答) 〔展示〕 粒子数 宏观 微观 体积 粒子数 〔讨论+计算〕在0℃、1.01×105 Pa 时1mol 下列物质的体积为多少? 〔讨论〕由体积数据结合物质状态可得出什么结论? 结论: 1. 在相同条件下,1mol 气体所占的体积比1mol 固体或液体所占的体积大得多 2. 在相同条件下,1mol 固体或液体的体积各不相同,而1mol 气体的体积却几乎完全相同 〔思考〕从微观角度分析,物质的体积由哪些因素决定? (一)决定物质的体积(V )的微观因素: 1. 粒子数目 2. 粒子大小 3. 粒子间距离
〔思考〕1. 固体、液体体积的主要决定因素有哪些? 粒子数目 固、液体体积 粒子大小 取决于 〔思考〕2. 气体体积的主要决定因素有哪些? [实验启示]气体分子间的平均距离要比固体和液体中粒子之间的平均距离大得多。 粒子数目 气体体积 粒子间平均距离(d) 取决于 〔思考〕分子间的平均距离受哪些条件影响?是怎样影响的? 〔讨论〕为什么在标准状况下1mol任何气体所占的体积都相同呢?其他的相同条件下,1mol 任何气体所占的体积是否都相同呢? (二)气体摩尔体积 定义:单位物质的量的气体所占的体积。 符号:V m 单位:L/mol或m3/mol等 公式:n V V m 对象:任何气体(纯净或混合气体) 标准状况:温度:0℃、压强1.01×105Pa 标准状况:Vm约22.4L/mol 思考:1mol气体在任何状况下所占的体积是不是都相等? 是不是都约为22 .4L? 几点注意: 1、状态:气体 2、状况:一定温度和压强下,一般指标准状况 3、定量:1mol
求动点的轨迹方程方法例题习题答案
求动点的轨迹方程(例题,习题与答案) 在中学数学教学和高考数学考试中,求动点轨迹的方程和曲线的方程是一个难 点和重点内容(求轨迹方程和求曲线方程的区别主要在于:求轨迹方程时,题目中 没有直接告知轨迹的形状类型;而求曲线的方程时,题目中明确告知动点轨迹的形 状类型)。求动点轨迹方程的常用方法有:直接法、定义法、相关点法、参数法与 交轨法等;求曲线的方程常用“待定系数法”。 求动点轨迹的常用方法 动点P 的轨迹方程是指点P 的坐标(x, y )满足的关系式。 1. 直接法 (1)依题意,列出动点满足的几何等量关系; (2)将几何等量关系转化为点的坐标满足的代数方程。 例题 已知直角坐标平面上点Q (2,0)和圆C :122=+y x ,动点M 到圆C 的切线长等与MQ ,求动点M 的轨迹方程,说明它表示什么曲线. 解:设动点M(x,y),直线MN 切圆C 于N 。 依题意:MN MQ =,即22MN MQ = 而222NO MO MN -=,所以 (x-2)2+y 2=x 2+y 2-1 化简得:x=45 。动点M 的轨迹是一条直线。 2. 定义法 分析图形的几何性质得出动点所满足的几何条件,由动点满足的几何条件可以判断出动点 的轨迹满足圆(或椭圆、双曲线、抛物线)的定义。依题意求出曲线的相关参数,进一步写出 轨迹方程。 例题:动圆M 过定点P (-4,0),且与圆C :082 2=-+x y x 相切,求动圆圆心M 的轨迹 方程。 解:设M(x,y),动圆M的半径为r 。 若圆M 与圆C 相外切,则有 ∣M C ∣=r +4 若圆M 与圆C 相内切,则有 ∣M C ∣=r-4 而∣M P ∣=r, 所以 ∣M C ∣-∣M P ∣=±4 动点M 到两定点P(-4,0),C(4,0)的距离差的绝对值为4,所以动点M 的轨迹为双曲线。其中a=2, c=4。 动点的轨迹方程为: 3. 相关点法 若动点P(x ,y)随已知曲线上的点Q(x 0,y 0)的变动而变动,且x 0、y 0可用x 、y 表示,则 将Q 点坐标表达式代入已知曲线方程,即得点P 的轨迹方程。这种方法称为相关点法。
动点例题解析及答案
初中数学动点问题及练习题附参考答案 所谓“动点型问题”是指题设图形中存在一个或多个动点,它们在线段、射线或弧线上运动的一类开放性题目.解决这类问题的关键是动中求静,灵活运用有关数学知识解决问题. 关键:动中求静. 数学思想:分类思想函数思想方程思想数形结合思想转化思想 注重对几何图形运动变化能力的考查。 从变换的角度和运动变化来研究三角形、四边形、函数图像等图形,通过“对称、动点的运动”等研究手段和方法,来探索与发现图形性质及图形变化,在解题过程中渗透空间观念和合情推理。选择基本的几何图形,让学生经历探索的过程,以能力立意,考查学生的自主探究能力,促进培养学生解决问题的能力.图形在动点的运动过程中观察图形的变化情况,需要理解图形在不同位置的情况,才能做好计算推理的过程。在变化中找到不变的性质是解决数学“动点”探究题的基本思路,这也是动态几何数学问题中最核心的数学本质。 二期课改后数学卷中的数学压轴性题正逐步转向数形结合、动态几何、动手操作、实验探究等方向发展.这些压轴题题型繁多、题意创新,目的是考察学生的分析问题、解决问题的能力,内容包括空间观念、应用意识、推理能力等.从数学思想的层面上讲:(1)运动观点;(2)方程思想;(3)数形结合思想;(4)分类思想;(5)转化思想等.研究历年来各区的压轴性试题,就能找到今年中考数学试题的热点的形成和命题的动向,它有利于我们教师在教学中研究对策,把握方向.只的这样,才能更好的培养学生解题素养,在素质教育的背景下更明确地体现课程标准的导向.本文拟就压轴题的题型背景和区分度测量点的存在性和区分度小题处理手法提出自己的观点. 专题一:建立动点问题的函数解析式 函数揭示了运动变化过程中量与量之间的变化规律,是初中数学的重要内容.动点问题反映的是一种函数思想,由于某一个点或某图形的有条件地运动变化,引起未知量与已知量间的一种变化关系,这种变化关系就是动点问题中的函数关系.那么,我们怎样建立这种函数解析式呢?下面结合中考试题举例分析. 一、应用勾股定理建立函数解析式。 二、应用比例式建立函数解析式。 三、应用求图形面积的方法建立函数关系式。 专题二:动态几何型压轴题 动态几何特点----问题背景是特殊图形,考查问题也是特殊图形,所以要把握好一般与特殊的关系;分析过程中,特别要关注图形的特性(特殊角、特殊图形的性质、图形的特殊位置。)动点问题一直是中考热点,近几年考查探究运动中的特殊性:等腰三角形、直角三角形、相似三角形、平行四边形、梯形、特殊角或其三角函数、线段或面积的最值。下面就此问题的常见题型作简单介绍,解题方法、关键给以点拨。 一、以动态几何为主线的压轴题。 (一)点动问题。(二)线动问题。(三)面动问题。 二、解决动态几何问题的常见方法有: 1、特殊探路,一般推证。 2、动手实践,操作确认。 3、建立联系,计算说明。
物质的量 气体摩尔体积练习题及答案
1.下列关于物质的量和摩尔质量的叙述,正确的是( ) A.水的摩尔质量是18 g B.0.012 kg 12C中含有×1023个碳原子 C.1 mol水中含有2 mol氢和1 mol氧 D.1 mol任何物质都含有×1023个分子 解析:选B。A选项,摩尔质量的单位是g·mol-1,A选项错误;B选项,碳是由原子构成的,根据规定,0.012 kg 12C中所含的碳原子数即为阿伏加德罗常数,近似为×1023mol-1,B选项正确;在使用“摩尔”作为物质的量的单位时,应该用化学式指明粒子的种类,而不使用该粒子的中文名称,而且选项C中表示水的组成时,氢、氧的含义也不具体,C选项错误;D选项,构成物质的基本粒子有分子、原子和离子,并非任何物质都是由分子构成的,D选项错误。 2.下列关于阿伏加德罗常数的说法中正确的是( ) A.×1023叫做阿伏加德罗常数 B.12 g碳-12含有的碳原子数就是阿伏加德罗常数 C.含有阿伏加德罗常数个微粒的物质是1摩尔 D.1摩尔氯含有×1023个氯分子 解析:选BC。摩尔的基准是0.012 kg 12C所含碳原子数,每摩尔物质含有阿伏加德罗常数个微粒。阿伏加德罗常数为×1023 mol-1,而不是×1023。用摩尔来表示粒子时应指明具体微粒。如1 mol Fe、1 mol H+、1 mol e-等,不能说1摩尔氯。 3.(2010年南充高一检测)在标准状况下,与12 g H2的体积相等的N2的( ) A.质量为12 g B.物质的量为6 mol
C .体积为22.4 L D .物质的量为12 mol 解析:选B 。12 g H 2的物质的量为6 mol ,因二者体积相等,所 以N 2的物质的量也为6 mol ,B 正确,N 2的质量为:28 g/mol×6 mol =168 g ,A 错误;体积为22.4 L/mol×6 mol=134.4 L ,C 错误。 4.下列说法中,正确的是( ) A .气体的摩尔体积为22.4 L·mol -1 B .1 mol H 2的质量是2 g ,它所占的体积是22.4 L C .在标准状况下,1 mol 任何气体所占的体积都为22.4 L·mol -1 D .在标准状况下,1 mol 任何气体所占的体积都约为22.4 L 解析:选D 。A 项、B 项气体的体积只有在标准状况下才正确;C 项,体积的单位为L 。 5.两个体积相同的容器,一个盛有NO ,另一个盛有N 2和O 2,在同温、同压下,两容器内的气体一定具有相同的( ) A .原子总数 B .质子总数 C .分子总数 D .质量 解析:选AC 。根据阿伏加德罗定律可知两种气体具有相同的分子数,又因为都是双原子分子,原子总数也相同。 6.一定量的液态化合物XY 2,在一定量O 2中恰好完全反应:XY 2(l)+3O 2(g)===XO 2(g)+2YO 2(g),冷却后在标准状况下,测得生成物的体 积为672 mL ,密度为2.56 g·L -1,则 (1)反应前O 2的体积为________。 (2)化合物XY 2的摩尔质量是________。 (3)在XY 2分子中,X 、Y 两元素质量比为3∶16,则X 、Y 两元素 分别为________和________(写元素名称)。 解析:(1)由题中方程式:XY 2(l)+3O 2(g)===XO 2(g)+2YO 2(g)可 知,该反应是反应前后气体分子数不变的反应,即反应前后气体体积相同。因反应物中的XY 2为液态,故反应前O 2的体积为672 mL 。 n (O 2)=672×10-3 L L·m ol -1 = mol 。 (2)因XY 2与O 2恰好完全反应,且它们的物质的量比为1∶3(由方 程式知),故XY 2的物质的量为 mol 。又因反应后的气体体积为672 mL , 密度为2.56 g·L -1,则反应后气体总质量为:m =ρV =2.56 g·L -1×672×10-3 L =1.72 g ,根据质量守恒定律: m (XY 2)=1.72 g -m (O 2) =1.72 g - mol×32 g·mol -1=0.76 g , M (XY 2)=错误!=76 g·mol -1。
动点问题中的最值、最短路径问题(解析版)
专题01 动点问题中的最值、最短路径问题 动点问题是初中数学阶段的难点,它贯穿于整个初中数学,自数轴起始,至几何图形的存在性、几何 图形的长度及面积的最值,函数的综合类题目,无不包含其中. 其中尤以几何图形的长度及面积的最值、最短路径问题的求解最为繁琐且灵活多变,而其中又有一些 技巧性很强的数学思想(转化思想),本专题以几个基本的知识点为经,以历年来中考真题为纬,由浅入深探讨此类题目的求解技巧及方法. 一、基础知识点综述 1. 两点之间,线段最短; 2. 垂线段最短; 3. 若A 、B 是平面直角坐标系内两定点,P 是某直线上一动点,当P 、A 、B 在一条直线上时,PA PB 最大,最大值为线段AB 的长(如下图所示); (1)单动点模型 作图方法:作已知点关于动点所在直线的对称点,连接成线段与动点所在直线的交点即为所求点的位 置. 如下图所示,P 是x 轴上一动点,求PA +PB 的最小值的作图.
(2)双动点模型 P 是∠AOB 内一点,M 、N 分别是边OA 、OB 上动点,求作△PMN 周长最小值. 作图方法:作已知点P 关于动点所在直线OA 、OB 的对称点P ’、P ’’,连接P ’P ’’与动点所在直线的交点 M 、N 即为所求. O B P P' P''M N 5. 二次函数的最大(小)值 ()2 y a x h k =-+,当a >0时,y 有最小值k ;当a <0时,y 有最大值k . 二、主要思想方法 利用勾股定理、三角函数、相似性质等转化为以上基本图形解答. (详见精品例题解析) 三、精品例题解析 例1. (2019·凉山州)如图,正方形ABCD 中,AB =12,AE =3,点P 在BC 上运动(不与B 、C 重合),过点P 作PQ ⊥EP ,交CD 于点Q ,则CQ 的最大值为 例2. (2019·凉山州)如图,已知A 、B 两点的坐标分别为(8,0),(0,8). 点C 、F 分别是直线x =-5 和x 轴上的动点,CF =10,点D 是线段CF 的中点,连接AD 交y 轴于点E ,当△ABE 面积取最小值时,tan ∠BAD =( )
人教版高中化学必修一 第二章 第三节 第2课时气体摩尔体积 同步测试(解析版)
人教版高中化学必修一第二章第三节第2课时气体摩尔体积1.下列关于决定物质体积的因素的说法不正确的是( ) A.物质的体积取决于粒子数目、粒子大小和粒子间距 B.相同条件下,粒子数相同的任何气体都具有相同的体积 C.同温同压下,1 mol任何物质所占有的体积均相同 D.等质量的H2,压强越小、温度越高,气体所占体积越大 2.标准状况下,下列物质所占体积最大的是( ) A.196 g H2SO4 B.1 mol CO2 C.44.8 L HCl D.6 g H2 3.设N A表示阿伏加德罗常数的值,下列说法正确的是( ) A.标准状况下,4.48 L水中分子的数目为0.2N A B.标准状况下,1.12 L氨气中氢原子的数目为0.05N A C.常温常压下,16 g O2和O3的混合气体中氧原子的数目为N A。 D.常温常压下,0.3 mol N2和0.7 mol O2混合气体总体积约为22.4 L 4.下列各物质中所含原子个数由多到少的顺序正确的是( ) ①0.3 mol NH3②标准状况下22.4 L氯气 ③9 mL H2O(4℃) ④0.2 mol H3PO4。 A.①④③② B.④③②① C.②④③① D.①④②③ 5.如果a g某气体中含有的分子数为b,则cg该气体在标准状况下的体积是(设N A 为阿伏加德罗常数的值)( ) A.L aN A bc 4. 22 B. L cN A ab 4. 22 C. L bN A ac 4. 22 D. L acN A b4. 22 6.某双原子分子构成的气体,其摩尔质量为M g.moIˉ1, 该气体的质量为mg,阿伏加德罗常数的值为N A,则: (1)该气体在标准状况下的体积为_______________L; (2)该气体在标准状况下的密度为________g·Lˉ1; (3)该气体所含的原子总数为________个; (4)该气体的一个分子的质量为____g。 7.通过下列条件,无法确定该物质摩尔质量的是( ) A.物质标准状况下的体积和质量 B.该物质一个分子的真实质量
气体摩尔体积习题及答案详解
气体摩尔体积 1.四种因素:①温度和压强②所含微粒数③微粒本身大小④微粒间的距离,其中对气态物质体积有显着影响的是 ( ) A.②③④ B.②④ C.①③④ D.①②④ 2.下列有关气体体积的叙述中,正确的是 ( ) A.一定温度和压强下,各种气态物质体积的大小由构成气体的分子大小决定 B.一定温度和压强下,各种气态物质体积的大小由构成气体的质量大小决定 C.不同的气体,若体积不同,则它们所含的分子数也不同 D.一定的温度和压强下,各种气体的物质的量决定它们的体积 3.当温度和压强一定时,决定气体体积大小的主要因素是( ) A.分子直径的大小B.分子间距离的大小 C.分子间引力的大小D.分子数目的多少 4.在标准状况下,与12 g H 2的体积相等的N 2 ( ) A.质量为12 g B.物质的量为6 mol C.体积为22.4 L
D.分子数为6.02×1023 5.如果a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是(式中N A为阿伏加德罗常数的值)( ) A.22.4ab cN A L B. 22.4bc aN A L C.22.4ac bN A L D. 22.4b acN A L 6.在标准状况下,由0.5 g H 2、11 g CO 2 和4 g O 2 组成的混合气体,其体积约为( ) A.8.4 L B.11.2 L C.14.0 L D.16.8 L 7.同温同压下,用等质量的CH 4、CO 2 、O 2 、SO 2 四种气体分别吹出四个气球,其中气体为CH 4 的是 ( ) 8.在一定条件下,1体积气体A 2和3体积气体B 2 完全反应生成了2体积气体X(体积在相 同条件下测定),则X的化学式是 ( ) A.AB 2B.A 2 B 3 C.AB 3D.AB 2 9.在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是 ( ) A.甲的分子数比乙的分子数多
圆的动点问题--经典习题及答案
圆的动点问题 25.(本题满分14分,第(1)小题4分,第(2)小题5分,第(3)小题5分) 已知:在Rt ABC △中,∠ACB =90°,BC =6,AC =8,过点A 作直线MN ⊥AC ,点E 是直线 MN 上的一个动点, (1)如图1,如果点E 是射线AM 上的一个动点(不与点A 重合),联结CE 交AB 于点P .若 AE 为x ,AP 为y ,求y 关于x 的函数解析式,并写出它的定义域; (2) 在射线AM 上是否存在一点E ,使以点E 、A 、P 组成的三角形与△ABC 相似,若存在求 AE 的长,若不存在,请说明理由; (3)如图2,过点B 作BD ⊥MN ,垂足为D ,以点C 为圆心,若以AC 为半径的⊙C 与以ED 为半径的⊙E 相切,求⊙E 的半径. A B C P E M 第25题图1 D A B C M 第25题图2 N
25.(本题满分14分,第(1)小题6分,第(2)小题2分,第(3)小题6分) 在半径为4的⊙O 中,点C 是以AB 为直径的半圆的中点,OD ⊥AC ,垂足为D ,点E 是射线AB 上的任意一点,DF //AB ,DF 与CE 相交于点F ,设EF =x ,DF =y . (1) 如图1,当点E 在射线OB 上时,求y 关于x 的函数解析式,并写出函数定义域; (2) 如图2,当点F 在⊙O 上时,求线段DF 的长; (3) 如果以点E 为圆心、EF 为半径的圆与⊙O 相切,求线段DF 的长. A B E F C D O A B E F C D O
25.如图,在半径为5的⊙O中,点A、B在⊙O上,∠AOB=90°,点C是弧AB上的一个动点,AC与OB的延长线相交于点D,设AC=x,BD=y. (1)求y关于x的函数解析式,并写出它的定义域; (2)如果⊙O1与⊙O相交于点A、C,且⊙O1与⊙O的圆心距为2,当BD=OB时,求⊙O1 的半径; (3)是否存在点C,使得△DCB∽△DOC?如果存在,请证明;如果不存在,请简要说明理由.
高一化学气体摩尔体积练习题及答案
气体摩尔体积 概念巩固 一.摩尔体积 1. 定义: 符号:单位: 数学表达式: 适用范围: 物质的体积,指一定量的物质在一定条件下所占据空间的大小。 从微观的角度去分析,物质的体积的大小决定因素有: ① 物质的体积的大小② ③ 由上述可知气体的摩尔体积只与和。 理解上述概念,注意以下要点: (1)标准状况:指0℃、1.01×105 Pa的状态。 (2)“单位物质的量的气体”即“1mol任何气体”。 (3)1mol任何气体的体积在标准状况下都约为22.4L,在非标准状况下,其体积也可能为22.4L,可能不为22.4L。 (一). 选择题: 1. 下列物质在常温、常压下,各取0.1mol,其体积最大的是() A. 原子半径为0.152nm的金属锂 B. 原子半径为0.227nm的金属钾 C. 原子半径为0.158nm的硫原子 D. 原子半径为0.128nm的金属铜 2. 决定一定量气体的体积大小和主要因素是() A. 气体分子的大小 B. 气体分子的相对分子质量 C. 气体分子间的平均距离 D. 气体分子的数目 3. 标准状况下,若两种气体所占的体积不同,其原因是() A. 气体性质不同 B. 气体分子的大小不同 C. 气体分子间平均距离不同 D. 气体的物质的量不同 (二). 判断正误: 1. 温度为0℃,压强为505kPa时,CO2的气体摩尔体积为2 2.4L/mol () 2. 标准状况下,一定量的任何气体体积都约为22.4L () 3. 标准状况下,1molH2O的体积约为22.4L() 4. 当温度高于0℃时,1mol任何气体体积都大于22.4L()
5. 相同条件下,1molCO 和1molCO 2所含分子数相同,体积也相同 ( ) (三)、有关气体摩尔体积的计算: 例题1:在标准状况下,3.2gSO 2的体积是多少? 例题2:在标准状况下,测得0.88g 某气体的体积为448mL.计算此气体的相对分子质量。 例题3:标况下,2.24LH 2与2L 氧气反应生成多少mol 水? 2、阿伏加德罗定律及其应用 阿伏加德罗定律: 同温同压下:2 12121N N =n n =V V ②、推论: 同温同压下: 212121Mr Mr =M M =ρρ 同温同体积下:212121N N =n n =P P Ⅰ、气体休的密度和相对密度: 标况下:1-L ?g 4.22Mr =mol ?.4L 22M =)(ρ气体 A 气体对B 气体的相对密度:) B (M )A (M =)B (ρ)A (ρ= )B (D Ⅱ、摩尔质量M (或平均摩尔质量M —) M=22.4L ·mol -1×ρ,???+)B (n +)A (n ???+)B (M ?)B (n +)A (M ?)A (n = M — M —=M(A)ф(A)+M(B)ф(B)+· ·· ф为体积分数。 例题精选 1. 用N A 表示阿伏加德罗常数的值,下列叙述正确的是( ) A. 含有N A 个氦原子的氦气在标准状况下的体积约为11.2L B. 25℃,1.01×105Pa ,64gSO 2中含有的原子数为3N A C. 在常温常压下,11.2L Cl 2含有的分子数为0.5N A D. 标准状况下,11.2LH 2O 含有的分子数为0.5N A 2. 等物质的量的氢气和氦气在同温同压下具有相等的( ) A. 原子数 B. 体积 C. 质子数 D. 质量 3. 相同状况下,下列气体所占体积最大的是( ) A. 80g SO 3 B. 16g O 2 C. 32g H 2S D. 3g H 2 4. 下列各物质所含原子数目,按由大到小顺序排列的是( ) ①0.5mol NH 3 ②标准状况下22.4L He ③4℃ 9mL 水 ④0.2mol H 3PO 4 A. ①④③② B. ④③②① C. ②③④① D. ①④③② 5. 下列说法正确的是( ) A. 标准状况下22.4L/mol 就是气体摩尔体积 B. 非标准状况下,1mol 任何气体的体积不可能为22.4L C. 标准状况下22.4L 任何气体都含有约6.02×1023个分子 D. 1mol H 2和O 2的混合气体在标准状况下的体积约为22.4L ③、运用: 阿伏加 德罗定 律及其推论:
中考动点问题专题 教师讲义带答案
中考动点型问题专题 一、中考专题诠释 所谓“动点型问题”是指题设图形中存在一个或多个动点,它们在线段、射线或弧线上运动的一类开放性题目.解决这类问题的关键是动中求静,灵活运用有关数学知识解决问题. “动点型问题”题型繁多、题意创新,考察学生的分析问题、解决问题的能力,内容包括空间观念、应用意识、推理能力等,是近几年中考题的热点和难点。 二、解题策略和解法精讲 解决动点问题的关键是“动中求静”. 从变换的角度和运动变化来研究三角形、四边形、函数图像等图形,通过“对称、动点的运动”等研究手段和方法,来探索与发现图形性质及图形变化,在解题过程中渗透空间观念和合情推理。在动点的运动过程中观察图形的变化情况,理解图形在不同位置的情况,做好计算推理的过程。在变化中找到不变的性质是解决数学“动点”探究题的基本思路,这也是动态几何数学问题中最核心的数学本质。 三、中考考点精讲 考点一:建立动点问题的函数解析式(或函数图像) 函数揭示了运动变化过程中量与量之间的变化规律,是初中数学的重要内容.动点问题反映的是一种函数思想,由于某一个点或某图形的有条件地运动变化,引起未知量与已知量间的一种变化关系,这种变化关系就是动点问题中的函数关系.例1 (2015?兰州)如图,动点P从点A出发,沿线段AB运动至点B后,立即按原路返回,点P在运动过程中速度不变,则以点B为圆心,线段BP长为半
径的圆的面积S与点P的运动时间t的函数图象大致为() A.B.C.D. 思路分析:分析动点P的运动过程,采用定量分析手段,求出S与t的函数关系式,根据关系式可以得出结论. 解:不妨设线段AB长度为1个单位,点P的运动速度为1个单位,则: (1)当点P在A→B段运动时,PB=1-t,S=π(1-t)2(0≤t<1); (2)当点P在B→A段运动时,PB=t-1,S=π(t-1)2(1≤t≤2). 综上,整个运动过程中,S与t的函数关系式为:S=π(t-1)2(0≤t≤2), 这是一个二次函数,其图象为开口向上的一段抛物线.结合题中各选项,只有B 符合要求. 故选B. 点评:本题结合动点问题考查了二次函数的图象.解题过程中求出了函数关系式,这是定量的分析方法,适用于本题,如果仅仅用定性分析方法则难以作出正确选择. 对应训练 1.(2015?白银)如图,⊙O的圆心在定角∠α(0°<α<180°)的角平分线上运动,且⊙O与∠α的两边相切,图中阴影部分的面积S关于⊙O的半径r(r>0)变化的函数图象大致是() A.B.C.D.
气体摩尔体积练习题
气体摩尔体积练习题集团文件版本号:(M928-T898-M248-WU2669-I2896-DQ586-M1988)
第二节气体摩尔体积 Ⅰ.学习重点: 1.理解气体摩尔体积的概念 2.掌握有关气体摩尔体积的计算 3.通过气体摩尔体积推导出阿伏加德罗定律 Ⅱ.学习难点: 气体摩尔体积的概念 Ⅲ.训练习题: 一、选择题 1.用N A 表示阿伏加德罗常数的值,下列叙述正确的是() A.含有N A 个氦原子的氦气在标准状况下的体积约为11.2L B.25℃,1.01×105Pa,64gSO 2中含有的原子数为3N A C.在常温常压下,11.2L Cl 2含有的分子数为0.5N A D.标准状况下,11.2LH 2O含有的分子数为0.5N A 2.等物质的量的氢气和氦气在同温同压下具有相等的() A.原子数 B.体积 C.质子数 D.质量3.相同状况下,下列气体所占体积最大的是() A.80g SO 3 B.16g O 2 C.32g H 2 S D.3g H 2 4.下列各物质所含原子数目,按由大到小顺序排列的是() ①0.5mol NH 3 ②标准状况下22.4L He ③4℃ 9mL 水④0.2mol H 3PO 4 A.①④③② B.④③②①
C.②③④① D.①④③② 5.下列说法正确的是() A.标准状况下22.4L/mol就是气体摩尔体积 B.非标准状况下,1mol任何气体的体积不可能为22.4L C.标准状况下22.4L任何气体都含有约6.02×1023个分子 D.1mol H 2和O 2 的混合气体在标准状况下的体积约为22.4L 6.在一定温度和压强下的理想气体,影响其所占体积大小的主要因素是() A.分子直径的大小 B.分子间距离的大小 C.分子间引力的大小 D.分子数目的多少 7.在0℃ 1.01×105 Pa下,有关H 2、O 2 、CH 4 三种气体的叙述正确的 是() A.其密度之比等于物质的量之比 B.其密度之比等于摩尔质量之比 C.等质量的三种气体,其体积比等于相对分子质量的倒数比 D.等体积的三种气体,其物质的量之比等于相对分子质量之比8.A气体的摩尔质量是B气体的n倍,同温同压下,B气体的质量是同体积空气的m倍,则A的相对分子质量为() A.m/n B.29m/n C.29mn D.29n/m
动点例题解析及标准答案
动点例题解析及答案
————————————————————————————————作者:————————————————————————————————日期:
初中数学动点问题及练习题附参考答案 所谓“动点型问题”是指题设图形中存在一个或多个动点,它们在线段、射线或弧线上运动的一类开放性题目.解决这类问题的关键是动中求静,灵活运用有关数学知识解决问题. 关键:动中求静. 数学思想:分类思想函数思想方程思想数形结合思想转化思想 注重对几何图形运动变化能力的考查。 从变换的角度和运动变化来研究三角形、四边形、函数图像等图形,通过“对称、动点的运动”等研究手段和方法,来探索与发现图形性质及图形变化,在解题过程中渗透空间观念和合情推理。选择基本的几何图形,让学生经历探索的过程,以能力立意,考查学生的自主探究能力,促进培养学生解决问题的能力.图形在动点的运动过程中观察图形的变化情况,需要理解图形在不同位置的情况,才能做好计算推理的过程。在变化中找到不变的性质是解决数学“动点”探究题的基本思路,这也是动态几何数学问题中最核心的数学本质。 二期课改后数学卷中的数学压轴性题正逐步转向数形结合、动态几何、动手操作、实验探究等方向发展.这些压轴题题型繁多、题意创新,目的是考察学生的分析问题、解决问题的能力,内容包括空间观念、应用意识、推理能力等.从数学思想的层面上讲:(1)运动观点;(2)方程思想;(3)数形结合思想;(4)分类思想;(5)转化思想等.研究历年来各区的压轴性试题,就能找到今年中考数学试题的热点的形成和命题的动向,它有利于我们教师在教学中研究对策,把握方向.只的这样,才能更好的培养学生解题素养,在素质教育的背景下更明确地体现课程标准的导向.本文拟就压轴题的题型背景和区分度测量点的存在性和区分度小题处理手法提出自己的观点. 专题一:建立动点问题的函数解析式 函数揭示了运动变化过程中量与量之间的变化规律,是初中数学的重要内容.动点问题反映的是一种函数思想,由于某一个点或某图形的有条件地运动变化,引起未知量与已知量间的一种变化关系,这种变化关系就是动点问题中的函数关系.那么,我们怎样建立这种函数解析式呢?下面结合中考试题举例分析. 一、应用勾股定理建立函数解析式。 二、应用比例式建立函数解析式。 三、应用求图形面积的方法建立函数关系式。 专题二:动态几何型压轴题 动态几何特点----问题背景是特殊图形,考查问题也是特殊图形,所以要把握好一般与特殊的关系;分析过程中,特别要关注图形的特性(特殊角、特殊图形的性质、图形的特殊位置。)动点问题一直是中考热点,近几年考查探究运动中的特殊性:等腰三角形、直角三角形、相似三角形、平行四边形、梯形、特殊角或其三角函数、线段或面积的最值。下面就此问题的常见题型作简单介绍,解题方法、关键给以点拨。 一、以动态几何为主线的压轴题。 (一)点动问题。(二)线动问题。(三)面动问题。 二、解决动态几何问题的常见方法有: 1、特殊探路,一般推证。 2、动手实践,操作确认。 3、建立联系,计算说明。
测定气体摩尔体积实验误差的原因分析
资源信息表
10.1 测定1mol气体的体积(共3+1课时) 第4课时测定1mol气体体积实验误差的原因分 析 [设计思想] 任何定量测定的方法,得到的数据都有一定的精确范围,或者说存在一定的误差。定量实验必须尽可能减小实验误差,提高实验精确度。本节课的教学围绕实验中如何实现这一要求展开教学讨论,让学生认识实验误差的来源:一是仪器装置精密度和药品试剂的品质;二是操作的失误。围绕着误差的来源,结合自己的实验,分析产生各种误差的原因,获得减小实验误差的方法。在讨论减小实验误差,提高实验精确度的方法、措施时,从以下几个方面展开:(1)根据实验要求和条件精选精度比较高的计量仪器(如量体积时,尽可能用滴定管或移液管);(2)进行重复测量。计算时取两次(或多次)可测量值之间的平均值;(3)准确规范操作。如读数液体体积时,视线应该与管中的凹液面最低处相切等。最后让学生归纳出:定量实验存在误差是一定的、允许的,重要的是误差要控制在合理的范围内,本实验误差值在-2—+2%。 一.教学目标 1.知识与技能 (1)实验误差分析(B)。 (2)实验报告的书写(B)。 2.过程与方法 (1)通过实验反思,认识重复测量、数据处理等科学方法。 (2)明白实验操作不当引起实验误差的方法。 3.情感态度与价值观 (1)通过实验报告的交流,同学间的倾听,体验相互学习、尊重他人的价值。 (2)通过对实验的反思,体验实事求是、严肃认真科学精神的意义。 二.教学重点与难点 1.教学重点 实验报告的书写。 2.教学难点
分析操作不当引起实验误差。 三.教学用品 媒体:电脑、投影仪等 四.教学流程 2.流程说明 引入:我们做了测定1摩尔氢气的体积的实验,下面请交流你们的实验报告。 学生交流:交流实验报告。 教师点评:根据报告与实验中观察获得的信息,对学生的实验作点评与评价。 师生交流:因操作不当而造成的误差。如:(1)没有进行装置的气密性检查,(2)镁带表面氧化镁没有擦除或没有除尽等等 学生练习:工业上测量SO2、N2、O2混合气体中SO2含量。 归纳小结:测定气体的质量或者体积一般有那些方法 作业:教材上 五.教学案例 1.教学过程
气体摩尔体积练习题及答案解析
(本栏目内容,在学生用书中以活页形式分册装订!) A组——知能训练 1.下列叙述中,正确的是( ) A.1 mol H 2 的质量只有在标准状况下才约为2 g B.在标准状况下某气体的体积是22.4 L,则可认为该气体的物质的量约是1 mol C.在20 ℃时,1 mol任何气体的体积总比22.4 L大 D.1 mol H 2和O 2 的混合气体的质量为24 g,则混合气体的相对分子质量无法确定 解析:气体的质量与气体的温度、压强无关,A选项不正确;22.4 L·mol-1是在特定条件下的气体摩尔体积,所以在标准状况下,某气体的体积是22.4 L,则可以认为该气体的物质的量是1 mol,B选项正确;由于气体摩尔体积与气体的温度、压强有关,因此仅温度定,而压强不定,1 mol气体的体积自然不能确定,也就是说在20 ℃时,1 mol任何气体的体积可能比22.4 L大,也可能比22.4 L小,还可能等于22.4 L,C选项不正确;D 项中M(混)= 24 g 1 mol =24 g·mol-1,即M r(混)=24,故该项错误。 答案:B 2.(2010·11大连高一检测)下列说法不正确的是(N A表示阿伏加德罗常数的值)( ) A.在常温、常压下,11.2 L氯气中含有的分子数小于0.5N A B.在常温、常压下,氦气为1 mol时含有的原子数为N A C.32 g氧气所含电子数目为16N A
D.28 g CO和CO 2 的混合物含有的分子数为1N A 解析:常温常压下,V m>22.4 L·mol-1,故A对;氦气为单原子分子,1 mol He含 有N A个He原子,故B对;n(O2)=32 g 32 g·mol-1=1 mol,1个O 2 分子中含有2×8=16个电子, 故C对;M(CO)=28 g·mol-1,M(CO2)=44 g·mol-1,二者混合气体M∈(28 g·mol-1,44 g·mol-1),故28 g混合气体的物质的量小于1 mol,因此D错。 答案:D 3.(2010·芜湖高一检测)如下图所示,两瓶体积相等的气体,在同温同压时瓶内气体的关系一定正确的是( ) 解析:设气体的质量均为4 g,则n(H2)= 4 g 2 g·mol-1 =2 mol,n(He)= 4 g 4 g·mol-1 = 1 mol。隔板静止后,上下压强相等,根据阿伏加德罗定律,V?H 2 ? V?He? = n?H 2 ? n?He? = 2 mol 1 mol = 2 1 。 答案:A 4.下列说法正确的是( ) A.同温、同压下,相同质量的气体都占有相同的体积 B.同温、同压下,相同体积的气体都含有相同数目的分子 C.在标准状况下,1 mol水的体积约是22.4 L D.1 mol某气体的体积约为22.4 L,该气体所处的状况一定是标准状况 解析:同温同压下,质量相同的不同气体物质的量不一定相同,所以不一定占有相
高一化学_气体摩尔体积相关习题 (1)
高一化学 气体摩尔体积习题 陕西 吴亚南 一、选择题 1.下列数量的物质中,含原子数最多的是 ( ) A 标准状况下11.2升CO 2 B 0.2mol NH 3 C 13.5g 水 D 6.02×1023个Ar 原子 2.同温同压下,下列气体的密度最大的是 ( ) A F 2 B Cl 2 C HCl D CO 2 3.下列叙述正确的是 ( ) A 1mol 任何气体的体积都约为22.4L B 48g O 3和1.5mol O 2所含氧原子数相等 C 17g OH - 和19g H 3O + 所含质子数相等 D 28g 氮气所含原子数为阿伏加德罗常数 4.在标准状况下,下列物质所占体积最大的是 ( ) A 98g H 2SO 4 B 6.02×1023个氮分子 B 44.8L HCl D 6g 氢气 5.在标准状况下, 如果5.6升氧气含有n 个氧分子,则阿伏加德罗常数为 ( ) A 8n B 16 n C 12n D 4n 6.两个体积相同的容器,一个盛NO ,另一个盛N 2和O 2,在同温同压下,两容器内的气体一 定具有相同的 ( ) A 原子总数 B 质子总数 C 分子总数 D 质量 7.在标准状况下,1升某气体的质量为1.25g , 则该气体可能是 ( ) A H 2 B N 2 C SO 2 D CO 2 8.标状下某气体的密度为1.429g/L,该气体可能是 ( ) A CO 2 B O 2 C N 2 D SO 2 9.1升甲气体和2升乙气体恰好完全化合生成2升丙气体(同温同压下测定),若丙气 体的分子式为YX 2,则甲和乙的分子式依次是 ( ) A Y 2与X 2 B XY 和X 2 C X 2和Y 2X D YX 与Y 2 10、某气体的密度相对于CH 4为4,该气体可能是下列中哪一种 ( ) A O 2 B Cl 2 C SO 2 D N 2H 4 11.用N A 表示阿伏加德罗常数的值,下列叙述正确的是 ( ) A .含有N A 个氦原子的氦气在标准状况下的体积约为11.2L B .25℃,1.01×105Pa ,64gSO 2中含有的原子数为3N A C .在常温常压下,11.2L Cl 2含有的分子数为0.5N A D .标准状况下,11.2LH 2O 含有的分子数为0.5N A 12.在0℃ 1.01×105 Pa 下,有关H 2、O 2、CH 4三种气体的叙述正确的是 ( ) A .其密度之比等于物质的量之比 B .其密度之比等于摩尔质量之比 C .等质量的三种气体,其体积比等于相对分子质量之比 D .等体积的三种气体,其物质的量之比等于相对分子质量之比 13.将20.8g 两种金属的混合物投入足量的盐酸中,将反应完全后得到氢气11.2L(标准状 况),该混合物的组成可能是 ( )
