紫外光谱总结

第1章紫外光谱
紫外可见光谱(Ultraviolet and Visible Spectroscopy, UV-Vis)是由分子吸收能量激发价电子或外层电子跃迁而产生的电子光谱。其波长范围为10~800 nm,又可以细分为三个波段:可见光区(400~800nm):有色物质在此区段有吸收;
近紫外区(200~400nm):芳香族化合物或具有共轭体系的物质在此区域有吸收;
远紫外区/真空紫外区(10~200nm):空气中的O2、N2、CO2和水蒸气在此区域有吸收,对测定有干扰,需要在真空条件下测定。
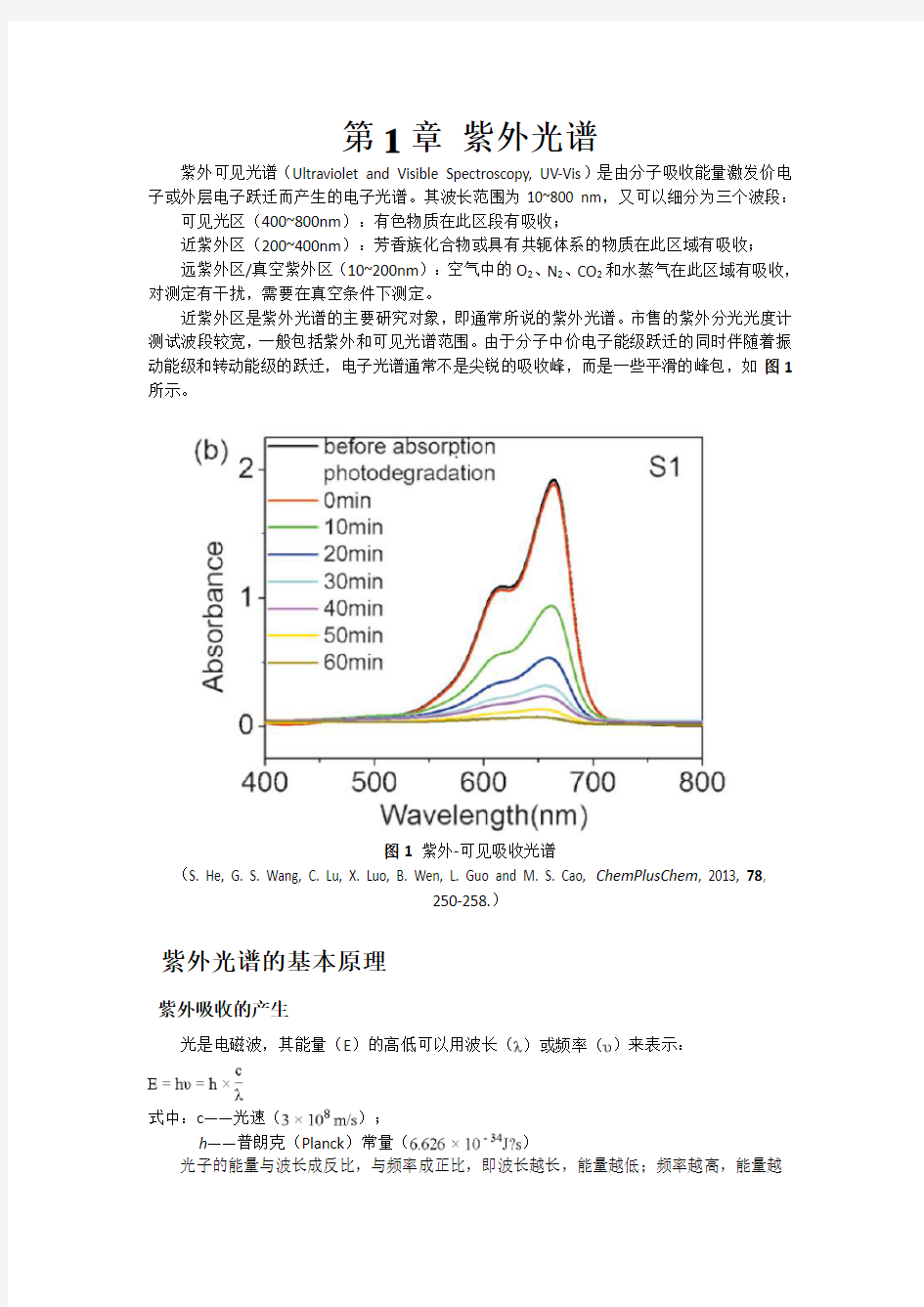
近紫外区是紫外光谱的主要研究对象,即通常所说的紫外光谱。市售的紫外分光光度计测试波段较宽,一般包括紫外和可见光谱范围。由于分子中价电子能级跃迁的同时伴随着振动能级和转动能级的跃迁,电子光谱通常不是尖锐的吸收峰,而是一些平滑的峰包,如图1所示。
图1紫外-可见吸收光谱
(S. He, G. S. Wang, C. Lu, X. Luo, B. Wen, L. Guo and M. S. Cao, ChemPlusChem, 2013, 78,
250-258.)
紫外光谱的基本原理
紫外吸收的产生
光是电磁波,其能量(E)的高低可以用波长()或频率()来表示:
式中:c——光速();
h——普朗克(Planck)常量()
光子的能量与波长成反比,与频率成正比,即波长越长,能量越低;频率越高,能量越
高。表1列出了不同电磁波段的相应波长范围以及分子吸收不同能量电磁波所能激发的分子能级跃迁。
表1 电磁波谱及产生原因
波长范围波谱区名称跃迁类型光谱类型~γ射线原子核反应莫斯鲍尔谱~10nm X射线内层电子X射线电子能谱
10~200nm远紫外外层电子真空紫外吸收光谱
200~400nm近紫外外层电子
紫外可见吸收光谱
400~760nm可见外层电子
~μm近红外分子振动
~50μm中红外分子振动、转动
红外吸收光谱、拉曼光谱50~1000μm远红外分子振动、转动
~100cm微波分子转动电子自旋电子自旋共振
1~1000m无线电波原子核自旋核磁共振
朗伯-比尔定律
朗伯-比尔定律是吸收光谱的基本定律,也是吸收光谱定量分析的理论基础。理论指出:被吸收的入射光的分数正比于光程中吸光物质的分子数目;对于溶液,如果溶液不吸收,则被溶液所吸收的光的分数正比于溶液的浓度和光在溶液中经过的距离。公式为:
式中:A——吸光度(absorbance),表示单色光通过是也是被吸收的程度,为入射光强度I0与透过光强度I1的壁纸的对数;
T——透光率/透射率(transmittance)为透过光强度I1与入射光强度I0之比值;
l——光在溶液中经过的距离,一般为吸收池的厚度;
ε——摩尔吸光系数(molar absorptivity),它是浓度为1 mol·L-1的溶液在1 cm的吸收池中,在一定波长下测得的吸光度。ε > 104则跃迁是完全“允许的”;ε < 103则跃迁概率较低;ε < 50则跃迁是“禁阻的”。
紫外吸收中的最大吸收波长位置及摩尔吸光系数,表示为:
即样品在乙醇溶剂中,最大吸收波长为204你们,摩尔吸光系数为1120。
朗伯-比尔定律适宜于单色光和一定的低浓度范围的真溶液,随浓度的升高会逐渐偏离线性关系。另外,吸光度具有加和性,可以进行多组分测定。
紫外光谱中常用的名词术语
1. 发色团/生色团(chromophore):在一个分子中产生紫外吸收的官能团;一般为带有π电子的基团。常见的生色团有:C=C、C≡C、C=O、COOH、COOR、COR、CONH2、NO2、-
N=N-、芳环等。
2. 助色团(auxochrome):有些原子或原子团单独在分子中存在时,吸收波长小于200 nm,而与一定的发色团相连时,可以使发色团所产生的吸收峰位红移,吸收强度增加,这些原子或原子团称为助色团;助色团一般为带有孤对电子的原子或原子团。常见的助色团有:-OH、-OR、-NHR、-SH、-SR、-Cl、—Br、—I等。
3. 红移现象(red shift):由于取代基或溶剂的影响使最大吸收峰向长波方向移动的现象称为红移现象。
4. 蓝移现象(blue shift):由于取代基或溶剂的影响使最大吸收峰向短波方向移动的现象称为蓝移现象。
5. 增色效应(hyperchromic effect):使值增加的效应称为增色效应。
6. 减色效应(hypochromic effcet):使值减少的效应称为减色效应。
7. 强带:在紫外光谱中,凡摩尔吸光系数大于104的吸收带。
8. 弱带:凡摩尔吸光系数小于103的吸收带称为弱带。
电子跃迁的类型
紫外吸收光谱是由价电子能级跃迁而产生的,有机化合物中的价电子根据成键电子种类分为三种:σ电子、形成双键或叁键的π电电子、未成键的n电子。跃迁的类型有:*, n *, *, n *。各类能级和电子跃迁的能量大小见图2。
图2电子能级和跃迁示意图
各种电子跃迁需要的能量大小次序为:* n * * n *。
1. *跃迁:所需能量最大,σ电子只有吸收远紫外光的能量才能发生跃迁。饱和烷烃的分子吸收光谱出现在远紫外区(吸收波长λ < 150 nm)。
2. n→σ*跃迁:所需能量较大。吸收波长为150~250 nm,大部分在远紫外区,近紫外区仍不易观察到。含非键电子的饱和烃衍生物(含N、O、S和卤素等杂原子)均呈现n →σ*跃迁。
3. π→π*跃迁:所需能量较小,吸收波长处于远紫外区的近紫外端或近紫外区,一般孤立的π→π*跃迁,吸收峰的波长在200 nm附近,其特征是吸收强度大(ε>104)。不饱和烃、共轭烯烃和芳香烃类均可发生该类跃迁。
分子中的两个或两个以上的双键共轭时,π→π*跃迁能量降低,吸收波长红移出现210~250 nm的吸收,ε>104,称为K带。随共轭长度增加,K带吸收峰红移,吸收强度增加。(共轭烯烃的K带不收溶剂极性影响,不饱和醛酮的K带吸收随溶剂极性的增大而红移)
图3苯环紫外光谱中的E带和K带
芳香族化合物的π→π*跃迁在光谱学上称为B带和E带。苯的B带ε约为200,峰在230~270 nm,非极性溶剂中B带为一具有精细结构的宽峰,在极性溶剂中精细结构消失。E 带分为E1和E2带,E1带ε>104,波长为184 nm;E2带ε约为103,波长为204 nm。当苯环上有发色基团取代并和苯环共轭时,E带和B带均发生红移,E2带波长出现在210~250 nm 时视为K带。
4. n →π*跃迁:需能量最低,吸收波长λ>200nm。这类跃迁在跃迁选律上属于禁阻跃迁,ε一般为10~100 ,吸收谱带强度较弱。分子中孤对电子和π键同时存在时发生n →π*跃迁。这种跃迁在谱学上称为R 带,ε在100以内,波长为270~350 nm。随溶剂的极性增加,吸收波长发生蓝移。
影响紫外吸收波长的因素
1. 共轭效应
1)共轭体系中,共轭双键数目越多,π →π *间的能量差越小,吸收峰红移越显着。
2)当助色基团,如-OH、-X、或-NH2,被引入双键的一端时,将产生p-π 共轭效应,使λ max
红移,ε max增加。p-π 共轭体系越大,助色基团的助色效应越强,吸收带红移越明显。
3)超共轭效应:烷基取代双键碳上的氢以后,通过烷基的C-H 键和π 体系电子云重叠引
起的共轭作用,也会使共轭体系的吸收发生较小的红移。
2. 立体效应
1)空间位阻:只有共轭体系处于同一平面时才能达到有效的共轭,否则,共轭程度降低,
λmax减小。
2)顺反异构:一般反式异构体空间位阻较小,能有效地共轭,π →π *跃迁能量较小,λ max
位于长波端,吸收强度也较大。
3)跨环效应:在环状体系中,分子中非共轭的两个发色团因为空间位置上的接近,发生轨
道间的交盖作用,使得吸收带长移,同时吸光强度增强。
3. 溶剂极性
溶剂影响:吸收峰位置、吸收强度、光谱形状。(与基态和激发态的极性大小有关)溶剂极性增大时:n →π*跃迁产生的吸收峰蓝移
π →π*跃迁产生的吸收峰红移(若只有长链烯烃没有杂原子则受
溶剂极性影响很小)
4. 溶液PH
在测定酸性、碱性或两性物质时,溶剂的pH值对光谱的影响很大。例如酚类化合物和苯胺类化合物,由于在酸性、碱性溶液中的解离情况不同,从而影响共轭系统的长短,导致吸收光谱也不同。
紫外光谱仪
1. 光源:紫外区:氘灯(160~390 nm)
可见光区:钨丝灯(350~800 nm)
2. 分光系统:入射狭缝、准直镜、色散元件(棱镜或衍射光栅)、出射狭缝
3. 吸收池:石英池(可见光区和紫外光区)、玻璃池(紫外光区有吸收,只能用于可见光区)
4. 检测系统:光电池、光电管、光电倍增管(灵敏度高、不易疲劳,常用)、自扫描光敏二极管阵列(新兴的检测器)
各类化合物的紫外吸收光谱
饱和烃化合物
1. 饱和烷烃:*,能级差很大,紫外吸收的波长很短,属远紫外范围。如:甲烷125nm,乙烷135nm。
2. 环烷烃:*,由于环张力的存在,降低了C—C键强度,*所需能量较少,紫外吸收比直链烷烃长。环越小,吸收波长越大。如:丙烷150 nm,环丙烷190 nm。
3. 含饱和杂原子的化合物:*、n *,吸收弱,只有部分有机化合物(如C-Br、C-I、C-NH2)的n *跃迁有紫外吸收。杂原子半径越大,化合物的电离能越低,吸收带波长红移,如在卤代烷中波长和强度有:F < Cl < Br < I;另外由于超共轭效应存在,吸收带波长随碳链的增长和分支的增多而红移。
简单的不饱和化合物
1. 非共轭的烯类和炔类
非共轭π →π*跃迁,λmax位于190 nm以下的远紫外区。如:乙烯165 nm,乙炔173 nm。碳碳双键或三键与杂原子O、N、S、Cl等相连时,由于杂原子的助色效应,λmax红移。但若不与强的助色团N,S相连,π →π*跃迁仍位于远紫外区。
2. 含杂原子的双键化合物
含不饱和杂原子基团的紫外吸收(如图4所示)*、n *、π → π*属于远紫外吸收n → π*跃迁为禁阻跃迁,弱吸收带--R带;当醛、酮被羟基、胺基等取代变成酸、酯、酰胺时,由于共轭效应和诱导效应影响羰基,λmax蓝移;硫羰基化合物R2C=S 较R2C=O 同系物中n → π*跃迁λmax红移。
图4含不饱和杂原子基团的紫外吸收
共轭双烯
共轭体系越长,其最大吸收越移向长波方向,甚至可达可见光部分;随着波长红移,吸收强度也增大。经验计算方法:Woodward-Fieser规则。
α,β-不饱和羰基化合物
助色团取代基的引入使α,β-不饱和酮的紫外吸收红移,具体可根据Woodward/Fieser/Scott提出的经验规则计算。α,β-不饱和醛的π → π*跃迁规律与酮类似,只是醛的吸收波长要蓝移5 nm。α,β-不饱和羧酸和酯类似,波长蓝移;酰胺的波长小于相应的羧酸。
芳香族化合物
1. 苯
苯环显示三个吸收带,都是起源于π π*跃迁:(如图3所示)
= 184 nm ( = 60000)E1带
max
= 204 nm ( = 7900)E2带
max
= 255 nm ( = 250)B带
max
2. 单取代苯
烷基取代苯:烷基无孤电子对,对苯环电子结构产生很小的影响。由于有超共轭效应,一般导致B带、E2带红移。
助色团取代苯:助色团含有孤电子对,它能与苯环π电子共轭。使 B 带、E 带均移向
长波方向。不同助色团的红移顺序为:NCH3)2 ﹥NHCOCH3 ﹥O-,SH ﹥NH2﹥OCH3﹥OH﹥Br﹥Cl﹥CH3﹥NH3+
生色团取代的苯:含有π 键的生色团与苯环相连时,产生更大的π π* 共轭体系,使B 带E带产生较大的红移。不同生色团的红移顺序为:NO2 > Ph >CHO > COCH3 > COOH > COO ->CN > SO2NH2
3. 双取代苯
对位取代:两个取代基属于同类型时,λmax红移值近似为两者单取代时的最长波长。两个取代基类型不同时,λmax的红移值远大于两者单取代时的红移值之和。(共轭效应)邻位或间位取代:两个基团产生的λmax的红移值近似等于它们单取代时产生的红移值之和。
4. 稠环芳烃
随着稠环数的增加,共轭双键数目增多,E1、E2和B带均红移,且吸收强度增加。E1可到200nm以上,E2和B有可能进入可见光区。E2带的移动幅度最大,可能淹没B带。稠环芳烃的紫外吸收比较复杂且往往具有精细结构,可以用于化合物的指纹鉴定。
5. 杂环化合物
当芳环上的碳原子被杂原子(如O、S、N)取代时,即得到杂环化合物,其紫外光谱可与相应的芳香环相似。
含氮化合物
最简单的含氮化合物是氨,自可产产生*跃迁和nπ*跃迁,其中nπ*跃迁可产生两个谱带,分别位于nm和nm。氨的衍生物也同样具有两个吸收谱带,烷基的取代使波长红移;不饱和含氮化合物由于受n-π ,π-π共轭作用的影响,波长红移,吸收强度增加。
硝基和亚硝基化合物由于N、O均含有未共用电子对和π *反键轨道,具有n →π *跃迁产生的R 带。亚硝基化合物在可见光区有一弱吸收带,675 nm,ε为20,为氮原子的n →π*跃迁产生,300 nm处有一强谱带,为氧原子的n →π *跃迁产生。硝基化合物可以产生n →π*旷和π→π *跃迁,π→π *的吸收<200 nm, n →π *吸收在275nm 处,强度低。如有双键与硝基共轭,则吸收红移,强度增加。
无机化合物
无机化合物的紫外光谱通常是由两种跃迁引起的,即电荷迁移跃迁和配位场跃迁。
1. 电荷迁移跃迁:
指在光能激发下,某一化合物(配合物)中的电荷发生重新分布,导致电荷可以从化合物(配合物)的一部分迁移到另一部分而产生的吸收光谱。有人认为电荷迁移的过程实际是分于内的氧化还原过程。例如,Fe3+与硫氰酸盐生成的配合物为红色,在可见光区有强烈的电荷迁移吸收(电子从配体硫氰根跃迁至铁离子产生吸收)。
2. 配位场跃迁:
d→d 跃迁:在配位场的影响下,处于低能态d轨道上的电子受激发后跃迁到高能态的d轨道,这种跃迁称为d→d 跃迁。
f→f跃迁:镧系和锕系元素含有f 轨道,在配位场的影响下,处于低能态f 轨道上的电子受激发后跃迁到高能态的f 轨道,这种跃迁称为f→f跃迁。镧系元素离子光谱的尖锐特征吸收峰常用来校正分光光度计的波长。
紫外光谱的应用
化合物的鉴定
紫外鉴定有机物的方法有两种:与标准物、标准谱图对照(用同种溶剂配制相同浓度溶液并在同一条件下测定);对照吸收波长和摩尔消光系数。
1)化合物在220~800 nm 内无紫外吸收,说明该化合物是脂肪烃、脂环烃或它们的简单
衍生物(氯化物、醇、醚、羧酸等),甚至可能是非共轭的烯。
2)220-250nm内显示强的吸收(近10000或更大),这表明K带的存在,即存在共轭的两
个不饱和键(共轭二烯或、不饱和醛、酮)
3)250-290nm内显示中等强度吸收,且常显示不同程度的精细结构,说明苯环或某些杂芳
环的存在。
4)250-350nm内显示中、低强度的吸收,说明羰基或共轭羰基的存在。
5)300nm以上的高强度的吸收,说明该化合物具有较大的的共轭体系。若高强度吸收具
有明显的精细结构,说明稠环芳烃、稠环杂芳烃或其衍生物的存在。
纯度检查
如果有机化合物在紫外可见光区没有明显的吸收峰,而杂质在紫外区有较强的吸收,则可利用紫外光谱检验化合物的纯度。如果样品本身有紫外吸收,则可以通过差示法进行检验,即取相同浓度的纯品在同一溶剂中测定作空白对照,样品与纯品之间的差示光谱就是样品中含有的杂质的光谱。
异构体的而确定
对于构造异构体,可以通过经验规则计算出λmax的值,与实测值比较,即可证实化合物是哪种异构体。
对于顺反异构体,一般来说,某一化合物的反式异构体的λmax和εmax大于顺式异构体。
另外还有互变异构体,常见的互变异构体有烯醇式互变异构,如乙酰乙酸乙酯的酮-烯醇式互变异构:
在极性溶剂中测定乙酰乙酸乙酯的紫外光谱,出现一个弱峰,λmax=272 nm (ε max=16),说明该峰由n→π *跃迁引起,故可确定在极性溶剂中该化合物主要是以酮型异构体存在。这是由于酮型与极性溶剂(水)形成氢键,故稳定。在非极性溶液中测定时,形成强峰,表明此时为烯醇型(形成分子内氢键)。
位阻作用的测定
由于位阻作用会影响共轭体系的共平面性质,当组成共轭体系的生色基团近似处于同一平面,两个生色基团具有较大的共振作用时,λmax不改变,εmax略为降低,空间位阻作用较小;当两个生色基团具有一部分共振作用,两共振体系部分偏离共平面时,λmax和εmax略为降低;当连接两生色基团的单键或双键被扭曲得很厉害,以致两生色基团基本未共轭,或具有极小共振作用或无共振作用,剧烈影响其UV 光谱特征时,情况较为复杂。
氢键强度的测定
溶剂分子与溶质分子缔合生成氢键时,对榕质分子的UV 光谱有较大的影响。对于羰基化合物,根据在极性溶剂和非极性溶剂中R 带的差别,可以近似测定氢键的强度。
成分含量分析
紫外光谱在有机化合物的成分分析方面的应用比其在化合物定性鉴定方面有更大的优越性,方法的灵敏度高,准确性和重现性都很好,应用非常广泛。只要对近紫外光有吸收或可能有吸收的化合物,均可用紫外分光光度法进行测定。定量分析的基础是朗伯-比尔定律。
各种光谱原理解读
紫外吸收光谱 UV 分析原理:吸收紫外光能量,引起分子中电子能级的跃迁 谱图的表示方法:相对吸收光能量随吸收光波长的变化 提供的信息:吸收峰的位置、强度和形状,提供分子中不同电子结构的信息 荧光光谱法 FS 分析原理:被电磁辐射激发后,从最低单线激发态回到单线基态,发射荧光 谱图的表示方法:发射的荧光能量随光波长的变化 提供的信息:荧光效率和寿命,提供分子中不同电子结构的信息 红外吸收光谱法 IR 分析原理:吸收红外光能量,引起具有偶极矩变化的分子的振动、转动能级跃迁 谱图的表示方法:相对透射光能量随透射光频率变化 提供的信息:峰的位置、强度和形状,提供功能团或化学键的特征振动频率 拉曼光谱法 Ram 分析原理:吸收光能后,引起具有极化率变化的分子振动,产生拉曼散射 谱图的表示方法:散射光能量随拉曼位移的变化 提供的信息:峰的位置、强度和形状,提供功能团或化学键的特征振动频率 核磁共振波谱法 NMR 分析原理:在外磁场中,具有核磁矩的原子核,吸收射频能量,产生核自旋能级的跃迁 谱图的表示方法:吸收光能量随化学位移的变化 提供的信息:峰的化学位移、强度、裂分数和偶合常数,提供核的数目、所处化学环境和几何构型的信息 电子顺磁共振波谱法 ESR 分析原理:在外磁场中,分子中未成对电子吸收射频能量,产生电子自旋能级跃迁 谱图的表示方法:吸收光能量或微分能量随磁场强度变化 提供的信息:谱线位置、强度、裂分数目和超精细分裂常数,提供未成对电子密度、分子键特性及几何构型信息 质谱分析法 MS 分析原理:分子在真空中被电子轰击,形成离子,通过电磁场按不同m/e分离 谱图的表示方法:以棒图形式表示离子的相对峰度随m/e的变化 提供的信息:分子离子及碎片离子的质量数及其相对峰度,提供分子量,元素组成及结构的信息 气相色谱法 GC 分析原理:样品中各组分在流动相和固定相之间,由于分配系数不同而分离 谱图的表示方法:柱后流出物浓度随保留值的变化 提供的信息:峰的保留值与组分热力学参数有关,是定性依据;峰面积与组分含量有关 反气相色谱法 IGC
仪器分析光谱法总结
AES 原子发射光谱:原子的外层由高层能及向底层能级,能量以电磁辐射的形式发射出去, 这样就得到了发射光谱。原子发射一般是线状光谱。 原理:原子处于基态,通过电至激发,热至激发或者,光至激发等激发作用下,原子获得能 量,外层电子从基态跃迁到较高能态变成激发态,经过10-8s ,外层电子就从高能级向较低 能级或基态跃迁,多余能量的发射可得到一条光谱线。 光谱选择定律:①主量子数的变化△n 为包括零的整数,②△L=±1,即跃迁只能在S 项与P 项间,P 与S 或者D 间,D 到P 和F 。③△S=0,即不同多重性状间的迁移是不可能的。 ③△J=0,±1。但在J=0时,J=0的跃迁是允许的。 N 2S+1 L J 影响谱线强度的主要因素:1激发电位2跃迁概率3 统计权重4激发温度(激发温度↑离 子↑原子光谱↓离子光谱↑)5原子密度 原子发射光谱仪组成:激发光源,色散系统,检测系统, 激发光源:①火焰:2000到3000K ,只能激发激发电位低的原子:如碱性金属和碱土金属。 ② 直流电弧:4000到7000K ,优点:分析的灵敏度高,背景小,适合定量分析和低含量的 测定。缺点:不宜用于定量分析及低熔点元素的分析。 ③交流电弧:温度比直流高,离子线相对多,稳定性比直流高,操作安全,但灵敏度差 ④火花:一万K ,稳定性好,定量分析以及难测元素。每次放电时间间隔长,电极头温度低。 适合分析熔点低。缺点:灵敏度较差,背景大,不宜做痕量元素分析(金属,合金等组成均 匀的试样)⑤辉光 激发能力强,可以激发很难激发的元素,(非金属,卤素,一些气体)谱 线强度大,背景小,检出限低,稳定性好,准确度高(设备复杂,进样不方便)⑥电感耦合 等离子体10000K 基体效应小,检出限低,限行范围宽⑦激光 一万K ,适合珍贵样品 分光系统:单色器:入射狭缝,准直装置,色散装置,聚焦透镜,出射狭缝。 棱镜:分光原理:光的折射,由于不同的光有不同的折射率,所以分开。 光栅:光的折射与干涉的总效果,不同波长的光通过光栅作用各有不同的衍射角。 分辨率: 原子发射检测法:①目视法,②光电法, ③摄谱法:用感光板来记录光谱,感光板:载片(光学玻璃)和感光乳剂(精致卤化 银精致明胶)。 曝光量H=Et E 感光层接受的照度、 黑度:S=lgT -1=lg io/i io 为没有谱线的光强,i 通过谱线的光强度i ,透过率 T 定性分析:铁光谱比较法,标样光谱比较法,波长测定法。 定量法:①基本原理②内标法 ⑴内标元素和被测元素有相近的物理化学性质,如沸点,熔 点近似,在激发光源中有相近的蒸发性。⑵内标元素和被测元素有相近的激发能,如果选用 离子线组成分析线对时,则不仅要求两线对的激发电位相等,还要求内标元素的电离电位相 近。⑶内标元素是外加的,样品中不应有内标元素,⑷内标元素的含量必须适量且固定,⑸ 汾西线和内标线无自吸或者自吸很小,且不受其他谱线干扰。⑹如采用照相法测量谱线强度, 则要求两条谱线的波长应尽量靠近。 简述内标法基本原理和为什么要使用内标法。 答:内标法是通过测量谱线相对强度进行定量分析的方法。通常在被测定元素的谱线中选一 条灵敏线作为分析线,在基体元素(或定量加入的其它元素)的谱线中选一条谱线为比较线, 又称为内标线。分析线与内标线的绝对强度的比值称为分析线对的相对强度。在工作条件相 对变化时,分析线对两谱线的绝对强度均有变化,但对分析线对的相对强度影响不大,因此 可准确地测定元素的含量。从光谱定量分析公式a c b I lg lg lg +=,可知谱线强度I 与元素 的浓度有关,还受到许多因素的影响,而内标法可消除工作条件变化等大部分因素带来的影 响。 激发电位:原子中某一外层电子由基态激发到高能级所需要的能量。共振线:由激发态像基 态跃迁所发射的谱线。(共振线具有最小电位,最容易被激发,最强谱线)
大学物理物理知识点总结!!!!!!word版本
B r ? A r B r y r ? 第一章质点运动学主要内容 一. 描述运动的物理量 1. 位矢、位移和路程 由坐标原点到质点所在位置的矢量r 称为位矢 位矢r xi yj =+,大小 2r r x y ==+运动方程 ()r r t = 运动方程的分量形式() ()x x t y y t =???=?? 位移是描述质点的位置变化的物理量 △t 时间内由起点指向终点的矢量B A r r r xi yj =-=?+?△,2r x =?+△路程是△t 时间内质点运动轨迹长度s ?是标量。 明确r ?、r ?、s ?的含义(?≠?≠?r r s ) 2. 速度(描述物体运动快慢和方向的物理量) 平均速度 x y r x y i j i j t t t 瞬时速度(速度) t 0r dr v lim t dt ?→?== ?(速度方向是曲线切线方向) j v i v j dt dy i dt dx dt r d v y x +=+==,2222y x v v dt dy dt dx dt r d v +=??? ??+??? ??== ds dr dt dt = 速度的大小称速率。 3. 加速度(是描述速度变化快慢的物理量) 平均加速度v a t ?=? 瞬时加速度(加速度) 220lim t d d r a t dt dt υυ→?===?△ a 方向指向曲线凹向j dt y d i dt x d j dt dv i dt dv dt v d a y x 2222+=+== 2 2222222 2 2???? ??+???? ??=? ?? ? ??+??? ??=+=dt y d dt x d dt dv dt dv a a a y x y x 二.抛体运动
红外光谱总结
第2章红外光谱 通常红外光谱(infrared spectroscopy, IR)就是指波长2~25 μm的吸收光谱(即中红外区),这段波长范围反映出分子中原子间的振动与变角运动。分子在振动的同时还会发生转动运动,虽然分子的转动所涉及的能量变化较小,处在远红外区域,但转动运动影响振动的偶极矩变化,因而在红外光谱区实际所测的谱图就是分子的振动与转动运动的加与表现,因此红外光谱又称为分子振转光谱。 红外光谱可以应用于化合物分子结构的测定、未知物鉴定以及混合物成分分析。 2、1 红外光谱的基本原理 2、1、1 红外吸收光谱 1、当一束具有连续波长的红外光通过物质,物质分子中某个基团的振动频率或转动频率与红外光的频率一样时,分子就吸收能量由原来的基态振(转)动能级跃迁到能量较高的振(转)动能级,分子吸收红外辐射后发生振动与转动能级的跃迁,该处波长的光就被物质吸收。 波谱区近红外光中红外光远红外光 波长/m 0、75~2、5 2、5~50 50~1000 波数/cm-113333~4000 4000~200 200~10 跃迁类型分子振动分子转动 中红外区:绝大多数有机与无机化合物的基频吸收所在,主要就是振动能级的跃迁; 远红外区:分子纯转动能级跃迁及晶体的晶格振动。 3、波数()单位就是cm-1。波长与波数的关系就是: 4、胡克定律: 其中:——折合质量,,单位为kg; ——化学键力常数,与化学键的键能呈正比,单位为N·m-1; ——波数; ——真空中的光速。 (1)因为,红外频率。 (2)与碳原子城建的其她原子,随着其原子质量的增大,折合质量也增大,则红外波数减小。 (3)与氢原子相连的化学键的折合质量都小,红外吸收在高波数区。 (4)弯曲振动比伸缩振动容易,弯曲振动的K均较小,故弯曲振动吸收在低波数区。 5、光谱选律:原子与分子与电磁波作用发生能级跃迁就是要服从一定的规律的,这些规律由量子化学解释。量子化学解得与体系振动量子数(v)相对应的体系能量(E)为: (v = 0, 1, 2, 3…) 简谐振动光谱选律为:,即跃迁必须在相邻震动能级之间进行。
大学物理知识点总结汇总
大学物理知识点总结汇总 大学物理知识点总结汇总 大学物理知识点总结都有哪些内容呢?我们不妨一起来看看吧!以下是小编为大家搜集整理提供到的大学物理知识点总结,希望对您有所帮助。欢迎阅读参考学习! 一、物体的内能 1.分子的动能 物体内所有分子的动能的平均值叫做分子的平均动能. 温度升高,分子热运动的平均动能越大. 温度越低,分子热运动的平均动能越小. 温度是物体分子热运动的平均动能的标志. 2.分子势能 由分子间的相互作用和相对位置决定的能量叫分子势能. 分子力做正功,分子势能减少, 分子力做负功,分子势能增加。 在平衡位置时(r=r0),分子势能最小. 分子势能的大小跟物体的体积有关系. 3.物体的内能
(1)物体中所有分子做热运动的动能和分子势能的总和,叫做物体的内能. (2)分子平均动能与温度的关系 由于分子热运动的无规则性,所以各个分子热运动动能不同,但所有分子热运动动能的`平均值只与温度相关,温度是分子平均动能的标志,温度相同,则分子热运动的平均动能相同,对确定的物体来说,总的分子动能随温度单调增加。 (3)分子势能与体积的关系 分子势能与分子力相关:分子力做正功,分子势能减小;分子力做负功,分子势能增加。而分子力与分子间距有关,分子间距的变化则又影响着大量分子所组成的宏观物体的体积。这就在分子势能与物体体积间建立起某种联系。因此分子势能分子势能跟体积有关系, 由于分子热运动的平均动能跟温度有关系,分子势能跟体积有关系,所以物体的内能跟物的温度和体积都有关系:温度升高时,分子的平均动能增加,因而物体内能增加; 体积变化时,分子势能发生变化,因而物体的内能发生变化. 此外, 物体的内能还跟物体的质量和物态有关。 二.改变物体内能的两种方式 1.做功可以改变物体的内能.
光谱基础知识解读
太阳光光谱 紫外线谱带:波长280-400nm之间,其特点是穿透性强,可使人体皮肤黑色素沉积,颜色加深,过度的紫外线曝晒会导致皮肤癌,可导致地毯、窗帘、织物及家具油漆褪色。 可见光谱带:波长380~780nm之间,其特点是肉眼可以看见的唯一光谱,可见光波段进一步可以分为不同的颜色(赤橙黄绿蓝靛紫七色),对人体没有直接伤害。 红外光谱带:波长700~2400nm之间,其特点是我们可以直接感受到阳光“不可见”的热量,所含能量最大,所以热量也高。 各波段的远近红外线构成了太阳能的53%,紫外线占3%,可见光占44%。 元素光谱简介 如果物质是以单原子的形式而存在,关键看该原子的电子激发能了。如果在可见光的某个范围内,并且吸收某一部分光线,那它就显剩下的部分的光线的颜色。如该原子的电子激发能非常低,可以吸收任意的光线,该原子就是黑色的,如果该原子的电子激发能非常高。不能吸收任何光线,它就是白色的。如果它能吸收短波部分的光线,那它就是红色或黄色的。 具体的元素光谱:红色代表硫元素,蓝色代表氧元素,而绿色代表氢元素。 元素燃烧发出的光谱 燃烧所发出的光色根据不同的元素发出不同的光谱,每一种元素燃烧时都发出多条光谱,这种光通过三梭镜或光栅后会在屏障上显现出多条亮线,也就是说只发出有限的几种频率的光,这就是这种元素的光谱。其中会有一条或几条最亮的线,这几条最亮的线决定了在人眼中所看到的颜色。 观察光谱的方法 连续光谱的光线在通过含某种元素的气体时在光谱带上会出现多条暗线,这些暗线刚好与这种元素的光谱线位置相同,强度刚好相反,(光谱线越强的位置暗线越明显)这就是元素的吸收光谱。天文学家就是利用吸收光谱来查明遥远的恒星大气和星云中所含的元素,观察恒星红移或蓝移也要利用吸收光谱。 观察固态或液态物质的原子光谱,可以把它们放到煤气灯的火焰或电弧中去烧,使它们气化后发光,就可以从分光镜中看到它们的明线光谱 原子决定明线光谱 实验证明,原子不同,发射的明线光谱也不同,每种元素的原子都有一定的明线光谱.彩图7就是几种元素的明线光谱.每种原子只能发出具有本身特征的某些波长的光,因此,明线光谱的谱线叫做原子的特征谱线.利用原子的特征谱线可以鉴别物质和研究原子的结构。 吸收光谱 吸收光谱高温物体发出的白光(其中包含连续分布的一切波长的光)通过物质时,
光谱学课程总结
《光谱学与光谱技术》课程总结 第一章 氢原子光谱的基础 1. 氢原子的旧量子理论是由玻尔创立的,玻尔并成功地解释了氢原子光谱。 2. 在光谱学中波数定义为波长的倒数,即 。 3光谱图强度曲线中横坐标可用波长表示,也可用波数表示,还可用频率表示。 4. 当原子被激发到电离限之下时其光谱线为分立谱;当原子被激发到接近或高 于电离限的位置时其光谱线为连续谱。原子光谱是原子的结构的体现。 5. 针对H 原子的Pfund 系光谱, 22115R n ν??=- ??? H , R H =109677.6cm -1 为已知常数。请计算该线系的最长波长和最短波长。 221115R n νλ??==- ???H n =6, 22115R n ??- ??? H 最小,λ最大 n →∞,221115R n νλ??= =- ???H 最大,λ最短 6. 激光作为光谱学研究的光源有优势 (1)单色性好:普通光源发射的光包含各种不相同的频率,含有多种颜色;而激光发射的光频宽极窄, 是最好的单色光源。 (2)相干性好:由于激光是受激辐射的光放大,具有很好的相干性;而普通光 源的光由自发辐射产生是非相干光。 (3)方向性好:激光束的发散角很小,几乎是一平行的光线,便于调整光路;而普 通光源发出的光是发散的,不便于调整光路。 (4)高亮度:激光的亮度可比普通光源高出1012-1019倍,便于做各种实验。 7. 使H 原子解除简并的两种效应及其异同。 部分解除简并是由相对论(速度)效应和LS 耦合(自旋与轨道作用)作用共同 导致的,要想完全解除简并, 则需加磁场(与原子磁矩相互作用产生附加能导致 1λ
大学物理物理知识点总结
y 第一章质点运动学主要内容 一. 描述运动的物理量 1. 位矢、位移和路程 由坐标原点到质点所在位置的矢量r r 称为位矢 位矢r xi yj =+r v v ,大小 r r ==v 运动方程 ()r r t =r r 运动方程的分量形式() ()x x t y y t =???=?? 位移是描述质点的位置变化的物理量 △t 时间内由起点指向终点的矢量B A r r r xi yj =-=?+?r r r r r △,r =r △路程是△t 时间内质点运动轨迹长度s ?是标量。 明确r ?r 、r ?、s ?的含义(?≠?≠?r r r s ) 2. 速度(描述物体运动快慢和方向的物理量) 平均速度 x y r x y i j i j t t t u u u D D = =+=+D D r r r r r V V r 瞬时速度(速度) t 0r dr v lim t dt ?→?== ?r r r (速度方向是曲线切线方向) j v i v j dt dy i dt dx dt r d v y x ??????+=+==,2222y x v v dt dy dt dx dt r d v +=?? ? ??+??? ??==?? ds dr dt dt =r 速度的大小称速率。 3. 加速度(是描述速度变化快慢的物理量) 平均加速度v a t ?=?r r 瞬时加速度(加速度) 220lim t d d r a t dt dt υυ→?===?r r r r △ a r 方向指向曲线凹向j dt y d i dt x d j dt dv i dt dv dt v d a y x ????ρ ?2222+=+== 2 2222222 2 2???? ??+???? ??=? ?? ? ??+??? ??=+=dt y d dt x d dt dv dt dv a a a y x y x ? 二.抛体运动 运动方程矢量式为 2 012 r v t gt =+ r r r
仪器分析-光谱法总结
原子发射光谱:原子的外层由高层能及向底层能级,能量以电磁辐射的形式发射出去,这样就得到了发射光谱。原子发射一般是线状光谱。 原理:原子处于基态,通过电至激发,热至激发或者,光至激发等激发作用下,原子获得能量,外层电子从基态跃迁到较高能态变成激发态,经过10-8s,外层电子就从高能级向较低能级或基态跃迁,多余能量的发射可得到一条光谱线。 光谱选择定律:①主量子数的变化△n为包括零的整数,②△±1,即跃迁只能在S项与P项间,P与S或者D间,D到P和F。 ③△0,即不同多重性状间的迁移是不可能的。 ③△0,±1。但在0时,0的跃迁是允许的。N21 影响谱线强度的主要因素:1激发电位2跃迁概率3 统计权重4激发温度(激发温度↑离子↑原子光谱↓离子光谱↑)5原子密度 原子发射光谱仪组成:激发光源,色散系统,检测系统, 激发光源:①火焰:2000到3000K,只能激发激发电位低的原子:如碱性金属和碱土金属。 ②直流电弧:4000到7000K,优点:分析的灵敏度高,背景小,适合定量分析和低含量的测定。缺点:不宜用于定量分析及低熔点元素的分析。 ③交流电弧:温度比直流高,离子线相对多,稳定性比直流高,操作安全,但灵敏度差
④火花:一万K,稳定性好,定量分析以及难测元素。每次放电时间间隔长,电极头温度低。 适合分析熔点低。缺点:灵敏度较差,背景大,不宜做痕量元素分析(金属,合金等组成均匀的试样)⑤辉光激发能力强,可以激发很难激发的元素,(非金属,卤素,一些气体)谱线强度大,背景小,检出限低,稳定性好,准确度高(设备复杂,进样不方便)⑥电感耦合等离子体10000K 基体效应小,检出限低,限行范围宽⑦激光一万K,适合珍贵样品 分光系统:单色器:入射狭缝,准直装置,色散装置,聚焦透镜,出射狭缝。 棱镜:分光原理:光的折射,由于不同的光有不同的折射率,所以分开。 光栅:光的折射与干涉的总效果,不同波长的光通过光栅作用各有不同的衍射角。 分辨率: 原子发射检测法:①目视法,②光电法, ③摄谱法:用感光板来记录光谱,感光板:载片(光学玻璃)和感光乳剂(精致卤化银精致明胶)。曝光量 E感光层接受的照度、 黑度:1为没有谱线的光强,i通过谱线的光强度i ,透过率T 定性分析:铁光谱比较法,标样光谱比较法,波长测定法。
(整理)光谱分析技术及应用
光谱分析技术及应用 一、光谱分析的分类 1、原子吸收光谱法——也叫湿法分析。它是以待测元素的特征光波,通过样品的蒸发,被蒸发中的待测元素的基态原子所吸收,由辐射强度的减弱程度,来测定该元素的存在与否和含量多少;通常是采用火焰或无火焰(也叫等离子)方法,把被测元素转化为基态原子。根据吸收光波能量的多少测定元素的含量。 通常原子吸收光谱法是进行仪器定量分析的湿法分析。 2、原子发射光谱法——利用外部能量激发光子发光产生光谱。 看谱分析法就是原始的、也是最经典的利用原子发射光谱的分析方法。看谱分析法在我国工业生产上的使用是在上世纪50年代,58年北京永定机械厂制造了第一台仿苏联技术的看谱仪,随后天津光学仪器厂成为我国大量生产棱镜分光的看谱镜基地。 上世纪80年代起,德国、英国、美国等国家,开始研制采用CCD (Charge Coupled Device电荷耦合器件)技术作为光谱接收器件的直读式定量光谱仪,德国以实验室用大型直读定量光谱仪为主;英国阿朗公司、美国尼通公司以便携式金属分析仪为主打市场。近年来,德国、芬兰等国家研制生产便携式、直读定量光谱仪,分析精度在一定条件下可以替代实验室直读式定量光谱仪。 二、看谱分析的特点 1、操作简便,分析速度快。 2、适合现场操作。
3、无损检测(现场操作情况下无须破坏样品)。 4、检测成本低。是便携式金属分析仪的1/30左右,是便携式直读定量光谱仪的1/40。 5、有一定的灵敏度和准确度。 三、看谱分析的方法: 定性分析方法,所谓定性就是判定分析的元素是否存在的分析。严格的讲定性分析是根据某元素的特征灵敏线的出现与否,来确定该元素是否存在的分析方法。 那么,什么叫灵敏线呢? 某元素在某几个区域出现的几条与其它元素不同的特征线;或称“在较低含量情况下出现的谱线”,或者说是在某一范围内出现的谱线,叫做灵敏线。 半定量方法就是近似的估计元素含量的方法。 利用谱线进行比较,即通过 亮度比较含量,就是与铁基线进 行比较,含量与亮度的对数成正 比关系。(用来进行比较的铁基线 的亮度应不变。)lgI(谱线强度) 四、看谱分析的一般步骤 1、分析前的准备
仪器分析实验有机化合物的红外光谱分析解读
仪器分析实验有机化合物的红外光谱分析 2015年4月21日 有机化合物的红外光谱分析 开课实验室:环境资源楼312 【实验目的】 1、初步掌握两种基本样品制备技术及傅里叶变换光谱仪器的简单操作; 2、通过谱图解析及网上标准谱图的检索,了解由红外光谱鉴定未知物的一般过程; 3、掌握有机化合物红外光谱测定的制样方法,回顾基础有机化学光谱的相关知识。 【基本原理】 ? 原理概述:物质分子中的各种不同基团,在有选择地吸收不同频率的红外辐射后,发生振动能级之间的跃迁,形成各自独特的红外吸收光谱。据此,可对物质进行定性和定量分析。特别是对化合物结构的鉴定,应用更为广泛。 ? 红外吸收法: 类型:吸收光谱法; 原理:电子的跃迁:电子由于受到光、热、电等的激发,从一个能级转移到另一个能级的现象。这是因为分 子中的电子总是处在某一种运动状态中,每一种状态都具有一定的能量,属于一定的能级。当这些电子有选择地吸收了不同频率的红外辐射的能量,发生振动能级之间的跃迁,形成各自独特的红外吸收光谱。据此,可对化合物进行定性和定量分析; 条件:分子具有偶极矩。 【仪器与试剂】 1、仪器: 傅里叶变换红外光谱仪(德国Bruker公司,TENSOR 27型; 美国Thermo Fisher 公司, Nicolet 6700型);压片机; 玛瑙研钵; 红外灯。 2、试剂:NaCl窗片、KBr晶体,待分析试样液体及固体。 【实验步骤】 1、样品制备 (1)固体样品:KBr压片法 在玛瑙研钵将KBr晶体充分研磨后加入其量5%左右的待测固体样品,混合研磨直至均匀。在一个具有抛光面的金属模具上放一个圆形纸环,用刮勺将研磨好的
【北京理工大学】大学物理1(上)知识点总结
一 质 点 运 动 学 知识点: 1. 参考系 为了确定物体的位置而选作参考的物体称为参考系。要作定量描述,还应在参考系上建立坐标系。 2. 位置矢量与运动方程 位置矢量(位矢):是从坐标原点引向质点所在的有向线段,用矢量r 表示。位矢用于确定质点在空间的位置。位矢与时间t 的函数关系: k ?)t (z j ?)t (y i ?)t (x )t (r r ++== 称为运动方程。 位移矢量:是质点在时间△t 内的位置改变,即位移: )t (r )t t (r r -+=?? 轨道方程:质点运动轨迹的曲线方程。 3. 速度与加速度 平均速度定义为单位时间内的位移,即: t r v ?? = 速度,是质点位矢对时间的变化率: dt r d v = 平均速率定义为单位时间内的路程:t s v ??= 速率,是质点路程对时间的变化率:ds dt υ= 加速度,是质点速度对时间的变化率:dt v d a = 4. 法向加速度与切向加速度 加速度 τ?a n ?a dt v d a t n +==
法向加速度ρ=2 n v a ,方向沿半径指向曲率中心(圆心),反映速度方向的变化。 切向加速度dt dv a t =,方向沿轨道切线,反映速度大小的变化。 在圆周运动中,角量定义如下: 角速度 dt d θ = ω 角加速度 dt d ω= β 而R v ω=,22 n R R v a ω== ,β==R dt dv a t 5. 相对运动 对于两个相互作平动的参考系,有 ''kk pk pk r r r +=,'kk 'pk pk v v v +=,'kk 'pk pk a a a += 重点: 1. 掌握位置矢量、位移、速度、加速度、角速度、角加速度等描述质点运动和运动变化的 物理量,明确它们的相对性、瞬时性和矢量性。 2. 确切理解法向加速度和切向加速度的物理意义;掌握圆周运动的角量和线量的关系,并能灵活运用计算问题。 3. 理解伽利略坐标、速度变换,能分析与平动有关的相对运动问题。 难点: 1.法向和切向加速度 2.相对运动问题 三、功和能 知识点: 1. 功的定义 质点在力F 的作用下有微小的位移d r (或写为ds ),则力作的功定义为力和位移的标积即 θθcos cos Fds r d F r d F dA ==?= 对质点在力作用下的有限运动,力作的功为 ? ?=b a r d F A 在直角坐标系中,此功可写为 ???++=b a z b a y b a x dz F dy F dx F A
仪器分析光谱法总结
AES原子发射光谱:原子的外层由高层能及向底层能级,能量以电磁辐射的形式发射出去,这样就得到了发射光谱。原子发射一般是线状光谱。 原理:原子处于基态,通过电至激发,热至激发或者,光至激发等激发作用下,原子获得能屋,外层电子从基态跃迁到较髙能态变成激发态,经过10%,外层电子就从髙能级向较低能级或基态跃迁,多余能量的发射可得到一条光谱线。 光谱选择定律:①主量子数的变化为包括零的整数,②1,即跃迁只能在S项与P 项间,P与S或者D间,D到P和F。③△$=(),即不同多重性状间的迁移是不可能的。@AJ=0, ±1。但在J=O 时,J=0的跃迁是允许的。N2S+1L J 影响谱线强度的主要因素:1激发电位2跃迁概率3统汁权重4激发温度(激发温度f离子t原子光谱I离子光谱t )5原子密度 原子发射光谱仪组成:激发光源,色散系统,检测系统, 激发光源:①火焰:2000到3000K,只能激发激发电位低的原子:如碱性金属和碱上金属。 ②直流电弧:4000到7000K,优点:分析的灵敏度髙,背景小,适合定量分析和低含量的测定。缺点:不宜用于定量分析及低熔点元素的分析。 ③交流电弧:温度比直流高,离子线相对多,稳左性比直流髙,操作安全,但灵敏度差 ④火花:一万K,稳定性好,泄量分析以及难测元素。每次放电时间间隔长,电极头温度低。适合分析熔点低。缺点:灵敏度较差,背景大,不宜做痕量元素分析(金属,合金等组成均匀的试样)⑤辉光激发能力强,可以激发很难激发的元素,(非金属,卤素,一些气体)谱线强度大,背景小,检岀限低,稳左性好,准确度髙(设备复杂,进样不方便)⑥电感耦合等离子体10000K基体效应小,检岀限低,限行范用宽⑦激光一万K,适合珍贵样品分光系统:单色器:入射狭缝,准直装巻,色散装置,聚焦透镜,出射狭缝。 棱镜:分光原理:光的折射,由于不同的光有不同的折射率,所以分开。 光栅:光的折射与干涉的总效果,不同波长的光通过光栅作用各有不同的衍射角。分辨率: 原子发射检测法:①目视法,②光电法, ③摄谱法:用感光板来记录光谱,感光板:载片(光学玻璃)和感光乳剂(精致卤化银精致明胶)。曝光^H=Et E感光层接受的照度、 黑度:S=lgT-*=lg io/i io为没有谱线的光强,i通过谱线的光强度i,透过率T 定性分析:铁光谱比较法,标样光谱比较法,波长测定法。 龙量法:①基本原理②内标法⑴内标元素和被测元素有相近的物理化学性质,如沸点,熔点近似,在激发光源中有相近的蒸发性。⑵内标元素和被测元素有相近的激发能,如果选用离子线组成分析线对时,则不仅要求两线对的激发电位相等,还要求内标元素的电离电位相近。⑶内标元素是外加的,样品中不应有内标元素,⑷内标元素的含量必须适量且固泄,⑸ 汾西线和内标线无自吸或者自吸很小,且不受其他谱线干扰。⑹如采用照相法测量谱线强度,则要求两条谱线的波长应尽量靠近。 简述内标法基本原理和为什么要使用内标法。 答:内标法是通过测量谱线相对强度进行龙量分析的方法。通常在被测左元素的谱线中选一条灵敏线作为分析线,在基体元素(或定量加入的英它元素)的谱线中选一条谱线为比较线,又称为内标线。分析线与内标线的绝对强度的比值称为分析线对的相对强度。在工作条件相对变化时,分析线对两谱线的绝对强度均有变化,但对分析线对的相对强度影响不大,因此可准确地测泄元素的含量。从光谱泄量分析公式lg/=/?lgc + lgt/,可知谱线强度I与元素的浓度有关,还受到许多因素的影响,而内标法可消除工作条件变化等大部分因素带来的影响。 激发电位:原子中某一外层电子由基态激发到髙能级所需要的能量。共振线:由激发态像基态跃迁所发射的谱线。(共振线具有最小电位,最容易被激发,最强谱线) 火花线:火法激发产生的谱线,激发能量大,产生的谱线主要是离子线。又称共振线。自吸和自
有机光谱分析完整版.doc
有机光谱分析完整版 (友情提醒:本门课程内容繁芜庞杂,若能将本资料辅以课本复习,必所向披靡战无不胜) 第一章紫外吸收光谱 紫外 -可见吸收光谱是由电子能级跃迁产生的吸收光谱,检测波长在紫外和可见区即200-800 nm;红外光谱是指物质受中红外光(波长范围 400-4000cm -1)照射,发生分子振动和转动能级 跃迁产生光谱;核磁共振光谱是指在强外磁场中,用垂直于强外磁场的射频电磁场照射样品分 子,某些具有磁性的原子核吸收电磁波(射频电磁波频率与磁化矢量进动频率相同)产生原子核 能级跃迁。 自然光:包含有许多不同波长并在不同方向振动平面上传播的光; 单色光:自然光通过分光器(棱镜或光栅)得到单一波长的光,UV 光谱定量分析用单色光。 非偏振光:光波电场矢量与传播方向所组成的平面成为广播的振动面,这个振动面是无限多的。 光波垂直于光传播方向有任意方向发射的光,称为非偏振光。 圆偏正光:单一波长的线偏振光可分解为两束振幅、频率相同,旋转方向相反的圆偏振光。 椭圆偏振光:如果两束圆偏振光的振幅(强度)不相同,则合成的将是一束椭圆偏振光。 分子的运动可分为平动、转动、振动和分子内电子的运动。各能量状态是分立的,非连续的,具有量子化特征。每个电子能级中包含了若干振动能级,每个振动能级中包含了若干转动能级,即△ E 电子 >△ E 振动 >△ E 转动 有机化合物中的价电子:形成单键的ζ电子;形成双键或三键的电子;未成键的 n 电子 (O、N、 S、Cl) 电子跃迁:分子吸收光子后,基态的一个电子被激发到反键分子轨道(电子激发态)。 电子跃迁的必要条件:物质接受的紫外光或可见光的能量与价键电子的跃迁能△ E 相等。 跃迁类型: 1、ζ→ζ*跃迁:ζ轨道上的电子由基态激发到激发态产生的跃迁。需要较高能 量,一般发生在低于 150nm 的远紫外区。 2、→ * 跃迁:双键或三键中轨道上的电子吸 收紫外线后产生的跃迁。吸收峰一般在小于200 nm 的紫外区。 3、n→*跃迁:在 -CO- 、-CH O、-COOH 、硝基等基团中,不饱和键一端直接与未用电子对的杂原子相连所产生的跃迁。4、n→ζ*跃迁:含有未用电子对基团中的未用电子对在吸收光能后产生的跃迁。如-OH 、 -SH、-Cl 等。△ E:ζ→ζ*>n→ζ →*> *> n→* 电子跃迁的选律:1.自旋定律,△ S = 0(电子在跃迁过程中自旋方向不变);2.轨道选律,△ L = 0,±1(电子在同种轨道之间的跃迁是禁止的);3.对称性选律(允许跃迁:ζ→ζ*、→ * 禁阻跃迁:→ζ*、ζ→ * 、 n→ * ) 紫外吸收光谱:应用不同波长紫外或可见光依次照射一定浓度的样品溶液,并测出在不同波长处样品的吸收度,然后以波长为横坐标,吸收度为纵坐标作图,所得曲线即紫外吸收曲线。波 长范围: 100-400nm, 其中 100-200nm 为远紫外区, 200-400nm 为近紫外区(常指) 肩峰(曲折): S,是指当吸收曲线在下降或上升处有停顿或吸收稍有增加的现象,常是由 主峰内藏有其他吸收峰造成。 末端吸收:紫外吸收曲线的短波末端处吸收增强,但未成峰形。
大学物理重要知识点归纳
《大学物理上》重要知识点归纳 第一部分 (2012.6) 一、简谐运动的运动方程: x Acos( t ) 振幅 A:A x 02 (v 0 )2 角频率 :反映振动快慢,系统属性。 初相位 : 取决于初始条件 2 2 k T m 二、简谐运动物体的合外力: F kx (k 为比例系数 ) 简谐运动物体的位移: 简谐运动物体的速度: 简谐运动物体的加速度: x Acos( t ) v Asin( t ) a 2 A cos( t ) 三、旋转矢量法( 旋转矢量端点在 x 轴上投影作简谐振动) 矢量转至一、二象限,速度为负 A x o 矢量转至三、四象限,速度为正 x 四、振动动能: E k 1 mv 2 1 kA 2 sin 2 ( t ) 2 2 振动势能: E p 1 kx 2 1 k A 2 cos 2 ( t ) 2 2 振动总能量守恒: E E k E p 1 k A 2 2 五、平面简谐波波函数的几种标准形式: y Acos [ (t x ) o ] A cos [ t 2 x o ] u 0 :坐标原点处质点的初相位 x 前正负号反应波的传播方向 六、波的能量 不守恒! 任意时刻媒质中某质元的 动能 = 势能 !
a,c,e,g点:能量最大! b,d,f 点:能量最小! 七、波的相干条件: 1. 频率相同; 2. 振动方向相同; 3.相位差恒定。 八、驻波:是两列波干涉的结果 波腹点:振幅最大的点波节点:振幅最小的点 相邻波腹 (或波节 )点的距离: 2 九、电场的高斯定理 真空中:介质中:电位移: 1 q E dS S ( S内) D dS q0q0:自由电荷 S(S内) D0r E 电极化强度: P ( r 1) 0 E 十、点电荷的电场:球对称性!方向沿球面径向。 q 点电荷 q 的电场 : E( r ) 2 4 0 r 点电荷 dq 的电场:dE(r )dq 2 4 0r 十一、无限大均匀带电平面(两侧为匀强电场) E E E E 2 0 2 0 2 0 2 0
各种光谱分析的原理解读
各种仪器分析的基本原理及谱图表示方法!!!来源:张月娟的日志 紫外吸收光谱 UV 分析原理:吸收紫外光能量,引起分子中电子能级的跃迁 谱图的表示方法:相对吸收光能量随吸收光波长的变化 提供的信息:吸收峰的位置、强度和形状,提供分子中不同电子结构的信息 荧光光谱法 FS 分析原理:被电磁辐射激发后,从最低单线激发态回到单线基态,发射荧光 谱图的表示方法:发射的荧光能量随光波长的变化 提供的信息:荧光效率和寿命,提供分子中不同电子结构的信息 红外吸收光谱法 IR 分析原理:吸收红外光能量,引起具有偶极矩变化的分子的振动、转动能级跃迁谱图的表示方法:相对透射光能量随透射光频率变化 提供的信息:峰的位置、强度和形状,提供功能团或化学键的特征振动频率 拉曼光谱法 Ram 分析原理:吸收光能后,引起具有极化率变化的分子振动,产生拉曼散射 谱图的表示方法:散射光能量随拉曼位移的变化 提供的信息:峰的位置、强度和形状,提供功能团或化学键的特征振动频率 核磁共振波谱法 NMR 分析原理:在外磁场中,具有核磁矩的原子核,吸收射频能量,产生核自旋能级的跃迁 谱图的表示方法:吸收光能量随化学位移的变化 提供的信息:峰的化学位移、强度、裂分数和偶合常数,提供核的数目、所处化学环境和几何构型的信息电子顺磁共振波谱法 ESR 分析原理:在外磁场中,分子中未成对电子吸收射频能量,产生电子自旋能级跃迁 谱图的表示方法:吸收光能量或微分能量随磁场强度变化 提供的信息:谱线位置、强度、裂分数目和超精细分裂常数,提供未成对电子密度、分子键特性及几何构型信息质谱分析法 MS 分析原理:分子在真空中被电子轰击,形成离子,通过电磁场按不同m/e分离谱图的表示方法:以棒图形式表示离子的相对峰度随m/e的变化 提供的信息:分子离子及碎片离子的质量数及其相对峰度,提供分子量,元素组成及结构的信息气相色谱法 GC 分析原理:样品中各组分在流动相和固定相之间,由于分配系数不同而分离 谱图的表示方法:柱后流出物浓度随保留值的变化
(完整版)现代有机分析期末试卷(网络版)
2008学年第二学期现代有机分析期末试卷 班级:姓名:学号: 一、判断题(1*7) 1.分子离子可以是奇电子离子,也可以是偶电子离子。……………………………(×) 2. 苯环中有三个吸收带,都是由σ→σ*跃迁引起的。………………………….......…(×) 3. 离子带有的正电荷或不成对电子是它发生碎裂的原因和动力之一。..........……….....(√) 4. 当物质分子中某个基团的振动频率和红外光的频率一样时,分子就要释放能量,从原来的基态振动能级跃迁到能量较高的振动能级。…………………………………….…(×) 5. 在核磁共振中,凡是自旋量子数不为零的原子核都没有核磁共振现象。......………...(×) 6.符合比尔定律的有色溶液稀释时,其最大吸收峰的波长位置不移动但吸收峰强度发生浅色效应。………………………………………………………………………………………(√) 7. 质谱图中质荷比最大的峰不一定是分子离子峰。但分子离子峰一定是质谱图中质荷比最大的峰。………………………………………………………………………………………(√) 二、选择题(3*12) 1.含O、N、S、卤素等杂原子的饱和有机物,其杂原子均含有未成键的( B )电子。由于其所占据的非键轨道能级较高,所以其到σ*跃迁能……………………………………( A ) 1 . A. π B. n C. σ 2. A.小 B. 大 C.100nm左右 D. 300nm左右 2.质谱中分子离子能被进一步裂解成多种碎片离子,其原因是……………………( D ) A.加速电场的作用。 B.电子流的能量大。 C.分子之间相互碰撞。 D.碎片离子均比分子离子稳定。 3.用紫外可见光谱法可用来测定化合物构型,在几何构型中,顺式异构体的波长一般都比反式的对应值短,并且强度也较小,造成此现象最主要的原因是…………………………( B )
大学物理学知识总结
大学物理学知识总结 第一篇 力学基础 质点运动学 一、描述物体运动的三个必要条件 (1)参考系(坐标系):由于自然界物体的运动是绝对的,只能在相对的意义上讨论运动,因此,需要引入参考系,为定量描述物体的运动又必须在参考系上建立坐标系。 (2)物理模型:真实的物理世界是非常复杂的,在具体处理时必须分析各种因素对所涉及问题的影响,忽略次要因素,突出主要因素,提出理想化模型,质点和刚体是我们在物理学中遇到的最初的两个模型,以后我们还会遇到许多其他理想化模型。 质点适用的范围: 1.物体自身的线度l 远远小于物体运动的空间范围r 2.物体作平动 如果一个物体在运动时,上述两个条件一个也不满足,我们可以把这个物体看成是由许多个都能满足第一个条件的质点所组成,这就是所谓质点系的模型。 ~ 如果在所讨论的问题中,物体的形状及其在空间的方位取向是不能忽略的,而物体的细小形变是可以忽略不计的,则须引入刚体模型,刚体是各质元之间无相对位移的质点系。 (3)初始条件:指开始计时时刻物体的位置和速度,(或角位置、角速度)即运动物体的初始状态。在建立了物体的运动方程之后,若要想预知未来某个时刻物体的位置及其运动速度,还必须知道在某个已知时刻物体的运动状态,即初台条件。 二、描述质点运动和运动变化的物理量 (1)位置矢量:由坐标原点引向质点所在处的有向线段,通常用r 表示,简称位矢或矢径。 在直角坐标系中 zk yi xi r ++= 在自然坐标系中 )(s r r = 在平面极坐标系中 rr r = : (2)位移:由超始位置指向终止位置的有向线段,就是位矢的增量,即
1 2r r r -=? 位移是矢量,只与始、末位置有关,与质点运动的轨迹及质点在其间往返的次数无关。 路程是质点在空间运动所经历的轨迹的长度,恒为正,用符号s ?表示。路程的大小与质点运动的轨迹开关有关,与质点在其往返的次数有关,故在一般情况下: s r ?≠? 但是在0→?t 时,有 ds dr = (3)速度v 与速率v : 平均速度 t r v ??= ( 平均速率 t s v ??= 平均速度的大小(平均速率) t s t r v ??≠ ??= 质点在t 时刻的瞬时速度 dt dr v = 质点在t 时刻的速度 dt ds v = 则 v dt ds dt dr v === " 在直角坐标系中
原子光谱解读
光谱『spectrum』 光波是由原子内部运动的电子产生的.各种物质的原子内部电子的运动情况不同,所以它们发射的光波也不同.研究不同物质的发光和吸收光的情况,有重要的理论和实际意义,已成为一门专门的学科——光谱学.下面简单介绍一些关于光谱的知识. 分光镜观察光谱要用分光镜,这里我们先讲一下分光镜的构造原理.图6-18是分光镜的构造原理示意图.它是由平行光管A、三棱镜P和望远镜筒B组成的.平行光管A的前方有一个宽度可以调节的狭缝S,它位于透镜L1的焦平面①处.从狭缝射入的光线经透镜L1折射后,变成平行光线射到三棱镜P上.不同颜色的光经过三棱镜沿不同的折射方向射出,并在透镜L2后方的焦平面MN上分别会聚成不同颜色的像(谱线).通过望远镜筒B的目镜L3,就看到了放大的光谱像.如果在MN那里放上照相底片,就可以摄下光谱的像.具有这种装置的光谱仪器叫做摄谱仪. 发射光谱物体发光直接产生的光谱叫做发射光谱.发射光谱有两种类型:连续光谱和明线光谱. 连续分布的包含有从红光到紫光各种色光的光谱叫做连续光谱(彩图6).炽热的固体、液体和高压气体的发射光谱是连续光谱.例如电灯丝发出的光、炽热的钢水发出的光都形成连续光谱. 只含有一些不连续的亮线的光谱叫做明线光谱(彩图7).明线光谱中的亮线叫做谱线,各条谱线对应于不同波长的光.稀薄气体或金属的蒸气的发射光谱是明线光谱.明线光谱是由游离状态的原子发射的,所以也叫原子光谱.观察气体的原子光谱,可以使用光谱管(图6-19),它是一支中间比较细的封闭的玻璃管,里面装有低压气体,管的两端有两个电极.把两个电极接到高压电源上,管里稀薄气体发生辉光放电,产生一定颜色的光. 观察固态或液态物质的原子光谱,可以把它们放到煤气灯的火焰或电弧中去烧,使它们气化后发光,就可以从分光镜中看到它们的明线光谱. 实验证明,原子不同,发射的明线光谱也不同,每种元素的原子都有一定的明线光谱.彩图7就是几种元素的明线光谱.每种原子只能发出具有本身特征的某些波长的光,因此,明线光谱的谱线叫做原子的特征谱线.利用原子的特征谱线可以鉴别物质和研究原子的结构. 吸收光谱高温物体发出的白光(其中包含连续分布的一切波长的光)通过物质时,某些波长的光被物质吸收后产生的光谱,叫做吸收光谱。例如,让弧光灯发出的白光通过温度较低的钠气(在酒精灯的灯心上放一些食盐,食盐受热分解就会产生钠气),然后用分光镜来观察,就会看到在连续光谱的背景中有两条挨得很近的暗线(见彩图8.分光镜的分辨本领不够高时,只能看见一条暗线).这就是
