第三章 烯烃
合集下载
第三章 烯烃
2-甲基-1-丁烯
CH2 CHC CH3 CH3
CH2
CH3CH
CH2
C CH3 CH3 2-甲基-2-丁烯
CH3CH2CH
CHCH3
3-甲基-1-丁烯
2. 顺反异构:由于双键旋转受阻,构造相同的分子中的 原子在空间排列方式的不同所造成的异构现象。
CH3 C H C CH3 H
顺-2-丁烯,bp:3.5℃,mp: -139.3℃,r:0.6213
(2).顺反异构体的命名 对于取代基不同的烯烃,很难用顺或反来表示,则 用Z,E表示。
a C b (Z) C d b (E) c a C C c c>d d a>b
优先基团选择规律 a. 原子量大的原子优先 Br>Cl>S>P>Si>F>O>N>C>B>Li>H b. 若取代基游离价所在的原子的原子序数和原子量相同而 无法决定其次序时,应用外推法即顺次比较第一个、第二 个…… (CH3)3C->(CH3)2CH->CH3CH2->CH3c. 确定不饱和基团的次序时,应把不饱和键的成键原子看 做是以单键分别和相同的原子相接。 例如: C O C 当作 C C C O 当作
CH3 C H C CH3 H
CH3 H
C C
H CH3
(Z)-2-丁烯
(E)-2-丁烯
较优先基团在双键同侧的构型为Z,在异侧的构型为E。 例如:
CH3 C C CH3CH2 CH(CH3)2 CH2CH2CH3
CH3 C C CH3CH2
CH(CH3)2 >
CH(CH3)2 CH2CH2CH3
CH2CH2CH3
在酸催化剂存在时,烯烃可与羧酸、醇加成生成羧酸酯和醚:
CH2 CHC CH3 CH3
CH2
CH3CH
CH2
C CH3 CH3 2-甲基-2-丁烯
CH3CH2CH
CHCH3
3-甲基-1-丁烯
2. 顺反异构:由于双键旋转受阻,构造相同的分子中的 原子在空间排列方式的不同所造成的异构现象。
CH3 C H C CH3 H
顺-2-丁烯,bp:3.5℃,mp: -139.3℃,r:0.6213
(2).顺反异构体的命名 对于取代基不同的烯烃,很难用顺或反来表示,则 用Z,E表示。
a C b (Z) C d b (E) c a C C c c>d d a>b
优先基团选择规律 a. 原子量大的原子优先 Br>Cl>S>P>Si>F>O>N>C>B>Li>H b. 若取代基游离价所在的原子的原子序数和原子量相同而 无法决定其次序时,应用外推法即顺次比较第一个、第二 个…… (CH3)3C->(CH3)2CH->CH3CH2->CH3c. 确定不饱和基团的次序时,应把不饱和键的成键原子看 做是以单键分别和相同的原子相接。 例如: C O C 当作 C C C O 当作
CH3 C H C CH3 H
CH3 H
C C
H CH3
(Z)-2-丁烯
(E)-2-丁烯
较优先基团在双键同侧的构型为Z,在异侧的构型为E。 例如:
CH3 C C CH3CH2 CH(CH3)2 CH2CH2CH3
CH3 C C CH3CH2
CH(CH3)2 >
CH(CH3)2 CH2CH2CH3
CH2CH2CH3
在酸催化剂存在时,烯烃可与羧酸、醇加成生成羧酸酯和醚:
第三章-烯烃

Alkene
§3.1 定义
含有碳碳双键的不饱和烃叫做烯烃 碳碳双键,是烯烃的官能团。 碳碳双键,是烯烃的官能团。 官能团 分类: 分类: 单烯烃:通式是C 单烯烃:通式是CnH2n 二烯烃: 二烯烃: CnH2n-2 2n多烯烃: 多烯烃: 不饱和度: 不饱和度:Ω=n4+1+(n3-n1)/2
§3.2 结构
亲电加成反应 环状溴鎓 环状溴鎓离子 解释
立体化学特征: 立体化学特征:反式加成 几个例子
CH 3 C H CH3 C H 顺 -2-丁烯 丁 C H CH3 C H CH 3 Br2
Br+ C Br
CH3 CH3 H H C C
Br CH3
H Br 2R,3R - 2,3 - 二 溴 丁 烷 Br CH 3 H CH3 H C C Br CH 3 H
乙烯分子中的σ键 乙烯分子中的σ
乙烯分子中的π键 乙烯分子中的π
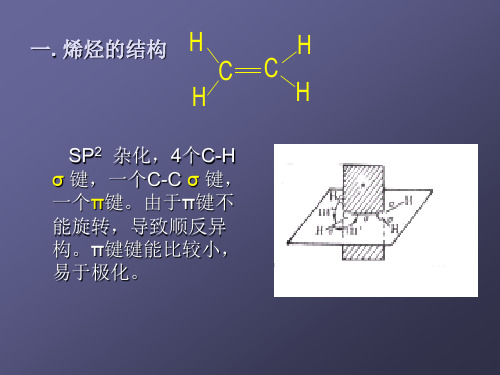
五个σ键在同一个平面上; 五个σ键在同一个平面上;π电子云分布在平面的 上下两方。C=C( 键和2p 2pπ键 上下两方。C=C(sp2-sp2 σ键和2p-2p π键) 。C=C
π键的特点: 键的特点: 不如σ键牢固( 轨道是侧面重叠的) 不如σ键牢固(因p轨道是侧面重叠的) 不能自由旋转( 键没有轨道轴的重叠) 不能自由旋转(π键没有轨道轴的重叠) 电子云沿键轴上下分布,易极化,发生反应。 电子云沿键轴上下分布,易极化,发生反应。 不能独立存在 乙烯分子中所有原子在同一平面上,键长和键角为: 乙烯分子中所有原子在同一平面上,键长和键角为:
Br+ C Br
2S,3S - 2,3 - 二 溴 丁 烷
CH3 C H CH3 C H 反-2-丁烯 丁 C CH3 CH3 C H H Br2
§3.1 定义
含有碳碳双键的不饱和烃叫做烯烃 碳碳双键,是烯烃的官能团。 碳碳双键,是烯烃的官能团。 官能团 分类: 分类: 单烯烃:通式是C 单烯烃:通式是CnH2n 二烯烃: 二烯烃: CnH2n-2 2n多烯烃: 多烯烃: 不饱和度: 不饱和度:Ω=n4+1+(n3-n1)/2
§3.2 结构
亲电加成反应 环状溴鎓 环状溴鎓离子 解释
立体化学特征: 立体化学特征:反式加成 几个例子
CH 3 C H CH3 C H 顺 -2-丁烯 丁 C H CH3 C H CH 3 Br2
Br+ C Br
CH3 CH3 H H C C
Br CH3
H Br 2R,3R - 2,3 - 二 溴 丁 烷 Br CH 3 H CH3 H C C Br CH 3 H
乙烯分子中的σ键 乙烯分子中的σ
乙烯分子中的π键 乙烯分子中的π
五个σ键在同一个平面上; 五个σ键在同一个平面上;π电子云分布在平面的 上下两方。C=C( 键和2p 2pπ键 上下两方。C=C(sp2-sp2 σ键和2p-2p π键) 。C=C
π键的特点: 键的特点: 不如σ键牢固( 轨道是侧面重叠的) 不如σ键牢固(因p轨道是侧面重叠的) 不能自由旋转( 键没有轨道轴的重叠) 不能自由旋转(π键没有轨道轴的重叠) 电子云沿键轴上下分布,易极化,发生反应。 电子云沿键轴上下分布,易极化,发生反应。 不能独立存在 乙烯分子中所有原子在同一平面上,键长和键角为: 乙烯分子中所有原子在同一平面上,键长和键角为:
Br+ C Br
2S,3S - 2,3 - 二 溴 丁 烷
CH3 C H CH3 C H 反-2-丁烯 丁 C CH3 CH3 C H H Br2
第三章_烯烃概要

CH3CH=CH-
丙烯基 CH3 CH2=C- 异丙烯基
乙烯基
CH=CHCH2-
烯丙基
CH2
亚甲基 或 甲叉基
CH3CH
亚乙基 或 乙叉基
三、物理性质(Physical Property)
与烷烃相似 ①沸点随碳原子数目增加而升高; ②密度小于1,随碳原子数目(分子量)增加而增大; ③不溶于水,易溶于苯、乙醚、氯仿,四氯化碳等 有机溶剂。
H2C=CHCH3 H2C=CHCH2C
(2)顺反异构
• 由于有机分子中存在阻碍自由旋转的因素(如双 键或脂环),在一定条件下,引起原子或原子团 在空间排列方式不同的异构现象。
顺反异构产生的原因和条件
(1)产生原因: 碳碳双键的自由转动限制
a e C C b d
CH3CH=CH2 + H 2 H2 Ni
Pt / C
CH3CH2CH3
原理:烯烃与氢加成 反应需要很高的活化 能,加入催化剂后,
可以降低反应的活化
能,使反应容易进行。
在进行催化加氢时 , 常将烯烃先溶于适当的溶剂 ( 如乙
醇,乙酸等), 然后和催化剂一起在搅拌下通入氢气。
催化剂一般制成高度分散的粉末状,还负载于载体. 大部分催化加氢都是顺式加成 , 即新的 C-H 键都形 成于双键的同侧。
反-2-丁烯 0.9 -106 0
二、命名(Nomenclature)
烯烃很少用普通名称:
CH2 CH2 CH3 CH
丙稀
CH3 C
异丁稀
CH2 CH3
CH2
乙烯
(ethylene)
(propene)
(isobutylene)
烯烃常用的是 IUPAC 命名法
有机化学 第三章 烯烃全

KOH
Br
C2H5OH
+ HBr
17
3-4 烯烃的物理性质
物质状态 C2~C4 气体,C5~C18液体 ,C19~固体
沸点、熔点和相对密度 均随相对分子量的增加而上升;直链烯烃的沸 点略高于支链烯烃;末端烯烃(α-烯烃)的沸点 略低于双键位于碳链中间的异构体。
溶解性 不溶于水,易溶于有机溶剂。
HCl CF3CH2CH2 Cl
Cl
CF3CH2CH2
(主)
HCl CF3CHCH3
Cl
Cl
CF3CHCH3
35
烯烃的亲电加成反应
HX反应活性 HI > HBr > HCl > HF
H2C CH2
HBr HAc
CH2 Br
CH2 H
HCl H2C CH2 AlCl3
H2C CH3 Cl
36
与硫酸的加成 ——间接水合
H3C C
H
CH3 C
H
H C
H3C
CH3 C
H
顺式
反式
7
3-2 烯烃的异构和命名
系统命名法
选主链:选择含双键的最长碳链作主链, 称 “某烯”, 若碳原子数大于10, 则称为“某碳 烯”;
编号:从靠近双键的一端开始编号,确定双键 (两双键碳原子中编号小的数字)及其它取代 基的位次;
其它同烷烃的命名。
18
顺 反 异 构 体 的 差 异
极性较大, b.p. 较高 极性较小, b.p. 较低
对称性较差,m.p. 较低
对称性较好,m.p. 较高19
3-5 烯烃的化学性质(重点)
• 反应:加成、氧化、卤代
α HCCC
第三章 烯 烃

第三章 烯 烃 (Alkenes )
3.1 烯烃的结构
一、sp2杂化(sp2 Hybridization)
H C H C
H H
乙烯的结构
三个 sp2 杂化轨道 乙烯中的五个σ键 处于同一平面
定义:两个P电子轨道以“肩并肩”的方式 而形成的键叫π键。形成π键的电子称为 π电子。
H C H C H
H
亲电加成(Electrophilic Addtion Reactions) :
C
C
+
H
X
C H
C X
A. 反应机理:
δ + δ -
(1)
C
C
+
H
X
C H
C +
+
X
碳正 离 子 中 间 体
(2)
C H C +
+
X
C H
C X
CH2 CH2 CH2
CH2 CH2 CH2ຫໍສະໝຸດ + + +
HCl HBr HI
(1)、催化氧化 使用催化剂,以氧气或过氧化物为氧化剂 可得到不同产物:
O
+ O2 + O2
PdCl2/CuCl2
Ag
O
(2)、高锰酸钾氧化
• 与冷而稀的高锰酸钾水溶液反应
R R' H
KMnO4
常温
R HO
R'
顺式 邻 二 醇
H
OH
•与热而浓的高锰酸钾水溶液反应,随着烯 烃结构不同产物不同
R R'' H
规则的理论依据:
1)碳正离子稳定性 碳正离子的形成:
3.1 烯烃的结构
一、sp2杂化(sp2 Hybridization)
H C H C
H H
乙烯的结构
三个 sp2 杂化轨道 乙烯中的五个σ键 处于同一平面
定义:两个P电子轨道以“肩并肩”的方式 而形成的键叫π键。形成π键的电子称为 π电子。
H C H C H
H
亲电加成(Electrophilic Addtion Reactions) :
C
C
+
H
X
C H
C X
A. 反应机理:
δ + δ -
(1)
C
C
+
H
X
C H
C +
+
X
碳正 离 子 中 间 体
(2)
C H C +
+
X
C H
C X
CH2 CH2 CH2
CH2 CH2 CH2ຫໍສະໝຸດ + + +
HCl HBr HI
(1)、催化氧化 使用催化剂,以氧气或过氧化物为氧化剂 可得到不同产物:
O
+ O2 + O2
PdCl2/CuCl2
Ag
O
(2)、高锰酸钾氧化
• 与冷而稀的高锰酸钾水溶液反应
R R' H
KMnO4
常温
R HO
R'
顺式 邻 二 醇
H
OH
•与热而浓的高锰酸钾水溶液反应,随着烯 烃结构不同产物不同
R R'' H
规则的理论依据:
1)碳正离子稳定性 碳正离子的形成:
03第三章 烯烃

2-甲基 丁烯,2-甲基丁烯 甲基-1-丁烯 甲基 丁烯, 甲基丁烯
如双键位置在第一个碳上,双键位置数据可省。 如双键位置在第一个碳上,双键位置数据可省。
命名规则(系统命名 命名规则 系统命名): 系统命名
(1) 选择含碳碳双键的最长碳链为主链 母体 ; 选择含碳碳双键的最长碳链为主链(母体 含碳碳双键的最长碳链为主链 母体); (2) 碳链编号时,应从靠近双键的一端开始; 碳链编号时,应从靠近双键的一端开始; 靠近双键的一端开始 (3) 烯前要冠以官能团位置的数字 编号最小 ; 烯前要冠以官能团位置的数字(编号最小 位置的数字 编号最小); (4) 其它同烷烃的命名规则。 其它同烷烃的命名规则。
(5) 乙烯的结构对键长、键角的影响 乙烯的结构对键长、
甲烷的H-C-H键角 键角109.5º 甲烷的 键角 单键长:0.154nm • C-C单键长 单键长 C=C双键键长 双键键长:0.133nm 双键键长 • 断裂乙烷C-C σ 单键需要 断裂乙烷C-C 347kJ/mol 断裂双键需要611kJ/mol; 断裂双键需要 双键需要
双键使烯烃有较大的活性
说明碳碳 π 键断裂需要264kJ/mol 键断裂需要
3.2.2 顺反异构现象 (立体异构现象 立体异构现象) 立体异构现象
由于双键不能自由旋转, 由于 双键不能自由旋转,当双键的两个碳原子各连接 双键不能自由旋转 不同的原子或基团时,可能产生不同的异构体。 不同的原子或基团时,可能产生不同的异构体。
(2) sp2杂化
能 量
2p — — — 2s — 1s —
基态
2p — — — 2s — 1s —
激发态
————
sp2
pz
sp2杂化态
第三章 烯烃

亲电试剂
H X C H 0oC C H C OSO3H C OH C X C OH C X
卤代烷
(X=Cl, Br, I) H OSO3H
硫酸氢酯
C
C
+
H H OH C H
-
醇
CCl4 C X C X
X X (X=Cl, Br)
-
邻二卤代烷
X
OH
b-卤代醇
次卤酸
1、 烯烃与 H-X 的加成
烯烃的化学性质
1. 双键的结构与性质分析
C C
C
C
键能: s 键 ~347 kJ / mol p 键 ~263 kJ / mol
p 电子结合较松散, 易参与反应。是电子 供体,有亲核性。
p 键活性比 s 键大
与亲电试剂结合
不饱和,可加成至饱和
与氧化剂反应
2. 烯烃加成的三种主要类型
加 成
双取代烯烃异构体用“顺”、“反”标
记
(H3C)2HC H C(CH3)3 H
顺-2, 2, 5-三甲基-3-己烯
cis-2, 2, 5-trimethyl-3-hexene
取代基在双键的同侧
多取代烯烃,用 Z 或 E 型标记 Z 型:两个双键碳上的优先基团(或原子)在同一侧。 E 型:两个双键碳上的优先基团(或原子)不在同一侧。
o
Br H
+
H
Br
立体有择反应,立体选择性:Br2 > Cl2
在有机分析中的应用:鉴别烯烃 例:烯烃 + 5%溴的CCl4溶液 红棕色褪去
烯烃与X2的亲电加成机理(环正离子机理)
X X C C X X C C C X X X C C C C OH2 X H2O H2O C C -H HO C -H X C C OH X C C C C X X X
第三章 烯烃

3.1.2 烯烃的命名规则(系统命名):
(1)主链选择:选择含碳碳双键的最长碳链为主 链(母体),根据含碳数目称为某烯. (2)主链编号:从最靠近双键的一端开始给主碳 链编号. (3)双键位置:将双键位置标明在烯烃名称前面 (只标出位次较小双键碳原子位置). (4)其它同烷烃的命名规则.
Naming alkenes
B.碳正离子的结构和稳定性 ----马尔科夫尼科夫(Markovnikov,s rule)规律 CH3
2 C=CH2 CH3 2-甲基丙烯
CH3 CH3 + 2HCl C-CH3 + CH-CH2Cl CH3 Cl CH3
主要产物
马尔科夫尼科夫规律 --卤化氢与不对称烯烃加成时, 可以得到两种不同的产物,以H原子加到含氢较多的双 键C原子上,而卤素原子加到含氢较少或不含氢的双键 碳原子上的那种产物为主. Why?
>C=C< + Y-X -C-C( sp2) Y Z
(sp3)
例1: CH2=CH2 +Cl-Cl CH2Cl-CH2Cl H= -171kJ/mol 例2: CH2=CH2 +Br-Br CH2Br-CH2Br H= -69kJ/mol
• 加成反应往往是放热反应,往往需要较低的活化能. 所以烯烃容易发生加成反应是烯烃的一个特征反应.
在烯烃名称前加顺(cis-)或反(trans-)字表示,例如:
CH3 CH3 CH3 CH3
C=C
H H H
C=C
Cl
顺-2-丁烯
CH3 C=C H
顺-2-氯-2-丁烯
CH3CH2 C=C CH3
H
CH3
H
H
反-2-丁烯
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第三章 单烯烃
饱和烃(烷烃) 烃
单烯烃,二烯烃
不饱和烃
炔烃
联烯
1
§.1 烯烃的结构
单烯烃:分子中含有一个碳碳双键的不饱和开链 烃,通式为CnH2n。
C
C
官能团:烯键,碳碳双键
2
§.1 烯烃的结构
0.1330nm H 116.6
o
H 0.108nm 121.7o H
H
六个原子共平面
3
§.1 烯烃的结构
亲电加成反应
与卤素加成 与硼烷加成
自由基加成反应
39
烯烃与HBr的自由基加成反应 ――过氧化物效应
有ROOR (过氧化物) CH3 CH2CH 1-丁烯 无ROOR CH2
CH3 CH2 CH2 CH2 Br (1) 1-溴丁烷 (反马氏加成) CH3 CH2 CH CH3 Br 2-溴丁烷 (顺马氏加成)
H3C
CH2CH3
H3C
CH3
C C H CH3 ( Z )-3- 甲基-2-戊烯
C C H CH2CH3 (E )-3- 甲基-2-戊烯
反-3- 甲基-2-戊烯
顺-3- 甲基-2-戊烯
19
§.2 烯烃的同分异构和命名
烯基
当烯烃去掉一个氢原子后剩下的一价基团叫做 烯基。
CH2=CHCH3CH=CHCH2=CH-CH2CH2= C(CH 3)–
CH3CH=CH2 + HI
CH3CHICH3 + CH3CH2CH2I (主) (极少)
31
§4.1 加成反应
马尔科夫尼科夫规则:
不对称结构的烯烃与酸(HX)加成时,酸的负基(X-)主 要加到含氢原子较少的双键碳原子上。简称马氏规则。
CH3CH2 CH 1-丁烯
CH2
+
HBr
HOAC
CH3CH2CH CH3 Br 2-溴丁烷 80%(主)
49
a-H反应:
250oC CH3CH=CH2 + Cl2 500-600oC O CH3CH=CH2 + NBr O R 2O 2
Cl Cl CH 3 CH CH2
加成
Cl CH2 CH CH2 取代 O Br CH2 CH CH2 + NH O
易断裂、易极化、易起化学反应。
5
§.1 烯烃的结构
分子轨道理论的描述
ψ 2 = Φ1 - Φ2
Φ1
Φ2
ψ 1= Φ 1 + Φ 2
6
§.2 烯烃的同分异构和命名
烯烃的同分异构
碳干异构 构造异构 (双键)位置异构 顺反异构
①或②与③为碳链异构 ①或②与③为碳链异构 ①与②为位置异构 ①与②为位置异构
44
酸性条件下,烯烃氧化后双键断裂,并遵循如下规律:
CH 2
CO 2
RCH R2
RCO 2H R1R2CO
R1
CH 3 CH3C=CHCH 3
KMnO 4 H+
CH 3COCH 3 + CH 3COOH
45
§.4 烯烃的化学性质
OsO4代替KMnO4,产物为顺式二醇。但OsO4价格昂贵且毒性 大。
势能
-126.8 kJ/mol
-119.7 kJ/mol
-115.5 kJ/mol
29
§4.1 加成反应
E
与卤化氢加成 与酸加成 与硫酸加成 与卤素加成 与硼烷加成
R C R
R C R
亲电加成反应
30
§4.1 加成反应
与HX加成:
气态卤化氢,发烟氢卤酸能反应。浓氢碘酸、浓氢溴酸可反 应,浓盐酸一般不反应,要用催化剂(AlCl3)才行。 卤化氢活泼性的次序:HI > HBr >
CH3CH CH2 + Cl2 + H2O
CH3CH CH2 OH Cl 1-氯异丙醇
HO
Cl
36
与乙硼烷的加成:
由B-H键对烯烃双键进行加成的反应,称为硼氢化反应。
C C
+ 1/2B2H6
C C H BH2
B2H6
2BH3
乙硼烷
甲硼烷
37
当不对称烯烃与乙硼烷反应时,加成取向反马氏规 则,即硼加到含氢多的碳原子上。
27
为什么有催化剂存在,烯烃与氢加成就 很容易进行呢? 催化剂能降低反应的活化能。
烯烃氢化反应是定量进行。氢化反应是放热反应。1mol不 饱和化合物氢化时放出的热量即为氢化热。
氢化热小,化合物内能少,更稳定;连接在双键碳原子上的 烷基数目越多的烯烃更为稳定。反式比顺式稳定。
28
§4.1 加成反应
41
加成反应
氧化
a-H反应
聚合反应
42
KMnO 4或OsO4氧化
氧化
臭氧化
催化氧化
43
KMnO4或OsO4氧化:
碱性KMnO4
RCH CH2
R-CH OH
CH2 OH
+ MnO 2
+ KOH
酸性KMnO 4
顺-1,2- 二醇
RCOOH +
棕色
CO 2 + Mn2+
无色
反应现象明显,可以用来定性鉴别不饱和烃。
22
因杂化轨道中,s成分越多,原子核对这一轨道 上电子的束缚力越强。所以在C(sp3)-C(sp2)键 上电子云是不对称分布的。
电负性:sp > sp2 > sp3
23
CH 3 H
C
C
CH 3 H
CH 3 H
H
C
C CH 3
μ = 1.1× 10-30 C.m
μ=0
b.p
顺式(3.5℃)> 反式(0.9℃)
碳原子依次编号。
3 、将双键的位置标明在烯烃(母体)名称的前面
(只写出双键碳原子中位次较小的一个)。
4、其它同烷烃的命名。
11
2-甲基-2- 丁烯
3-甲基-2- 乙基-1- 丁烯
2,4,5-三甲基-2- 庚烯
12
§.2 烯烃的同分异构和命名
顺反异构体的命名
a b a b
H 3C H H 3C H
CH3 CH3CH2CH CH2 1- 丁烯 ① CH3 CH CH CH3 CH3 C CH2
2- 丁烯 ②
异丁烯 ③
7
§.2 烯烃的同分异构和命名
a
c d
b a
c d
顺反异构
b
a≠b且 c≠d
产生原因:组成双键的两个碳原子不能相对自由旋转, 使得这两个原子上所连的原子和原子团在空间配置不 同,以致形成不同的几何构型。
H BH2 CH3 CH3 CH CH2 CH CH2 CH3 CH3 CH CH2 CH CH2 (BH3)2
OH-、H2O2
(80%)
CH3 CH CH2 CH2 CH2 OH CH3
硼氢化-氧化反应:由烯烃制醇(加成方式与烯烃直接水解不同)。
38
催化氢化 与酸加成
与卤化氢加成 与硫酸加成
加成反应
催化氢化 与酸加成
与卤化氢加成 与硫酸加成
加成反应
亲电加成反应
与卤素加成 与硼烷加成
自由基加成反应
26
§4.1 加成反应
氢化反应是还原反应的一种重要形式。在催化剂存在下,烯 烃与分子氢所起的加成反应称为催化氢化。
R-CH=CH
2
+ H2
cPd粉或Raney Ni等异相催化剂;(Ph3P) 3RhCl 等均相催化剂。
+
HBr
(2)
解释:反应机理不同 (1)为自由基加成 (2)为离子型亲电加成
40
RO OR
均裂
2 RO
▲ 链引发:
RO
+
HBr
ROH
+
Br
CH3CH2 CH
CH2
+ + +
Br 2
Br
π键均裂
CH3CH2 CHCH2 Br (仲自由基)
▲ 链传递:
CH3CH2CH
CH2
Br
CH3CH2 CHCH2 (伯自由基) Br
CH3 H2O H3C C CH3 OSO2OH
CH3 H3C C CH3 OH
33
卤化:烯烃与卤素起加成反应,生成相邻两个碳原 子各带一个卤原子的邻二卤化物。
CC
+ X2
C C X X
BrBr n-C4H9-HC-CH2
n-C4H9-HC=CH2 + Br2
CCl4
溴的CCl4溶液褪色常作为烯烃定性鉴别的依据。 卤素的活泼性次序:F2>Cl2>Br2>I2
+
CH CH3CH2CH2 2 Br 1-溴丁烷 20%(次)
凡反应中键的形成或断裂有两种以上取向而只有一主要产物生 成者称为区位选择性。
32
§4.1 加成反应
与硫酸加成:
H2C CH2 + HHSO4
H3C CH2 OSO2OH
H2O
H3C CH2 OH
H3C C CH2 + HHSO4 H3C
催化氧化:
Ag H 2C CH 2 + O2 200-300℃ PdCl2-CuCl2 100-125℃ PdCl2-CuCl2 120℃
H 2C
CH 2 O
CH 2 CH2 H3C H H H
+ O2
CH 3CHO
+ O2
CH3COCH3
以氧化钼与氧化铋或磷钼酸铋为催化剂,则:
CH3 CH=CH2 + NH3 + O2 cat. H2C=CHCN + 3H2O
饱和烃(烷烃) 烃
单烯烃,二烯烃
不饱和烃
炔烃
联烯
1
§.1 烯烃的结构
单烯烃:分子中含有一个碳碳双键的不饱和开链 烃,通式为CnH2n。
C
C
官能团:烯键,碳碳双键
2
§.1 烯烃的结构
0.1330nm H 116.6
o
H 0.108nm 121.7o H
H
六个原子共平面
3
§.1 烯烃的结构
亲电加成反应
与卤素加成 与硼烷加成
自由基加成反应
39
烯烃与HBr的自由基加成反应 ――过氧化物效应
有ROOR (过氧化物) CH3 CH2CH 1-丁烯 无ROOR CH2
CH3 CH2 CH2 CH2 Br (1) 1-溴丁烷 (反马氏加成) CH3 CH2 CH CH3 Br 2-溴丁烷 (顺马氏加成)
H3C
CH2CH3
H3C
CH3
C C H CH3 ( Z )-3- 甲基-2-戊烯
C C H CH2CH3 (E )-3- 甲基-2-戊烯
反-3- 甲基-2-戊烯
顺-3- 甲基-2-戊烯
19
§.2 烯烃的同分异构和命名
烯基
当烯烃去掉一个氢原子后剩下的一价基团叫做 烯基。
CH2=CHCH3CH=CHCH2=CH-CH2CH2= C(CH 3)–
CH3CH=CH2 + HI
CH3CHICH3 + CH3CH2CH2I (主) (极少)
31
§4.1 加成反应
马尔科夫尼科夫规则:
不对称结构的烯烃与酸(HX)加成时,酸的负基(X-)主 要加到含氢原子较少的双键碳原子上。简称马氏规则。
CH3CH2 CH 1-丁烯
CH2
+
HBr
HOAC
CH3CH2CH CH3 Br 2-溴丁烷 80%(主)
49
a-H反应:
250oC CH3CH=CH2 + Cl2 500-600oC O CH3CH=CH2 + NBr O R 2O 2
Cl Cl CH 3 CH CH2
加成
Cl CH2 CH CH2 取代 O Br CH2 CH CH2 + NH O
易断裂、易极化、易起化学反应。
5
§.1 烯烃的结构
分子轨道理论的描述
ψ 2 = Φ1 - Φ2
Φ1
Φ2
ψ 1= Φ 1 + Φ 2
6
§.2 烯烃的同分异构和命名
烯烃的同分异构
碳干异构 构造异构 (双键)位置异构 顺反异构
①或②与③为碳链异构 ①或②与③为碳链异构 ①与②为位置异构 ①与②为位置异构
44
酸性条件下,烯烃氧化后双键断裂,并遵循如下规律:
CH 2
CO 2
RCH R2
RCO 2H R1R2CO
R1
CH 3 CH3C=CHCH 3
KMnO 4 H+
CH 3COCH 3 + CH 3COOH
45
§.4 烯烃的化学性质
OsO4代替KMnO4,产物为顺式二醇。但OsO4价格昂贵且毒性 大。
势能
-126.8 kJ/mol
-119.7 kJ/mol
-115.5 kJ/mol
29
§4.1 加成反应
E
与卤化氢加成 与酸加成 与硫酸加成 与卤素加成 与硼烷加成
R C R
R C R
亲电加成反应
30
§4.1 加成反应
与HX加成:
气态卤化氢,发烟氢卤酸能反应。浓氢碘酸、浓氢溴酸可反 应,浓盐酸一般不反应,要用催化剂(AlCl3)才行。 卤化氢活泼性的次序:HI > HBr >
CH3CH CH2 + Cl2 + H2O
CH3CH CH2 OH Cl 1-氯异丙醇
HO
Cl
36
与乙硼烷的加成:
由B-H键对烯烃双键进行加成的反应,称为硼氢化反应。
C C
+ 1/2B2H6
C C H BH2
B2H6
2BH3
乙硼烷
甲硼烷
37
当不对称烯烃与乙硼烷反应时,加成取向反马氏规 则,即硼加到含氢多的碳原子上。
27
为什么有催化剂存在,烯烃与氢加成就 很容易进行呢? 催化剂能降低反应的活化能。
烯烃氢化反应是定量进行。氢化反应是放热反应。1mol不 饱和化合物氢化时放出的热量即为氢化热。
氢化热小,化合物内能少,更稳定;连接在双键碳原子上的 烷基数目越多的烯烃更为稳定。反式比顺式稳定。
28
§4.1 加成反应
41
加成反应
氧化
a-H反应
聚合反应
42
KMnO 4或OsO4氧化
氧化
臭氧化
催化氧化
43
KMnO4或OsO4氧化:
碱性KMnO4
RCH CH2
R-CH OH
CH2 OH
+ MnO 2
+ KOH
酸性KMnO 4
顺-1,2- 二醇
RCOOH +
棕色
CO 2 + Mn2+
无色
反应现象明显,可以用来定性鉴别不饱和烃。
22
因杂化轨道中,s成分越多,原子核对这一轨道 上电子的束缚力越强。所以在C(sp3)-C(sp2)键 上电子云是不对称分布的。
电负性:sp > sp2 > sp3
23
CH 3 H
C
C
CH 3 H
CH 3 H
H
C
C CH 3
μ = 1.1× 10-30 C.m
μ=0
b.p
顺式(3.5℃)> 反式(0.9℃)
碳原子依次编号。
3 、将双键的位置标明在烯烃(母体)名称的前面
(只写出双键碳原子中位次较小的一个)。
4、其它同烷烃的命名。
11
2-甲基-2- 丁烯
3-甲基-2- 乙基-1- 丁烯
2,4,5-三甲基-2- 庚烯
12
§.2 烯烃的同分异构和命名
顺反异构体的命名
a b a b
H 3C H H 3C H
CH3 CH3CH2CH CH2 1- 丁烯 ① CH3 CH CH CH3 CH3 C CH2
2- 丁烯 ②
异丁烯 ③
7
§.2 烯烃的同分异构和命名
a
c d
b a
c d
顺反异构
b
a≠b且 c≠d
产生原因:组成双键的两个碳原子不能相对自由旋转, 使得这两个原子上所连的原子和原子团在空间配置不 同,以致形成不同的几何构型。
H BH2 CH3 CH3 CH CH2 CH CH2 CH3 CH3 CH CH2 CH CH2 (BH3)2
OH-、H2O2
(80%)
CH3 CH CH2 CH2 CH2 OH CH3
硼氢化-氧化反应:由烯烃制醇(加成方式与烯烃直接水解不同)。
38
催化氢化 与酸加成
与卤化氢加成 与硫酸加成
加成反应
催化氢化 与酸加成
与卤化氢加成 与硫酸加成
加成反应
亲电加成反应
与卤素加成 与硼烷加成
自由基加成反应
26
§4.1 加成反应
氢化反应是还原反应的一种重要形式。在催化剂存在下,烯 烃与分子氢所起的加成反应称为催化氢化。
R-CH=CH
2
+ H2
cPd粉或Raney Ni等异相催化剂;(Ph3P) 3RhCl 等均相催化剂。
+
HBr
(2)
解释:反应机理不同 (1)为自由基加成 (2)为离子型亲电加成
40
RO OR
均裂
2 RO
▲ 链引发:
RO
+
HBr
ROH
+
Br
CH3CH2 CH
CH2
+ + +
Br 2
Br
π键均裂
CH3CH2 CHCH2 Br (仲自由基)
▲ 链传递:
CH3CH2CH
CH2
Br
CH3CH2 CHCH2 (伯自由基) Br
CH3 H2O H3C C CH3 OSO2OH
CH3 H3C C CH3 OH
33
卤化:烯烃与卤素起加成反应,生成相邻两个碳原 子各带一个卤原子的邻二卤化物。
CC
+ X2
C C X X
BrBr n-C4H9-HC-CH2
n-C4H9-HC=CH2 + Br2
CCl4
溴的CCl4溶液褪色常作为烯烃定性鉴别的依据。 卤素的活泼性次序:F2>Cl2>Br2>I2
+
CH CH3CH2CH2 2 Br 1-溴丁烷 20%(次)
凡反应中键的形成或断裂有两种以上取向而只有一主要产物生 成者称为区位选择性。
32
§4.1 加成反应
与硫酸加成:
H2C CH2 + HHSO4
H3C CH2 OSO2OH
H2O
H3C CH2 OH
H3C C CH2 + HHSO4 H3C
催化氧化:
Ag H 2C CH 2 + O2 200-300℃ PdCl2-CuCl2 100-125℃ PdCl2-CuCl2 120℃
H 2C
CH 2 O
CH 2 CH2 H3C H H H
+ O2
CH 3CHO
+ O2
CH3COCH3
以氧化钼与氧化铋或磷钼酸铋为催化剂,则:
CH3 CH=CH2 + NH3 + O2 cat. H2C=CHCN + 3H2O
