2015届高三第一轮复习《化学反应速率和化学平衡》单元测试
高考化学化学反应速率和化学平衡一轮复习(原卷版)

化学反应速率和化学平衡一、单选题1.下列叙述正确的是( )A .铝单质可以从MnO 2中置换出MnB .海水中含有丰富的碘元素,因此碘被称为“海洋之素”C .我国华为Al 芯片已跻身于全球Al 芯片榜单前列,该芯片的主要材料是二氧化硅D .纯锌与稀硫酸反应产生氢气的速率较慢,再加入少量CuSO 4固体,速率不改变 2.反应()()()()2Fe s +CO g FeO s +CO g ,ΔH>0,700℃时平衡常数为1.47。
下列说法正确的是A .升高温度该反应的正反应速率增大,逆反应速率减小B .平衡后再加入一定质量的铁粉,该反应速率加快,平衡向正反应方向移动C .绝热容器中进行该反应,温度不再变化时,则达到化学平衡状态D .900℃时平衡常数小于1.47 3.可逆反应2NO 2(g)2NO(g)+O 2(g)在恒容密闭容器中进行,达到平衡状态的标志是( )①单位时间内生成nmolO 2的同时生成2nmolNO ②单位时间内生成nmolO 2的同时生成2nmolNO 2③用NO 2、NO 、O 2的物质的量浓度变化表示的反应速率之比为2:2:1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态⑥混合气体的平均相对分子质量不再改变的状态。
A .①③⑤B .②④⑥C .①③④D .①②③④⑤⑥4.某科研小组利用有机胺(TBA)参与联合生产碳酸氢钠和二氯乙烷的工艺流程如图所示。
下列说法错误的是A .过程①中的TBA 替代了侯德榜制碱法中的氨气B .过程②的反应为2224TBA HCl+O +4CuCl=4TBA+4CuCl +2H O ⋅C .理论上每产生2421molC H Cl 需要21molCuClD .流程中可循环利用的物质是TBA 、CuCl 5.在密闭容器中,反应 X(g) + 2Y(g)2Z(g) + W(s)达到平衡后,若将容器体积扩大一倍,对反应产生的影响是A .v(正) 减小, v(逆) 增大B .v(正) 增大, v(逆) 减小C .v(正) 、v(逆) 都减小D .v(正) 、v(逆) 都增大6.密闭容器中进行反应M(g)+N(g)R(g)+2L(?),R 的体积分数φ随时间的变化情况如图所示。
化学反应速率和化学平衡单元测试

化学反应速率与化学平衡月考一、选择题(3分×10=30分)1. 在2A(g) +B(g)3C(g)+ 4D(g) 反应中,表示该反应速率最快的是()A. v(A)=0.5 mol·L-1· s-1B. v(B)=0.3 mol·L-1· s-1C. v(C)=0.8 mol·L-1· s-1D. v(D)=60 mol·L-1· min-12. 可以证明可逆反应N 2+3H22NH3已达到平衡状态的是()①混合气体的总质量不变;②一个N≡N键断裂的同时,有6个N—H键断裂;③其它条件不变时,混合气体平均相对分子质量不再改变;④保持其它条件不变时,体系压强不再改变;⑤NH3、N2、H2的体积分数都不再改变;⑥恒温恒容时,混合气体的密度保持不变;⑦正反应速率v(H2)=0.6 mol·L-1· min-1,逆反应速率v(NH3)=0.4 mol·L-1· min-1A.全部B.②③④⑤⑦C.①③④⑤D.③⑤⑥⑦3.反应X(g)+Y(g)2Z(g) △H<0,达到平衡时,下列说法正确的是()A. 减小容器体积,平衡向右移动B. 加入催化剂,Z的产率增大C. 增大c(X),X的转化率增大D. 降低温度,Y的转化率增大4. 只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是()A.K值不变,平衡可能移动B.K值变化,平衡一定移动C.平衡移动,K值可能不变D.平衡移动,K值一定变化5. 某反应过程能量变化如图所示,下列说法正确的是()A.反应过程a有催化剂参与B.该反应为放热反应,热效应等于△HC.改变催化剂,可改变该反应的焓变D.有催化剂的条件下,反应的活化能等于E1+E26. 已知一定温度时发生反应Na 2SO4(s)+4H2(g)Na2S(s)+4H2O(g)ΔH=-225 kJ·mol-1,该反应的正反应速率随时间的变化情况如图所示,在t1时改变了某种条件,反应在t2时达平衡,改变的条件可能是( )A .升高温度B .增大H 2的浓度C .使用催化剂D .增大压强7. 某温度下,对于反应N 2(g)+3H 2(g)2NH 3(g) ΔH =-92.4 kJ/mol 。
高三第一轮复习《化学反应速率和化学平衡》单元测试

高三第一轮复习《化学反应速率和化学平衡》单元测试相对原子质量:H-1 C-12 N-14 O-16 Mg-24 Si-28一、选择题(共42分)1、科学家最近研制出可望成为高效火箭推动剂N(NO2)3(如以下图所示)。
已知该分子中N-N-N键角都是108.1°,以下相关N(NO2)3的说法准确的是()A.分子中N、O间形成的共价键是非极性键B.分子中四个氮原子共平面C.该物质既有氧化性又有还原性D.15.2g该物质含有6.02×1022个原子2、结合右图判断,以下表达准确的是A.I和II中正极均被保护B. I和II中负极反应均是Fe-2e-=Fe2+C. I和II中正极反应均是O2+2H2O+4e-===4OH―D. I和II中分别加入少量K3[Fe(CN)6]溶液,均有蓝色沉淀3、25℃、101kPa下:①2Na(s)+12O2(g)=Na2O(s) △H= -414kJ mol-1②2Na(s)+O2(g)=Na2O2(s) △H= -511kJ mol-1以下说法准确的是A.①和②产物的阴阳离子个数比不相等B.①和②生成等物质的量的产物,转移电子数不同C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快D. 25℃、101kPa下:Na2O2(s)+2Na(s)=2Na2O(s) △H= -317kJ mol-14、电镀废液中Cr2O72-可通过以下反应转化成铬黄(PbCrO4):Cr2O72-(aq)+2Pb2+(aq)+H2O(l)2PbCrO4(s)+2H+(aq)△H<0该反应达平衡后,改变横坐标表示的反应条件,以下示意图准确的是5、中学化学中很多“规律”都有其适用范围,以下根据相关“规律”推出的结论合理的是A.根据同周期元素的最高价氧化物的酸性强弱,推出F非金属性比N强B.根据较强酸能够制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO C.根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性D.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+76、体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2 (g)+O2 (g)2SO3 (g)并达到平衡。
2015届高考化学(人教版B)一轮复习配套单元测试:第七章化学反应速率化学平衡(含解析)
升学助考一网通第七章化学反响速率化学均衡测试卷满分 100 分,考试时间90 分钟试卷说明:本试卷分第Ⅰ卷(选择题 )和第Ⅱ卷(非选择题 )两部分。
请将第Ⅰ卷的答案填涂在答题卡上,第Ⅱ卷可在各题后直接作答。
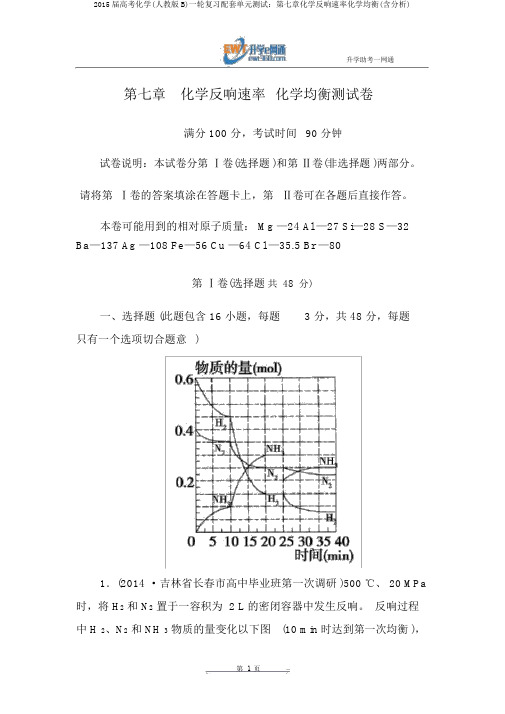
本卷可能用到的相对原子质量: Mg —24 Al —27 Si—28 S—32 Ba—137 Ag —108 Fe—56 Cu —64 Cl —35.5 Br —80第Ⅰ卷(选择题共48分)一、选择题 (此题包含 16 小题,每题 3 分,共 48 分,每题只有一个选项切合题意)1.(2014 ·吉林省长春市高中毕业班第一次调研)500 ℃、 20 MPa 时,将 H2和 N2置于一容积为 2 L 的密闭容器中发生反响。
反响过程中 H 2、N2和 NH 3物质的量变化以下图(10 min 时达到第一次均衡 ),以下说法正确的选项是 ()A .反响开始到第一次均衡时,N2的均匀反响速率为0.005 mol/(L ·min)B.从曲线能够看出,反响进行到10 min 至 20 min 时可能是使用了催化剂C.从曲线能够看出,反响进行至25 min 时,增添了 0.1 mol 的氨气D.在 25 min 时均衡正向挪动但达到新均衡后 NH 3的体积分数比原均衡小分析:此题考察化学均衡有关知识,意在考察考生的识图能力和剖析问题的能力。
第一次在10 min时达到均衡,则v(N2) =0.4 mol-0.35 mol2 L=0.0025 mol/(L ·min) ,A 项错误;因为10 min 到10 min20min 时,N2和 H2持续减少,氨气持续增添,而催化剂不可以使均衡发生挪动,故 B 项错误;从图像能够看出, 25 min 时, NH 3减少了0.1 mol ,C 项错误; 25 min 时,氨气的物质的量减少,故均衡正向挪动,依据勒夏特列原理可知,再次达均衡时,氨气的体积分数比原均衡小, D 项正确。
2015年高考化学真题-反应速率、化学平衡

专题11:反应速率、化学平衡2.【2015天津理综化学】下列说法不正确...的是()A.Na与H2O的反应是熵增的放热反应,该反应能自发进行B.饱和Na2SO4溶液或浓硝酸均可使蛋白质溶液产生沉淀,但原理不同C、FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同D.Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)Mg2+(aq)+2OH—(aq),该固体可溶于NH4Cl溶液3.【2015天津理综化学】某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g)3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。
在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。
下列叙述不正确...的是()A.m=2B.两次平衡的平衡常数相同C.X与Y的平衡转化率之比为1:1D、第二次平衡时,Z的浓度为0.4 mol·L-14.【2015四川理综化学】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g) 2CO(g)。
平衡时,体系中气体体积分数与温度的关系如下图所示:已知:气体分压(P分)=气体总压(P总)×体积分数。
下列说法正确的是()A.550℃时,若充入惰性气体,ʋ正,ʋ逆均减小,平衡不移动B、650℃时,反应达平衡后CO2的转化率为25.0%C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数K P=24.0P总5.【2015福建理综化学】在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v )如下表。
A .a=6.00B .同时改变反应温度和蔗糖的浓度,v 可能不变C .b <318.2D 、不同温度时,蔗糖浓度减少一半所需的时间相同6.【2015海南化学】10ml 浓度为1mol/L 的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成的是( )A 、K 2SO 4B 、CH 3COONaC .CuSO 4D .Na 2CO 37.【2015江苏化学】在体积均为1.0L 的量恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO 2和0.2molCO 2,在不同温度下反应CO 2(g)+c(s) V 2O 5△ 高温、高压催化剂 浓硫酸Δ180℃催化剂 充电放电 催化剂Δ 2CO(g)达到平衡,平衡时CO 2的物质的量浓度c(CO 2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。
2015届高三化学反应速率和化学平衡(速率、图像、计算等)word 版 含答案 全国适用

单元化学反应速率和化学平衡单元化学反应速率和化学平衡 ........................................................................................................1 化学反应速率 ..............................................................................................................................2 化学平衡及勒夏特列原理化学反应进行的方向(课标中必须有).......................................3 速率、平衡图像 ..........................................................................................................................4 等效平衡与化学平衡计算 ..........................................................................................................5 化学反应速率和化学平衡综合 ..................................................................................................1化学反应速率1.(14分)碳、氮及其化合物在工农业生产生活中有着重要作用。
请回答下列问题:(1)用CH4 催化还原NO x 可以消除氮氧化物的污染。
例如:CH4(g) + 4NO2(g) = 4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1CH4(g) + 4NO(g) = 2 N2(g)+CO2(g) + 2H2O(g) ΔH2若2 mol CH4 还原NO2 至N2,整个过程中放出的热量为1734 kJ,则ΔH2=;(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁。
2015高考化学专题复习精练:化学反应速率和化学平衡(含答案)

化学反应速率和化学平衡(15分)平衡指的是两个相反方向的变化最后所处的运动状态;在平衡时,两种变化仍在继续进行,但是它们的速率相等;根据变化的性质可分为物理平衡和化学平衡,中学阶段涉及的平衡有气体可逆反应的平衡、酸碱电离平衡、水解平衡及沉淀-溶解平衡等等。
(1)现有容积为1 L的恒温恒容密闭容器,向其中加入2 mol A气体和2 mol B气体后发生如下反应:A(g)+B(g)C(g) △H=" -" a kJ·mol-1,20s后,反应达到平衡状态,生成1 mol C气体,放出热量Q1kJ。
回答下列问题。
①计算20s内B气体的平均化学反应速率为___________,写出该反应的平衡常数表达式___________。
②保持容器温度和容积不变,若改为向其中加入1molC气体,反应达到平衡时,吸收热量Q2kJ,则Q1 与Q2的相互关系正确的是____________(填字母)。
(A)Q1 + Q2 = a(B) Q1 + 2Q2 < 2a(C)Q1 + 2Q2 > 2a(D)Q1 + Q2 < a③在原平衡基础上,保持容器温度和容积不变,向容器中再通入b molA气体(b>0)时,v(正)_____v(逆)(填“>”、“<”或“=”),重新达平衡后,C气体的平衡体积分数(C) = ,则b= ____________。
(2)常温下,将VmL、0.1000mol·L-1氢氧化钠溶液逐滴加入到20.00mL、0.1000mol·L-1醋酸溶液中,充分反应。
回答下列问题。
(忽略溶液体积的变化)①如果溶液pH=7,此时V的取值_____20.00(填“>”、“<”或“=”),而溶液中c(Na+)、c(CH3COO-)、c(H+)、c(OH-)的大小关系为_____________________________________________。
高三化学一轮复习《化学反应速率与化学平衡》测试含答案

绝密★启用前高三化学一轮复习《化学反应速率与化学平衡》测试本试卷分第Ⅰ卷和第Ⅱ卷两部分,共100分。
第Ⅰ卷一、单选题(共20小题,每小题3.0分,共60分)1.在恒容密闭容器中通入X并发生反应:2X(g)Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是()A.该反应进行到M点放出的热量大于进行到W点放出的热量B.T2下,在0~t1时间内,v(Y)=mol·L-1· min-1C. M点的正反应速率v正大于N点的逆反应速率v逆D. M点时再加入一定量的X,平衡后X的转化率减小2.下列条件一定能使反应速率加快的是()①增加反应物的物质的量②升高温度③增大反应体系的压强④不断分离出生成物⑤加入MnO2A.全部B.①②⑤C.②D.②③3.可逆反应m A(g)+n B(g)p C(g)+q D(g)的v-t图像如下图,如若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图像如下右图:①a1>a2②a1<a2③b1>b2④b1<b2⑤t1>t2⑥t1=t2⑦两图中阴影部分面积相等⑧右图中阴影部分面积更大以上说法中正确的是()A.②③⑤⑧B.①④⑥⑧C.②④⑤⑦D.①③⑥⑦4.如图是关于反应A2(g)+3B2(g)2C(g)(正反应为放热反应)的平衡移动图像,影响平衡移动的原因可能是( )A.升高温度,同时加压B.降低温度,同时减压C.增大反应物浓度,同时减小生成物浓度D.增大反应物浓度,同时使用催化剂5.工业合成氨的正反应是放热反应,下列关于反应N2(g)+3H2(g)2NH3(g)的图像中,错误的是()6.一定条件下,在一恒容密闭容器中,能表示反应X(g)+2Y(g)2Z(g) 一定达到化学平衡状态的是()①容器中气体的密度不再发生变化②X、Y、Z的浓度不再发生变化③容器中的压强不再发生变化④单位时间内生成2n mol Z,同时消耗2n mol YA.①②B.②③C.③④D.①④7.X、Y、Z三种气体,取X和Y按照1∶1物质的量之比混合,放入密闭容器中发生如下反应:X +2Y2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于()A. 33%B. 40%C. 50%D. 65%8.分析下列反应在任何温度下均能自发进行的是()A. 2N2(g)+O2(g)===2N2O(g) ΔH=+163 kJ· mol-1B. Ag(s)+Cl2(g)===AgCl(s)ΔH=-127 kJ· mol-1C. HgO(s)===Hg(l)+O2(g)ΔH=+91 kJ· mol-1D. H2O2(l)===O2(g)+H2O(l)ΔH=-98 kJ· mol-19.为了探索外界条件对反应a X(g)+b Y(g)c Z(g)的影响,以X和Y的物质的量比为a∶b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2015届高三第一轮复习《化学反应速率和化学平衡》单元测试姓名学号相对原子质量:H-1 C-12 N-14 O-16 Mg-24 Si-28一、选择题(共42分)1.[2014天津]化学与生产、生活息息相关,下列叙述错误的是()A.铁表面镀锌可增强其抗腐蚀性B.用聚乙烯塑料代替聚乳酸塑料可减少白色污染C.大量燃烧化石燃料是造成雾霾天气的一种重要因素D.含重金属离子的电镀废液不能随意排放2.[2014天津]运用相关化学知识进行判断,下列结论错误的是()A.某吸热反应能自发进行,因此该反应是熵增反应B.NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中C.可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率11.[2014江苏]下列有关说法正确的是()A.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀B.2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的△H>0C.加热0.1mol/LNa2CO3溶液,CO32-的水解程度和溶液的pH均增大D.对于乙酸与乙醇的酯化反应(△H<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大4.[2014上海]向饱和澄清石灰水中加入少量CaC2,充分反应后恢复到原来的温度,所得溶液中()A.C(Ca2+)、C(OH-)均增大B.C(Ca2+)、C(OH-)均保持不变C.C(Ca2+)、C(OH-)均减小D.C(OH-)增大,C(H+)减小5.[2014新课标I]已知分解1 mol H2O2 放出热量98KJ,在含少量I-的溶液中,H2O2的分解机理为:H2O2+I-→H2O +IO-慢H2O2+IO-→H2O +O2+I-快下列有关反应的说法正确的是( )A.反应的速率与I-的浓度有关B.IO-也是该反应的催化剂C.反应活化能等于98KJ·mol-1D.v(H2O2)=v(H2O)=v(O2)6.[2014新课标I]溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是( ) A.溴酸银的溶解时放热过程Array B.温度升高时溴酸银溶解速度加快C.60 ℃时溴酸银的K sp约等于6×10-4D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯80 t/℃7.[2014重庆]在恒容密闭容器中通入X 并发生反应:2X(g) Y(g),温度T 1、T 2下X 的物质的量浓度c(X)随时间t 变化的曲线如题7图所示。
下列叙述正确的是( )A .该反应进行到M 点放出的热量大于进行到WB .T 2下,在0~t 1时间内,c(Y)=a -bt 1mol·L -1·min -1C .M 点的正反应速率V 正大于N 点的逆反应速率V 逆D .M 点时再加入一定量X ,平衡后X 的转化率减小二、非选择题(共58分)8.[2014江苏](共14分)磷酸铁(FePO 4·2H 2O ,难溶于水的米白色固体)可用于生成药物、食品添加剂和锂离子电池的正极材料,实验室可通过下列实验制备磷酸铁。
(1)称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热、搅拌,反应一段时间后过滤,反应加热的目的是 。
(2)向滤液中加入一定量H 2O 2氧化Fe 2+。
为确定加入H 2O 2的量,需先用K 2Cr 2O 7标准溶液滴定滤液中的Fe 2+,离子方程式如下:Cr 2O 72-+6Fe 2++14H +===2Cr 3++6Fe 3++7H 2O①在向滴定管注入K 2Cr 2O 7标准溶液前,滴定管需要检漏、_________ 和_________ 若滴定xmL 滤液中的Fe 2+,消耗amol·L -1K 2Cr 2O 7标准溶液bmL ,则滤液中c (Fe 2+)=______________mol·L -1②为使滤液中的Fe 2+完全被H 2O 2氧化,下列实验条件控制正确的是________(填序号)。
A .加入适当过量的H 2O 2溶液 B .缓慢滴加H 2O 2溶液并搅拌 C .加热,使反应在较高温度下进行 D .用氨水调节pH=7(3)将一定量的Na 2HPO 4溶液(溶液显碱性)加入含有Fe 3+的溶液中,搅拌、过滤、洗涤、干燥得到FePO 4·2H 2O 。
若反应得到的FePO 4·2H 2O 固体呈棕黄色,则磷酸铁中混有的杂质可能为___________________。
(4)磷酸铁作锂离子电池的正极材料,电极方程式为 。
9.[2014海南](14分)硝基苯甲酸乙酯在OH — 存在下发生水解反应: O 2NC 6H 4COOC 2H 5+OH -O 2NC 6H 4COO -+C 2H 5OH两种反应物的初始浓度均为0.050mol/L ,15°C 时测得O 2NC 6H 4COOC 2H 5的转化率α随时间变化的数据如表所示,回答下列问题: (1__________ ,1题7图__________ ;比较两者大小可得出的结论是______________________________ 。
(2)列式计算15°C时该反应的平衡常数____________________ 。
(3)为提高O2NC6H4COOC2H5的平衡转化率,除可适当控制反应温度外,还可以采取的措施有_____________________________ (要求写出两条)。
(4)硝基苯甲酸乙酯有种,其中苯环上的一氯代物最少的结构简式为。
10.[2014安徽](15分)某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1)。
从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1)请完成以下实验设计表(表中不要留空格):(2)编号①实验测得容器中压强随时间变化如图2。
t2时,容器中压强明显小于起始压强,其原因是铁发生了腐蚀,请在图3中用箭头标出发生该腐蚀时电子流动方向;此时,碳粉表面发生了(“氧化”或“还原”)反应,其电极反应式是。
(3)该小组对图2中0~t1时压强变大的原因提出了如下假设,请你完成假设二:假设一:发生析氢腐蚀产生了气体;假设二:;……(4)为验证假设一,某同学设计了检验收集的气体中是否含有H2的方案。
请你再设计一个实验方案验证假设一,写出实验步骤和结论(不要求写具体操作过程):。
11.[2014北京](15分)顺丁橡胶、制备醇酸树脂的原料M 以及杀菌剂N 的合成路线如下:CH 2=CH CH=CH已知:i.CHCH CH 2CH 2+CH 22(1) O 3(2) Zn/H 2Oii. RCH=CHR'RCHO + R'CHO (R 、R'代表烃基或氢)(1)CH 2=CH —CH=CH 2的名称是________________________。
(2)反应I 的反应类型是(选填字母)_________。
a. 加聚反应 b.缩聚反应(3)顺式聚合物P 的结构式是(选填字母)________。
(4)A 的相对分子质量为108。
①反应II 的化学方程式是___________________________________________________。
②1 molB 完全转化成M 所消耗的H 2的质量是_______g 。
(5)反应III 的化学方程式是___________________________________________________。
(6)A 的某些同分异构体在相同的反应条件下也能生成B 和C ,写出其中一种同分异构体的结构简式____________________________。
2015届高三第一轮复习《化学反应速率和化学平衡》单元测试参考答案 1、B 2、D 3、C 4、B 5、A 6、A 7、C 8、(1)加快铁与稀硫酸反应速率(2分)(2)①用蒸馏水洗净(2分) 用K 2Cr 2O 7 标准溶液润洗2 ~3 次(2分)②6ab x(2分) ③AB (2分)(3)Fe(OH)3(或氢氧化铁)(2分) (4)FePO 4+e -+Li +===LiFePO 4;(2分) 9、(1)V(O 2NC 6H 4COOC 2H 5)= 0.050×(41.8%-33.0%)180-120=7.3×10—5mol·L -1·s -1;(2分)V(O 2NC 6H 4COOC 2H 5)=0.050×(48.8%-41.8%)240-180=5.8×10—5mol·L -1·s -1;(2分)随着反应的进行,反应物的浓度降低,反应速率减小。
(2分)(2)K=(0.050×71.%)2(0.050-0.050×71%)2=6.0(2分)(3)可以增大OH -浓度,及时分离出生成物。
(2分) (4)3;(2分)(2分) 10、(1)②2.0 (1分)③碳粉的质量的影响(1分) (2)吸氧;(1分)(2分)还原;(1分)O 2+4e -+2H 2O ===4OH -;(2分) (3)铁粉直接与醋酸发生化学腐蚀生成气体。
(2分)(4)①药品用量与操作同编号① (1分)②通入氩气排尽装置中空气(1分)③滴入醋酸溶液,同时测定量气瓶气体压强。
(2分) 如果压强增大,则假设合理。
(1分)或11、(1)1,3—丁二烯(2分)(2)a (2分)(3)b (2分)(4)①2CH 2=CH -CH=CH 2△(2分)②6g (2分)(5) (2分)(6) (2分)CH=CH 2H + +HCHO Cl2Cl ClCl Cl2Cl CH 2+H 2OCH 2CH=CH 2 COOCH 2CH 3 O 2N。
