乙醇气相脱水制乙烯动力学实验精选文档
乙醇气相脱水制乙烯实验报告(一)

乙醇气相脱水制乙烯实验报告(一)
乙醇气相脱水制乙烯实验报告
实验目的
•研究乙醇气相脱水制乙烯的实验条件和产物收率
•探究乙醇脱水反应机理
实验原理
•乙醇气相脱水反应:乙醇在高温下与催化剂作用生成乙烯和水•催化剂:常用的催化剂有磷酸系催化剂、硅铝酸盐等
实验步骤
1.准备实验装置:包括加热器、冷凝器、反应容器等
2.将乙醇与催化剂按一定比例加入反应容器中
3.将装置密封,加热至特定温度,并控制温度保持稳定
4.收集冷凝水,记录产物乙烯的收率
5.进行实验单点和多点对比实验,研究不同条件下的乙醇脱水反应
情况
实验结果
•控制温度为300°C、催化剂为磷酸系催化剂的实验,乙醇脱水产物乙烯收率为70%
•提高温度至400°C,乙醇脱水产物乙烯收率上升至80%
结论
•乙醇气相脱水制乙烯是一种有效的方法,可以通过调节温度和催化剂种类来控制乙烯的产率
•高温对乙醇脱水反应有促进作用,但过高温度可能导致副反应的发生和产物选择性的降低
实验改进
•进一步研究不同催化剂在乙醇脱水反应中的催化活性和选择性•调查不同温度下乙醇脱水反应的反应动力学特性
以上是本次乙醇气相脱水制乙烯实验的相关报告。
通过实验的不断改进和深入研究,有望在工业生产中应用该方法来制备乙烯。
乙醇气相脱水制乙烯实验报告

乙醇气相脱水制乙烯实验报告1. 引言本实验旨在通过乙醇气相脱水制备乙烯,并探究不同反应条件对乙烯产率的影响。
乙烯是一种重要的工业原料,广泛应用于塑料、橡胶、化肥等领域。
本实验通过控制反应温度、气体流速和催化剂用量,寻找最佳的制备乙烯的条件。
2. 实验步骤2.1 原料准备准备乙醇、催化剂和载气。
乙醇要保持高纯度,以确保反应的可靠性和重复性。
催化剂一般选择酸性固体催化剂,如磷钨酸盐等。
载气可以选择氮气,用于控制反应系统的气氛。
2.2 反应装置搭建搭建乙醇气相脱水反应装置,并将所需的催化剂放置在反应器中。
反应器需要具备对温度和流速的精确控制能力,以确保反应的可控性。
2.3 反应条件设定根据实验要求,设定不同的反应条件,包括反应温度、气体流速和催化剂用量。
通过改变这些条件,可以比较它们对乙烯产率的影响。
2.4 实验操作将乙醇注入反应器中,加热至设定的反应温度。
在反应过程中,控制气体流速,并定期取样分析乙烯产率。
根据乙烯的生成速率和反应时间,计算乙烯的产率。
3. 实验结果与分析3.1 不同反应温度下的产率比较在固定流速和催化剂用量的条件下,分别设定不同的反应温度,并测定乙烯的产率。
结果显示,随着反应温度的升高,乙烯的产率逐渐增加,但在一定温度范围内,随着温度的继续升高,乙烯的产率开始下降。
这可能是因为催化剂在高温下活性减弱,导致反应速率降低。
3.2 不同气体流速下的产率比较在固定温度和催化剂用量的条件下,分别设定不同的气体流速,并测定乙烯的产率。
结果显示,随着气体流速的增加,乙烯的产率逐渐增加,并达到一个稳定的值。
这可能是因为较高的流速有利于乙醇与催化剂的接触,促使反应更充分地进行。
3.3 不同催化剂用量下的产率比较在固定温度和气体流速的条件下,分别设定不同的催化剂用量,并测定乙烯的产率。
结果显示,随着催化剂用量的增加,乙烯的产率呈现先增加后减少的趋势。
这是因为催化剂的增加可以提高反应速率,但过多的催化剂可能会导致反应中产生的副产物增加,从而降低乙烯的产率。
乙醇气相脱水制乙烯动力学(内循环无梯度)
3.300
气 81.57 1.465 16.46 0.08825 0.408
液
16.24
83.5
0.6000
318.5
气 89.78 2.065
液
48.81
7.098
0.1551 51.09
0.984 0.9600
气 90.18 2.298 7.109 0.3243
1.440
液
56.59
43.02
1.570
水,乙醇,乙醚的摩尔数分别为 0.0134,0.0151,0.0041 质量计算;乙烯质量=原子量×摩尔数=32×0.0087=0.2795 水和乙醇,乙醚的质量分别为 0.2407,0.6975,0.3030 合计为:0.0087+0.2407+0.6975+0.303=1.5206 与乙醇进料量基本平衡。
六、讨论 1、本次实验用来巩固所学的有关动力学的知识,由实验证明该反应器是本
征反应。 2、本次实验在操作过程中,另取了 4 个点,得一直线。 3、由实验结果可以看出,升高反应温度,乙醇气相脱水制乙烯反应有利于
生成乙烯,不利于生成乙醚。最佳反应温度在 350℃左右。
95.98
46.45 0.03515
69.50 24.59 2.155 3.766
96.62
66.36 0.01675
59.08 38.42 0.7433 1.763
98.67
64.13 0.03238
54.62 43.76 0.4146 1.198
99.24
60.84 0.04605
CA
0.0002080 0.0001580 0.0001230 0.0004320 0.0002540 0.0002310 0.001462 0.0005890 0.0005340 0.0004270 0.0001470 0.00008210
乙醇气相脱水制乙烯动力学实验

化工专业实验报告实验名称:乙醇气相脱水制乙烯动力学实验学院:化学工程学院专业:化学工程与工艺班级:化工、班姓名:、学号、同组者姓名:指导教师:杨春风日期:2012年3月8日一、实验目的1.巩固所学的有关动力学方面的知识。
2.掌握获得反应动力学数据的方法和手段。
3.学会动力学数据的处理方法,根据动力学方程求出相应的参数值。
4.熟悉内循环式无梯度反应器的特点以及其它有关设备的使用方法,提高自己的实验技能。
二、实验原理乙醇属于平行反应。
既可以进行分子内脱水生成乙烯,又可以进行分子间脱水生成乙醚。
一般而言,较高的温度有利于生成乙烯,而较低的温度有利于生成乙醚。
因此,对于乙醇脱水这样一个复合反应,随着反应条件的变化,脱水过程的机理也会有所不同。
借鉴前人在这方面做的工作,将乙醇在分子筛催化剂作用下的脱水过程描述成:2C2H5OH→C2H5OC2H5+H2OC 2H5OH→C2H4+H2O三、实验装置及流程实验装置:无梯度反应器试剂和催化剂:无水乙醇,优级纯;分子筛催化剂,重3.0克。
内循环无梯度反应色谱实验装置流程示意图四、实验步骤开始实验之前,需熟悉流程中所有设备、仪器、仪表的性能及使用方法。
然后才可按实验步骤进行实验。
1.打开H2钢瓶使柱前压达到0.5kg/cm2确认色谱检测中截气通过后启动色谱,柱温110℃,气化室130℃,检测室温达到120℃,待温度稳定后,打开热导池—微电流放大器开关,桥电流至100mA。
2.在色谱仪升温的同时,开启阀恒温箱加热器升温至110℃,开启保温加热器升温至150℃。
3.打开反应器温度控制器开关,升温,同时向反应器冷却水夹套通冷却水。
4.打开微量泵,以小流量向气化器内通原料乙醇。
5.用阀箱内旋转六通阀取样分析尾气组成,记录色谱处理的浓度值。
6.在260-360℃之间选两个温度,改变三次进料速度,测定各种条件下的数据。
五、原始实验数据(附页)六、实验数据记录及处理乙醇密度:0.79g/ml 进料速度:0.3ml/min 乙醇进料质量:3.0g计算说明:乙醇的转化率=反应掉的乙醇摩尔数/原料中乙醇的摩尔数乙烯的收率=生成乙烯的摩尔数/原料中乙醇的摩尔数乙醇的进料速度=乙醇液的体积流量×0.79(乙醇的密度)/46(乙醇的分子量)乙烯的生成速度=(乙醇进料速度×乙烯的收率)/[催化剂用量(g)] mol/(g·h)反应器内乙醇的浓度:C A=P A/(R·T)式中P A为乙醇的分压;反应的总压为0.1Mpa。
乙醇脱水反应动力学参数测定实验讲义

三、实验装置及流程
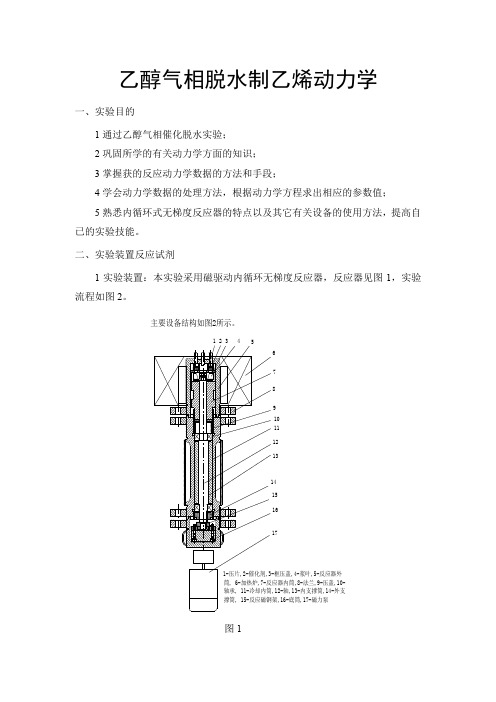
采用磁驱动内循环无梯度反应器,实验流程如图 1,反应器见图 2。
TT—热电偶,PI—压力计,1—钢瓶,2—稳压阀,3—调节阀,4—转子流量计,5—预热器,6— 预热炉,7—反应器,8—反应炉,9—冷凝器,10—尾液收集器,11—六通阀,12—马达 图 1 内循环无梯度乙醇脱水实验装置
2、数据处理
表 2 数据处理表 实 验 号 1 反应 温度 /℃ 245 乙醇进 料量 /(ml/mi n) 2 4 6 2 270 2 4 6 3 312 2 4 6 产物摩尔数组成 乙烯 0.064 0.025 0.056 0.515 0.549 0.504 0.544 0.523 0.454 水 0.321 0.281 0.221 0.195 0.152 0.229 0.309 0.333 0.305 乙醇 0.602 0.667 0.712 0.265 0.258 0.235 0.145 0.144 0.240 乙醚 0.013 0.027 6 0.011 0.025 0.041 0.032 0.003 0 0.006 乙醇转 化率 0.1301 0.1073 0.099 0.6807 0.7098 0.7073 0.7910 0.7841 0.6601 乙烯 收率 0.092 5 0.033 5 0.070 9 0.620 5 0.617 5 0.627 6 0.782 7 0.784 1 0.643 1 V/(mol · min1 -1 g ) 0.0010 0.0008 0.0024 0.0071 0.0141 0.0646 0.0090 0.0179 0.0221 C/(L/m ol) 0.0141 6 0.0156 9 0.0167 5 0.0059 5 0.0057 9 0.0052 7 0.0030 2 0.0030 0 0.0050 0 2.9801 1.1933 K/( L1 · min1 -1 g ) 0.0706 2
乙醇气相脱水制备乙烯动力学

实验三乙醇气相脱水制乙烯反应动力学(简易无梯度内循环)反应动力学描述了化学反应速度与各种因素如浓度、温度、压力、催化剂等之间的定量关系。
动力学在反应过程开发和反应器设计过程中起着重要的作用。
它也是反映工程学科的重要组成部分。
其中,分子筛催化剂的突出优点是乙烯收率高,反应温度较低。
故选用分子筛作为本实验的催化剂。
一.实验目的1.巩固所学有关反应动力学方面的知识。
2.掌握获得反应动力学数据的手段和方法。
3.熟悉内循环式无剃度反应器的特点及其它有关设备的使用方法,提高实验技能。
二.实验原理乙醇脱水属于平行反应,既可以进行分子内脱水生成乙烯,又可以进行分子间脱水生成乙醚。
一般而言,较高的温度有利于生成乙烯,而较低的温度有利于生成乙醚。
因此,对于乙醇脱水这样一个复合反应,随着反应条件的变化,脱水过程的机理也会有所不同。
借鉴前人在这方面所做的工作,将乙醇在分子筛催化剂作用下的脱水过程描述成:2C2H5OH→C2H5OC2H5+H2OC2H5OH→C2H4+H2O三.装置、流程及试剂1.装置本实验装置由三部分构成。
第一部分是由微量进料泵、氢气钢瓶、汽化器和取样六通阀组成的进料系统。
第二部分是反应系统,它是由一台内循环式无剃度反应器、温度控制器和显示仪表组成。
反应器的结构如图5-1所示。
图5-1无梯度反应器结构图1-直流电机;2-磁钢固定片;3-磁钢;4-上法兰;5-磁钢;6-磁钢固定片;7-轴承;8-密封垫片;9-冷却水夹套;10-反应器上部;11-轴承;12-密封垫片;13-密封垫片;14-反应器下部;15-旋转轴:16-反应器外壁;17-旋转叶片;18-催化剂及固定框;19-加热电炉;20-热电偶套管;21-进气口;22-出气口第三部分是取样和分析系统。
包括取样六通阀、产品收集器和在线气相色谱仪。
整套实验装置安装在一个实验柜中,操作方便。
2.流程实验流程见图5-2图5-2实验流程简图1-微量进料泵;2-氢气钢瓶;3-记录仪;4-气相色谱仪;5-汽化器;6-六通阀;7-冷凝器;8-温度控制仪;9-反应器;10-电机调速器;11-数字化温度显示器;12-恒温阀箱;13-色谱处理器3.试剂和催化剂:无水乙醇,优级纯;分子筛催化剂,60~80目,重3.0克。
乙醇脱水乙烯实验报告

一、实验目的1. 了解乙醇脱水制乙烯的反应原理及实验操作流程。
2. 掌握乙醇脱水制乙烯的实验条件对产物的影响。
3. 通过实验,观察并分析乙醇脱水制乙烯的反应过程及产物。
二、实验原理乙醇在催化剂的作用下,通过脱水反应生成乙烯。
该反应属于平行反应,既可以进行分子内脱水生成乙烯,又可以进行分子间脱水生成乙醚。
实验中,通过调节反应温度、催化剂种类和浓度等条件,可以控制反应方向,提高乙烯的产率。
三、实验材料与仪器1. 实验材料:乙醇、浓硫酸、沸石分子筛、NaOH、水、无水乙醇、乙醚等。
2. 实验仪器:恒温水浴锅、反应釜、冷凝管、集气瓶、量筒、滴定管、移液管、酒精灯、蒸馏装置等。
四、实验步骤1. 准备工作(1)将乙醇、浓硫酸、沸石分子筛等实验材料称量、配制。
(2)检查反应釜、冷凝管、集气瓶等实验仪器的完好性。
2. 实验操作(1)将一定量的乙醇加入反应釜中,加入适量的沸石分子筛作为催化剂。
(2)开启恒温水浴锅,将反应釜放入其中,调节温度至反应所需温度。
(3)反应一定时间后,停止加热,待反应釜冷却至室温。
(4)将反应液转移到蒸馏装置中,进行蒸馏操作,收集乙烯气体。
(5)对收集到的乙烯气体进行定量分析,测定乙烯的产率。
3. 实验结果分析(1)通过观察反应液的颜色变化、气体收集量等,分析反应过程。
(2)对收集到的乙烯气体进行定量分析,计算乙烯的产率。
(3)分析不同实验条件对乙烯产率的影响。
五、实验结果与讨论1. 反应过程观察实验过程中,反应液颜色逐渐变浅,说明乙醇逐渐被转化为乙烯。
随着反应时间的延长,气体收集量逐渐增加,说明乙烯的产率逐渐提高。
2. 乙烯产率测定通过定量分析,得到实验条件下乙烯的产率为80%。
3. 实验条件对乙烯产率的影响(1)温度:实验发现,在反应温度为150℃时,乙烯产率最高。
(2)催化剂:采用沸石分子筛作为催化剂,比浓硫酸具有更高的催化活性,且对环境友好。
(3)反应时间:实验结果表明,反应时间对乙烯产率有一定影响,但超过一定时间后,乙烯产率趋于稳定。
乙醇气相脱水制乙烯动力学实验

乙醇气相脱水制乙烯动力学实验乙醇气相脱水制乙烯动力学实验是一个研究乙醇脱水反应动力学的实验,该实验旨在探究反应条件对反应速率的影响,从而了解反应机理和动力学规律。
以下是实验的详细步骤和数据分析。
一、实验步骤1.准备实验装置:本实验采用气相反应装置,包括反应器、加热器、温度控制器、压力控制器、冷凝器、收集瓶等。
2.准备试剂:本实验采用95%乙醇作为原料,催化剂为酸性催化剂(如硫酸或磷酸)。
3.装填催化剂:将酸性催化剂装填到反应器中,确保催化剂表面平整。
4.添加原料:将95%乙醇加入到反应器中,确保液面在催化剂表面以上。
5.启动实验:开启加热器,将反应器加热到预设的反应温度,同时开启压力控制器,保持反应压力在预设值。
6.收集数据:在实验过程中,通过冷凝器收集反应产物,并记录不同时间下的产物产量。
7.实验结束:实验结束后,关闭加热器和压力控制器,取出产物进行分析。
二、数据分析1.产物分析:通过气质联用仪(GC-MS)对产物进行分析,确定产物种类及其含量。
2.动力学参数测定:根据实验数据,采用适当的动力学模型进行拟合,求得反应速率常数、活化能等动力学参数。
3.反应机理研究:结合产物分析和动力学参数测定结果,推断反应机理。
三、实验结果与讨论1.产物分析结果:实验结果表明,乙醇气相脱水制乙烯的主要产物为乙烯和水,其中乙烯的产量随反应时间的延长而增加。
2.动力学参数测定结果:通过拟合实验数据,得到反应速率常数为k=0.05min-1,活化能为Ea=300kJ/mol。
这些参数可以用于描述乙醇气相脱水制乙烯的动力学行为。
3.反应机理研究结果:结合产物分析和动力学参数测定结果,可以推断乙醇气相脱水制乙烯的反应机理为:乙醇在酸性催化剂的作用下脱去一分子水生成乙烯和水蒸气,整个反应过程包括扩散、吸附、反应和脱附等步骤。
其中,扩散和吸附是限制反应速率的步骤,而反应和脱附则相对较快。
四、结论本实验研究了乙醇气相脱水制乙烯的动力学行为,得到了反应速率常数和活化能等动力学参数,并确定了反应机理。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
乙醇气相脱水制乙烯动
力学实验精选文档 TTMS system office room 【TTMS16H-TTMS2A-TTMS8Q8-
一、实验目的
1、巩固所学的有关动力学方面的知识;
2、掌握获得的反应动力学数据的方法和手段;
3、学会动力学数据的处理方法,根据动力学方程求出相应的参数值;
4、熟悉内循环式无梯度反应器的特点以及其他有关设备的特点以及其它有关设备的使用方法,提高自己的实验技能。
二、实验原理
乙醇脱水属于平等反应。
既可以进行分子内脱水成乙烯,又可以分子间脱水生成乙醚。
一般而言,较高的温度有利于生成乙烯,而较低的温度则有利于生成乙醚。
三、实验装置及流程
1.实验装置
图7-1 反应器装置图
装置由三部分组成:
第一部分是有微量进料泵,氢气钢瓶,汽化器和取样六通阀组成的系统;
第二部分是反应系统,它是由一台内循环式无梯度反应器,温度控制器和显示仪表组成;
第三部分是取样和分析系统,包括六通阀,产品收集器和在线气相色谱信。
2.实验流程如下图所示:
内循环无梯度反应色谱实验装置流程示意图
K3-进气旁路调节阀;K2-阀箱产物流量调节;K3-气液分离后尾气调节;J-进液排放三通阀;1-气体钢瓶;2-稳压阀;3-转子流量计;4-过滤器;5-质量流量计;6-缓冲器;7-压力传感器;8-预热器;9-预热炉;10-反应器;11-反应炉;12-马达;13-恒温箱;14-气液分离器;15-调压阀;16-皂膜流量计;17-加料泵
12
图7-2 内循环无梯度反应色谱实验装置流程示意图
3.试剂和催化剂:无水乙醇,优级纯;分子筛催化剂,60~80目,重0.4克。
四、实验步骤
1、打开H 2钢瓶使柱前压达到0.5kg/cm 2确认色谱检测中截气通过后启动色谱,柱
温110℃,汽化室130℃,检测室温达到120℃,待温度稳定后,打开导热池——微电流放大器开关,桥电流至100mA ;
2、在色谱仪升温的同时,开启阀恒温箱加热器升温至110℃,开启保温加热器升温
至160℃;
3、打开反应器温度控制开关,升温,同时向反应器冷却水夹套通冷却水。
4、打开微量泵,以小流量向气化器内通原料乙醇;
5、用阀箱内旋转六通阀取样分析尾气组成,记录色谱处理的浓度值;
6、在200~380℃之间选择四个温度,改变三次进料速度,测定各种条件下的数
据。
五、数据处理
原料乙醇进料:0.3ml/min 时间间隔:5min 乙醇密度ρ=0.7893g/ml
催化剂装填用量:0.4g
表1 原始数据记录表
数据计算:
以第一组数据为例,
(1)计算乙醇的转化率X乙醇:
m
初乙醇=0.3×5×0.7893=1.18395g, ∴n初乙醇= m初乙醇÷46g/mol=1.18395÷46=0.02574mol ∵平均△m=(1.16+1.15)÷2=1.155g ∴m乙烯= m初乙醇-△m=0.02895g
∴n乙烯=0.001034mol = n反应乙醇∴X= n反应乙醇/ n初乙醇=4.02%
(2)计算乙烯的生成速率:
∵乙烯收率ψ= n
乙烯/ n初乙醇=4.02%
V
乙醇=0.3×3600×0.7893÷46=185.4mol/h
∴ V乙烯=ψ×V乙醇/m催化剂=4.02%×185.4÷0.4=18.63g/mol?h
同理,计算出另外两组的乙醇转化率和乙烯生成速率,并将数据汇总成表2
表2 数据记入表
六、思考题
1、用无梯度反应器测定化学反应动力学的优缺点是什么
优点:反应器进口浓度物料循环,使累计的转换率较高。
缺点:进料浓度和出口浓度有较大值,使组分分析对出口浓度很接近,不存在浓度梯度和温度梯度。
