乙醇气相脱水制乙烯动力学
乙醇气相脱水制乙烯实验报告

乙醇气相脱水制乙烯实验报告1. 引言本实验旨在通过乙醇气相脱水制备乙烯,并探究不同反应条件对乙烯产率的影响。
乙烯是一种重要的工业原料,广泛应用于塑料、橡胶、化肥等领域。
本实验通过控制反应温度、气体流速和催化剂用量,寻找最佳的制备乙烯的条件。
2. 实验步骤2.1 原料准备准备乙醇、催化剂和载气。
乙醇要保持高纯度,以确保反应的可靠性和重复性。
催化剂一般选择酸性固体催化剂,如磷钨酸盐等。
载气可以选择氮气,用于控制反应系统的气氛。
2.2 反应装置搭建搭建乙醇气相脱水反应装置,并将所需的催化剂放置在反应器中。
反应器需要具备对温度和流速的精确控制能力,以确保反应的可控性。
2.3 反应条件设定根据实验要求,设定不同的反应条件,包括反应温度、气体流速和催化剂用量。
通过改变这些条件,可以比较它们对乙烯产率的影响。
2.4 实验操作将乙醇注入反应器中,加热至设定的反应温度。
在反应过程中,控制气体流速,并定期取样分析乙烯产率。
根据乙烯的生成速率和反应时间,计算乙烯的产率。
3. 实验结果与分析3.1 不同反应温度下的产率比较在固定流速和催化剂用量的条件下,分别设定不同的反应温度,并测定乙烯的产率。
结果显示,随着反应温度的升高,乙烯的产率逐渐增加,但在一定温度范围内,随着温度的继续升高,乙烯的产率开始下降。
这可能是因为催化剂在高温下活性减弱,导致反应速率降低。
3.2 不同气体流速下的产率比较在固定温度和催化剂用量的条件下,分别设定不同的气体流速,并测定乙烯的产率。
结果显示,随着气体流速的增加,乙烯的产率逐渐增加,并达到一个稳定的值。
这可能是因为较高的流速有利于乙醇与催化剂的接触,促使反应更充分地进行。
3.3 不同催化剂用量下的产率比较在固定温度和气体流速的条件下,分别设定不同的催化剂用量,并测定乙烯的产率。
结果显示,随着催化剂用量的增加,乙烯的产率呈现先增加后减少的趋势。
这是因为催化剂的增加可以提高反应速率,但过多的催化剂可能会导致反应中产生的副产物增加,从而降低乙烯的产率。
乙醇气相脱水制乙烯动力学(内循环无梯度)
3.300
气 81.57 1.465 16.46 0.08825 0.408
液
16.24
83.5
0.6000
318.5
气 89.78 2.065
液
48.81
7.098
0.1551 51.09
0.984 0.9600
气 90.18 2.298 7.109 0.3243
1.440
液
56.59
43.02
1.570
水,乙醇,乙醚的摩尔数分别为 0.0134,0.0151,0.0041 质量计算;乙烯质量=原子量×摩尔数=32×0.0087=0.2795 水和乙醇,乙醚的质量分别为 0.2407,0.6975,0.3030 合计为:0.0087+0.2407+0.6975+0.303=1.5206 与乙醇进料量基本平衡。
六、讨论 1、本次实验用来巩固所学的有关动力学的知识,由实验证明该反应器是本
征反应。 2、本次实验在操作过程中,另取了 4 个点,得一直线。 3、由实验结果可以看出,升高反应温度,乙醇气相脱水制乙烯反应有利于
生成乙烯,不利于生成乙醚。最佳反应温度在 350℃左右。
95.98
46.45 0.03515
69.50 24.59 2.155 3.766
96.62
66.36 0.01675
59.08 38.42 0.7433 1.763
98.67
64.13 0.03238
54.62 43.76 0.4146 1.198
99.24
60.84 0.04605
CA
0.0002080 0.0001580 0.0001230 0.0004320 0.0002540 0.0002310 0.001462 0.0005890 0.0005340 0.0004270 0.0001470 0.00008210
乙醇脱水制乙烯催化剂的分析及适宜工艺条件的确定

乙醇脱水制乙烯催化剂的分析及适宜工艺条件的确定摘要:文章首先分析了三个厂家所制备的关于乙烯的乙醇脱水制法中使用γ-Al2O3催化剂进行了包括物理、化学和动力学等性能的测定和评价,从而对适宜工艺条件进行了确定,使生产中的经济效益有很大的提升。
引言:乙烯的工业酒精制法目前是较为成熟的工艺方法。
我国乙烯的生产大多数是依靠石油,但很多中、小型工厂因为不具备裂解分离的装置,且由乙醇脱水而制得的乙烯的纯度较高,也比较经济实用,所以依然采用乙醇脱水来制乙烯并作为制备各种产品用的中间产物。
然而,国内各个厂家所具备催化剂的制备条件不相同,工艺条件和生产管理的情况也不相同,所以,生产状况都有较大的差别。
一、对各个厂家催化剂进行测试1. 对物性进行考察分别对三个不同厂家生产的催化剂使用光谱法对铁含量进行测定;用压汞仪对孔径的分布、总控的体积及比表面进行了测定;用强度测定仪对三种不同催化剂其机械强度进行了测定,结果得知,γ-Al2O3 (L)的含铁量比其他两个厂低了一个数量级。
因为铁含量比较低的催化剂较难积炭,可以延长催化剂的寿命。
且γ-Al2O3 (L)的其他各项指标都比其他两厂更良好。
另又分析孔径分布的测定及对γ-Al2O3 (L)进行的X射线粉末衍射物相,可得出结论,γ-Al2O3 (L)催化剂的物相较纯、比表面较大、微孔丰富,所以它的物理性质是十分优异的。
2.对温度稳定性进行考察采取变温的操作方法对三个厂的催化剂在温度变化时的稳定性进行考察。
结果得知,γ-Al2O3 (L)经反复地变温后,在低温下它的活性仍然能保持稳定且水平较高,另外,乙烯的选择性十分高,尾气中的乙醚含量较少;γ-Al2O3 (Z)变温后的稳定性还好,但是转化率低于γ-Al2O3 (L),而且经三次的反复后其转化率有下降趋势,乙醚含量较高;γ-Al2O3 (X)不仅转化率较低,乙醚含量更是高达10%,并且在变温后其活性大幅度地下降。
经过实验可得出结论,γ-Al2O3 (L)的活性较高,乙烯选择性较高,对温度的变化稳定,在这三种催化剂中温度稳定性最强。
乙醇气固相催化制备乙烯实验报告

化工专业实验报告实验六乙醇气固催化脱水制乙烯姓名:XXX学号:XXXXXX班级:同组人:一实验目的1、掌握乙醇脱水实验的反应过程、实验流程和操作。
2、掌握乙醇气相脱水操作条件对产物收率的影响,学会获取稳定的工艺条件的方法。
3、了解固定床反应器的构造、原理和使用方法,学习反应器的正常操作和安装。
4、学习气相色谱在线分析的方法和定性、定量分析,学习如何手动进样分析液体成分。
了解气相色谱的原理和构造,掌握色谱的正常使用和分析条件选择。
5、学习微量泵的使用方法,学会使用湿式流量计测量流体流量。
二、实验原理乙醇脱水属于平行反应,即可进行分子内脱水生成乙烯,又可进行分子间脱水生成乙醚。
一般而言,较低的温度有利于生成乙醚,因此该复合反应条件改变,脱水机理也有不同。
采用浓硫酸、氧化铝和分子筛催化剂可以有下列反应过程产生:浓硫酸:2C2H5-OH C2H5OC2H5+H2O(140℃)C2H5OH C2H4+H2O(170℃)氧化铝:C2H5OH C2H4+H2O(360℃)分子筛:C2H5OH C2H4+H2O(300℃)随着温度升高,反应可得到足够多的乙烯转化,而乙醚的生成量较少。
乙烯是世界上产量最大的化学产品之一,乙烯工业是石油化工产业的核心,乙烯产品占石化产品的70%以上,在国民经济中占有重要的地位。
世界上已将乙烯产品作为衡量一个国家石油化工生产水平的重要标志之一。
主要用于制聚乙烯、聚氯乙烯、醋酸、高级醇等,还可用来催熟水果。
三、实验装置及流程图6-1 固定床反应装置实物图 VAVV 57151683TCITITCI-控温热电偶;TI-测温热电偶;PI-压力计; K-调节阀;V-截止阀;VA-调节阀;VB-安全阀;1-气体钢瓶;2-钢瓶减压阀;3-稳压阀;4-干燥器;5-过滤器;6-质量流量控制器;7,7'-取样器;8-预热炉;9-预热器;10-反应炉;11-固定床反应器;12-汽液分离器;13-冷凝器; 14-尾液收集器;15-转子流量计;16-湿式流量计; 17-加料罐;18-液体泵;PI9104TCI TCITCI6137'141812111217KPIVV57151683TCITI TCI-控温热电偶;TI-测温热电偶;PI-压力计; K-调节阀;V-截止阀;VA-调节阀;VB-安全阀;1-气体钢瓶;2-钢瓶减压阀;3-稳压阀;4-干燥器;5-过滤器;6-质量流量控制器;7,7'-取样器;8-预热炉;9-预热器;10-反应炉;11-固定床反应器;12-汽液分离器;13-冷凝器; 14-尾液收集器;15-转子流量计;16-湿式流量计; 17-加料罐;18-液体泵;PI9104TCI TCITCI6137'14181111217K PI图6-2 乙醇气固催化制备乙烯实验流程图本实验选用固定床反应器,凡是流体通过不动的固体物料所形成的床层而进行反应的装置都称作固定床反应器。
乙醇催化脱水制乙烯反应系统的数学模拟的开题报告

乙醇催化脱水制乙烯反应系统的数学模拟的开题报告一、课题背景乙烯是化工产业中广泛应用的重要原料,其制备方法多样,常用的方法有烷基化、氧化和催化脱水等。
在各种方法中,催化脱水法是目前广泛使用的乙烯制备方法。
该方法可以使用不同的催化剂和反应条件,不仅可以提高产率和选择性,而且可以使催化剂得到良好的稳定性,实现反应的节能和环保。
乙醇催化脱水制乙烯反应是一种非常重要的工业反应之一,该反应的催化剂主要为二氧化硅、氧化铝等,反应条件为高温高压。
该反应的基本化学方程式为:C2H5OH → C2H4 + H2O在催化脱水反应系统中,乙醇是被添加的物质,而乙烯是被生产的产物。
因此,催化脱水制乙烯的反应系统中要考虑乙醇和乙烯的浓度、反应温度和压力等因素对该反应的影响。
对反应过程进行数学模拟可以帮助我们更好地了解反应过程的动力学机制和条件优化。
二、研究目的和意义本研究旨在通过数学模拟的方法研究乙醇催化脱水制乙烯反应的动力学机制和条件优化,主要研究内容包括以下方面:1. 构建乙醇催化脱水制乙烯反应的动力学模型:根据反应机理和反应条件等方面的影响因素,建立该反应的动力学模型,探究各因素对反应的影响规律。
2. 模拟乙醇催化脱水制乙烯反应的过程和性能:根据建立的动力学模型,对反应过程进行数值模拟,并对产物的成分和产率、能量转化效率等性能参数进行分析和优化。
3. 优化反应条件并进行实验验证:在数学模拟的基础上,通过调整反应条件来优化催化脱水制乙烯反应的效率和产品质量,并通过实验证实数学模拟的合理性和可靠性。
本研究的意义在于帮助我们深入了解乙醇催化脱水制乙烯反应的反应机理和动力学过程,为该反应的优化和工业应用提供科学依据和技术支持。
三、研究方法和步骤本研究的主要研究方法是数学建模和数值模拟。
具体步骤如下:1. 收集和分析已有的相关文献和实验数据,对反应机理和影响因素进行详细分析和探究。
2. 根据反应机理和影响因素,建立乙醇催化脱水制乙烯反应的动力学模型。
乙醇气相脱水制乙烯动力学实验

化工专业实验报告实验名称:乙醇气相脱水制乙烯动力学实验学院:化学工程学院专业:化学工程与工艺班级:化工、班姓名:、学号、同组者姓名:指导教师:杨春风日期:2012年3月8日一、实验目的1.巩固所学的有关动力学方面的知识。
2.掌握获得反应动力学数据的方法和手段。
3.学会动力学数据的处理方法,根据动力学方程求出相应的参数值。
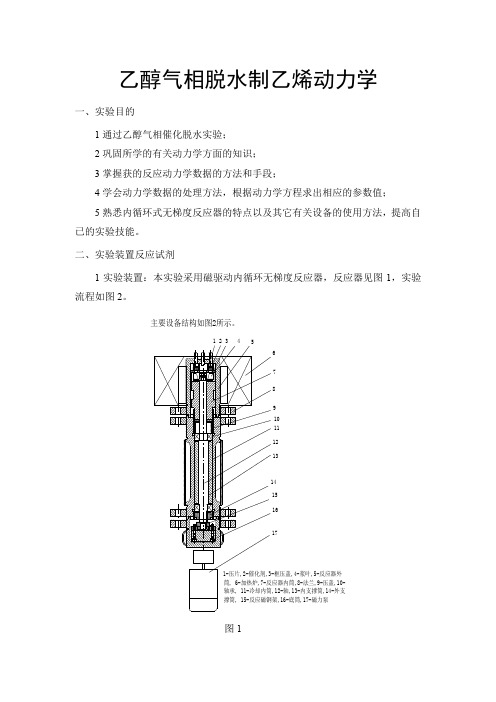
4.熟悉内循环式无梯度反应器的特点以及其它有关设备的使用方法,提高自己的实验技能。
二、实验原理乙醇属于平行反应。
既可以进行分子内脱水生成乙烯,又可以进行分子间脱水生成乙醚。
一般而言,较高的温度有利于生成乙烯,而较低的温度有利于生成乙醚。
因此,对于乙醇脱水这样一个复合反应,随着反应条件的变化,脱水过程的机理也会有所不同。
借鉴前人在这方面做的工作,将乙醇在分子筛催化剂作用下的脱水过程描述成:2C2H5OH→C2H5OC2H5+H2OC 2H5OH→C2H4+H2O三、实验装置及流程实验装置:无梯度反应器试剂和催化剂:无水乙醇,优级纯;分子筛催化剂,重3.0克。
内循环无梯度反应色谱实验装置流程示意图四、实验步骤开始实验之前,需熟悉流程中所有设备、仪器、仪表的性能及使用方法。
然后才可按实验步骤进行实验。
1.打开H2钢瓶使柱前压达到0.5kg/cm2确认色谱检测中截气通过后启动色谱,柱温110℃,气化室130℃,检测室温达到120℃,待温度稳定后,打开热导池—微电流放大器开关,桥电流至100mA。
2.在色谱仪升温的同时,开启阀恒温箱加热器升温至110℃,开启保温加热器升温至150℃。
3.打开反应器温度控制器开关,升温,同时向反应器冷却水夹套通冷却水。
4.打开微量泵,以小流量向气化器内通原料乙醇。
5.用阀箱内旋转六通阀取样分析尾气组成,记录色谱处理的浓度值。
6.在260-360℃之间选两个温度,改变三次进料速度,测定各种条件下的数据。
五、原始实验数据(附页)六、实验数据记录及处理乙醇密度:0.79g/ml 进料速度:0.3ml/min 乙醇进料质量:3.0g计算说明:乙醇的转化率=反应掉的乙醇摩尔数/原料中乙醇的摩尔数乙烯的收率=生成乙烯的摩尔数/原料中乙醇的摩尔数乙醇的进料速度=乙醇液的体积流量×0.79(乙醇的密度)/46(乙醇的分子量)乙烯的生成速度=(乙醇进料速度×乙烯的收率)/[催化剂用量(g)] mol/(g·h)反应器内乙醇的浓度:C A=P A/(R·T)式中P A为乙醇的分压;反应的总压为0.1Mpa。
乙醇制取乙烯实验报告

一、实验目的1. 掌握乙醇在浓硫酸催化下脱水制备乙烯的反应原理。
2. 熟悉实验装置的组装和操作方法。
3. 了解乙烯的收集和性质。
二、实验原理乙醇在浓硫酸催化下发生消去反应,脱水生成乙烯和水。
反应方程式如下:CH3CH2OH → CH2=CH2↑ + H2O三、实验器材1. 乙醇(分析纯)2. 浓硫酸(分析纯)3. 铁架台4. 铁夹5. 铝制蒸馏烧瓶6. 温度计7. 石棉网8. 烧杯9. 水槽10. 水龙头11. 集气瓶12. 橡皮塞13. 棉花14. 碎瓷片四、实验步骤1. 将蒸馏烧瓶放在铁架台上,加入适量的乙醇和浓硫酸,总体积约为烧瓶体积的2/3。
2. 用铁夹固定温度计,水银球部分插入液面以下,确保温度准确。
3. 在烧瓶口塞上橡皮塞,并在塞子上插入碎瓷片,防止反应液暴沸。
4. 用石棉网覆盖烧瓶,用酒精灯加热烧瓶底部,使反应液温度迅速升至170℃。
5. 观察反应液,当有气体产生时,打开水龙头,将气体导入集气瓶中。
6. 继续加热至反应结束,关闭水龙头,收集乙烯。
7. 将收集到的乙烯气体进行性质验证,如使溴水褪色等。
五、实验结果1. 反应过程中,烧瓶内液面产生大量气泡,并有气体收集到集气瓶中。
2. 乙烯气体使溴水褪色,证明乙烯的生成。
六、实验讨论1. 实验过程中,温度计插入液面以下,确保温度准确。
若温度过高,反应液可能发生炭化,影响乙烯的生成;若温度过低,反应速率减慢,乙烯产量降低。
2. 实验过程中,碎瓷片的作用是防止反应液暴沸,保证实验安全。
3. 实验过程中,应确保反应液总体积不超过烧瓶体积的2/3,避免反应液溢出。
七、实验结论通过本实验,我们成功制取了乙烯,并了解了乙醇在浓硫酸催化下脱水制备乙烯的反应原理。
在实验过程中,我们掌握了实验装置的组装和操作方法,熟悉了乙烯的收集和性质。
实验结果表明,在170℃条件下,乙醇在浓硫酸催化下可以成功脱水生成乙烯。
乙醇脱水反应动力学参数测定实验讲义

三、实验装置及流程
采用磁驱动内循环无梯度反应器,实验流程如图 1,反应器见图 2。
TT—热电偶,PI—压力计,1—钢瓶,2—稳压阀,3—调节阀,4—转子流量计,5—预热器,6— 预热炉,7—反应器,8—反应炉,9—冷凝器,10—尾液收集器,11—六通阀,12—马达 图 1 内循环无梯度乙醇脱水实验装置
2、数据处理
表 2 数据处理表 实 验 号 1 反应 温度 /℃ 245 乙醇进 料量 /(ml/mi n) 2 4 6 2 270 2 4 6 3 312 2 4 6 产物摩尔数组成 乙烯 0.064 0.025 0.056 0.515 0.549 0.504 0.544 0.523 0.454 水 0.321 0.281 0.221 0.195 0.152 0.229 0.309 0.333 0.305 乙醇 0.602 0.667 0.712 0.265 0.258 0.235 0.145 0.144 0.240 乙醚 0.013 0.027 6 0.011 0.025 0.041 0.032 0.003 0 0.006 乙醇转 化率 0.1301 0.1073 0.099 0.6807 0.7098 0.7073 0.7910 0.7841 0.6601 乙烯 收率 0.092 5 0.033 5 0.070 9 0.620 5 0.617 5 0.627 6 0.782 7 0.784 1 0.643 1 V/(mol · min1 -1 g ) 0.0010 0.0008 0.0024 0.0071 0.0141 0.0646 0.0090 0.0179 0.0221 C/(L/m ol) 0.0141 6 0.0156 9 0.0167 5 0.0059 5 0.0057 9 0.0052 7 0.0030 2 0.0030 0 0.0050 0 2.9801 1.1933 K/( L1 · min1 -1 g ) 0.0706 2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
序号:40
化工专业实验报告
实验名称:乙醇气相脱水制乙烯动力学实验学院:化学工程学院
专业:化学工程与工艺
班级:化工095班
姓名:何小龙
学号:09402010541
指导教师:杨春风
日期:2012年3月22日
一.实验目的
1. 巩固所学有关反应动力学方面的知识;
2. 掌握获得反应动力学数据的手段和方法;
3. 学会动力学数据的处理方法,根据动力学方程求出相应的参数值;
4. 熟悉内循环式无剃度反应器的特点及其它有关设备的使用方法,提高实验技能。
二.实验原理及原理图
乙醇脱水属于平行反应,既可以进行分子内脱水生成乙烯,又可以进行分子间脱水生成乙醚。
一般而言,较高的温度有利于生成乙烯,而较低的温度有利于生成乙醚。
乙醇在分子筛催化剂作用下的脱水过程可描述成:
2C2H5OH→C2H5OC2H5+H2O
C2H5OH→C2H4+H2O
三.实验装置、流程及试剂
1. 装置
本实验装置由三部分构成:
第一部分是由微量进料泵、氢气钢瓶、汽化器和取样六通阀组成的进料系统。
第二部分是反应系统,它是由一台内循环式无剃度反应器、温度控制器和显示仪表组成。
反应器的结构如图1所示。
1-直流电机;2-磁钢固定片;3-磁钢;
4-上法兰;5-磁钢;6-磁钢固定片;7-轴承;
8-密封垫片;9-冷却水夹套;10-反应器上部;
11-轴承;12-密封垫片;13-密封垫片;
14-反应器下部;15-旋转轴;16-反应器外壁;
17-旋转叶片;18-催化剂及固定框;19-加热
电炉;20-热电偶套管;21-进气口;22-出气口
图1无梯度反应器结构图
第三部分是取样和分析系统。
包括取样六通阀、产品收集器和在线气相色谱仪。
整套实验装置安装在一个实验柜中,操作方便。
2.实验流程
PI
内循环无梯度反应色谱实验装置流程示意图10
17
TI
TCI 8
911
TIC-控温;TT-测温;PI-压力计;V1-进气截止;V2-进气预热截止阀;
K3-进气旁路调节阀;K2-阀箱产物流量调节;K3-气液分离后尾气调节;J-进液排放三通阀;1-气体钢瓶;2-稳压阀;3-转子流量计;4-过滤器;5-质量流量计;6-缓冲器;7-压力传感器;8-预热器;9-预热炉;10-反应器;11-反应炉;12-马达;13-恒温箱;14-气液分离器;15-调压阀;16-皂膜流量计;17-加料泵
12
1
1
V 1
PI
色谱
TCI
TCI
TCI
2
3
4
56
13
14
15
3
16
18
K 1
K 2
V 2
进气预热截止
K 3
7
J
内循环无梯度反应色谱实验装置流程示意图
3. 试剂和催化剂:无水乙醇,优级纯;分子筛催化剂,装填量为0.8g 。
四.实验步骤
开始实验之前,需熟悉流程中所有设备、仪器、仪表的性能及使用方法。
然后才可以按步骤进行实验。
1.打开H 2钢瓶调整色谱仪的柱前压力至0.05kg/cm 2确认色谱检测器有载气通过后启动色谱仪。
柱温110℃,汽化室130℃,检测室温达到120℃,待温度稳定后,打开热导池-微电流放大器的开关,并调整桥电流至150mA 。
2.在色谱仪升温同时,打开阀恒温箱加热器开关,使之升温到110℃。
开启保温加热器升温至150℃。
3.打开反应器温度控制器的电源开关使反应器加热升温,同时向反应器的冷水夹套中通入冷却水。
4.打开微量进料泵,以小流量向汽化器内通入原料乙醇。
5.用阀箱内旋转六通阀取样分析尾气组成,记录色谱处理的浓度值。
6.在200~380℃之间选择三个温度,在各温度下各测三次,测定各种条件下的数据。
五.实验数据处理
实验过程中,应将有用的数据及时、准确地记录下来。
记录表格可参见表1。
ρ(乙醇)=0.79g/ml 操作时间t=5min
m总(乙醇)=0.79 g/ml×0.3ml/min×5min=1.185g
n总(乙醇)=1.185/46=0.0258mol
表1:
序号设定温
度℃乙醇进料
mol
乙醇剩余量
g
乙醇剩余量
mol
m平均值(乙烯)
g
n平均值(乙烯)
mol
1 202.0 0.0258 1.17 0.02540.0150.000536
2 246.9 0.0258 1.1
3 0.02460.0550.001964
3 288.7 0.0258 0.845 0.01840.3400.012143由第一组数据:
n乙醇剩余量=1.17g/46g/mol=0.0254mol
m平均值(乙烯)=1.185-1.17=0.015g
n平均值(乙烯)=0.015g/28g/mol=0.000536mol
乙醇的转化率=反应掉的乙醇摩尔数/原料中乙醇的摩尔数
乙烯的收率=生成乙烯的摩尔数/原料中乙醇的摩尔数
乙醇的进料速度=乙醇液的体积流量×0.79(乙醇的密度)/46(乙醇的分子量)
乙烯的生成速度=(乙醇进料速度×乙烯的收率)/[催化剂用量(g)] mol/(g·h)
反应器内乙醇的浓度:C A=P A/(R·T)
式中P A为乙醇的分压;反应的总压为0.1Mpa。
所以可将反应器内的混合气视为理
想气体。
生成乙烯的反应步骤的速率常数k可以通过下式求出:
k =r/c A
由阿仑尼乌斯方程k=k0exp(-E/RT),将lnk对1/T作图,即可求出k0和E。
由第一组数据:乙醇的转化率=(0.0258-0.0254) /0.0258=0.0142
乙烯的收率=0.000536/0.0258=0.02076
乙醇的进料速度=0.3 × 0.79 / 46= 5.15×10-3mol/min=0.309 mol/h
乙烯的生成速率=(0.309×0.02077)/0.8=8.02×10-3mol/(g·h)
反应器内乙醇的浓度:C A =P A /(R·T )
0.1:P A =0.0258:0.0254 P A =0.0986MPa
C A =P A /(R·T )=0.09845×106/(8.3145×475.15)=24.92mol/m 3=0.02496mol/L 生成乙烯的反应步骤的速率常数k 可以通过下式求出:
K =r/c A =8.02×10-3/0.02492=0.32138L/(g·h )
同理可得如下:
序号 设定温度T/℃ 1/T 1/K 乙醇的转化率
乙烯的收率
乙烯的生成速率mol/(g·h ) P A MPa C A mol/L
K L/(g·h )
ln K
1 202.0 0.002105 0.014
2 0.02076 0.00802 0.0986 0.02496 0.32138 -1.135 2 246.9 0.00192
3 0.0479 0.0761
4 0.02940 0.0952 0.02202 1.33539 0.2892 3
288.7 0.001780
0.2880 0.47065
0.18179
0.0712
0.01524 11.9267 2.4788
由阿仑尼乌斯方程k=k 0exp(-E/RT),将lnK 对1/T 作图,即可求出k 0和E 。
以lnK 为纵坐标,1/T 为横坐标作图如下:
由k=k 0exp(-E/RT),则lnk=lnk 0-E/(R·T), 由图中可知:-E/R=-10973, lnk 0=21.787 得:E=91.235KJ/mol k 0=2.90×109L/(g·h )
六.实验讨论
1. lnK 与1/T 的趋势线如图呈线性关系,Y= - 10973x+ 21.789,R 2= 0.964,在误差范围内这个实验是成功的。
得:E=91.235KJ/mol k 0=
2.90×109L/(g·h ) 2. 乙烯易挥发,做实验时室温应较低。
y = -10973x + 21.787
R 2 = 0.964
-2
-1 0
1
2
3 0.0017 0.0018
0.0019
0.002
0.0021
0.0022
1/T
lnK 系列1
趋势线
数据图 lnK-1/T
3. 本实验相对来说比较的简单,但是由于实验的仪器问题,只能进行实验的了解,
在实验的操作上还是较欠缺的,所以实验还是较顺利的完成了。
本次实验数据主要误差可能是:实验仪器的误差;乙醇溶剂的不纯;反应不够完全,出来的物质不均匀等。
七.思考题
1. 用无梯度反应器测定化学反应动力学的优、缺点是什么?
答:反应器进口浓度物料循环,使累计的转化率较高,进料浓度和出口浓度有较大的差值,因此对组成分析没有过苛要求和出口浓度十分接近,反应器内不存在浓度梯度和温度梯度。
2. 要证明测定的本证动力学数据,还需要补充哪些实验内容?
答:还需要补充热量传递,质量传递,动量传递等内容,加上前面的反应,即三传一反是化学动力学的本证特性。
