乙醇气相脱水制乙烯动力学(内循环无梯度)
“乙醇脱水反应制乙烯实验”综述报告

收稿日期:2021-10-13基金项目:2020年安徽省教学示范课“化工专业实验”(13210467);安徽省化工类专业合作委员会教学研究项目(2020jyxm1660);安徽省化工类专业合作委员会教学研究项目(2017jyxm1258);安徽省化工类专业合作委员会教学研究项目(2018jyxm0276);省级“六卓越、一拔尖”卓越人才培养创新项目(2020zyrc052)作者简介:荣俊锋(1987-),男,硕士,毕业于安徽理工大学化学工程专业,研究方向:环境化学工程,实验室管理,136****************。
“乙醇脱水反应制乙烯实验”综述报告荣俊锋,焦发存,张晔,武成利,王一双,李伏虎,刘铭(安徽理工大学化学工程学院,安徽淮南232001)摘要:乙烯产量是衡量一个国家石油化工工业发展水平的重要标志。
乙醇脱水制乙烯是一种不同于传统石油烃类裂解的方法,该反应是一个吸热、分子数增不变的可逆反应。
提高反应温度,降低反应压力,都能提高反应转化率。
通过“乙醇脱水反应制乙烯实验”的学习,让同学们了解该反应的反应机理,以及气固相管式催化反应器的构造、原理和使用方法;学会动态控制仪表的使用,学习气体在线分析的方法和定性、定量分析,为即将进行的毕业实习及毕业设计打下基础。
关键词:乙醇;乙烯;脱水反应;气固相管式催化反应器doi :10.3969/j.issn.1008-553X.2022.02.010中图分类号:TQ013.1文献标识码:A文章编号:1008-553X (2022)02-0030-05乙烯产量是衡量一个国家石油化工工业发展水平的重要标志。
乙醇脱水制乙烯是一种不同于传统石油烃类裂解的方法,该反应是一个吸热、分子数增不变的可逆反应。
提高反应温度,降低反应压力,都能提高反应转化率。
通过“乙醇脱水反应制乙烯实验”的学习,让同学们了解该反应的反应机理,以及气固相管式催化反应器的构造、原理和使用方法;学会动态控制仪表的使用,学习气体在线分析的方法和定性、定量分析。
乙醇气相脱水制乙烯动力学实验

一、实验目的1、巩固所学的有关动力学方面的知识;2、掌握获得的反应动力学数据的方法和手段;3、学会动力学数据的处理方法,根据动力学方程求出相应的参数值;4、熟悉内循环式无梯度反应器的特点以及其他有关设备的特点以及其它有关设备的使用方法,提高自己的实验技能。
二、实验原理乙醇脱水属于平等反应。
既可以进行分子内脱水成乙烯,又可以分子间脱水生成乙醚。
一般而言,较高的温度有利于生成乙烯,而较低的温度则有利于生成乙醚。
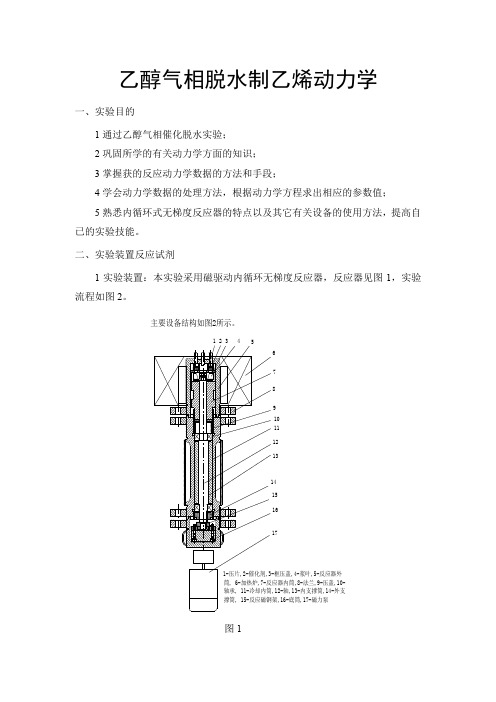
三、实验装置及流程1.实验装置图7-1 反应器装置图装置由三部分组成:第一部分是有微量进料泵,氢气钢瓶,汽化器和取样六通阀组成的系统;第二部分是反应系统,它是由一台内循环式无梯度反应器,温度控制器和显示仪表组成;第三部分是取样和分析系统,包括六通阀,产品收集器和在线气相色谱信。
2.实验流程如下图所示:PI 内循环无梯度反应色谱实验装置流程示意图1017TI TCI8911TIC-控温;TT-测温;PI-压力计;V1-进气截止;V2-进气预热截止阀;K3-进气旁路调节阀;K2-阀箱产物流量调节;K3-气液分离后尾气调节;J-进液排放三通阀;1-气体钢瓶;2-稳压阀;3-转子流量计;4-过滤器;5-质量流量计;6-缓冲器;7-压力传感器;8-预热器;9-预热炉;10-反应器;11-反应炉;12-马达;13-恒温箱;14-气液分离器;15-调压阀;16-皂膜流量计;17-加料泵1211V 1PI 色谱TCITCI TCI 2345613141531618K 1K 2V 2进气预热截止K 37J图7-2 内循环无梯度反应色谱实验装置流程示意图3.试剂和催化剂:无水乙醇,优级纯;分子筛催化剂,60~80目,重0.4克。
四、实验步骤1、打开H 2钢瓶使柱前压达到0.5kg/cm 2确认色谱检测中截气通过后启动色谱,柱温110℃,汽化室130℃,检测室温达到120℃,待温度稳定后,打开导热池——微电流放大器开关,桥电流至100mA ;2、在色谱仪升温的同时,开启阀恒温箱加热器升温至110℃,开启保温加热器升温至160℃;3、打开反应器温度控制开关,升温,同时向反应器冷却水夹套通冷却水。
实验3乙醇气相脱水制乙烯宏观反应速率的测定

实验三简易内循环无梯度反应(乙醇气相脱水制乙烯宏观反应速率的测定)一、实验目的1.巩固所学有关反应动力学方面的知识。
2.掌握测取宏观反应动力学数据的手段和方法。
3.学会实验数据的处理方法,并能根据动力学方程求出相关的动力学参数值。
4.了解内循环式无梯度反应器的特点及其使用方法。
二、实验原理反学动力学描述了化学反应速率与各种因素如浓度、温度、压力、催化剂等之间的定量关系。
动力学在反应过程开发和反应器设计过程中起着重要的作用。
它也是反应工程学科的重要组成部分。
气固相催化反应是一个多步骤的反应,它包括以下七个步骤:1.反应物分子由气流主体向催化剂的外表面扩散(外扩散);2.反应物分子由催化剂外表面向催化剂微孔内表面扩散(内扩散);3.反应物分子在催化剂微孔内表面上被吸附(表面吸附);4.吸附的反应物分子在催化剂的表面上发生化学反应,转化成产物分子(表面反应);5.产物分子从催化剂的内表面上脱附下来(表面脱附);6.脱附下来的产物分子从微孔内表面向催化剂外表面扩散(内扩散);7.产物分子从催化剂的外表面向气流主体扩散。
这七个步骤可分为物理过程和化学过程。
其中步骤1、2、6、7为物理扩散过程,步骤3、4、5为化学过程。
在化学过程中,步骤3、步骤5分别为化学吸附和化学脱附过程,步骤4为表面化学反应过程。
整个反应的总速率取决于这7个步骤中阻力最大的一步,该步骤称为反应的速率控制步骤。
如果步骤1或7为控制步骤,称反应为外扩散控制反应;如果步骤2或6为控制步骤,称反应为内扩散控制反应;如果步骤3、4或5的任何一步为控制步骤,称反应过程为反应控制或动力学控制。
在考虑以上所有步骤的影响的反应速率为为宏观反应速率,在消除了传递过程(包括热量传递和质量传递)的影响的理想情况下,测得的化学反应的反应速率为相应反应的本征反应速率。
在实际反应过程中,由于固体催化剂一般都具有很大的内表面,反应物质通过扩散达到催化剂内部的不同深度进行反应,因而导致常常具有浓度梯度和温度梯度,而这个浓度梯度和温度梯度对催化反应影响一般很大,因此需要了解催化剂颗粒内表面的浓度和温度梯度,即内扩散对总反应速率的影响。
乙醇气相脱水制乙烯动力学(内循环无梯度)
3.300
气 81.57 1.465 16.46 0.08825 0.408
液
16.24
83.5
0.6000
318.5
气 89.78 2.065
液
48.81
7.098
0.1551 51.09
0.984 0.9600
气 90.18 2.298 7.109 0.3243
1.440
液
56.59
43.02
1.570
水,乙醇,乙醚的摩尔数分别为 0.0134,0.0151,0.0041 质量计算;乙烯质量=原子量×摩尔数=32×0.0087=0.2795 水和乙醇,乙醚的质量分别为 0.2407,0.6975,0.3030 合计为:0.0087+0.2407+0.6975+0.303=1.5206 与乙醇进料量基本平衡。
六、讨论 1、本次实验用来巩固所学的有关动力学的知识,由实验证明该反应器是本
征反应。 2、本次实验在操作过程中,另取了 4 个点,得一直线。 3、由实验结果可以看出,升高反应温度,乙醇气相脱水制乙烯反应有利于
生成乙烯,不利于生成乙醚。最佳反应温度在 350℃左右。
95.98
46.45 0.03515
69.50 24.59 2.155 3.766
96.62
66.36 0.01675
59.08 38.42 0.7433 1.763
98.67
64.13 0.03238
54.62 43.76 0.4146 1.198
99.24
60.84 0.04605
CA
0.0002080 0.0001580 0.0001230 0.0004320 0.0002540 0.0002310 0.001462 0.0005890 0.0005340 0.0004270 0.0001470 0.00008210
乙醇气固相催化制备乙烯实验报告

化工专业实验报告实验六乙醇气固催化脱水制乙烯姓名:XXX学号:XXXXXX班级:同组人:一实验目的1、掌握乙醇脱水实验的反应过程、实验流程和操作。
2、掌握乙醇气相脱水操作条件对产物收率的影响,学会获取稳定的工艺条件的方法。
3、了解固定床反应器的构造、原理和使用方法,学习反应器的正常操作和安装。
4、学习气相色谱在线分析的方法和定性、定量分析,学习如何手动进样分析液体成分。
了解气相色谱的原理和构造,掌握色谱的正常使用和分析条件选择。
5、学习微量泵的使用方法,学会使用湿式流量计测量流体流量。
二、实验原理乙醇脱水属于平行反应,即可进行分子内脱水生成乙烯,又可进行分子间脱水生成乙醚。
一般而言,较低的温度有利于生成乙醚,因此该复合反应条件改变,脱水机理也有不同。
采用浓硫酸、氧化铝和分子筛催化剂可以有下列反应过程产生:浓硫酸:2C2H5-OH C2H5OC2H5+H2O(140℃)C2H5OH C2H4+H2O(170℃)氧化铝:C2H5OH C2H4+H2O(360℃)分子筛:C2H5OH C2H4+H2O(300℃)随着温度升高,反应可得到足够多的乙烯转化,而乙醚的生成量较少。
乙烯是世界上产量最大的化学产品之一,乙烯工业是石油化工产业的核心,乙烯产品占石化产品的70%以上,在国民经济中占有重要的地位。
世界上已将乙烯产品作为衡量一个国家石油化工生产水平的重要标志之一。
主要用于制聚乙烯、聚氯乙烯、醋酸、高级醇等,还可用来催熟水果。
三、实验装置及流程图6-1 固定床反应装置实物图 VAVV 57151683TCITITCI-控温热电偶;TI-测温热电偶;PI-压力计; K-调节阀;V-截止阀;VA-调节阀;VB-安全阀;1-气体钢瓶;2-钢瓶减压阀;3-稳压阀;4-干燥器;5-过滤器;6-质量流量控制器;7,7'-取样器;8-预热炉;9-预热器;10-反应炉;11-固定床反应器;12-汽液分离器;13-冷凝器; 14-尾液收集器;15-转子流量计;16-湿式流量计; 17-加料罐;18-液体泵;PI9104TCI TCITCI6137'141812111217KPIVV57151683TCITI TCI-控温热电偶;TI-测温热电偶;PI-压力计; K-调节阀;V-截止阀;VA-调节阀;VB-安全阀;1-气体钢瓶;2-钢瓶减压阀;3-稳压阀;4-干燥器;5-过滤器;6-质量流量控制器;7,7'-取样器;8-预热炉;9-预热器;10-反应炉;11-固定床反应器;12-汽液分离器;13-冷凝器; 14-尾液收集器;15-转子流量计;16-湿式流量计; 17-加料罐;18-液体泵;PI9104TCI TCITCI6137'14181111217K PI图6-2 乙醇气固催化制备乙烯实验流程图本实验选用固定床反应器,凡是流体通过不动的固体物料所形成的床层而进行反应的装置都称作固定床反应器。
乙醇气相脱水制乙烯动力学实验

化工专业实验报告实验名称:乙醇气相脱水制乙烯动力学实验学院:化学工程学院专业:化学工程与工艺班级:化工、班姓名:、学号、同组者姓名:指导教师:杨春风日期:2012年3月8日一、实验目的1.巩固所学的有关动力学方面的知识。
2.掌握获得反应动力学数据的方法和手段。
3.学会动力学数据的处理方法,根据动力学方程求出相应的参数值。
4.熟悉内循环式无梯度反应器的特点以及其它有关设备的使用方法,提高自己的实验技能。
二、实验原理乙醇属于平行反应。
既可以进行分子内脱水生成乙烯,又可以进行分子间脱水生成乙醚。
一般而言,较高的温度有利于生成乙烯,而较低的温度有利于生成乙醚。
因此,对于乙醇脱水这样一个复合反应,随着反应条件的变化,脱水过程的机理也会有所不同。
借鉴前人在这方面做的工作,将乙醇在分子筛催化剂作用下的脱水过程描述成:2C2H5OH→C2H5OC2H5+H2OC 2H5OH→C2H4+H2O三、实验装置及流程实验装置:无梯度反应器试剂和催化剂:无水乙醇,优级纯;分子筛催化剂,重3.0克。
内循环无梯度反应色谱实验装置流程示意图四、实验步骤开始实验之前,需熟悉流程中所有设备、仪器、仪表的性能及使用方法。
然后才可按实验步骤进行实验。
1.打开H2钢瓶使柱前压达到0.5kg/cm2确认色谱检测中截气通过后启动色谱,柱温110℃,气化室130℃,检测室温达到120℃,待温度稳定后,打开热导池—微电流放大器开关,桥电流至100mA。
2.在色谱仪升温的同时,开启阀恒温箱加热器升温至110℃,开启保温加热器升温至150℃。
3.打开反应器温度控制器开关,升温,同时向反应器冷却水夹套通冷却水。
4.打开微量泵,以小流量向气化器内通原料乙醇。
5.用阀箱内旋转六通阀取样分析尾气组成,记录色谱处理的浓度值。
6.在260-360℃之间选两个温度,改变三次进料速度,测定各种条件下的数据。
五、原始实验数据(附页)六、实验数据记录及处理乙醇密度:0.79g/ml 进料速度:0.3ml/min 乙醇进料质量:3.0g计算说明:乙醇的转化率=反应掉的乙醇摩尔数/原料中乙醇的摩尔数乙烯的收率=生成乙烯的摩尔数/原料中乙醇的摩尔数乙醇的进料速度=乙醇液的体积流量×0.79(乙醇的密度)/46(乙醇的分子量)乙烯的生成速度=(乙醇进料速度×乙烯的收率)/[催化剂用量(g)] mol/(g·h)反应器内乙醇的浓度:C A=P A/(R·T)式中P A为乙醇的分压;反应的总压为0.1Mpa。
乙醇脱水反应动力学参数测定实验讲义

三、实验装置及流程
采用磁驱动内循环无梯度反应器,实验流程如图 1,反应器见图 2。
TT—热电偶,PI—压力计,1—钢瓶,2—稳压阀,3—调节阀,4—转子流量计,5—预热器,6— 预热炉,7—反应器,8—反应炉,9—冷凝器,10—尾液收集器,11—六通阀,12—马达 图 1 内循环无梯度乙醇脱水实验装置
2、数据处理
表 2 数据处理表 实 验 号 1 反应 温度 /℃ 245 乙醇进 料量 /(ml/mi n) 2 4 6 2 270 2 4 6 3 312 2 4 6 产物摩尔数组成 乙烯 0.064 0.025 0.056 0.515 0.549 0.504 0.544 0.523 0.454 水 0.321 0.281 0.221 0.195 0.152 0.229 0.309 0.333 0.305 乙醇 0.602 0.667 0.712 0.265 0.258 0.235 0.145 0.144 0.240 乙醚 0.013 0.027 6 0.011 0.025 0.041 0.032 0.003 0 0.006 乙醇转 化率 0.1301 0.1073 0.099 0.6807 0.7098 0.7073 0.7910 0.7841 0.6601 乙烯 收率 0.092 5 0.033 5 0.070 9 0.620 5 0.617 5 0.627 6 0.782 7 0.784 1 0.643 1 V/(mol · min1 -1 g ) 0.0010 0.0008 0.0024 0.0071 0.0141 0.0646 0.0090 0.0179 0.0221 C/(L/m ol) 0.0141 6 0.0156 9 0.0167 5 0.0059 5 0.0057 9 0.0052 7 0.0030 2 0.0030 0 0.0050 0 2.9801 1.1933 K/( L1 · min1 -1 g ) 0.0706 2
乙醇气相脱水制备乙烯动力学

实验三乙醇气相脱水制乙烯反应动力学(简易无梯度内循环)反应动力学描述了化学反应速度与各种因素如浓度、温度、压力、催化剂等之间的定量关系。
动力学在反应过程开发和反应器设计过程中起着重要的作用。
它也是反映工程学科的重要组成部分。
其中,分子筛催化剂的突出优点是乙烯收率高,反应温度较低。
故选用分子筛作为本实验的催化剂。
一.实验目的1.巩固所学有关反应动力学方面的知识。
2.掌握获得反应动力学数据的手段和方法。
3.熟悉内循环式无剃度反应器的特点及其它有关设备的使用方法,提高实验技能。
二.实验原理乙醇脱水属于平行反应,既可以进行分子内脱水生成乙烯,又可以进行分子间脱水生成乙醚。
一般而言,较高的温度有利于生成乙烯,而较低的温度有利于生成乙醚。
因此,对于乙醇脱水这样一个复合反应,随着反应条件的变化,脱水过程的机理也会有所不同。
借鉴前人在这方面所做的工作,将乙醇在分子筛催化剂作用下的脱水过程描述成:2C2H5OH→C2H5OC2H5+H2OC2H5OH→C2H4+H2O三.装置、流程及试剂1.装置本实验装置由三部分构成。
第一部分是由微量进料泵、氢气钢瓶、汽化器和取样六通阀组成的进料系统。
第二部分是反应系统,它是由一台内循环式无剃度反应器、温度控制器和显示仪表组成。
反应器的结构如图5-1所示。
图5-1无梯度反应器结构图1-直流电机;2-磁钢固定片;3-磁钢;4-上法兰;5-磁钢;6-磁钢固定片;7-轴承;8-密封垫片;9-冷却水夹套;10-反应器上部;11-轴承;12-密封垫片;13-密封垫片;14-反应器下部;15-旋转轴:16-反应器外壁;17-旋转叶片;18-催化剂及固定框;19-加热电炉;20-热电偶套管;21-进气口;22-出气口第三部分是取样和分析系统。
包括取样六通阀、产品收集器和在线气相色谱仪。
整套实验装置安装在一个实验柜中,操作方便。
2.流程实验流程见图5-2图5-2实验流程简图1-微量进料泵;2-氢气钢瓶;3-记录仪;4-气相色谱仪;5-汽化器;6-六通阀;7-冷凝器;8-温度控制仪;9-反应器;10-电机调速器;11-数字化温度显示器;12-恒温阀箱;13-色谱处理器3.试剂和催化剂:无水乙醇,优级纯;分子筛催化剂,60~80目,重3.0克。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
反应温度 乙醇进料量
实验号
℃
ml/min
0.05
1
275.8
0.10
0.15
0.05
2
289.8
0.10
0.150.0533源自8.50.100.15
0.05
4
341.9
0.10
0.15
产物组成(mol%)
乙醇转化率 乙烯收率
γ
乙烯 水 乙醇 乙醚
%
%
6.719 27.23 0.9391 65.12
99.32
图2
试剂:无水乙醇―分析纯 分子筛催化剂:60~80 目,2.04g
三、实验方法及操作步骤
1、打开 H2 钢瓶使柱前压达到 0.5kg/cm2 确认色谱检测中载气通过后启动色 谱,柱温 110℃,汽化室 130℃,检测室温达到 120℃,待温度稳定后,打开热
导池微电流放大器开关,桥电流至 100mA。
水,乙醇,乙醚的摩尔数分别为 0.0134,0.0151,0.0041 质量计算;乙烯质量=原子量×摩尔数=32×0.0087=0.2795 水和乙醇,乙醚的质量分别为 0.2407,0.6975,0.3030 合计为:0.0087+0.2407+0.6975+0.303=1.5206 与乙醇进料量基本平衡。
K
1.804 3.657 6.227 1.782 4.429 8.517 3.202 20.47 32.94 19.61 109.9 280.3
3、计算方法:
乙烯
乙醇
分子量
28
46
质量校正因子
0.585
0.64
摩尔校正因子
2.08
1.39
计算举例:以 318.5℃,0.15ml/min 为例:
乙醚 74
22.4L / mol n 乙烯=0.06429mol 0.9163=0.05890mol 同理可得:
n 乙醇=0.003103
n 水=0.002186
n 乙醚=0.00009267
液体中:
56.59 0.55
w 水=
=0.5192
56.59 0.55 43.02 0.67
同理可得:
w 乙醚=0.4808
图1.设备结构图图 1
7 3
13 16
19
TIC-控温;TT-测温;PI-压力计;V1-进气截止;V2-进气预热截止;K-阀箱产物流量调节;J-进液排放三通阀; 1-气体钢瓶;2-稳压阀;3-干燥器;4-过滤器;5-质量流量计;6-止逆阀;7-缓冲器;8-预热器;9-预热炉;10-反应器 11-反应炉;12-马达;13-冷凝器;14-气液分离器;15-取样器;16-转子流量计,17-湿式流量计;18-加料罐;19-加料泵
0.67 0.91
水 18 0.55 3.03
a.
Xi
ci fm
m
cj fi
f 1
气体中:
X
乙烯=
90.18
90.18 2.08 2.08+2.298 3.03+7.109
1.39+0.3243
0.91
=0.9163
同理可得:
X 乙醇=0.04827 X 水=0.03401 X 乙醚=0.001442 气体总 mol 数= 1.440L =0.06429mol
3.物料衡算
温度 265℃,流速 4ml/hr,ρ=0.789
半小时乙醇的量:4×0.5×0.789=1.578(g)
乙烯生成速率由造膜流量计 10ml 为 92s
半小时乙烯的摩尔数: 10 / 92 60 30 0.008734 22400
总的摩尔数:
乙烯的摩尔数 乙烯组份
0.008734=0.0413 0.2113
3.300
气 81.57 1.465 16.46 0.08825 0.408
液
16.24
83.5
0.6000
318.5
气 89.78 2.065
液
48.81
7.098
0.1551 51.09
0.984 0.9600
气 90.18 2.298 7.109 0.3243
1.440
液
56.59
43.02
1.570
e.乙烯生成速率
=
乙醇进料速率 乙烯收率= 催化剂用量
0.1544 0.4645=0.03515/ 2.04
g
f.反应时乙醇的浓度
C
=
A
PA RT
=
0.08206(0.207235.9115+318.5)=0.
0005337
g.生成乙烯反应的速率常数 K 0.03515 65.86 CA 0.0005337
95.98
46.45 0.03515
69.50 24.59 2.155 3.766
96.62
66.36 0.01675
59.08 38.42 0.7433 1.763
98.67
64.13 0.03238
54.62 43.76 0.4146 1.198
99.24
60.84 0.04605
CA
0.0002080 0.0001580 0.0001230 0.0004320 0.0002540 0.0002310 0.001462 0.0005890 0.0005340 0.0004270 0.0001470 0.00008210
1、原始数据表:
进料量 反应温度
实验号
ml/min
℃
产物含量,wt%
乙烯
水 乙醇 乙醚
半小时的量
气 80.6 1.594 16.86 0.1117 0.033L
0.05
液
10.93
88.87
0.995g
气 82.31 1.286 15.92 0.06419 0.050L
1
0.10
275.8
液
5.102
气 91.50 2.358 4.246 0.2151
0.672
液
63.79
36.18
0.27
341.9
气 92.99 2.583
液
86.31
1.751
0.2498 13.69
1.280 0.7100
气 95.89 2.07 1.089 0.5459
1.800
液
92.03
7.842
1.1800
2、数据处理
4.437
以 1/T 为横坐标,以 lnK 为纵坐标作图
a=
1
0.001822
273.15 275.8
b=
1
0.001776
273.15 289.8
c=
1
0.001690
273.15 318.5
d=
1
0.001626
273.15 341.9
5 4.5
4 3.5
3 2.5
1 实验装置:本实验采用磁驱动内循环无梯度反应器,反应器见图 1,实验 流程如图 2。
主要设备结构如图2所示。
123 4 5 6 7 8 9 10 11 12 13
14 15 16
17
1-压片,2-催化剂,3-框压盖,4-浆叶,5-反应器外 筒, 6-加热炉,7-反应器内筒,8-法兰,9-压盖,10轴承, 11-冷却内筒,12-轴,13-内支撑筒,14-外支 撑筒, 15-反应磁钢架,16-底筒,17-磁力泵
2、在色谱仪升温的同时,打开反应器温度控制器开关,升温,同时向反应
器冷却水夹套通冷却水,并打开搅拌器,将转速调至 1000r/min-1500r/min
3、待反应温度稳定后,打开微量泵,以小流量向气化器内通入原料乙醇。
4、待气液分离器内出现液体,且湿度流量计指针开始转动时,按下述方法
取样分析:
① 记录下湿度流量计的读数,并放空气液分离器内的液体,开始计时,半
=
原料乙醇量 - 产物中乙醇量 原料乙醇量
0.15
30 0.789 0.003103 0.15 30 0.789
46
=95.98%
c.乙烯的收率=
生成的乙烯量 原料乙醇量
0.05890 28 0.15 30 0.789
=46.45%
d.乙醇的进料速度= 0.15 60 0.7893=0.1544mol/ hr 46
半小时的量
气 86.18 1.003 12.32 0.06785 0.068
液
6.684
93.10
1.065
289.8
气 81.30 1.212 17.06 0.06581
液
8.512
91.09
0.098 2.165
气 81.01 1.299 17.45 0.08171 0.164
液
8.792
90.76
n 水= 2.070g 0.4822 =0.04529mol
18g / mol
同理可得:
n 乙醚=0.01020mol
由此可得产物总 mol 数=0.06429+0.04529+0.01020=0.1198mol
产物中:
X乙烯=
0.05890 0.1198
0.4917
同理可得:
X 乙醇=0.02591 X 水=0.3964 X 乙醚=0.08593 b.乙醇转化率
小时后读出湿度流量计的读数,其差值即为半小时的尾气量。同时用取样瓶取出
气液分离器内的液体,称量其重量(此前要称好取样瓶的重量),其差值即为半
小时液体的量。
② 分别取样用色谱仪测出气体和液体中各组分的含量
