中级无机化学-第二章
中级无机化学-习题及答案-完整版

NH4+ + NH2-,K=1.0 ×10-33
[NH4+][NH2-]=1.0×10-33,
[NH4+]=(1.0×10-33)1/2=3.16×10-17 mol·L-1
1.10 硬软酸碱原理:硬酸趋向于与硬碱形成稳定的配合物,而软酸趋向于与软碱形成稳定 的配合物。
根据前线分子轨道理论,酸是电子对接受体,它的反应性主要决定于它的 LUMO(最 低空分子轨道);碱是电子对给予体,它的反应性主要决定于它的 HOMO(最高占据分子轨 道)。由于硬酸具有高能量的电子接受轨道 LUMO,而硬碱具有低能量的电子给予轨道 HOMO,它们前线轨道的能量差别比较大,因此硬酸与硬碱之间主要以静电作用相互吸引 生成稳定配合物。与此相反,软酸具有能量较低的 LUMO,软碱具有能量较高的 HOMO,
1,2,4 取代:最高次轴:C1,其他轴:无 1,3,5 取代:最高次轴:C3,3 个C2⊥C3
2.3(1)属Td点群,含对称元素:4C3、3C2、3S4、6σd
(2)属D4h点群,含对称元素C4、C2、2 C2' 、 2C2'' 、i、2S4、σh、2σv、2σd
(3)若忽略H原子,属C2v点群,含对称元素C2、2σv (4)属D3d点群,含对称元素C3、3C2'⊥C3、i、2S6、3σd (5)属C3v点群,含对称元素C3、3σv (6)属D2h点群,含对称元素C2、2C2'⊥C2、i、2σv、σh (7)属D∞h点群,含对称元素C∞、∞C2'、σh、∞σv、i、S∞ (8)属C2v点群,含对称元素C2、2σv
1.8 (1) KNH2 +
NH2 NH3(l)
NH3 +
NHK
(2) HNO3 + 2H2SO4
中级无机化学第二章

被水分子的氧所吸引生成氢键。换句话说,裸露的原子核在水中
是不可能稳定存在的,易被水合。水合时放出大量的热量:
H+(g)+H2O(l)→H+(aq) △Hθ=-1091.1 kJ·mol-1
如此多的热量表明水合趋势很大,H+在水中是同水分子结合在一起而存在的:
如H
H
H
H O:
H O······H O
H (H3O+)
Cr(H2O)63+ → H++
Cr(H2O)5(OH)2+
碱: 除了如NH3、H2O和胺等分子碱外,还有
●弱酸的酸根阴离子,如 Ac-, S2-, HPO42-
●阳离子碱,如 Al(H2O)5(OH)2+, Cu(H2O)3(OH)+等。
有些物种既能给出质子显酸性,又能结合质子显碱性,如
H2O → OH- + H+
NH3 → NH2-+ H+
-
2-
H2O + H+ → H3O+
NH3 + H+ → NH4+
+ 第十一页,共37页
-
+
2 质子溶剂
某些溶剂同水一样,也能自身电离放出质子生成去质子后的
溶剂阴离子。
H2O+H2O H3O++OH- EtOH+EtOH EtOH2++EtO- HF+2HF H2F++HF2- H2SO4+H2SO4 H3SO4++HSO4- 显然Brosted-Lowry的定义也适合这些溶剂。因此可将这种
中级无机化学第二章
第一页,共37页
第二章 酸碱和溶剂化学
2.1 酸碱概念
酸和碱不能简单地分别定义为在电离时会产生H+离子和OH-
离子的物质。且即使是酸,在水溶液中也不能产生游离的H+离子
。由于H+是一个裸露的原子核,其半径极小,为Li+离子半径的
中级无机化学

CCl4难水解,是因C的价轨道已用于成键且又没有孤电子对之故。 NF3的分子结构与NCl3同,其中N原子也是采用sp3杂化轨道成键,其上有一对孤 对电子。然而, 1 由于F原子的电负性较大,使得NF3的碱性(给电子性)比NCl3小,因而亲电水解 很难发生; 2 由于N是第二周期元素,只有4条价轨道(没有d轨道),不可能有空轨道接受水 的亲核进攻; 3 N-F键的键能比N-Cl键的键能大,不容易断裂。 这些原因决定了NF3不会发生水解作用。
第一章 原子、分子及元素周期性
第一节 原子结构理论概述 第二节 原子参数及元素周期性 第三节 共价键理论概述 第四节 键参数与分子构型 第五节 分子对称性与点群 第六节 单质的性质及其周期性递变规律 第七节 主族元素化合物的周期性性质 以上七节主要自学,要求掌握: 1 用徐光宪的改进的Slater规则计算电子的屏蔽常数 2 了解电负性的几种标度,理解环境对电负性的影响和基 团电负性的概念 3 键参数 价层电子对互斥理论 分子对称性知识 4 单质及其化合物的一些性质的周期性变化规律 同时,还要特别注意 5 掌握周期反常现象的几种表现形式及合理解释
习题:1,2,3,4,6,7,8,10,11,12,13,15,17
原子所带电荷
电负性与电荷的关系可用式 χ = a + b 表示。 式中为分子中原子所带的部分电荷。a、b为两个 参数。其意义是: a表示中性原子的电负性(中性原 子=0), b为电荷参数,表示电负性随电荷而改变 的变化率。大的、易极化的原子有较小的b值; 小 的、难以极化的原子b值较大。
分子
是
是 D∞h i i? 否 C∞v
直线型 ?
是
否 两个或多个 Cn(n≥3) ?
否 Cn ? 否 ζ?
T,Th,Td,O,Oh 是
中级无机化学要点

《中级无机化学》教辅材料余红霞主编湖南理工学院第一章酸碱理论与非水溶液化学本章学习重点本章内容为无机化学的基础知识,它是对基础无机化学中学过的酸碱知识的总结、扩展与提高,我们应较全面地掌握以下内容:1、掌握路易斯理论、溶剂体系理论的要点,结合具体实例了解相应物质之间的酸碱反应;2、掌握二元氢化物、无机含氧酸碱物质的酸碱强度变化规律,了解酸碱强度与分子结构之间的关系;3、掌握HSAB原理及其应用;4、了解超酸的概念及超酸的主要用途,主要非水溶剂以及一些常见物质在硫酸和液氨中的反应。
本章主要重点是近代酸碱理论中的路易斯理论和溶剂体系理论、HSAB原理及其应用。
本章学习难点本章的难点是酸碱强度与分子结构之间的关系、对溶剂体系理论的理解、溶剂的自电离式、物质在非水溶剂中的酸碱行为与酸碱反应。
疑难解答1-1简述溶剂体系理论的要点,有何优缺点?并以此分析在液态BrF3中,SbF5与KF的反应?答:溶剂体系理论认为,许多溶剂能发生自电离,生成特征阳离子和特征阴离子。
如:特征阳离子特征阴离子2H2O H3O+ + OH—2NH3NH4+ + NH2—2H2SO4H3SO4++ HSO4—2BrF3BrF2+ + BrF4—溶剂体系理论的要点是:凡在溶剂中产生(或通过反应生成)该溶剂的特征阳离子的溶质称作酸,而产生(或通过反应生成)该溶剂的特征阴离子的溶质称作碱。
溶剂体系理论的优点是将酸碱范围扩大到了非质子体系,缺点是只能适用于能发生自电离的溶剂体系中。
在液态BrF3中,BrF3作为溶剂发生自电离:2BrF3BrF2++ BrF4—SbF5和KF分别按下式跟BrF3反应:SbF5+ BrF3→BrF2++ SbF6—酸KF + BrF3 →K+ + BrF4—碱BrF2+ + BrF4—2BrF3净反应:SbF5+ KF→K SbF61-2为何在液态SO2中,Cs2SO3可用来滴定SOCl2?答:在液态SO2中,SO2按下式子电离:2SO2 SO2++SO32—在液态SO2中,Cs2SO3是碱,SOCl2是酸,因为SOCl2和Cs2SO3在SO2中分别按下式解离:SOCl2 SO2++2Cl—酸Cs2SO3 2Cs++ SO32—碱SO2++ SO32—2SO2净反应:SOCl2+ Cs2SO3→2 Cs Cl+2SO2所以,在液态SO2中,Cs2SO3可用来滴定SOCl2。
中级无机化学答案整理版

中级⽆机化学答案整理版中级⽆机化学项斯芬姚光庆编著北京⼤学出版社第⼀章1.4.解:1) H 2O 2C 22(2)S 2O 32C3v3) N 2O (N N O ⽅式) C v(4)Hg 2Cl 2 D h5)H 2C=C=CH 2 D2d(6)UOF 4 C 5v7) BF 4T d(8)SClF 5C 4v9) 反 -Pt (NH 3)2Cl 2D2h(10)PtCl 3(C 2H 4)C2v第⼆章2.1 解:transP 代表 PPh 3)2.2 解 1)MA 2B 4Ni 2+d 8 组态 Pt 2+ d 8 组态第四周期分裂能⼩) 第六周期(分裂能⼤)ClNi PClClP Cl Cl Pt PP Cl P P Pt C C l l四⾯体构型平⾯四⽅形构型(两种构型)BM BA B M A BAMAAA MBcisCo(en)2(NH 3)Cl 2+trans cis fac(⾯式) mer(经式) D 4h=00 C 2vC 3vC 2v2.3 Co(en)2Cl 2+ D 2hC 2 光活异构体 C 2trans Co(en)(NH 3)2Cl 2+ Cl Cl NH 3 NH 3cisCl NH 3trans(1) trans(2) 2.4 Co(en)33+ D 3PtCl(dien)+Ru(bipy)32+D 3H 3cis⼿性分⼦CH 2 CH 2 NH 2HNCH 2 CH 2 NH 2dien基本上为平⾯分⼦ ,⽆⼿性2.5 (1) 分别⽤ BaCl 2 溶液滴⼊,有⽩⾊沉液出现的为 [Co(NH 3)5Br]SO 4,或分别加⼊ AgNO 3溶液,产⽣浅黄⾊沉淀的为 [Co(NH 3)5SO 4]Br 。
(2) 等物质量的异构体中分别加⼊过量 AgNO 3,产⽣少量沉淀( 1molAgCl ↓) 的为前者(摩尔⽐为 2:1),产⽣⼤量沉淀( 2molAgCl ↓)的为后者。
无机化学(周祖新)习题解答第二章

无机化学(周祖新)习题解答第二章第二章化学热力学初步思考题1.状态函数得性质之一就是:状态函数得变化值与体系得始态与终态有关;与过程无关。
在U、H、S、G、T、p、V、Q、W中,属于状态函数得就是U、S、G、T、p、V。
在上述状态函数中,属于广度性质得就是U、H、S、G、V,属于强度性质得就是T、p。
2.下列说法就是否正确:⑴状态函数都具有加与性。
⑵系统得状态发生改变时,状态函数均发生了变化。
⑶用盖斯定律计算反应热效应时,其热效应与过程无关。
这表明任何情况下,化学反应得热效应只与反应得起止状态有关,而与反应途径无关。
⑷因为物质得绝对熵随温度得升高而增大,故温度升高可使各种化学反应得△S大大增加。
⑸△H,△S受温度影响很小,所以△G受温度得影响不大。
2.⑴错误。
强度状态函数如T、p就不具有加与性。
⑵错误。
系统得状态发生改变时,肯定有状态函数发生了变化,但并非所有状态函数均发生变化。
如等温过程中温度,热力学能未发生变化。
⑶错误。
盖斯定律中所说得热效应,就是等容热效应ΔU或等压热效应ΔH。
前者就就是热力学能变,后者就是焓变,这两个都就是热力学函数变,都就是在过程确定下得热效应。
⑷错误。
物质得绝对熵确实随温度得升高而增大,但反应物与产物得绝对熵均增加。
化学反应△S得变化要瞧两者增加得多少程度。
一般在无相变得情况,变化同样得温度,产物与反应物得熵变值相近。
故在同温下,可认为△S不受温度影响。
⑸错误。
从公式△G=△H-T△S可见,△G受温度影响很大。
3.标准状况与标准态有何不同?3.标准状态就是指0℃,1atm。
标准态就是指压力为100kPa,温度不规定,但建议温度为25℃。
4.热力学能、热量、温度三者概念就是否相同?试说明之。
4.这三者得概念不同。
热力学能就是体系内所有能量得总与,由于对物质内部得研究没有穷尽,其绝对值还不可知。
热量就是指不同体系由于温差而传递得能量,可以测量出确定值。
温度就是体系内分子平均动能得标志,可以用温度计测量。
中级无机化学总结(2)-酸碱篇
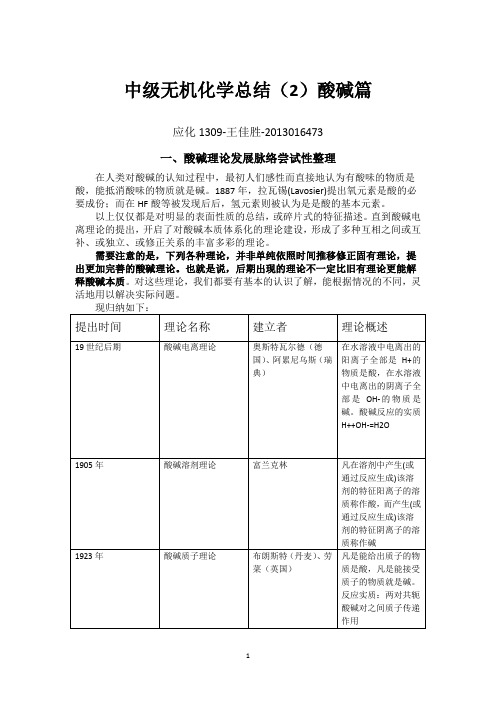
中级无机化学总结(2)酸碱篇应化1309-王佳胜-2013016473一、酸碱理论发展脉络尝试性整理在人类对酸碱的认知过程中,最初人们感性而直接地认为有酸味的物质是酸,能抵消酸味的物质就是碱。
1887年,拉瓦锡(Lavosier)提出氧元素是酸的必要成份;而在HF酸等被发现后后,氢元素则被认为是是酸的基本元素。
以上仅仅都是对明显的表面性质的总结,或碎片式的特征描述。
直到酸碱电离理论的提出,开启了对酸碱本质体系化的理论建设,形成了多种互相之间或互补、或独立、或修正关系的丰富多彩的理论。
需要注意的是,下列各种理论,并非单纯依照时间推移修正固有理论,提出更加完善的酸碱理论。
也就是说,后期出现的理论不一定比旧有理论更能解释酸碱本质。
对这些理论,我们都要有基本的认识了解,能根据情况的不同,灵活地用以解决实际问题。
现归纳如下:提出时间理论名称建立者理论概述19世纪后期酸碱电离理论奥斯特瓦尔德(德国)、阿累尼乌斯(瑞典)在水溶液中电离出的阳离子全部是H+的物质是酸,在水溶液中电离出的阴离子全部是OH-的物质是碱。
酸碱反应的实质H++OH-=H2O1905年酸碱溶剂理论富兰克林凡在溶剂中产生(或通过反应生成)该溶剂的特征阳离子的溶质称作酸,而产生(或通过反应生成)该溶剂的特征阴离子的溶质称作碱1923年酸碱质子理论布朗斯特(丹麦)、劳菜(英国)凡是能给出质子的物质是酸,凡是能接受质子的物质就是碱。
反应实质:两对共轭酸碱对之间质子传递作用1923年酸碱电子理论路易斯能接受电子对的物质是酸,能给出电子对的物质是碱1939年正负离子理论乌萨诺维奇(前苏联)任何能产生阳离子或其他能结合一个阴离子(或一个电子)的物质为酸,相反地,任何能产生阴离子或其他能结合一个阳离子(或给出一个电子)的物质为碱。
1939年氧化物-离子理论(氧离子理论)鲁克斯酸是氧离子的接受体,碱是氧离子的给予体。
附:以下重点介绍部分理论的适用范围及特点——酸碱溶剂理论。
中级无机化学复习资料

中级无机化学第一部分中级无机化学复习资料一酸碱理论。
1.水-离子理论:酸是能在水中电离出H+的物质,碱是能电离出OH-的物质。
2.质子理论:任何可以作为质子给予体的物质叫做酸,任何可以充当质子接受体的物质叫做碱。
3.溶剂体系理论:凡是能产生该溶剂的特征阳离子的物质是酸,产生该溶剂的特征阴离子的物质是碱。
NH3 + H2O = NH4+ + OH-由于产生特征阴离子OH-,所以该溶剂是碱。
4.电子理论【Lewis】:能接受电子的是酸,给电子的是碱。
5.正负离子理论:任何能中和碱形成盐并放出阳离子或结合阴离子【电子】的物质是酸,任何能中和酸放出的阴离子【电子】或结合阳离子的物质为碱。
6.Lux酸碱理论:酸为O2-离子接受体,碱定义为该离子的给予体。
二Lewis酸碱。
1.硼族酸:BF3<BCl3<BBr3 。
AlCl32.碳族酸:SiI4<SiBr4<SiCl4<SiF43.氮族和氧族酸:氨,胺,水,三氧化硫。
三软硬酸碱体积小,正电荷多的,在外电场作用下难以变形的为硬酸,反之称为软酸。
硬碱是分子的配位原子具有高的电负性,难极化和氧化的物质。
软硬酸碱的应用:可以有效地用来定性的估计盐类在水溶剂或其它溶剂中的溶解度。
四无机化合物的制备方法1高温无机合成:高熔点金属粉末的烧结,难熔化合物的熔化和再结晶,陶瓷体的烧成。
前驱体法,溶胶-凝胶合成法,化学转移反应。
2低温合成:冰盐共熔体系,干冰浴,液氮。
3 水热合成:a.在密闭的以水为溶剂体系,在一定的温度和水自身的压力下使原料混合物发生反应。
b.水热体系:高压釜或水热弹。
4高压合成无水无氧合成,电化学无机合成,等离子体合成.五无机分离技术溶剂萃取法,离子交换分离,膜法分离技术六表征技术X射线衍射法【粉末,单晶法】,紫外-可见分光光度法【金属配合物】,红外光谱,核磁共振谱,电子瞬磁共振,X射线光电子能谱,热分析技术【热重分析,差热分析,差示扫描量分析】七无机材料化学1.离子晶体的鲍林规则a.鲍林第一规则—负离子配位多面体规则。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二章:酸碱和溶剂化学
属于Lewis碱有: ① 阴离子; ② 具有孤对电子的中性分子,如NH3、H2O 等; ③ 含 键的分子(可将电子给出)。
第二章:酸碱和溶剂化学
许多Lewis酸碱反应的实质是酸碱的传 递反应:
如:B:+B’→A = B→A+:B’ (碱的置换或酸的传递) A+B→A’ = B→A+A’ (酸的置换或碱的传递) B→A+B’→A’ = B→A’+B’→A (酸碱同时传递)
第二章:酸碱和溶剂化学
下面列出了硬酸、硬碱、软酸、软碱以及交界酸碱的一些例子。
酸 酸 硬 酸 硬 酸 硬 酸
+ + + + + + + + +
酸
软 酸 软 酸 软 酸
+ - + + + +
交界酸 交界酸交界酸
+ + + + - H+ Li+,, Na+,, +, +(Rb+, +(Rb+ Fe2+, Co2++ Ni2+,+Cu2++ Zn2++ Co(CN)53 -, Pd25+, Pt2 +2,+Pt4 +2+, Pt4+ , K (Rb , Cs+ ) Fe , Ni2 , Ni , Cu Co(CN)53 , Pd2 3, , Pd , PtPt Co(CN) Pt2 , 4 H ,, Li HNaLi K Na , K Cs ) , Cs ) Fe2 , Co2 2 , , Co2, Cu2 2 , ,Zn2 2 , Zn2 + + + + + + + + + + + 2+ 2+ + 3+ 2++ 2+ 2++ + + + + + + + + Be2+ BeMe2 Mg2+, Ca2++, Ca (Ba 2+)+ Rh3+, Ir3+, +, Ir++ Os2++ Be2 , Mg , Mg , Sr + , Sr ) Rh3 Ru , Ru Cu , Ag , Au Cd + Be2 ,, BeMe2,,BeMe2,Ca2 2, Sr2 2(Ba2 2) (Ba2 Rh3 , Ir3 , Ru3 3 , ,Os2 3 , Os2 Cu , Ag , Au , Cd 2 ,, ,Hg2 2 ,, Hg 2 2 ,, , Hg Cu , Ag , Au , Cd Hg 2 Hg 2
就是软酸是受体原子对外层电子的吸引力弱的酸)。 金属原子、Hg 2+ 离子及InCl 3之类化合物即是典 型的软酸。
第二章:酸碱和溶剂化学
硬碱和软碱可以按照同样的原理处理:
硬碱中的价电子结合紧密,软碱中的价电子容 易被极化。
典型的硬碱是一些较小的阴离子如F- 离子,对 称的含氧酸阴离子,如ClO4-,以及具有小的给予体 原子的分子如NH3等。 典型的软碱是一些较大的阴离子如I-、H-,或 者含有较大的给予体原子的分子。
第二章:酸碱和溶剂化学
HSAS规则
为了说明上述的颠倒现象,Pearson提出了软 硬酸碱的概念。
把Lewis酸碱分成硬的、交界的和软的酸碱。
软酸、软碱之所以称为软,是形象地表明它 们较易变形; 硬酸、硬碱之所以称为硬,是形象地表明 它们不易变形。
第二章:酸碱和溶剂化学
换句话说,软酸或软碱是其价电子容 易被极化或容易失去的酸或碱,而硬酸或 硬碱则是其价电子与原子核结合紧密且不 容易被极化或不容易失去的酸或碱。
+ + + + + + + + +
+
+
+
+
+
+
+
+
+ GaI3, Tl +, TiMe3, TiMe3 GaI3, Tl GaI3, Tl , TiMe3 CH2(卡宾) 2(卡宾) CH CH2(卡宾) + + HO +, RO +, RS +,+RSe+,,,Te4 +,,+, Te4+, HO RS , RS RSe HO , RO , , RO, RSe Te4 + RTe + RTe+ RTe
第二章:酸碱和溶剂化学
研究表明,要判定哪一个Lewis碱强和哪一个弱,即要 对Lewis碱搞一个相对的碱度系统标准是十分困难的。当用 不同的酸作参比标准时,可以得到不同的碱度系统标准。 如,卤素离子(碱)对Al3+离子给电子能力为: I-< Br-< Cl-< F- 但卤素离子(碱)对Hg2+离子的给电子能力却有相反的 顺序: F-< Cl-< Br-< I- 类似的颠倒现象很多。 同样,要对Lewis酸搞一个相对的酸度系统标准也是十 分困难的,当用不同的碱作参比标准时,可以得到不同的 酸度系统标准。
第二章:酸碱和溶剂化学
右图示出Lewis 酸碱的可能轨道重 叠,左边是酸的空 轨道的情形 (空轨 道的情形未画出)。
根据这种反应的实质,可以把Lewis酸称作 电子接受体或亲电试剂,而把Lewis碱叫作电子
给予体或亲核试剂。
第二章:酸碱和溶剂化学
属于Lewis酸的有: ① 正离子,如Cu2+、Ni2+、Al3+,这些金 属离子包含有可用于成键的未被占据的价轨道; ② 含有价层未充满原子的缺电子化合物, 如BX3,AlX3; ③ 含有价层可扩展的原子的化合物 ,如 SnCl4(利用外层空d 轨道)。
第二章
酸碱和溶剂化学
第二章:酸碱和溶剂化学
要点
酸碱理论 电子酸碱理论及HSAB规则 质子酸碱和质子溶剂 溶剂化学 水合焓 非水质子溶剂体系(酸性质子溶剂 碱性质子溶剂、亲核质子溶剂 类水两性溶剂) 非质子溶剂体系(van der Waals溶剂 Lewis碱溶剂 离子传递溶剂 熔盐体系) 酸碱强度的量度 水溶液中质子酸碱的强度(影响质子酸碱强度的因素 水溶液中质子酸碱的强度 含氧酸的酸性) 非水溶剂中的质子酸碱的强度 电子酸碱的强度 超酸和魔酸 习题:1,2,3,4,5,6,7,8,9
4+ 4+ + Sc3+ La3+ +Ce3+ +Gd3++ Lu3++, Lu +, Th, + BMe3, GaH3 HgMe +HgMe+ BMe BMe Sc , La , Ce , Gd , Th , U Sc3 ,, La3 3,, Ce3 3,, Gd3 3 , ,Lu3 3, Th4 3, U4 ,4 , U4 , 3, GaH33, GaH3 HgMe + + + + 2+ 4+ + 2+ + 2+ + + + + UO2 Pu4 Pu R3C+, C6H5+ , Sn2+, Pb + R H5 Sn , Sn UO22 ,, UO22 , Pu4 R3C , C63C ,, C6H5, Pb2 2 , Pb2 BH3, GaMe,3, GaCl3,,, GaCl33,,,GaBr3, BH3 GaMe 3 GaBr BH3, GaMe3, GaCl3 GaBr 3
HO
第二章:酸碱和溶剂化学
2.1.1 Lewis电子酸碱理论及HSAS规则
Lewis(路易斯)电子酸碱理论
Lewis电子酸碱理论是一个广泛的理论,它完全不考虑溶剂, 实际上许多Lewis酸碱反应是在气相中进行的。在Lewis酸碱反应 中,一种粒子的电子对用来与另一种粒子形成共价键 。“供给” 电子对的粒子是碱,而“接受”电子对的粒子是酸 。反应可以写 成: A(酸)+:B(碱) A←B 显然,Lewis酸应该有空的价轨道,这种轨道可以是轨道, 也可以是轨道。而Lewis碱应该有多余的电子对,这些电子可以 是电子,也可以是电子。
- - - - - - - - - - - -
交界碱 C6H5NH2, C5H5N, N3 , N2 NO2 , SO32 Br
- - -
软 碱 H
- - -
R , C2H4, C6H6, CN , RNC, CO SCN , R3P, (RO)3P, R3As R2S, RSH, RS , S2O32 I
SnMe2 N3 , RPO2 , ROPO2 , As3 SO3, Cl7 , I5 , I7
+ + + + + + +
O, Cl, Br, I, N, RO, RO2 M0(金属原子和大块金属)
HX(键合氢的分子) 碱 硬 碱 NH3, RNH2, N2H4 H2O, OH , O2 , ROH, RO , R2O CH3COO , CO32 , SO42 , PO43 , NO3 , ClO4 , F , Cl
第二章:酸碱和溶剂化学 H+(g)离子水合时放出大量的热量:
2 H+(g) H+(aq) △Hθ=-1091.1 kJ· -1 mol 如此多的热量表明水合趋势很大,H+在水中是同水分子结合 在一起而存在的: H H H 如 H O: H O··H O ·· ·· H H (H3O+) (H5O2+) 酸在水中产生的是H3O+(写成H3O+是一种简化, 意指H+是与 H2O结合在一起的): H H O ··H Cl →[ ·· ·· O H]+ + Cl- H H 此外,在某些离子型晶体中也存在氧鎓离子H3O+,如 H3O+ClO4-(s)。
4 + + CO2 RCO+ NC+ ,+Si4+ , +, 4+ ,+SnMe3+, CO2,, RCO 2,,, RCO, Si4 , SnSi4, SnMe3 SnMe3 , CO NC , NC Sn , Sn4 , , + + SnMe22+ SnMe22SnMe22 3 + + N3+ RPO++ ROPO 2+, As3+ + N3 ,, RPO2 , ,,RPO2 , 2ROPO2 , As3 N3 2 ROPO , As + + 7+ SO3 Cl7+,, I 5+,, 7++ + + I I7 SO3,, ClSO3,5 ClI7 , I5 , I7
第二章:酸碱和溶剂化学
2.1 酸碱理论
酸和碱不能简单地分别定义为在电离时会产 生H+离子和OH-离子的物质。 即使是酸, 在水溶液中也不能产生游离H+离 子。 由于H+是个裸露的原子核, 其半径极小, 为 Li+离子半径的五万分之一,其电荷密度很大(为 Li+离子的2.5×109倍),易与水分子的氧生成氢 键。换句话说,裸露的原子核在水中是不可能稳 定存在的,易被水合。
