标准电极电势表 (碱)
电极电势表
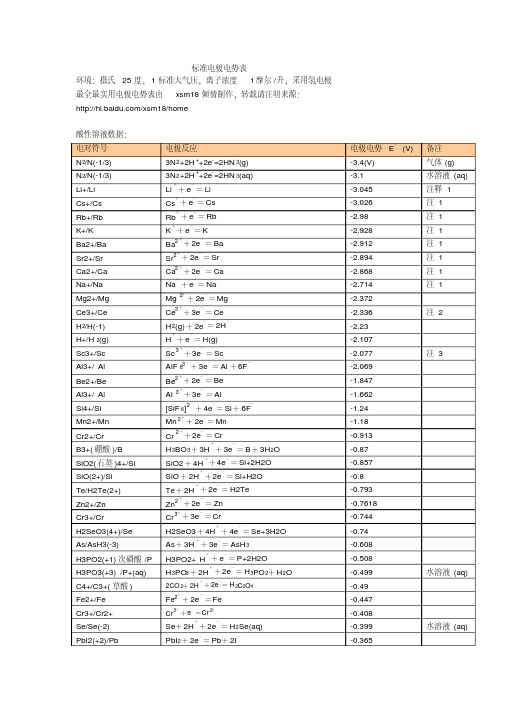
备注 气体 (g) 水溶液 (aq) 注释 1 注 1 注 1 注 1 注 1 注 1 注 1 注 1
+2+
+
+
-
+ 2e = Mg
- -
-
Ce3 + 3e = Ce H 2(g) + 2e = 2H H + e = H(g) Sc
3+
+ -
注 2
-2.23 -2.107 -2.077 注 3
- + - - - - + - + - -
-
0.2476 0.268 0.308 0.337 0.354 0.3572
HAsO 2 .H2O
SO42 + 8H + 6e = S+4H 2 O
2 Ag 2 CrO 4+ 2e = 2Ag + CrO 4
+ - -
0.447 0.449 0.4647 0.521 0.5355
2+
+ 2e = Cr
+ - + -
H 3BO 3+ 3H + 3e = B + 3H 2O SiO2 + 4H + 4e = Si+2H2O SiO + 2H + 2e = Si+H2O Te + 2H + 2e = H2Te Zn 2 + 2e = Zn Cr 3 + 3e = Cr H2SeO3 + 4H + 4e = Se+3H2O As + 3H + 3e = AsH 3 H3PO2+ H + e = P+2H2O H 3PO3 + 2H + 2e = H 3PO 2+ H 2O
3 Fe + 3e = Fe 2S Ag 2 S+ 2H + 2e = 2Ag +H
+ - + - - - + -
+
-
-0.12 -0.063 -0.0405 -0.037 -0.0366 0.00 气体 (g)
标准氢电极和标准电极电势

11.10.2 标准氢电极和标准电极电势二、标准氢电极和标准电极电势(1)标准氢电极为确定各不同电极的相对电极电势,目前国际上采用标准氢电极作为标准电极,并令其电极电势为零。
氢电极电极电势的温度系数很小。
若条件控制得当,电极电势稳定,重现性好。
其构造如图11-21所示。
它是由镀有铂黑﹡的铂片浸入a H+=1 的溶液中,并以P H2=100kPa 的纯净干燥氢气不断冲击到铂电极上而构成的。
氢气为一还原剂,氧气或其他氧化剂的存在会影响实验测定,而含砷、硫化物的气体易被铂黑吸附而使它失去吸附氢气的能力(即"中毒"现象),故氮气通入之前应预先流经碱性没食子酸溶液和碱性高锰酸钾溶液以净化之。
*铂黑是由许多微小铂晶体组成的,表面积很大,当光线射入经过不断反射均被吸收,因而呈现黑色。
镀铂黑的工艺为:① 1~1.5 克铂用热硝酸洗过后用 HCl:HNO3:H2O=3:1:4 的王水溶解加入 2ml HCl得红棕色 H2PtCl6(无水氯铂酸)即成镀液。
②在 100~200 mA/cm2的电流密度下,电镀 1~3 分钟,得到均匀一致的铂黑镀层。
(2)标准电极电势将任意一待测电极(指定为阴极)与标准氢电极(阳极)组成电池,在消除液接电势后用对消法测其电动势,则此电动势的数值和符号就是待测电极电势的数值和符号。
例如,298K 时以标准氯化银电极与标准氢电极构成一电池:测得电池电动势为 0.2224V 。
则此值即为氯化银电极的标准电极电势。
又例如,298K 时,以标准锌电极与标准氢电极构成一电池,测得电池电动势为 0.763V 。
但由于电池自发放电时,锌电极上实际进行的是氧化反应,锌电极应为负极。
故锌电极的标准电极电势为 -0.763V 。
表11-5列举一些水溶液中标准电极电势的数据。
表11-5 水溶液中的标准电极电势(298K)电极电极反应酸性溶液(a H+=1)Pt,F2F-F2(g)+2e-=2F-+2.87PtH2O2,H+H2O2+2H++2e-=2H2O +1.77PtMn2+,MnO-4MnO-4+8H++5e-=Mn2++4H2O +1.51Pt,Cl2Cl-Cl2+2e-=2Cl-+1.3595PtTl+,Tl3+Tl3++2e-=Tl++1.25PtBr2,Br-Br2+2e-=2Br-+1.065AgAg+Ag++e-=Ag 0.7991 PtFe2+,Fe3+Fe3++e-=Fe2++0.771Pt,O2H2O2O2+2H++2e-=H2O2+0.682PtI2,I-I-3+2e-=3I-+0.536CuCu2+Cu2++2e-=Cu +0.337 PtHgHg2Cl2,Cl-Hg2Cl2+2e-=2Cl-+2Hg +0.2676AgAgCl,Cl-AgCl+e-=Ag+Cl-+0.2224PtCu+,Cu2+Cu2++e-=Cu++0.153AgAgBr,Br-AgBr+e-=Ag+Br-+0.0713Pt,H2H+2H++2e-=H20.0000PbPb2+Pb2++2e-=Pb -0.126AgAgI,I-AgI+e-=Ag+I--0.1518CuCuI,I-CuI+e-=Cu+I--0.1852 PbPbSO4,SO42-PbSO4+2e-=Pb+SO42--0.3588 PtTi2+,Ti3+Ti3++e-=Ti2+-0.369 CdCd2+Cd2++2e-=Cd -0.403 FeFe2+Fe2++2e-=Fe -0.4402 CrCr3+Cr3++3e-=Cr -0.744 ZnZn2+Zn2++2e-=Zn -0.7628 MnMn2+Mn2++2e-=Mn -1.180 AlAl3+Al3++3e-=Al -1.662 MgMg2+Mg2++2e-=Mg -2.363 NaNa+Na++e-=Na -2.7142 CaCa2+Ca2++2e-=Ca -2.866 BaBa2+Ba2++2e-=Ba -2.906 KK+K++e-=K -2.925 LiLi+Li2++e-=Li -3.045 碱性溶液(a OH-=1)PtMnO2,MnO-4MnO-4+2H2O+3e-=MnO2+4OH-+0.588 Pt,O2OH-O2+2H2O+4e-=4OH-+0.401 PtS,S2-S+2e-=S2--0.447 Pt,H2OH-2H2O+2e-=H2+2OH--0.82806 PtSO32-,SO42-SO42-+H2O+2e-=SO32-+2OH--0.93氢电极装置和实验手续均较麻烦,一般只用作一级基准,实际使用中常用一类微溶盐电极如甘汞电极、氯化银电极和硫酸亚汞电极作为二级基准,这类电极常称为"参比电极"。
标准电极电势表

标准电极电势表目录[隐藏]电极电势的产生—双电层理论定义公式电极电势内容标准电极电势表[编辑本段]电极电势的产生—双电层理论德国化学家能斯特(H.W.Nernst)提出了双电层理论(electron double lay er theory)解释电极电势的产生的原因。
当金属放入溶液中时,一方面金属晶体中处于热运动的金属离子在极性水分子的作用下,离开金属表面进入溶液。
金属性质越活泼,这种趋势就越大;另一方面溶液中的金属离子,由于受到金属表面电子的吸引,而在金属表面沉积,溶液中金属离子的浓度越大,这种趋势也越大。
在一定浓度的溶液中达到平衡后,在金属和溶液两相界面上形成了一个带相反电荷的双电层(electron double layer),双电层的厚度虽然很小(约为10-8厘米数量级), 但却在金属和溶液之间产生了电势差。
通常人们就把产生在金属和盐溶液之间的双电层间的电势差称为金属的电极电势(electrode potential),并以此描述电极得失电子能力的相对强弱。
电极电势以符号E Mn+/ M表示, 单位为V(伏)。
如锌的电极电势以EZn2+/ Zn 表示, 铜的电极电势以ECu2+/Cu 表示。
电极电势的大小主要取决于电极的本性,并受温度、介质和离子浓度等因素的影响。
[编辑本段]定义标准电极电势是可逆电极在标准状态及平衡态时的电势,也就是标准态时的电极电势.标准电极电势有很大的实用价值,可用来判断氧化剂与还原剂的相对强弱,判断氧化还原反应的进行方向,计算原电池的电动势、反应自由能、平衡常数,计算其他半反应的标准电极电势,等等。
将半反应按电极电势由低到高排序,可以得到标准电极电势表,可十分简明地判断氧还反应的方向.[编辑本段]公式任何温度下标准氢电极的标准电极电势值都为0,但其他电极电势值会受到温度影响。
以Ni/NiO电极为例,它可以用作高温伪参比电极,在0-400°C时的电极电势大致符合以下公式:E°(T)=-0.0003T+0.1414,T为温度[编辑本段]电极电势内容1 在酸性溶液中(298K)电对方程式Eq/VLi(I)-(0) Li++e-=Li -3.0401Cs(I)-(0) Cs++e-=Cs -3.026Rb(I)-(0) Rb++e-=Rb -2.98K(I)-(0) K++e-=K -2.931Ba(II)-(0) Ba2++2e-=Ba -2.912Sr(II)-(0) Sr2++2e-=Sr -2.89Ca(II)-(0) Ca2++2e-=Ca -2.868Na(I)-(0) Na++e-=Na -2.71La(III)-(0) La3++3e-=La -2.379Mg(II)-(0) Mg2++2e-=Mg -2.372Ce(III)-(0) Ce3++3e-=Ce -2.336H(0)-(-I) H2(g)+2e-=2H--2.23Al(III)-(0) AlF63-+3e-=Al+6F--2.069Th(IV)-(0) Th4++4e-=Th -1.899Be(II)-(0) Be2++2e-=Be -1.847U(III)-(0) U3++3e-=U -1.798Hf(IV)-(0) HfO2++2H++4e-=Hf+H2O -1.724Al(III)-(0) Al3++3e-=Al -1.662Ti(II)-(0) Ti2++2e-=Ti -1.630Zr(IV)-(0) ZrO2+4H++4e-=Zr+2H2O -1.553Si(IV)-(0) [SiF6]2-+4e-=Si+6F--1.24Mn(II)-(0) Mn2++2e-=Mn -1.185Cr(II)-(0) Cr2++2e-=Cr -0.913Ti(III)-(II) Ti3++e-=Ti2+-0.9B(III)-(0) H3BO3+3H++3e-=B+3H2O -0.8698*Ti(IV)-(0) TiO2+4H++4e-=Ti+2H2O -0.86Te(0)-(-II) Te+2H++2e-=H2Te -0.793Zn(II)-(0) Zn2++2e-=Zn -0.7618Ta(V)-(0) Ta2O5+10H++10e-=2Ta+5H2O -0.750Cr(III)-(0) Cr3++3e-=Cr -0.744Nb(V)-(0) Nb2O5+l0H++10e-=2Nb+5H2O -0.644 As(0)-(-III) As+3H++3e-=AsH3 -0.608U(IV)-(III) U4++e-=U3+-0.607Ga(III)-(0) Ga3++3e-=Ga -0.549P(I)-(0) H3PO2+H++e-=P+2H2O -0.508P(III)-(I) H3PO3+2H++2e-=H3PO2+H2O -0.499 *C(IV)-(III) 2CO2+2H++2e-=H2C2O4 -0.49Fe(II)-(0) Fe2++2e-=Fe -0.447Cr(III)-(II) Cr3++e-=Cr2+-0.407Cd(II)-(0) Cd2++2e-=Cd -0.4030Se(0)-(-II) Se+2H++2e-=H2Se(aq) -0.399Pb(II)-(0) PbI2+2e-=Pb+2I--0.365Eu(III)-(II) Eu3++e-=Eu2+-0.36Pb(II)-(0) PbSO4+2e-=Pb+SO42--0.3588In(III)-(0) In3++3e-=In -0.3382Tl(I)-(0) Tl++e-=Tl -0.336Co(II)-(0) Co2++2e-=Co -0.28P(V)-(III) H3PO4+2H++2e-=H3PO3+H2O -0.276 Pb(II)-(0) PbCl2+2e-=Pb+2Cl--0.2675Ni (II)-(0) Ni2++2e-=Ni -0.257V(III)-(II) V3++e-=V2+-0.255Ge(IV)-(0) H2GeO3+4H++4e-=Ge+3H2O -0.182 Ag(I)-(0) AgI+e-=Ag+I--0.15224Sn(II)-(0) Sn2++2e-=Sn -0.1375Pb(II)-(0) Pb2++2e-=Pb -0.1262*C(IV)-(II) CO2(g)+2H++2e-=CO+H2O -0.12P(0)-(-III) P(white)+3H++3e-=PH3(g) -0.063Hg(I)-(0) Hg2I2+2e-=2Hg+2I--0.0405Fe(III)-(0) Fe3++3e-=Fe -0.037H(I)-(0) 2H++2e-=H2 0.0000Ag(I)-(0) AgBr+e-=Ag+Br-0.07133S(II.V)-(II) S4O62-+2e-=2S2O32-0.08*Ti(IV)-(III) TiO2++2H++e-=Ti3++H2O 0.1S(0)-(-II) S+2H++2e-=H2S(aq) 0.142Sn(IV)-(II) Sn4++2e-=Sn2+0.151Sb(III)-(0) Sb2O3+6H++6e-=2Sb+3H2O 0.152Cu(II)-(I) Cu2++e-=Cu+0.153Bi(III)-(0) BiOCl+2H++3e-=Bi+Cl-+H2O 0.1583 S(VI)-(IV) SO42-+4H++2e-=H2SO3+H2O 0.172 Sb(III)-(0) SbO++2H++3e-=Sb+H2O 0.212Ag(I)-(0) AgCl+e-=Ag+Cl-0.22233As(III)-(0) HAsO2+3H++3e-=As+2H2O 0.248Hg(I)-(0) Hg2Cl2+2e-=2Hg+2Cl-(饱和KCl) 0.26808 Bi(III)-(0) BiO++2H++3e-=Bi+H2O 0.320U(VI)-(IV) UO22++4H++2e-=U4++2H2O 0.327C(IV)-(III) 2HCNO+2H++2e-=(CN)2+2H2O 0.330V(IV)-(III) VO2++2H++e-=V3++H2O 0.337Cu(II)-(0) Cu2++2e-=Cu 0.3419Re(VII)-(0) ReO4-+8H++7e-=Re+4H2O 0.368Ag(I)-(0) Ag2CrO4+2e-=2Ag+CrO42-0.4470S(IV)-(0) H2SO3+4H++4e-=S+3H2O 0.449Cu(I)-(0) Cu++e-=Cu 0.521I(0)-(-I) I2+2e-=2I-0.5355I(0)-(-I) I3-+2e-=3I-0.536As(V)-(III) H3AsO4+2H++2e-=HAsO2+2H2O 0.560 Sb(V)-(III) Sb2O5+6H++4e-=2SbO++3H2O 0.581 Te(IV)-(0) TeO2+4H++4e-=Te+2H2O 0.593U(V)-(IV) UO2++4H++e-=U4++2H2O 0.612**Hg(II)-(I) 2HgCl2+2e-=Hg2Cl2+2Cl-0.63Pt(IV)-(II) [PtCl6]2-+2e-=[PtCl4]2-+2Cl-0.68O(0)-(-I) O2+2H++2e-=H2O2 0.695Pt(II)-(0) [PtCl4]2-+2e-=Pt+4Cl-0.755*Se(IV)-(0) H2SeO3+4H++4e-=Se+3H2O 0.74Fe(III)-(II) Fe3++e-=Fe2+0.771Hg(I)-(0) Hg22++2e-=2Hg 0.7973Ag(I)-(0) Ag++e-=Ag 0.7996Os(VIII)-(0) OsO4+8H++8e-=Os+4H2O 0.8N(V)-(IV) 2NO3-+4H++2e-=N2O4+2H2O 0.803 Hg(II)-(0) Hg2++2e-=Hg 0.851Si(IV)-(0) (quartz)SiO2+4H++4e-=Si+2H2O 0.857 Cu(II)-(I) Cu2++I-+e-=CuI 0.86N(III)-(I) 2HNO2+4H++4e-=H2N2O2+2H2O 0.86 Hg(II)-(I) 2Hg2++2e-=Hg22+0.920N(V)-(III) NO3-+3H++2e-=HNO2+H2O 0.934Pd(II)-(0) Pd2++2e-=Pd 0.951N(V)-(II) NO3-+4H++3e-=NO+2H2O 0.957N(III)-(II) HNO2+H++e-=NO+H2O 0.983I(I)-(-I) HIO+H++2e-=I-+H2O 0.987V(V)-(IV) VO2++2H++e-=VO2++H2O 0.991V(V)-(IV) V(OH)4++2H++e-=VO2++3H2O 1.00Au(III)-(0) [AuCl4]-+3e-=Au+4Cl- 1.002Te(VI)-(IV) H6TeO6+2H++2e-=TeO2+4H2O 1.02N(IV)-(II) N2O4+4H++4e-=2NO+2H2O 1.035N(IV)-(III) N2O4+2H++2e-=2HNO2 1.065I(V)-(-I) IO3-+6H++6e-=I-+3H2O 1.085Br(0)-(-I) Br2(aq)+2e-=2Br- 1.0873Se(VI)-(IV) SeO42-+4H++2e-=H2SeO3+H2O 1.151 Cl(V)-(IV) ClO3-+2H++e-=ClO2+H2O 1.152Pt(II)-(0) Pt2++2e-=Pt 1.18Cl(VII)-(V) ClO4-+2H++2e-=ClO3-+H2O 1.189I(V)-(0) 2IO3-+12H++10e-=I2+6H2O 1.195Cl(V)-(III) ClO3-+3H++2e-=HClO2+H2O 1.214Mn(IV)-(II) MnO2+4H++2e-=Mn2++2H2O 1.224O(0)-(-II) O2+4H++4e-=2H2O 1.229Tl(III)-(I) T13++2e-=Tl+ 1.252Cl(IV)-(III) ClO2+H++e-=HClO2 1.277N(III)-(I) 2HNO2+4H++4e-=N2O+3H2O 1.297**Cr(VI)-(III) Cr2O72-+14H++6e-=2Cr3++7H2O 1.33 Br(I)-(-I) HBrO+H++2e-=Br-+H2O 1.331Cr(VI)-(III) HCrO4-+7H++3e-=Cr3++4H2O 1.350Cl(0)-(-I) Cl2(g)+2e-=2Cl- 1.35827Cl(VII)-(-I) ClO4-+8H++8e-=Cl-+4H2O 1.389Cl(VII)-(0) ClO4-+8H++7e-=1/2Cl2+4H2O 1.39Au(III)-(I) Au3++2e-=Au+ 1.401Br(V)-(-I) BrO3-+6H++6e-=Br-+3H2O 1.423I(I)-(0) 2HIO+2H++2e-=I2+2H2O 1.439Cl(V)-(-I) ClO3-+6H++6e-=Cl-+3H2O 1.451Pb(IV)-(II) PbO2+4H++2e-=Pb2++2H2O 1.455Cl(V)-(0) ClO3-+6H++5e-=1/2Cl2+3H2O 1.47Cl(I)-(-I) HClO+H++2e-=Cl-+H2O 1.482Br(V)-(0) BrO3-+6H++5e-=l/2Br2+3H2O 1.482Au(III)-(0) Au3++3e-=Au 1.498Mn(VII)-(II) MnO4-+8H++5e-=Mn2++4H2O 1.507Mn(III)-(II) Mn3++e-=Mn2+ 1.5415Cl(III)-(-I) HClO2+3H++4e-=Cl-+2H2O 1.570Br(I)-(0) HBrO+H++e-=l/2Br2(aq)+H2O 1.574N(II)-(I) 2NO+2H++2e-=N2O+H2O 1.591I(VII)-(V) H5IO6+H++2e-=IO3-+3H2O 1.601Cl(I)-(0) HClO+H++e-=1/2Cl2+H2O 1.611Cl(III)-(I) HClO2+2H++2e-=HClO+H2O 1.645Ni(IV)-(II) NiO2+4H++2e-=Ni2++2H2O 1.678Mn(VII)-(IV) MnO4-+4H++3e-=MnO2+2H2O 1.679Pb(IV)-(II) PbO2+SO42-+4H++2e-=PbSO4+2H2O 1.6913 Au(I)-(0) Au++e-=Au 1.692Ce(IV)-(III) Ce4++e-=Ce3+ 1.72N(I)-(0) N2O+2H++2e-=N2+H2O 1.766O(-I)-(-II) H2O2+2H++2e-=2H2O 1.776Co(III)-(II) Co3++e-=Co2+(2mol·L-1 H2SO4) 1.83Ag(II)-(I) Ag2++e-=Ag+ 1.980S(VII)-(VI) S2O82-+2e-=2SO42- 2.010O(0)-(-II) O3+2H++2e-=O2+H2O 2.076O(II)-(-II) F2O+2H++4e-=H2O+2F- 2.153Fe(VI)-(III) FeO42-+8H++3e-=Fe3++4H2O 2.20O(0)-(-II) O(g)+2H++2e-=H2O 2.421F(0)-(-I) F2+2e-=2F- 2.866F2+2H++2e-=2HF 3.0532 在碱性溶液中(298K)电对方程式Eq/VCa(II)-(0) Ca(OH)2+2e-=Ca+2OH--3.02Ba(II)-(0) Ba(OH)2+2e-=Ba+2OH--2.99La(III)-(0) La(OH)3+3e-=La+3OH--2.90Sr(II)-(0) Sr(OH)2·8H2O+2e-=Sr+2OH-+8H2O -2.88Mg(II)-(0) Mg(OH)2+2e-=Mg+2OH--2.690Be(II)-(0) Be2O32-+3H2O+4e-=2Be+6OH--2.63Hf(IV)-(0) HfO(OH)2+H2O+4e-=Hf+4OH--2.50Zr(IV)-(0) H2ZrO3+H2O+4e-=Zr+4OH--2.36Al(III)-(0) H2AlO3-+H2O+3e-=Al+OH--2.33P(I)-(0) H2PO2-+e-=P+2OH--1.82B(III)-(0) H2BO3-+H2O+3e-=B+4OH--1.79P(III)-(0) HPO32-+2H2O+3e-=P+5OH--1.71Si(IV)-(0) SiO32-+3H2O+4e-=Si+6OH--1.697P(III)-(I) HPO32-+2H2O+2e-=H2PO2-+3OH--1.65Mn(II)-(0) Mn(OH)2+2e-=Mn+2OH--1.56Cr(III)-(0) Cr(OH)3+3e-=Cr+3OH--1.48*Zn(II)-(0) [Zn(CN)4]2-+2e-=Zn+4CN--1.26Zn(II)-(0) Zn(OH)2+2e-=Zn+2OH--1.249Ga(III)-(0) H2GaO3-+H2O+2e-=Ga+4OH--1.219Zn(II)-(0) ZnO22-+2H2O+2e-=Zn+4OH--1.215Cr(III)-(0) CrO2-+2H2O+3e-=Cr+4OH--1.2Te(0)-(-I) Te+2e-=Te2--1.143P(V)-(III) PO43-+2H2O+2e-=HPO32-+3OH--1.05*Zn(II)-(0) [Zn(NH3)4]2++2e-=Zn+4NH3 -1.04*W(VI)-(0) WO42-+4H2O+6e-=W+8OH--1.01*Ge(IV)-(0) HGeO3-+2H2O+4e-=Ge+5OH--1.0Sn(IV)-(II) [Sn(OH)6]2-+2e-=HSnO2-+H2O+3OH--0.93 S(VI)-(IV) SO42-+H2O+2e-=SO32-+2OH--0.93Se(0)-(-II) Se+2e-=Se2--0.924Sn(II)-(0) HSnO2-+H2O+2e-=Sn+3OH--0.909P(0)-(-III) P+3H2O+3e-=PH3(g)+3OH--0.87N(V)-(IV) 2NO3-+2H2O+2e-=N2O4+4OH--0.85H(I)-(0) 2H2O+2e-=H2+2OH--0.8277Cd(II)-(0) Cd(OH)2+2e-=Cd(Hg)+2OH--0.809Co(II)-(0) Co(OH)2+2e-=Co+2OH--0.73Ni(II)-(0) Ni(OH)2+2e-=Ni+2OH--0.72As(V)-(III) AsO43-+2H2O+2e-=AsO2-+4OH--0.71Ag(I)-(0) Ag2S+2e-=2Ag+S2--0.691As(III)-(0) AsO2-+2H2O+3e-=As+4OH--0.68Sb(III)-(0) SbO2-+2H2O+3e-=Sb+4OH--0.66*Re(VII)-(IV) ReO4-+2H2O+3e-=ReO2+4OH--0.59*Sb(V)-(III) SbO3-+H2O+2e-=SbO2-+2OH--0.59Re(VII)-(0) ReO4-+4H2O+7e-=Re+8OH--0.584*S(IV)-(II) 2SO32-+3H2O+4e-=S2O32-+6OH--0.58Te(IV)-(0) TeO32-+3H2O+4e-=Te+6OH--0.57Fe(III)-(II) Fe(OH)3+e-=Fe(OH)2+OH--0.56S(0)-(-II) S+2e-=S2--0.47627Bi(III)-(0) Bi2O3+3H2O+6e-=2Bi+6OH--0.46N(III)-(II) NO2-+H2O+e-=NO+2OH--0.46*Co(II)-C(0) [Co(NH3)6]2++2e-=Co+6NH3 -0.422Se(IV)-(0) SeO32-+3H2O+4e-=Se+6OH--0.366Cu(I)-(0) Cu2O+H2O+2e-=2Cu+2OH--0.360Tl(I)-(0) Tl(OH)+e-=Tl+OH--0.34*Ag(I)-(0) [Ag(CN)2]-+e-=Ag+2CN--0.31Cu(II)-(0) Cu(OH)2+2e-=Cu+2OH--0.222Cr(VI)-(III) CrO42-+4H2O+3e-=Cr(OH)3+5OH--0.13 *Cu(I)-(0) [Cu(NH3)2]++e-=Cu+2NH3 -0.12O(0)-(-I) O2+H2O+2e-=HO2-+OH--0.076Ag(I)-(0) AgCN+e-=Ag+CN--0.017N(V)-(III) NO3-+H2O+2e-=NO2-+2OH-0.01Se(VI)-(IV) SeO42-+H2O+2e-=SeO32-+2OH-0.05 Pd(II)-(0) Pd(OH)2+2e-=Pd+2OH-0.07S(II,V)-(II) S4O62-+2e-=2S2O32-0.08Hg(II)-(0) HgO+H2O+2e-=Hg+2OH-0.0977Co(III)-(II) [Co(NH3)6]3++e-=[Co(NH3)6]2+0.108Pt(II)-(0) Pt(OH)2+2e-=Pt+2OH-0.14Co(III)-(II) Co(OH)3+e-=Co(OH)2+OH-0.17Pb(IV)-(II) PbO2+H2O+2e-=PbO+2OH-0.247I(V)-(-I) IO3-+3H2O+6e-=I-+6OH-0.26Cl(V)-(III) ClO3-+H2O+2e-=ClO2-+2OH-0.33Ag(I)-(0) Ag2O+H2O+2e-=2Ag+2OH-0.342Fe(III)-(II) [Fe(CN)6]3-+e-=[Fe(CN)6]4-0.358Cl(VII)-(V) ClO4-+H2O+2e-=ClO3-+2OH-0.36*Ag(I)-(0) [Ag(NH3)2]++e-=Ag+2NH3 0.373O(0)-(-II) O2+2H2O+4e-=4OH-0.401I(I)-(-I) IO-+H2O+2e-=I-+2OH-0.485*Ni(IV)-(II) NiO2+2H2O+2e-=Ni(OH)2+2OH-0.490Mn(VII)-(VI) MnO4-+e-=MnO42-0.558Mn(VII)-(IV) MnO4-+2H2O+3e-=MnO2+4OH-0.595 Mn(VI)-(IV) MnO42-+2H2O+2e-=MnO2+4OH-0.60Ag(II)-(I) 2AgO+H2O+2e-=Ag2O+2OH-0.607Br(V)-(-I) BrO3-+3H2O+6e-=Br-+6OH-0.61Cl(V)-(-I) ClO3-+3H2O+6e-=Cl-+6OH-0.62Cl(III)-(I) ClO2-+H2O+2e-=ClO-+2OH-0.66I(VII)-(V) H3IO62-+2e-=IO3-+3OH-0.7Cl(III)-(-I) ClO2-+2H2O+4e-=Cl-+4OH-0.76Br(I)-(-I) BrO-+H2O+2e-=Br-+2OH-0.761Cl(I)-(-I) ClO-+H2O+2e-=Cl-+2OH-0.841*Cl(IV)-(III) ClO2(g)+e-=ClO2-0.95O(0)-(-II) O3+H2O+2e-=O2+2OH- 1.24标准电极电势表半反应E°(V) 来源& -9Zz 9N N2(g) + H+ + e− HN3(aq) -3.09 [6]Li+ + e− Li(s) -3.0401 [5]N2(g) + 4H2O + 2e− 2N H2OH(aq) + 2OH− -3.04 [6] Cs+ + e− Cs(s) -3.026 [5]Rb+ + e− Rb(s) -2.98 [4]K+ + e− K(s) -2.931 [5]Ba2+ + 2e− Ba(s) -2.912 [5]La(OH)3(s) + 3e− La(s) + 3OH− -2.90 [5]Sr2+ + 2e−Sr(s) -2.899 [5]Ca2+ + 2e− Ca(s) -2.868 [5]Eu2+ + 2e− Eu(s) -2.812 [5]Ra2+ + 2e− Ra(s) -2.8 [5]Na+ + e− Na(s) -2.71 [5][9]La3+ + 3e− La(s) -2.379 [5]Y3+ + 3e− Y(s) -2.372 [5]Mg2+ + 2e− Mg(s) -2.372 [5]ZrO(OH)2(s) + H2O + 4e− Zr(s) + 4OH− -2.36 [5]Al(OH)4− + 3e− Al(s) + 4OH− -2.33Al(OH)3(s) + 3e− Al(s) + 3OH− -2.31H2(g) + 2e− 2H− -2.25Ac3+ + 3e− Ac(s) -2.20Be2+ + 2e− Be(s) -1.85U3+ + 3e− U(s) -1.66 [7]Al3+ + 3e− Al(s) -1.66 [9]Ti2+ + 2e− Ti(s) -1.63 [9]ZrO2(s) + 4H+ + 4e− Zr(s) + 2H2O -1.553 [5]Zr4+ + 4e− Zr(s) -1.45 [5]TiO(s) + 2H+ + 2e− Ti(s) + H2O -1.31Ti2O3(s) + 2H+ + 2e− 2T iO(s) + H2O -1.23Ti3+ + 3e− Ti(s) -1.21Te(s) + 2e− Te2− -1.143 [2]V2+ + 2e− V(s) -1.13 [2]Nb3+ + 3e− Nb(s) -1.099Sn(s) + 4H+ + 4e− SnH4(g) -1.07Mn2+ + 2e− Mn(s) -1.029 [9]SiO2(s) + 4H+ + 4e− Si(s) + 2H2O -0.91B(OH)3(aq) + 3H+ + 3e− B(s) + 3H2O -0.89TiO2+ + 2H+ + 4e− Ti(s) + H2O -0.86Bi(s) + 3H+ + 3e− BiH3 -0.8H2H2O + 2e− H2(g) + 2OH− -0.8277 [5]Zn2+ + 2e− Zn(Hg) -0.7628 [5]Zn2+ + 2e− Zn(s) -0.7618 [5]Ta2O5(s) + 10H+ + 10e− 2T a(s) + 5H2O -0.75Cr3+ + 3e− Cr(s) -0.74Au[Au(CN)2]− + e− Au(s) + 2C N− -0.60Ta3+ + 3e− Ta(s) -0.6PbO(s) + H2O + 2e− Pb(s) + 2OH− -0.58Ti2T iO2(s) + 2H+ + 2e− Ti2O3(s) + H2O -0.56Ga3+ + 3e− Ga(s) -0.53U4+ + e− U3+ -0.52 [7]P H3PO2(aq) + H+ + e− P(白磷[10]) + 2H2O -0.508 [5]P H3PO3(aq) + 2H+ + 2e− H3PO2(aq) + H2O -0.499 [5] P H3PO3(aq) + 3H+ + 3e− P(红磷)[10] + 3H2O -0.454 [5] Fe2+ + 2e− Fe(s) -0.44 [9]C2C O2(g) + 2H+ + 2e− HOOCCOOH(aq) -0.43Cr3+ + e− Cr2+ -0.42Cd2+ + 2e− Cd(s) -0.40 [9]GeO2(s) + 2H+ + 2e− GeO(s) + H2O -0.37Cu2O(s) + H2O + 2e− 2C u(s) + 2O H− -0.360 [5]PbSO4(s) + 2e− Pb(s) + SO42− -0.3588 [5]PbSO4(s) + 2e− Pb(Hg) + SO42− -0.3505 [5]Eu3+ + e− Eu2+ -0.35 [7]In3+ + 3e− In(s) 0.34 [2]Tl+ + e− Tl(s) -0.34 [2]Ge(s) + 4H+ + 4e− GeH4(g) -0.29Co2+ + 2e− Co(s) -0.28 [5]P H3PO4(aq) + 2H+ + 2e− H3PO3(aq) + H2O -0.276 [5] V3+ + e− V2+ 0.26 [9]Ni2+ + 2e− Ni(s) -0.25As(s) + 3H+ + 3e− AsH3(g) -0.23 [2]MoO2(s) + 4H+ + 4e− Mo(s) + 2H2O -0.15Si(s) + 4H+ + 4e− SiH4(g) -0.14Sn2+ + 2e− Sn(s) -0.13O2(g) + H+ + e− HO2•(aq) -0.13Pb2+ + 2e− Pb(s) -0.13 [9]WO2(s) + 4H+ + 4e− W(s) + 2H2O -0.12P(红磷) + 3H+ + 3e− PH3(g) -0.111 [5]C CO2(g) + 2H+ + 2e− HCOOH(aq) -0.11Se(s) + 2H+ + 2e− H2Se(g) -0.11C CO2(g) + 2H+ + 2e− CO(g) + H2O -0.11SnO(s) + 2H+ + 2e− Sn(s) + H2O -0.10SnO2(s) + 2H+ + 2e− SnO(s) + H2O -0.09WO3(aq) + 6H+ + 6e− W(s) + 3H2O -0.09 [2]P(白磷) + 3H+ + 3e− PH3(g) -0.063 [5]C HCOOH(aq) + 2H+ + 2e− HCHO(aq) + H2O -0.03 H 2H+ + 2e− H2(g) ≡ 0S4O62− + 2e− 2S2O32− +0.08Fe3O4(s) + 8H+ + 8e− 3F e(s) + 4H2O +0.085 [8]N2(g) + 2H2O + 6H+ + 6e− 2N H4OH(aq) +0.092 HgO(s) + H2O + 2e− H g(l) + 2O H− +0.0977Cu(NH3)42+ + e− Cu(NH3)2+ + 2N H3 +0.10 [2]Ru(NH3)63+ + e− Ru(NH3)62+ +0.10 [7]N2H4(aq) + 4H2O + 2e− 2N H4+ + 4O H− +0.11 [6] Mo H2MoO4(aq) + 6H+ + 6e− Mo(s) + 4H2O +0.11 Ge4+ + 4e− Ge(s) +0.12C(s) + 4H+ + 4e− CH4(g) +0.13 [2]C HCHO(aq) + 2H+ + 2e− CH3OH(aq) +0.13S(s) + 2H+ + 2e− H2S(g) +0.14Sn4+ + 2e− Sn2+ +0.15Cu2+ + e− Cu+ +0.159 [2]S HSO4− + 3H+ + 2e− SO2(aq) + 2H2O +0.16UO22+ + e− UO2+ +0.163 [7]S SO42− + 4H+ + 2e− SO2(aq) + 2H2O +0.17TiO2+ + 2H+ + e− Ti3+ + H2O +0.19Bi3+ + 2e− Bi+ +0.2SbO+ + 2H+ + 3e− Sb(s) + H2O +0.20As H3AsO3(aq) + 3H+ + 3e− As(s) + 3H2O +0.24 GeO(s) + 2H+ + 2e− Ge(s) + H2O +0.26UO2+ + 4H+ + e− U4+ + 2H2O +0.273 [7]Re3+ + 3e− Re(s) +0.300Bi3+ + 3e− Bi(s) +0.32VO2+ + 2H+ + e− V3+ + H2O +0.34Cu2+ + 2e− Cu(s) +0.340 [2]Fe [Fe(CN)6]3− + e− [Fe(CN)6]4− +0.36O2(g) + 2H2O + 4e− 4OH−(aq) +0.40 [9]Mo H2MoO4 + 6H+ + 3e− Mo3+ +2H2O +0.43Bi+ + e− Bi(s) +0.50C CH3OH(aq) + 2H+ + 2e− CH4(g) + H2O +0.50S SO2(aq) + 4H+ + 4e− S(s) + 2H2O +0.50Cu+ + e− Cu(s) +0.520 [2]C CO(g) + 2H+ + 2e− C(s) + H2O +0.52I2(s) + 2e− 2I− +0.54 [9]I3− + 2e− 3I− +0.53 [9]Au [AuI4]− + 3e− Au(s) + 4I− +0.56As H3AsO4(aq) + 2H+ + 2e− H3AsO3(aq) + H2O +0.56 Au [AuI2]− + e− Au(s) + 2I− +0.58MnO4− + 2H2O + 3e− MnO2(s) + 4O H− +0.59S2O32−+ 6H+ + 4e− 2S(s) + 3H2O +0.60Mo H2MoO4(aq) + 2H+ + 2e− MoO2(s) + 2H2O +0.65 O2(g) + 2H+ + 2e− H2O2(aq) +0.70Tl3+ + 3e− Tl(s) +0.72PtCl62− + 2e− PtCl42− + 2C l− +0.726 [7]Se H2SeO3(aq) + 4H+ + 4e− Se(s) + 3H2O +0.74PtCl42− + 2e− Pt(s) + 4C l− +0.758 [7]Fe3+ + e− Fe2+ +0.77Ag+ + e− Ag(s) +0.7996 [5]Hg22+ + 2e− 2H g(l) +0.80N NO3−(aq) + 2H+ + e− NO2(g) + H2O +0.80Au [AuBr4]− + 3e− Au(s) + 4B r− +0.85Hg2+ + 2e− Hg(l) +0.85MnO4− + H+ + e− HMnO4− +0.90Hg 2H g2+ + 2e− Hg22+ +0.91 [2]Pd2+ + 2e− Pd(s) +0.915 [7]Au [AuCl4]− + 3e− Au(s) + 4C l− +0.93MnO2(s) + 4H+ + e− Mn3+ + 2H2O +0.95Au [AuBr2]− + e− Au(s) + 2B r− +0.96Br2(l) + 2e− 2B r− +1.07Br2(aq) + 2e− 2B r− +1.09 [9]I IO3− + 5H+ + 4e− HIO(aq) + 2H2O +1.13Au [AuCl2]− + e− Au(s) + 2C l− +1.15Se HSeO4− + 3H+ + 2e− H2SeO3(aq) + H2O +1.15 Ag2O(s) + 2H+ + 2e− 2A g(s) + H2O +1.17ClO3− + 2H+ + e− ClO2(g) + H2O +1.18Pt2+ + 2e− Pt(s) +1.188 [7]ClO2(g) + H+ + e− HClO2(aq) +1.19I 2I O3− + 12H+ + 10e− I2(s) + 6H2O +1.20ClO4− + 2H+ + 2e− ClO3− + H2O +1.20O2(g) + 4H+ + 4e− 2H2O +1.23 [9]MnO2(s) + 4H+ + 2e− Mn2+ + 2H2O +1.23Tl3+ + 2e− Tl+ +1.25Cl2(g) + 2e− 2C l− +1.36 [9]Cr2O7−−+ 14H+ + 6e− 2C r3+ + 7H2O +1.33CoO2(s) + 4H+ + e− Co3+ + 2H2O +1.42N 2N H3OH+ + H+ + 2e− N2H5+ + 2H2O +1.42 [6]I 2H IO(aq) + 2H+ + 2e− I2(s) + 2H2O +1.44Ce4+ + e− Ce3+ +1.44BrO3− + 5H+ + 4e− HBrO(aq) + 2H2O +1.45PbO β-PbO2(s) + 4H+ + 2e− Pb2+ + 2H2O +1.460 [2] PbO α-PbO2(s) + 4H+ + 2e− Pb2+ + 2H2O +1.468 [2] Br 2B rO3− + 12H+ + 10e− Br2(l) + 6H2O +1.48Cl 2ClO3− + 12H+ + 10e− Cl2(g) + 6H2O +1.49MnO4− + 8H+ + 5e− Mn2+ + 4H2O +1.51O HO2• + H+ + e− H2O2(aq) +1.51Au3+ + 3e− Au(s) +1.52NiO2(s) + 4H+ + 2e− Ni2+ + 2OH− +1.59Cl 2H ClO(aq) + 2H+ + 2e− Cl2(g) + 2H2O +1.63Ag2O3(s) + 6H+ + 4e− 2A g+ + 3H2O +1.67Cl HClO2(aq) + 2H+ + 2e− HClO(aq) + H2O +1.67Pb4+ + 2e− Pb2+ +1.69 [2]MnO4− + 4H+ + 3e− MnO2(s) + 2H2O +1.70O H2O2(aq) + 2H+ + 2e− 2H2O +1.78AgO(s) + 2H+ + e− Ag+ + H2O +1.77Co3+ + e− Co2+ +1.82Au+ + e− Au(s) +1.83 [2]BrO4− + 2H+ + 2e− BrO3− + H2O +1.85Ag2+ + e− Ag+ +1.98 [2]S2O82− + 2e− 2SO42− +2.07O3(g) + 2H+ + 2e− O2(g) + H2O +2.075 [7]Mn HMnO4− + 3H+ + 2e− MnO2(s) + 2H2O +2.09 F2(g) + 2e− 2F− +2.87 [2][9]F2(g) + 2H+ + 2e− 2H F(aq) +3.05 [2]。
最新最全最实用电极电势表

标准电极电势表环境:摄氏25度,1标准大气压,离子浓度1摩尔/升,采用氢电极最全最实用电极电势表由xsm18倾情制作,转载请注明来源:/xsm18/homePbSO4(+2)/Pb PbSO4+2e-=Pb+SO42--0.3588PbBr2(+2)/Pb PbBr2+2e-=Pb+2Br--0.284Co2+/Co Co2++2e-=Co-0.28H3PO4/H3PO3H3PO4+2H++2e-=H3PO3+H2O-0.276PbCl2(+2)/Pb PbI2+2e-=Pb+2I--0.2675Ni2+/Ni Ni2++2e-=Ni-0.257CO2/HCOOH(甲酸)CO2(g)+2H++2e-=HCOOH(aq)-0.199CuI(+1)/Cu CuI+e-=Cu+I-0.1852AgI(+1)/Ag AgI+e-=Ag+I-0.15224Sn2+/Sn Sn2++2e-=Sn-0.1375Pb2+/Pb Pb2++2e-=Pb-0.1262C4+/C2+CO2(g)+2H++2e-=CO+H2O-0.12P/PH3P(白磷)+3H++3e-=PH3(g)-0.063气体(g)Hg2I2(+1)/Hg Hg2I2+2e-=2Hg+2I--0.0405Fe3+/Fe Fe3++3e-=Fe-0.037Ag2S(+1)/Ag Ag2S+2H++2e-=2Ag+H2S-0.0366H+/H22H++2e-=H20.00CuBr(+1)/Cu CuBr+e-=Cu+Br-0.033AgBr(+1)/Ag AgBr+e-=Ag+Br-0.07133Si/SiH4Si+4H++4e-=SiH40.102C(石墨)/CH4C+4H++4e-=CH40.1316CuCl(+1)/Cu CuCl+e-=Cu+Cl-0.137Hg2Br2(+1)/Hg Hg2Br2+2e-=2Hg+2Br-0.13923S/H2S(aq)S+2H++2e-=H2S(aq)0.142水溶液Sn4+/Sn2+Sn4++2e-=Sn2+0.151Cu2+/Cu+Cu2++e-=Cu+0.153S6+/S4+SO42-+4H++2e-=H2SO3+H2O0.172AgCl(+1)/Ag AgCl+e-=Ag+Cl-0.2223As3+/As(亚砷酸)HAsO2(aq)+3H++3e-=As+2H2O0.2476HAsO2.H2O Hg2Cl2/Hg Hg2Cl2+2e-=2Hg+2Cl-0.268Bi3+/Bi Bi3++3e-=Bi0.308Cu2+/Cu Cu2++2e-=Cu0.337AgIO3/Ag AgIO3+e-=Ag+IO3-0.354S6+/S SO42-+8H++6e-=S+4H2O0.3572Ag2CrO4/Ag Ag2CrO4+2e-=2Ag+CrO42-0.447铬酸银S4+/S H2SO3+4H++4e-=S+3H2O0.449Ag2C2O4/Ag Ag2C2O4+2e-=2Ag+C2O42-0.4647草酸银Cu+/Cu Cu++e-=Cu0.521I2/I-I2+2e-=2I-0.5355AgBrO3/Ag AgBrO3+e-=Ag+BrO3-0.546As5+/As3+H3AsO4(aq)+2H++2e-=HAsO2+2H2O0.56水溶液AgNO2/Ag AgNO2+e-=Ag+NO2-0.564Te4+/Te TeO2+4H++4e-=Te+2H2O0.593Hg2SO4/Hg Hg2SO4+2e-=2Hg+SO42-0.614Ag2SO4/Ag Ag2SO4+2e-=2Ag+SO42-0.654Pt4+(氯铂酸)/Pt2+[PtCl6]2-+2e-=[PtCl4]2-+2Cl-0.68O2/O-O2+2H++2e-=H2O20.695Pt2+/Pt(二氯化铂)[PtCl4]2-+2e-=Pt+4Cl-0.73Se4+/Se H2SeO3+4H++4e-=Se+3H2O0.74Fe3+/Fe2+Fe3++e-=Fe2+0.771AgF/Ag AgF+e-=Ag+F-0.779Hg+/Hg Hg22++2e-=2Hg0.788Ag+/Ag Ag++e-=Ag0.7991N5+/N4+(硝酸)2NO3-+4H++2e-=N2O4(g)+2H2O0.803气体(g) Hg2+/Hg Hg2++2e-=Hg(lq)0.853液态(水银) Si4+(石英)/Si SiO2+4H++4e-=Si+2H2O0.857Hg2+/Hg+2Hg2++2e-=Hg22+0.92N5+/N3+(亚硝酸)NO3-+3H++2e-=HNO2+H2O0.934Pd2+/Pd Pd2++2e-=Pd0.951N5+/N2+NO3-+4H++3e-=NO+2H2O0.957Au3+/Au(三溴化金)AuBr2-+e-=Au+2Br-0.959N3+/2+HNO2+H++e-=NO+H2O0.983Au3+/Au(三氯化金)[AuCl4]-+3e-=Au+4Cl- 1.002Te6+/Te4+H6TeO6+2H++2e-=TeO2+4H2O 1.02N4+/N2+N2O4+4H++4e-=2NO+2H2O 1.03Pt4+/Pt PtO2+4H++4e-=Pt+2H2O 1.045Br2(lq)/Br-Br2(lq)+2e-=2Br- 1.0652液溴(lq)N4+/N3+N2O4+2H++2e-=2HNO2 1.07Br2(aq)/Br-Br2(aq)+2e-=2Br- 1.087水溶液(aq) Se6+/Se4+SeO42-+4H++2e-=H2SeO3+H2O 1.151Cl5+/Cl4+ClO3-+2H++e-=ClO2+H2O 1.152O2/H2O(g)O2+4H++4e-=2H2O(g) 1.185水蒸汽(g) Pt2+/Pt Pt2++2e-=Pt 1.188Cl7+/Cl5+ClO4-+2H++2e-=ClO3-+H2O 1.189I5+/I22IO3-+12H++10e-=I2(s)+6H2O 1.195碘单质(s) Cl5+/Cl3+ClO3-+3H++2e-=HClO2+H2O 1.21Mn4+/Mn2+MnO2+4H++2e-=Mn2++2H2O 1.224O2/H2O(液态水)O2+4H++4e-=2H2O 1.229常温水S+(S2Cl2)/S S2Cl2+2e-=2S+2Cl- 1.23Fe3O4/Fe2+Fe3O4+8H++2e-=3Fe2++4H2O 1.23Tl3+/Tl+T13++2e-=Tl+ 1.25注4Cl4+/Cl3+ClO2+H++e-=HClO2 1.277N3+/N+2HNO2(aq)+4H++4e-=N2O(g)+3H2O 1.297Cr6+/Cr3+Cr2O72-+14H++6e-=2Cr3++7H2O 1.33重铬酸根Br+/Br-HBrO+H++2e-=Br-+H2O 1.331Cr6+/Cr3+HCrO4-+7H++3e-=Cr3++4H2O 1.35铬酸根Cl2/Cl-Cl2(g)+2e-=2Cl- 1.358(g)氯气Au2O3(+3)/Au Au2O3+6H++6e-=2Au+3H2O 1.36Cl7+/Cl-ClO4-+8H++8e-=Cl-+4H2O 1.388Cl7+/Cl2ClO4-+8H++7e-=1/2Cl2+4H2O 1.392Au3+/Au+Au3++2e-=Au+ 1.41Br5+/Br-BrO3-+6H++6e-=Br-+3H2O 1.424I+/I22HIO+2H++2e-=I2+2H2O 1.439Cl5+/Cl-ClO3-+6H++6e-=Cl-+3H2O 1.451Pb4+/Pb2+PbO2+4H++2e-=Pb2++2H2O 1.455Cl5+/Cl2ClO3-+6H++5e-=1/2Cl2+3H2O 1.47CrO2(+4)/Cr3+CrO2+4H++e-=Cr3++2H2O 1.48二氧化铬Cl+/Cl-HClO+H++2e-=Cl-+H2O 1.482Au3+/Au Au3++3e-=Au 1.498Mn7+/Mn2+MnO4-+8H++5e-=Mn2++4H2O 1.507Cl4+/Cl-ClO2+4H++5e-=Cl-+2H2O 1.511Br5+/Br2BrO3-+6H++5e-=l/2Br2+3H2O 1.52Mn3+/Mn2+Mn3++e-=Mn2+ 1.5415注5Cl3+/Cl-HClO2+3H++4e-=Cl-+2H2O 1.57N2+/N+2NO+2H++2e-=N2O+H2O 1.59Br+/Br2HBrO+H++e-=l/2Br2(aq)+H2O 1.595I7+/I5+H5IO6+H++2e-=IO3-+3H2O 1.603注6Cl+/Cl2HClO+H++e-=1/2Cl2+H2O 1.611Cl3+/Cl2HClO2+3H++2e-=1/2Cl2+2H2O 1.628Cl3+/Cl+HClO2+2H++2e-=HClO+H2O 1.645Ni4+/Ni2+NiO2+4H++2e-=Ni2++2H2O 1.678Mn7+/Mn4+MnO4-+4H++3e-=MnO2+2H2O 1.68注7Pb4+/Pb2+PbO2+SO42-+4H++2e-=PbSO4+2H2O 1.69Au+/Au Au++e-=Au 1.691Ce4+/Ce3+Ce4++e-=Ce3+ 1.74注8Br7+/Br5+BrO4-+2H++2e-=BrO3-+H2O 1.763注9N+/N2N2O+2H++2e-=N2+H2O 1.766O-(H2O2)/O2-(H2O)H2O2+2H++2e-=2H2O 1.776NiO42-/NiO2NiO42-+4H++2e-=NiO2+2H2O 1.8Co3+/Co2+Co3++e-=Co2+ 1.808Co3+/Co2+Co3++e-=Co2+ 1.83稀硫酸中Co3+/Co2+Co3++e-=Co2+ 1.92稀高氯酸Ag2+/Ag+Ag2++e-=Ag+ 1.93稀硝酸Ag2+/Ag+Ag2++e-=Ag+ 1.98稀硫酸Ag2+/Ag+Ag2++e-=Ag+ 2.0稀高氯酸S2O82-/SO42-S2O82-+2e-=2SO42- 2.01Bi5+/Bi3+BiO3-+2H++2e-=Bi3++H2O 2.03铋酸盐O3/O2-O3+2H++2e-=O2+H2O 2.076XeO3/Xe XeO3+6H++6e-=Xe+3H2O 2.1最全最实用电极电势表由xsm18倾情制作,转载请注明来源:/xsm18/home注释1:碱族和从钙开始的碱土元素均和水发生反应,其电极电势数值为理论计算值注释2:铈元素(Ce)属于镧系元素,有稳定的+3,+4价,+3价有很强的还原性,+4有很强的氧化性,该元素有很好的代表性。
电极电势

1111-15 电动势测定的实际应用
E → ∆Gi , ∆H i , ∆Si L Lγ ± , a± , ti , pH , pM , K
平衡常数的测定
弱酸(碱)离解常数,水 的离子积常数, 溶度积, 活度积
氧化还原反应
∆rG = ∆rG + RT ln
o
∏
i
ai
能斯特(Nernst)方程 方程 能斯特
M
z+
+ ze
M
平衡时电化学势
µ M z + ( Sol ) = µ M z + ( M )
平衡时电化学势
µi
sol +
zie0φ
sol
=
M+ ze φ M µi i 0
µ M z + ( Sol ) = µ M z + ( M )
µM z+ (Sol) = µM (M ) − zµe (M )
Ka
a ⋅a RT o ln o E=E − 2 F pH / p o ⋅ a
2 + H
2
2 − Cl 2 AgCl
mHA ⋅ mCl − γ HA ⋅ γ Cl − (E − E )F + ln = − ln − ln K a o RT γ A− m − ⋅m
o A
E' ~ I
I → 0 γ →1
γ±=0.795
一元弱酸解离
HA
aH + ⋅ a A− Ka = a HA
+ + AH
a HA = γ HA ⋅
m HA m
o
(-) Pt,H2(p)|HA(m1),NaA(m2),NaCl(m3)|AgCl(s)|Ag(+)
标准电极电势表

S2O +2e-=2SO
Mn +e-=MO
Mn +4H++3e-=MnO2+2H2O
2H2SO3+H++2e-=H2SO4-+2H20
Mn +8H++5e-=Mn2++4H2O
H2SO3+4H++4e-=S+3H2O
MO3++3e-=MO
电极反应
E/V
Te4++4e-=Te
V3++e-=V2+
TeO2+4H++4e-=Te+2H2O
VO2++2H++e-=V3++H2O
Te +8H++7e-=Te+4H2O
VO +2H++e-=VO2++H2O
H6TeO6+2H++2e-=TeO2+4 H2O
V(OH) +2H++e-=VO2++3H2O
3
F2+2e-=2F-
Br2(l)+2e-=2Br-
Fe2++2e-=Fe
HBrO+H++2e-=Br-+H2O
Fe3++3e-=Fe
HBrO+H++e-=l/2Br2(aq)+H2O
Fe3++e-=Fe2+
HBrO+H++e-=l/2Br2(l)+H2O
[Fe(CN)6]3-+e-=[Fe(CN)6]4-
Sb2O5+6H++4e-=2SbO++3H2O
N2O4+2H++2e-=2HNO2
SbO++2H++3e-=Sb+H2O
N2O4+4H++4e-=2NO+2H2O
Sc3++3e-=Sc
2NO+2H++2e-=N2O+H2O
Se+2H++2e-=H2Se(aq)
HNO2+H++e-=NO+H2O
标准电极电势
由下列元素电势图判断所发生反应的是:
E(酸性或中性) BrO3- 1.51V Br2 1.07V Br-
E (碱性)
BrO3- 0.52V Br2 1.07V Br-
(A) 3 Br2 +3H2O=5Br-+BrO3-+6H+ (B) 5Br-+BrO3-+3H2O= 3 Br2 +6OH(C) 3 Br2 +6OH-= 5Br-+BrO3-+3H2O (D)以上答案都不对
a. 元素电势图
1.15 ClO2 1.27
1.19
1.21
ClO4¯
ClO3¯
1.64
HClO2
1.43
1.47
1.63
HClO
1.49
1.358
½ Cl2
Cl¯
1.45
如果一种元素具有多种氧化态,就可形成多对氧化 还原电对,为了便于比较各种氧化态的氧化还原性 质,将它们的E从高氧化态到低氧化态以图解的方 式表示出来,表明元素各氧化态之间标准电极电势
① 自然界均以化合物形式存在 ② 单质易与强碱反应 ③ 氧化物是难熔固体 ④ H3BO3 和 H2SiO3 在水中溶解度不大 ⑤ 由于B—B和Si—Si键能较小,烷的数目比 碳烷烃少得多,且易水解 ⑥ 卤化物易水解 ⑦ 易形成配合物,如 HBF4 和 H2SiF6
2B + 6NaOH == 2Na3BO3 +3H2 Si+2NaOH+H2O == Na2SiO3+2H2
对角线规则
下面三对处于对角线上的元素及其化合物 的性质有许多相似之处,叫做对角线规则
Li Be B C Na Mg AI Si
电对的电极电势

电对的电极电势1、电极电势的产生——双电层理论电极电势的大小主要取决于电极的本性,并受温度、介质和离子浓度等因素的影响。
为了赢得各种电极的电极电势数值,通常以某种电极的电极电势并作标准与其它各试样电极共同组成电池,通过测量电池的电动势, 而确认各种相同电极的相对电极电势e值。
年国际单纯化学与应用化学联合会(iupac)的建议,使用标准氢电极做为标准电极,并人为地规定标准氢电极的电极电势为零。
(1)标准氢电极电极符号: pt|h2(.3kpa)|h+(1mol.l-1)电极反应: 2h+ + 2e = h2(g)eφh+/ h2 = 0 v右上角的符号“φ”代表标准态。
标准态要求电极处于标准压力(.kpa)下,组成电极的固体或液体物质都是纯净物质;气体物质其分压为.kpa;组成电对的有关离子(包括参与反应的介质)的浓度为1mol.l-1(严格的概念是活度)。
通常测定的温度为k。
(2) 标准电极电势用标准氢电极和试样电极在标准状态下共同组成电池,测出该电池的电动势值,并通过直流电压表确认电池的正负极,即可根据e池 = e(+)- e(-)排序各种电极的标准电极电势的相对数值。
例如在k,用电位计测得标准氢电极和标准zn电极所组成的原电池的电动势(e池)为0.v,根据上式计算zn2+/zn电对的标准电极为-0.v。
用同样的办法可测得cu2+/cu电对的电极电势为+0.34v。
电极的 e为正值则表示共同组成电极的水解型物质,得电子的女性主义大于标准氢电极中的h+,例如铜电极中的 cu2+;例如电极的为负值,则共同组成电极的水解型物质得电子的女性主义大于标准氢电极中的h+,例如锌电极中的zn2+。
实际应用领域中,常采用一些电极电势较平衡电极例如饱和状态甘汞电极和银-氯化银电极做为参比电极和其它试样电极形成电池,求出其它电极的电势。
饱和状态甘汞电极的.电极电势为0.v。
银-氯化银电极的电极电势为0.v。
将不同氧化还原电对的标准电极电势数值按照由小到大的顺序排列,得到电极反应的标准电极电势表。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电对方程式E /V
Ca(II)-(0) Ca(OH)2+2e-=Ca+2OH--3.02 Ba(II)-(0) Ba(OH)2+2e-=Ba+2OH--2.99 La(III)-(0) La(OH)3+3e-=La+3OH--2.90 Sr(II)-(0) Sr(OH)2·8H2O+2e-=Sr+2OH-+8H2O -2.88 Mg(II)-(0) Mg(OH)2+2e-=Mg+2OH--2.690 Be(II)-(0) Be2O32-+3H2O+4e-=2Be+6OH--2.63 Hf(IV)-(0) HfO(OH)2+H2O+4e-=Hf+4OH--2.50 Zr(IV)-(0) H2ZrO3+H2O+4e-=Zr+4OH--2.36 Al(III)-(0) H2AlO3-+H2O+3e-=Al+OH--2.33 P(I)-(0) H2PO2-+e-=P+2OH--1.82 B(III)-(0) H2BO3-+H2O+3e-=B+4OH--1.79 P(III)-(0) HPO32-+2H2O+3e-=P+5OH--1.71 Si(IV)-(0) SiO32-+3H2O+4e-=Si+6OH--1.697 P(III)-(I) HPO32-+2H2O+2e-=H2PO2-+3OH--1.65 Mn(II)-(0) Mn(OH)2+2e-=Mn+2OH--1.56 Cr(III)-(0) Cr(OH)3+3e-=Cr+3OH--1.48 *Zn(II)-(0) [Zn(CN)4]2-+2e-=Zn+4CN--1.26 Zn(II)-(0) Zn(OH)2+2e-=Zn+2OH--1.249 Ga(III)-(0) H2GaO3-+H2O+2e-=Ga+4OH--1.219 Zn(II)-(0) ZnO22-+2H2O+2e-=Zn+4OH--1.215 Cr(III)-(0) CrO2-+2H2O+3e-=Cr+4OH--1.2 Te(0)-(-I) Te+2e-=Te2--1.143 P(V)-(III) PO43-+2H2O+2e-=HPO32-+3OH--1.05
*Zn(II)-(0) [Zn(NH3)4]2++2e-=Zn+4NH3-1.04
*W(VI)-(0) WO42-+4H2O+6e-=W+8OH--1.01
*Ge(IV)-(0) HGeO3-+2H2O+4e-=Ge+5OH--1.0
Sn(IV)-(II) [Sn(OH)6]2-+2e-=HSnO2-+H2O+3OH--0.93
S(VI)-(IV) SO42-+H2O+2e-=SO32-+2OH--0.93
Se(0)-(-II) Se+2e-=Se2--0.924 Sn(II)-(0) HSnO2-+H2O+2e-=Sn+3OH--0.909
P(0)-(-III) P+3H2O+3e-=PH3(g)+3OH--0.87
N(V)-(IV) 2NO3-+2H2O+2e-=N2O4+4OH--0.85
H(I)-(0) 2H2O+2e-=H2+2OH--0.8277 Cd(II)-(0) Cd(OH)2+2e-=Cd(Hg)+2OH--0.809 Co(II)-(0) Co(OH)2+2e-=Co+2OH--0.73
Ni(II)-(0) Ni(OH)2+2e-=Ni+2OH--0.72
As(V)-(III) AsO43-+2H2O+2e-=AsO2-+4OH--0.71
Ag(I)-(0) Ag2S+2e-=2Ag+S2--0.691 As(III)-(0) AsO2-+2H2O+3e-=As+4OH--0.68
Sb(III)-(0) SbO2-+2H2O+3e-=Sb+4OH--0.66
*Re(VII)-(IV) ReO4-+2H2O+3e-=ReO2+4OH--0.59
*Sb(V)-(III) SbO3-+H2O+2e-=SbO2-+2OH--0.59
Re(VII)-(0) ReO4-+4H2O+7e-=Re+8OH--0.584 *S(IV)-(II) 2SO32-+3H2O+4e-=S2O32-+6OH--0.58
Te(IV)-(0) TeO32-+3H2O+4e-=Te+6OH--0.57
Fe(III)-(II) Fe(OH)3+e-=Fe(OH)2+OH--0.56
S(0)-(-II) S+2e-=S2--0.47627 Bi(III)-(0) Bi2O3+3H2O+6e-=2Bi+6OH--0.46
N(III)-(II) NO2-+H2O+e-=NO+2OH--0.46 *Co(II)-C(0) [Co(NH3)6]2++2e-=Co+6NH3-0.422 Se(IV)-(0) SeO32-+3H2O+4e-=Se+6OH--0.366 Cu(I)-(0) Cu2O+H2O+2e-=2Cu+2OH--0.360 Tl(I)-(0) Tl(OH)+e-=Tl+OH--0.34 *Ag(I)-(0) [Ag(CN)2]-+e-=Ag+2CN--0.31 Cu(II)-(0) Cu(OH)2+2e-=Cu+2OH--0.222 Cr(VI)-(III) CrO42-+4H2O+3e-=Cr(OH)3+5OH--0.13 *Cu(I)-(0) [Cu(NH3)2]++e-=Cu+2NH3-0.12 O(0)-(-I) O2+H2O+2e-=HO2-+OH--0.076 Ag(I)-(0) AgCN+e-=Ag+CN--0.017 N(V)-(III) NO3-+H2O+2e-=NO2-+2OH-0.01 Se(VI)-(IV) SeO42-+H2O+2e-=SeO32-+2OH-0.05 Pd(II)-(0) Pd(OH)2+2e-=Pd+2OH-0.07
S(II,V)-(II) S4O62-+2e-=2S2O32-0.08 Hg(II)-(0) HgO+H2O+2e-=Hg+2OH-0.0977 Co(III)-(II) [Co(NH3)6]3++e-=[Co(NH3)6]2+0.108 Pt(II)-(0) Pt(OH)2+2e-=Pt+2OH-0.14 Co(III)-(II) Co(OH)3+e-=Co(OH)2+OH-0.17 Pb(IV)-(II) PbO2+H2O+2e-=PbO+2OH-0.247 I(V)-(-I) IO3-+3H2O+6e-=I-+6OH-0.26
Cl(V)-(III) ClO3-+H2O+2e-=ClO2-+2OH-0.33 Ag(I)-(0) Ag2O+H2O+2e-=2Ag+2OH-0.342 Fe(III)-(II) [Fe(CN)6]3-+e-=[Fe(CN)6]4-0.358 Cl(VII)-(V) ClO4-+H2O+2e-=ClO3-+2OH-0.36
*Ag(I)-(0) [Ag(NH3)2]++e-=Ag+2NH30.373 O(0)-(-II) O2+2H2O+4e-=4OH-0.401 I(I)-(-I) IO-+H2O+2e-=I-+2OH-0.485 *Ni(IV)-(II) NiO2+2H2O+2e-=Ni(OH)2+2OH-0.490 Mn(VII)-(VI) MnO4-+e-=MnO42-0.558 Mn(VII)-(IV) MnO4-+2H2O+3e-=MnO2+4OH-0.595 Mn(VI)-(IV) MnO42-+2H2O+2e-=MnO2+4OH-0.60 Ag(II)-(I) 2AgO+H2O+2e-=Ag2O+2OH-0.607 Br(V)-(-I) BrO3-+3H2O+6e-=Br-+6OH-0.61 Cl(V)-(-I) ClO3-+3H2O+6e-=Cl-+6OH-0.62 Cl(III)-(I) ClO2-+H2O+2e-=ClO-+2OH-0.66 I(VII)-(V) H3IO62-+2e-=IO3-+3OH-0.7 Cl(III)-(-I) ClO2-+2H2O+4e-=Cl-+4OH-0.76 Br(I)-(-I) BrO-+H2O+2e-=Br-+2OH-0.761 Cl(I)-(-I) ClO-+H2O+2e-=Cl-+2OH-0.841 *Cl(IV)-(III) ClO2(g)+e-=ClO2-0.95。
