合成氨合成工段课程设计说明书
氨合成课程设计

氨合成课程设计一、教学目标本课程旨在让学生了解和掌握氨的合成原理、流程和应用,培养学生运用化学知识解决实际问题的能力。
具体目标如下:1.知识目标:a.掌握氨的合成原理,包括哈柏-博施法和其他合成氨的方法。
b.了解氨的物理和化学性质。
c.掌握氨的用途,包括肥料、合成材料、能源等方面。
2.技能目标:a.能运用氨的合成原理分析实际生产问题。
b.能运用氨的化学性质进行实验操作。
c.能查阅相关资料,了解氨合成的最新研究动态。
3.情感态度价值观目标:a.培养学生对化学科学的兴趣和热情。
b.培养学生爱护环境、珍惜资源的意识。
c.培养学生团队合作、创新探究的精神。
二、教学内容本课程的教学内容主要包括以下几个部分:1.氨的合成原理:介绍哈柏-博施法、其他合成氨方法及其优缺点。
2.氨的物理和化学性质:包括氨的分子结构、溶解性、反应性等。
3.氨的用途:介绍氨在农业、工业、能源等领域的应用。
4.氨合成实验:演示氨的合成实验,让学生掌握实验操作技能。
5.氨合成技术的进展:介绍氨合成领域的新技术、新工艺。
三、教学方法本课程采用多种教学方法,以激发学生的学习兴趣和主动性:1.讲授法:讲解氨的合成原理、物理化学性质和应用。
2.讨论法:学生讨论氨合成技术的发展和应用。
3.案例分析法:分析实际生产中的氨合成问题,培养学生解决实际问题的能力。
4.实验法:进行氨合成实验,提高学生的实验技能。
四、教学资源1.教材:选用权威、实用的氨合成教材。
2.参考书:提供氨合成相关的参考书籍,丰富学生的知识体系。
3.多媒体资料:制作课件、视频等,生动展示氨合成的原理和实验。
4.实验设备:准备充足的实验设备,确保每个学生都能动手操作。
5.网络资源:利用互联网,为学生提供氨合成领域的最新研究动态。
五、教学评估本课程的评估方式包括以下几个方面:1.平时表现:评估学生在课堂上的参与程度、提问回答、小组讨论等,以体现学生的学习态度和积极性。
2.作业:布置相关的氨合成作业,评估学生的理解和应用能力。
产4万吨合成氨合成工段的工艺方案设计书大学本科方案设计书

本设计为年产4万吨合成氨合成工段的工艺设计,合成工段是整个合成氨生产过程中的核心部分。
在全世界不可再升能源不断减少的背景下,本设计选择了相对资源较多而且最为环保的天然气为生产原料。
合成氨合成工段工艺流程为:气体→冷交换器→合成塔→换热器→废热锅炉→水冷器→氨分离器→循环机。
通过查阅相关文献和资料,设计了年产4万吨合成氨合成工段的工艺流程,并且用CAD绘制了本设计的设备及工艺流程。
最后对本设计的工艺流程进行了物料衡算、能量衡算,并且根据本设计及操作温度、压力按照相关标准对工艺管道的尺寸和材质进行了选择。
最后,对生产过程中所产生的硫化物进行处理,避免造成环境污染。
关键字:天然气;合成;氨;物料恒算;能量衡算;脱硫;环境保护AbstractThe design for the process design of annual output of 40000 tons of synthetic ammonia synthesis, synthesis workshop section is part of the core of the production of synthetic ammonia. Can't l energy decreasing background in the whole world, this design choose relatively more resources and the protection of natural gas for the production of raw materials.Synthesis of ammonia synthesis process is: gas, cold heat exchanger, synthetic tower, heat exchanger, waste heat boiler, water cooler, ammonia separator, circulation machine. Through access to relevant literature and data, the design process of the annual output of 40000 tons of synthetic ammonia synthesis, and drawing with CAD equipment and process of the design of the. At the end of the design process for the material balance, energy balance, and according to the design and the operating temperature, pressure in accordance with the relevant standard of piping of the size and material of choice.Finally, to deal with the sulfide produced during the production process, to avoid the pollution of the environment.Keywords: gas。
年产三十万吨合成氨合成工段任务书

题目:
年产30万吨合成氨合成工段工艺设计
学院
化学与材料工程学院
专 业
煤炭利用与深加工
班 级
1013101
学 号
101310127
学生姓名
庞雷
指导教师
赵海鹏
发放日期
2013.4.1
河南城建学院毕业设计(论文)任务书
一、主要任务与目标:
设计任务:合成氨厂合成工段的工艺设计
设计题目:年产30万吨合成氨合成工段的工艺设计
指导教师意见:
(建议就任务书的规范性;任务书主要内容和基本要求的明确具体性;任务书计划进度的合理性;提供的参考文献数量等方面写出意见。)
指导教师签名:
年月日
教研室审核意见:
教研室主任签名:
年月日
注:任务书必须由指导教师和学生互相交流后,由指导老师下达并交教研室主任审核后发给学生,最后同学生毕业论文等其它材料一起存档。
5、工艺流程图绘制
以单线图的形式绘制,表出主题设备和辅助设备的物料流向、物流量、能量流量和主要工艺参数测量点和控制点(即带控制点的工艺流程图)。
6、主要设备结构图的绘制
7、编写设计说明书:对工段概况的说明,流程叙述,设计特点,主要设备选型或计算说明,生产制度,并列表说明原材料与产品技术规格。
基本要求
设计条件:
新鲜氮氢气组成
组分
H2
N2
CH4
Ar
合计
体积%
73.16
25.17
1.29
0.38
100
新鲜气体温度:35℃
合成操作压力:30
水冷却器的冷却水温:25℃
气体部位的温度和压力自定
设计目标:
氨合成说明说
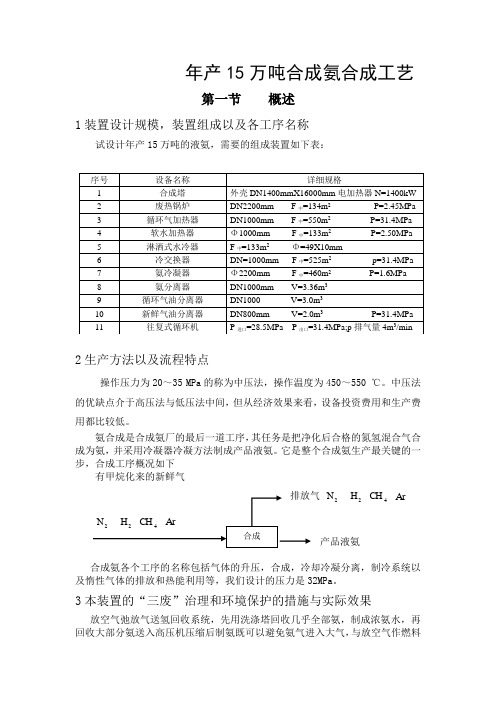
年产15万吨合成氨合成工艺第一节 概述1装置设计规模,装置组成以及各工序名称试设计年产15万吨的液氨,需要的组成装置如下表:2生产方法以及流程特点操作压力为20~35 MPa 的称为中压法,操作温度为450~550 ℃。
中压法的优缺点介于高压法与低压法中间,但从经济效果来看,设备投资费用和生产费用都比较低。
氨合成是合成氨厂的最后一道工序,其任务是把净化后合格的氮氢混合气合成为氨,并采用冷凝器冷凝方法制成产品液氨。
它是整个合成氨生产最关键的一步,合成工序概况如下有甲烷化来的新鲜气排放气 2N 2H 4CH Ar2N 2H 4CH Ar产品液氨合成氨各个工序的名称包括气体的升压,合成,冷却冷凝分离,制冷系统以及惰性气体的排放和热能利用等,我们设计的压力是32MPa 。
3本装置的“三废”治理和环境保护的措施与实际效果放空气弛放气送氢回收系统,先用洗涤塔回收几乎全部氨,制成浓氨水,再回收大部分氨送入高压机压缩后制氨既可以避免氨气进入大气,与放空气作燃料序号 设备名称 详细规格1 合成塔 外壳DN1400mmX16000mm 电加热器N=1400kW2 废热锅炉 DN2200mm F 中=134m 2P=2.45MPa3 循环气加热器 DN1000mm F 中=550m 2P=31.4MPa 4 软水加热器 Φ1000mm F 中=133m 2 P=2.50MPa 5 淋洒式水冷器 F 中=133m 2 Φ=49X10mm6 冷交换器 DN=1000mm F 中=525m 2 p=31.4MPa7 氨冷凝器 Φ2200mm F 中=460m 2 P=1.6MPa8 氨分离器 DN1000mm V=3.36m 39 循环气油分离器 DN1000 V=3.0m 310 新鲜气油分离器 DN800mm V=2.0m 3P=31.4MPa11 往复式循环机P 进口=28.5MPa P 出口=31.4MPa;p 排气量4m 3/min合成相比又更合理经济。
年产 10万吨合成氨厂合成工段工艺设计

年产10万吨合成氨厂合成工段工艺设计第一部分设计说明书一、概述产品在国民经济中的地位及用途;国内外生产的发展概况;合成氨工业的展望。
氨在国民经济中占有重要的地位,现在约有80%的氨用来制造化学肥料,其余作为生产其他化工产品的原料。
除液氨可直接作为肥料外,农业上使用的氨肥,例如尿素、硝酸铵、磷酸铵、硫酸铵、氯化铵、氨水以及各种含氨混肥和复肥,都是以氨为原料的氨在工业上主要用来制造炸药和各种化学纤维和塑料。
从氨可以制的硝酸,继而再制造硝酸铵、硝化甘油、三硝基甲苯和硝基纤维素等。
在化纤和塑料工业中,则以氨、硝酸和尿酸作为氮源,生产已内酰胺,己二胺、人造丝、全脂树脂和脲醛树脂等产品氨的其他工业用途也十分广泛,例如作为制冰、空调、冷藏等系统的制冷剂,在冶金工业中用来提炼矿石中的铜、镍等金属,在医药和生物化学方面生产磺胺类生物、维生素、蛋氨酸和其他氨基酸等。
氨气的发现十七世纪 30 年代末英国的牧师、化学家 S.哈尔斯(HaLes,1677~1761) ,用氯化铵与石灰的混合物在以水封闭的曲颈瓶中加热,只见水被吸入瓶中而不见气体放出, 1774 年化学家普利斯德里重做该实验,用汞代替水来密封,制得了碱空气(氨),并且他还研究发现了氨的性质,发现氨极易溶于水、可以燃烧,还发现该气体通以电火花时其容积增加,而且分解为两种气体: H2和 N2,其后 H.戴维(Davy, 1778~1829) 等化学家继续研究,进一步证明了 2 体积的氨通过电火花放电后,分解为 1体积的氮气和 3 体积的氢气[2]。
19 世纪以前农业上所需的氮肥来源主要来自于有机物的副产物和动植物的废物,如粪便、腐烂动植物等等,随着农业和军工生产的发展的需要,迫切的需要建立规模巨大的探索性的研究,化学家们设想,能不能把空气中大量的氮气固定下来,从而开始设计以氮和氢为原料的合成氨流程。
19 世纪,大量的化学家开始试图合成氨,他们试图利用高温、高压、电弧、催化剂等手段试验直接合成氨,均未成功。
年产8万吨合成氨合成工段设计--毕业设计[1]
![年产8万吨合成氨合成工段设计--毕业设计[1]](https://img.taocdn.com/s3/m/8537101dc281e53a5802ff62.png)
年产8万吨合成氨合成工段设计设计说明书1 总论氨是最为重要的基础化工产品之一,其产量居各种化工产品的首位; 同时也是能源消耗的大户,世界上大约有10 %的能源用于生产合成氨。
氨主要用于农业,合成氨是氮肥工业的基础,氨本身是重要的氮素肥料,其他氮素肥料也大多是先合成氨、再加工成尿素或各种铵盐肥料,这部分约占70 %的比例,称之为“化肥氨”;同时氨也是重要的无机化学和有机化学工业基础原料,用于生产铵、胺、染料、炸药、制药、合成纤维、合成树脂的原料,这部分约占30 %的比例,称之为“工业氨”。
世界合成氨技术的发展经历了传统型蒸汽转化制氨工艺、低能耗制氨工艺、装置单系列产量最大化三个阶段。
根据合成氨技术发展的情况分析, 未来合成氨的基本生产原理将不会出现原则性的改变, 其技术发展将会继续紧密围绕“降低生产成本、提高运行周期, 改善经济性”的基本目标, 进一步集中在“大型化、低能耗、结构调整、清洁生产、长周期运行”等方面进行技术的研究开发[1]。
(1) 大型化、集成化、自动化, 形成经济规模的生产中心、低能耗与环境更友好将是未来合成氨装置的主流发展方向。
以Uhde公司的“双压法氨合成工艺”和Kellogg 公司的“基于钌基催化剂KAAP 工艺”,将会在氨合成工艺的大型化方面发挥重要的作用。
氨合成工艺单元主要以增加氨合成转化率(提高氨净值) ,降低合成压力、减小合成回路压降、合理利用能量为主,开发气体分布更加均匀、阻力更小、结构更加合理的合成塔及其内件; 开发低压、高活性合成催化剂, 实现“等压合成”。
(2) 以“油改气”和“油改煤”为核心的原料结构调整和以“多联产和再加工”为核心的产品结构调整,是合成氨装置“改善经济性、增强竞争力”的有效途径。
实施与环境友好的清洁生产是未来合成氨装置的必然和惟一的选择。
生产过程中不生成或很少生成副产物、废物,实现或接近“零排放”的清洁生产技术将日趋成熟和不断完善。
提高生产运转的可靠性,延长运行周期是未来合成氨装置“改善经济性、增强竞争力”的必要保证。
《工业合成氨》 教学设计

《工业合成氨》教学设计一、教学目标1、知识与技能目标(1)了解工业合成氨的反应原理、主要设备和工艺流程。
(2)理解温度、压强、浓度等条件对合成氨反应平衡和反应速率的影响。
(3)掌握化学平衡移动原理在工业合成氨中的应用。
2、过程与方法目标(1)通过对工业合成氨反应条件的分析和讨论,培养学生运用化学平衡移动原理解决实际问题的能力。
(2)通过对工业合成氨工艺流程的学习,培养学生的观察能力和分析归纳能力。
3、情感态度与价值观目标(1)感受化学科学对工业生产和社会发展的重要作用,激发学生学习化学的兴趣和热情。
(2)培养学生的创新意识和可持续发展观念,增强学生的社会责任感。
二、教学重难点1、教学重点(1)工业合成氨的反应原理和化学平衡移动原理的应用。
(2)温度、压强、浓度等条件对合成氨反应的影响。
2、教学难点(1)综合考虑各种因素,选择适宜的工业合成氨条件。
(2)理解工业合成氨工艺流程中的循环操作和能量利用。
三、教学方法讲授法、讨论法、实验探究法、多媒体辅助教学法四、教学过程1、导入新课通过展示农业生产中对氮肥的大量需求,引出合成氨工业的重要性,从而导入新课。
2、知识讲解(1)合成氨的反应原理讲解氮气和氢气在一定条件下反应生成氨气的化学方程式:N₂+3H₂⇌ 2NH₃,并介绍该反应的特点:可逆反应、放热反应、气体体积减小的反应。
(2)化学平衡移动原理回顾化学平衡移动原理的内容,即勒夏特列原理:如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动。
(3)反应条件对合成氨的影响①温度从反应速率和化学平衡两个角度分析温度对合成氨反应的影响。
升高温度可以加快反应速率,但不利于化学平衡向生成氨气的方向移动;降低温度有利于化学平衡向生成氨气的方向移动,但会减慢反应速率。
综合考虑,工业上选择 500℃左右的温度。
②压强增大压强可以加快反应速率,同时使化学平衡向生成氨气的方向移动。
但过高的压强对设备要求高,成本增加。
合成氨变换工段毕业设计说明书

合成氨变换工段毕业设计说明书摘要本文是关于重油为原料年产8万吨氨一氧化碳变换工段初步设计。
在合成氨的生产中,一氧化碳变换反应是非常重要的反应。
用重油制造的原料气中,含有一部分一氧化碳,这些一氧化碳不能直接做为合成氨的原料,而且对合成氨的催化剂有毒害作用,必须在催化剂的催化作用下通过变换反应加以除去。
一氧化碳变换反应既是原料气的净化过程,又是原料气的制造过程。
本设计主要包括工艺路线的确定、中温变换炉的物料衡算和热量衡算、触媒用量的计算、中温变换炉工艺计算和设备选型、换热器的物料衡算和热量衡算以及设备选型等。
并且综合各方面因素对车间设备布置进行了合理的设计,最终完成了20 000字的设计说明书及生产工艺流程图、车间平立面布置图及主体设备装配图的绘制。
关键词:重油;一氧化碳变换;中温变换炉;流程图AbstractThis article was about the annual output of heavy oil as raw materials to transform eight thousand tons of carbon monoxide ammonia preliminary design section. In the production of ammonia, transformation of carbon monoxide was a very important reaction. Manufactured using heavy oil feed gas which containa part of carbon monoxide, carbon monoxide could not be directly used as those of the raw materials of synthetic ammonia, but also a catalyst for ammonia poisoning effect there must be a catalyst for transformation through the catalytic reaction to be removed. Transformation of carbon monoxide is a gas purification process of raw materials, but also the manufacturing process of feed gas. The design of the main routes which include the identification process, the medium variant of the furnace material balance , heat balance, the calculation of the amount of catalyst, in the variable furnace process of calculation and selection of equipment, heat exchanger of the material balance and heat balance as well as equipment selection type and so on. Taking all factors and workshop equipment to carry out a reasonable arrangement of the design. In the end, the20 000-word statement and map production process, shopping facade and the main equipment layout drawing assembly were completed.Key words: Heavy oil; Transformation of carbon monoxide; Temperature shiftconverter; Flow chart目录摘要 (Ⅰ)Abstract (Ⅱ)第1章总论 (1)1.1 概述 (1)1.1.1 一氧化碳变换反应的意义与作用 (1)1.1.2 国内外研究现状 (1)1.2 设计依据 (1)1.3 厂址的选择 (2)1.3.1 厂址选则 (2)1.3.2 方案比较 (2)1.4 设计规模与生产制度 (3)1.4.1 设计规模 (3)1.4.2 生产制度 (3)1.5 原料与产品规格 (3)1.5.1 原料规格 (3)1.5.2 产品规格 (3)第2章工艺设计与计算 (4)2.1 工艺原理 (4)2.2 工艺路线的选择 (4)2.3 工艺流程简述 (4)2.4 工艺参数 (5)2.4.1 原料气体组分 (5)2.4.2 工作压力 (5)2.4.3 工作温度 (5)2.4.4 计算基准 (6)2.5 物料衡算 (6)2.5.1 变换气量及变换率计算 (6)2.5.2 总蒸汽量计算 (7)2.5.3 中变炉物料衡算 (7)2.6 热量衡算 (16)2.6.1 中变炉一段CO变换反应热量衡算 (16)2.6.2 中变炉二段CO变换反应热量衡算 (17)2.6.3 中变炉三段CO变换反应热量衡算 (18)2.6.4 换热器热量衡算 (18)2.6.5 物料衡算和热量衡算一览表 (18)第3章设备选型 (22)3.1 设备选型原则 (22)3.2 主要设备计算 (22)3.2.1 中变炉设备计算 (22)3.2.2 换热器设备计算 (29)3.3 其他主要设备 (30)第4章设备一览表 (31)第5章车间设备布置设计 (33)5.1 车间布置设计的原则 (33)5.1.1 车间设备布置的原则 (33)5.1.2 车间设备平立面布置的原则 (34)5.1.3 本工段设计设备布置原则 (28)第6章自动控制 (29)6.1 主要的控制原理 (29)6.2 自控水平与控制点 (29)第7章安全和环境保护 (30)7.1 三废产生情况 (36)7.2 三废处理情况 (37)第8章公用工程 (37)8.1 供水 (37)8.2 供电 (38)8.3 通风 (38)8.4 供暖 (38)8.5 电气 (38)结束语 (39)参考文献..................................................................................................... 错误!未定义书签。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
符号说明-----V kmol 气体摩尔质量, -----d m 管道直径, -----,L kmol 液体摩尔质量 -----G 气液百分数 2-----/g m s 重力加速度, 3-----Nm 标准立方米 -----K 平衡常数 -----F 进料量-----l m 长度, -----p C 比热容-----m kg 质量, -----Q KJ 热量,-----/M kg kmol 摩尔质量, -----/I KJ kg 冷凝热, -----n 数量 -----K 绝热指数-----p MPa 压强, -----N KW 压缩功, -----r m 半径, -----Z 压缩系数-----/R H KJ kmol 反应焓, -----T 温度,℃2-----F m 传热面积, 3-----V m 体积,()2-----/KJ m h α⋅传热系数, -----m Φ直径,-----y 气相摩尔分数 -----/W kg h 重量流量, -----/()KJ m h λ⋅⋅导热系数,℃ -----λ摩擦系数 -----a c P s P μ⋅粘度,或 Pr-----普兰特常数3-----/kg m ρ密度, -----/Q KJ h 热负荷, 2-----()/R m h KJ ⋅⋅污垢系数,℃ -----x 液相摩尔分数第一章总论1.1 概述氨是一种重要的含氮化合物。
氮是蛋白质质中不可缺少的部分,是人类和一切生物所必须的养料;可以说没有氮,就没有蛋白质,没有蛋白质,就没有生命。
大气中存在有大量的氮,在空气中氨占78%(体积分数)以上,它是以游离状态存在的。
但是,如此丰富的氮,通常状况下不能为生物直接吸收,只有将空气中的游离氮转化为化合物状态,才能被植物吸收,然后再转化成人和动物所需的营养物质。
把大气中的游离氮固定下来并转变为可被植物吸收的化合物的过程,称为固定氮。
目前,固定氮最方便、最普通的方法就是合成氨,也就是直接由氮和氢合成为氨,再进一步制成化学肥料或用于其它工业。
在国民经济中,氨占有重要地位,特别是对农业生产有着重大意义。
氨主要用来制作化肥。
液氨可以直接用作肥料,它的加工产品有尿素、硝酸铵、氯化氨和碳酸氢氨以及磷酸铵、氮磷钾混合肥等。
氨也是非常重要的工业原料,在化学纤维、塑料工业中,则以氨、硝酸和尿素作为氮元素的来源生产己内酰胺、尼龙-6、丙烯腈等单体和尿醛树脂等产品。
由氨制成的硝酸,是各种炸药和基本原料,如三硝基申苯,硝化甘油以及其它各种炸药。
硝酸铵既是优良的化肥,又是安全炸药,在矿山开发等基本建设中广泛应用。
氨在其他工业中的应用也非常广泛。
在石油炼制、橡胶工业、冶金工业和机械加工等部门以及轻工、食品、医药工业部门中,氨及其加工产品都是不可缺少的。
例如制冷、空调、食品冷藏系统大多数都是用氨作为制冷剂。
1.2 氨的性质1.2.1 氨的物理性质氨在常温下是无色气体,比空气轻,具有刺激性臭味,能刺激人体感官粘膜空气中,含氨大于0.01%时即会引起人体慢性中毒。
气态氨易溶于水,成为氨水,氨水呈弱碱性。
氨在水中的溶解度随压力增大而降低。
氨水在溶解时放出大量热。
氨水中的氨极易挥发。
常压下气态氨需冷却到-33.35 ℃(沸点)才能液化。
而在常温下需加压到0.87MPa 时才能液化。
液氨为无色液体,气化时吸收大量的热。
1.2.2氨的化学性质⑴ 氨与氧在催化剂作用下生成氮的氧化物,并能进一步与水作用,制得硝酸:3224546NH O NO H O +→+⑵ 氨与酸或酐反应生成盐类,是制造氮肥的基本反应:3244242)NH H SO NH SO +=(3343 NH HNO NH NO +=34 NH HCl NH Cl +=334424NH H PO NH H PO +=⑶ 氨与二氧化碳作用生成氨基甲酸铵,进一步脱水成为尿素:32422NH CO NH COONH +=()42222NH COONH CO NH H O =+⑷ 氨与二氧化碳和水作用,生成碳酸氢铵:32243NH CO H O NH HCO ++=(5) 氨可与盐生成各种络合物,如CuCl 2•6NH 3、CuSO 4•4NH 3。
氨与空气(或氧)的混合气,在一定浓度范围内能发生剧烈的氧化作用而爆炸。
在常温常压下,氨与空气爆炸极限为15%~28%(NH 3)。
100℃,0.1 MPa 下,爆炸极限为14.5%~29.5%(NH 3)。
1.3 原料气来源原料气主要有两部分:氮气、氢气。
氮气主要是从空气中提取。
氢气是从半水煤气中提取的,以煤为原料,在一定的高温条件下通入空气、水蒸气或富氧空气-水蒸气混合气,经过一系列反应生成含有一氧化碳、二氧化碳、氢气、氮气、及甲烷等混合气体的过程。
在气化过程中所使用的空气、水蒸气或富氧空气-水蒸气混合气等称为汽化剂。
这种生成的混合气称为煤气。
煤气的成分取决于燃料和汽化剂的种类以及进行汽化的条件。
根据所用汽化剂的不同,工业煤气可分为下列四种:空气煤气:以空气为汽化剂制取的煤气,又称为吹风气。
水煤气:以水蒸气(或水蒸气与氧的混合气)为汽化剂制取的煤气。
混合煤气:以空气和适量的水蒸气为汽化剂制取的煤气,一般作燃料用。
半水煤气:是混合煤气中组成符合(H2+CO)/N2=3.1~3.2的一个特例。
可用蒸气与适量的空气或蒸气与适量的富养空气为汽化剂制得,也可用水煤气与吹风混合配制。
本设计采用半水煤气,半水煤气经过净化后得到纯净的氢气,再配制适量的氮气,成为合成氨的原料气,其中含有氮气、氢气、以及惰性气体甲烷和氩。
1.4 文献综述合成氨工业是氮肥工业的基础,也是一些工业部门的重要原料,它的迅速发展促进了一系列科学技术和化学合成工业的发展,随着科学技术的发展,合成氨工业在国民经济中的作用必将日益显著。
1.4.1 合成氨工业的发展合成氨工业在20世纪初期形成,开始用氨作为火炸药工业的原料,为战争服务;第一次世界大战结束后,转向为农业、工业服务。
随着科学技术的发展,对氨的需要量日益增长,近30年来合成氨工业发展很快。
目前,国内合成氨年生产能力30万吨以上的大型企业有26家,合成氨年生产能力10万吨以上的中型企业有100多家,其他还有800多家小氮肥厂也生产约占总量60%的合成氨。
1.4.2合成氨工业的现状我国合成氨工业存在一些特殊问题,一是氮肥资源紧张。
国际上以天然气为原料的氮肥占85%。
而我国氮肥原料以煤为主,天然气仅占20%,我国氮肥行业急需解决采用成熟的粉煤气化技术,以本地粉煤代替无烟块煤。
建议针对不同企业采用不同的技术路线。
内技术进行改造。
同时,对于有廉价天然气资源的地区,鼓励采用天然气改造现有装置或建设天然气化肥基地。
二是企业结构不合理,产业集中度低,技术水平不高。
在氮肥行业,要推广新型煤气化技术,包括粉煤气化、水煤浆气化技术等;新型净化技术,如低温变换、低温甲醇洗MDEA等净化技术;新型氨合成塔及大型低压合成的成套技术和装备。
1.4.3合成氨工业的发展趋势合成氨工业的发展趋势: ①原料路线的变化方向。
煤的储量约为石油、天然气总和的10倍,自从70年代中东石油涨价后,从煤制氨路线重新受到重视,但因以天然气为原料的合成氨装置投资低、能耗低、成本低的缘故,预计到20世纪末,世界大多数合成氨厂仍将以气体燃料为主要原料。
②节能和降耗。
合成氨成本中能源费用占较大比重,合成氨生产的技术改进重点放在采用低能耗工艺、充分回收及合理利用能量上,主要方向是研制性能更好的催化剂、开发新的原料气净化方法、降低燃料消耗、回收和合理利用低位热能等。
③与其他产品联合生产。
合成氨生产中副产大量的二氧化碳,不仅可用于冷冻、饮料、灭火,也是生产尿素、纯碱、碳酸氢铵的原料。
到2010年,力争组建50家大型企业集团,大型氮肥厂合成氨平均规模达40万吨/年以上,中型氮肥厂平均规模达20万吨/年以上。
其产品集中度达到50%,并形成3-5家在国际上有一定影响的大型企业集团。
同时,调整企业结构,减少基础肥料生产厂数量,提高单套装置的规模,使合成氨工业朝现代化又迈进一步。
1.5 设计任务的项目来源本课题是指导老师提高毕业生设计能力而选定的。
希望通过此次课程设计让学生可以较好地把理论学习中的分散知识点和实际生产操作有机结合起来,得到较为合理的设计成果,达到课程设计训练的目的,提高学生分析和解决化工实际问题的能力。
第二章 流程方案的确定2.1 生产原理氨是由气态氮和氢在适宜温度压力,并有触媒的作用下发生反应的,其反应式为:22331 46.22 22H N NH KJ +→+ 此式为一不可逆,放热,体积缩小的反应,其反应过程为: 223322222N N N H N H N H N H →→→→→(扩散)(吸附)(吸附)(吸附)(附)(扩散到气相)氨合成的反应特点:⑴ 反应过程要在高压下进行,压力越高,越有利于氨的合成。
⑵ 温度低时,反应有利于向氨合成的方向进行,但反应速度较慢,提高温度不利于反应平衡,但可以加快反应速度,在实际操作中,温度的选择取决于触媒的活性。
⑶ 必须借助触媒,以加快反应速度。
⑷ 混合气中氢、氮含量越高越有利于反应,因此,气体中惰性气体含量越少越好。
2.2 各生产方法及特点合成氨的生产主要包括三个步骤 :第一步是造气,即制备含有氢、氮的原料气;第二步是净化,不论选择什么原料,用什么方法造气,都必须对原料气进行净化处理,以除去氢、氮以外的杂质;第三步是压缩和合成,将纯净的氢、氮混合压缩到高压,在铁催化剂与高温条件下合成为氨。
目前氨合成的方法,由于采用的压力、温度和催化剂种类的不同,一般可分为低压法、中压法和高压法三种。
(1) 低压法操作压力低于20 MPa 的称低压。
采用活性强的亚铁氰化物作催化剂,但它对毒物很敏感,所以对气体中的杂质(CO、CO2)要求十分严格。
也可用磁铁矿作催化剂,操作温度450~550 ℃。
该法的优点是由于操作压力和温度较低,对设备、管道的材质要求低、生产容易管理,但低压法合成率不高,合成塔出口气体中含氮约8%~10%,所以催化剂的生产能力比较低;同时由于压力低而必须将循环气降至-20℃的低温才能使气体中的氨液化,分离比较完全,所以需要设置庞大的冷冻设备,使得流程复杂,且生产成本较高。
(2) 高压法操作压力为60 MPa 以上的称为高压法,其操作温度大致为550~650 ℃。
高压法的优点是,氨合成的效率高,合成氨出口气体中含氨达25%~30%,催化剂的生产能力较大。
由于压力高,一般用水冷的方法气体中的氨就能得到完全的分离,而不需要氨冷。
从而简化了流程;设备和流程比较低紧凑,设备规格小,投资少,但由于在高压高温下操作,对设备和管道的材质要求比较高。
合成塔需用高镍优质合金钢制造,即使这样,也会产生破裂。
