铜银锌及其化合物的化学方程式和离子方程式
初中常见化合价化学式及化学方程式
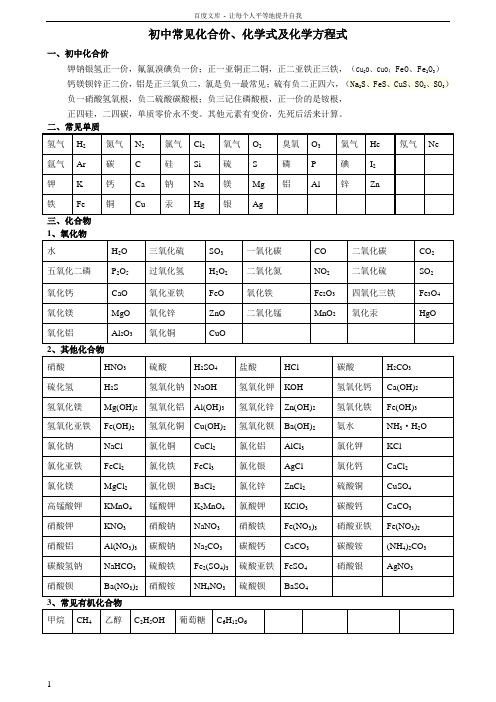
初中常见化合价、化学式及化学方程式一、初中化合价钾钠银氢正一价,氟氯溴碘负一价;正一亚铜正二铜,正二亚铁正三铁,(Cu2O、CuO;FeO、Fe2O3)钙镁钡锌正二价,铝是正三氧负二,氯是负一最常见;硫有负二正四六,(Na2S、FeS、CuS、SO2、SO3)负一硝酸氢氧根,负二硫酸碳酸根;负三记住磷酸根,正一价的是铵根,正四硅,二四碳,单质零价永不变。
其他元素有变价,先死后活来计算。
三、化合物初中化学方程式全(已配平)一、化合反应1、镁在空气中燃烧:2Mg+O2点燃2MgO2、铁在氧气中燃烧:3Fe+2O2点燃Fe3O43、铝在空气中燃烧:4Al+3O2点燃2Al2O34、氢气在空气中燃烧:2H2+O2点燃2H2O5、红磷在空气中燃烧:4P+5O2点燃2P2O56、硫粉在空气中燃烧:S+O2点燃SO27、碳在氧气中充分燃烧:C+O2点燃 CO28、碳在氧气中不充分燃烧:2C+O2点燃2CO9、二氧化碳通过灼热碳层:C+CO2高温2CO10、一氧化碳在氧气中燃烧:2CO+O2 点燃2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2+H2O=H2CO312、生石灰溶于水:CaO+H2O=Ca(OH)213、无水硫酸铜作干燥剂:CuSO4+5H2O=CuSO4·5H2O14、钠在氯气中燃烧:2Na+Cl2点燃2NaCl二、分解反应15、实验室用双氧水制氧气:2H2O2MnO22H2O+O2↑16、加热高锰酸钾:2KMnO4△K2MnO4+MnO2+O2↑17、水在直流电的作用下分解:2H2O通电2H2↑+O2↑18、碳酸化学性质不稳定而分解:H2CO3=H2O+CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3高温CaO+CO2↑20、加热氯酸钾分解:2KClO3=2KCl+3O2↑21、氧化汞加热分解:2HgO△2Hg+O2↑三、置换反应(单质+化合物→新的单质+新的合化物)22、锌和稀盐酸反应(实验室制氢气):Zn+2HCl=ZnCl2+H2↑锌和稀硫酸反应(实验室制氢气):Zn+H2SO4=ZnSO4+H2↑23、镁和稀盐酸反应:Mg+2HCl=MgCl2+H2↑镁和稀硫酸反应:Mg+H2SO4=MgSO4+H2↑24、铁和稀盐酸反应:Fe+2HCl=FeCl2+H2↑铁和稀硫酸反应:Fe+H2SO4=FeSO4+H2↑25、铝和稀盐酸反应:2Al+6HCl=2AlCl3+3H2↑铝和稀硫酸反应:2Al+3H2SO4=Al2(SO4)3+3H2↑26、铁和硫酸铜溶液反应:Fe+CuSO4 =FeSO4+Cu铝和硫酸铜溶液反应:2Al+3CuSO4=Al2(SO4)3+3Cu27、铜和硝酸银反应:Cu+2AgNO3=Cu(NO3)2+2Ag28、氢气还原氧化铜:H2+CuO△Cu+H2O29、木炭还原氧化铜:C+2CuO高温 2Cu+CO2↑30、焦炭还原氧化铁:3C+2Fe2O高温 4Fe+3CO2↑31、水蒸气通过灼热碳层:H2O+C高温 H2+CO四、复分解反应复分解反应是由两种互相交换成分,生成另外两种化合物的反应。
电化学方程式

电化学方程式work Information Technology Company.2020YEAR【原电池】1.Cu─H2SO4─Zn原电池正极: 2H+ + 2e- H2↑负极: Zn─2e- Zn2+总反应式: Zn + 2H+ Zn2+ + H2↑Cu─CuSO4─Zn原电池正极: Cu2+ + 2e-Cu负极: Zn─2e- Zn2+总反应式: Zn + Cu2+ Zn2+ +Cu2.Cu─FeCl3─C原电池正极: 2Fe3+ + 2e- 2Fe2+负极: Cu ─ 2e- == Cu2+总反应式: 2Fe3+ + Cu 2Fe2+ + Cu2+3.钢铁在潮湿的空气中发生吸氧腐蚀正极:O2 + 2H2O + 4e- 4OH-负极:2Fe ─ 4e- = 2Fe2+总反应式:2Fe + O2 + 2H2O 2F e(O H)2↓[F e(O H)2最终转变为铁锈]4.析氢腐蚀(酸性)负极:Fe–2e-=Fe2+正极:2H++2e-=H2↑总反应:Fe+2H+=Fe2+ +H2↑5.氢氧燃料电池(酸性介质)正极:O2 + 4H+ + 4e- 2H2O负极:2H2─4e-4H+总反应式:2H2 + O22H2O6.氢氧燃料电池(碱性介质)正极:O2 + 2H2O + 4e-4OH-负极:2H2─ 4e- + 4OH-4H2O总反应式:2H2 + O22H2O7.氢氧燃料电池(熔融氧化物O2-介质)正极:O2 + 4e-2O2-负极:2H2─ 4e- + 2O2-2H2O总反应式:2H2 + O22H2O8.铅蓄电池(放电)正极 (PbO2) :PbO2 + 2e- + SO42- + 4H+PbSO4↓ + 2H2O 负极 (Pb) :Pb ─2e- + SO42- PbSO4↓总反应式:Pb + PbO2 + 4H+ + 2SO42- 2PbSO4↓ + 2H2O 9.Al─NaOH─Mg原电池正极:2H2O + 2e-H2↑ + 2OH-负极:Al─3e- + 4OH- == AlO2- + 2H2O总反应式:2Al + 2OH- + 2H2O == 2AlO2- + 3H2↑10.CH4燃料电池(碱性介质)正极:O2 + 2H2O + 4e-4OH-负极:CH4─8e- + 10OH- CO32- + 7H2O总反应式:CH4 + 2O2 + 2OH-CO32- + 3H2O11.CH4燃料电池(酸性介质)正极:O 2 + 4H ++ 4e -2H 2O负极:CH 4─8e - + 2H 2O CO 2 + 8H + 总反应式:CH 4 + 2O 2CO 2 + 2H 2O12.CH 4燃料电池(熔融氧化物O 2-介质)正极:O 2 +4e -2O 2-负极:CH 4─8e - + 4 O 2- CO 2 + 2H 2O 总反应式:CH 4 + 2O 2CO 2 + 2H 2O13.CH 4燃料电池(熔融碳酸盐介质)正极:O 2 + 2 CO 2 + 4e - 2CO 32- 负极:CH 4─8e - + 4CO 32- 5CO 2+ 2H 2O 总反应式:CH 4 + 2O 2 CO 2 + 2H 2O14.熔融碳酸盐燃料电池(Li 2CO 3和Na 2CO 3熔融盐作电解液,CO 作燃料): 正极:O 2 + 2CO 2 + 4e - 2CO 32- (持续补充CO 2气体) 负极:2CO + 2CO 32-─4e - 4CO 2 总反应式:2CO + O 2 2CO 2 15.银锌纽扣电池(碱性介质)正极 (Ag 2O) :Ag 2O + H 2O + 2e - 2Ag + 2OH - 负极 (Zn) :Zn + 2OH -─2e - ZnO + H 2O 总反应式:Zn + Ag 2O ZnO + 2Ag16.Li-SOCl 2电池正极 22244SOCl e Cl S SO --+=++负极Li - e- = Li +总反应式:4Li+2SOCl2 = 4LiCl +S +SO217..Li-电池r-MnO2作正极活性材料,电解液是LiClO4正极Li + + MnO2 + e- = LiMnO2负极Li - e- = Li +总反应式:Li + MnO2 = LiMnO218.CH3OH燃料电池(碱性介质)正极:O2 + 2H2O + 4e-4OH-负极:CH3OH─6e- + 8OH- CO32- + 6H2O总反应式:2CH3OH + 3O2 + 4OH-2CO32- + 6H2O 19.CH3OH燃料电池(酸性介质)正极:O2 + 4H++ 4e-2H2O负极:CH3OH─6e- + H2O CO2 + 6H+总反应式:CH3OH + 2O2 CO2 + 2H2O.20.C2H5OH燃料电池(碱性介质)正极:O2 + 2H2O + 4e-4OH-负极:C2H5OH─12e- + 16OH- 2CO32- + 11H2O总反应式:C2H5OH + 3O2 + 4OH-2CO32- + 5H2O 21.氨气-氧气燃料电池(碱性介质)正极: O2 + 2H2O + 4e-4OH-负极:2NH3 — 6e- + 6OH- =N2 +6H2O总反应式 4NH3+3O2 2N2+6H2O,【电解电极反应式】1.电解CuCl2溶液阳极:2Cl-─2e- Cl2↑阴极:Cu2+ + 2e- Cu总反应式:2Cl- + Cu2+ Cl2↑ + Cu2.电解精炼铜阳极(粗铜):Cu ─2e-Cu2+阴极 (纯铜) :Cu2+ + 2e-Cu总反应式:3.电镀铜阳极(纯铜):Cu─2e-Cu2+阴极(待镀金属,如Fe):Cu2+ + 2e-Cu总反应式:4.电解饱和食盐水阳极:2Cl-─2e-Cl2↑阴极:2H+ + 2e- H2↑总反应式:2Cl- + 2H2O H2↑ + Cl2↑ + 2OH-2NaCl + 2H2O电解2NaOH + H2↑+ Cl2↑7.电解H2SO4溶液阳极:4OH-─4e- O2↑ + 2H2O阴极:4H+ +4e- 2H2↑总反应式:2H2O 2H2↑ + O2↑9.电解CuSO 4溶液阳极:4OH -─4e - O 2↑ + 2H 2O 阴极:2Cu 2+ + 4e - 2Cu总反应式:2Cu 2+ + 2H 2O 2Cu + O 2↑ + 4H +10.电解AgNO 3溶液阳极:4OH -─4e - O 2↑ + 2H 2O 阴极:4Ag + + 4e -4Ag总反应式:4Ag + + 2H 2O 4Ag + O 2↑ + 4H + 11.铅蓄电池充电阳极:PbSO 4─2e - + 2H 2O PbO 2 + SO 42- + 4H +阴极:PbSO 4 + 2e -Pb + SO 42-总反应式:2PbSO 4 + 2H 2O Pb + PbO 2 + 4H + + 2SO 42-12、Fe 3+ + 3H 2OFe(OH)3(胶体) + 3H +13、【Al 的工业制备—电解熔融的Al 2O 3】电解Na 3AlF 62Al 2O 3 4Al+3O 2↑。
无机化学实验报告:Ds区元素(铜、银、锌、镉、汞)

Hg2++4SCN =Hg (SCN) 42
- -
-
Zn2++Hg (SCN) 42 =Zn[Hg (SCN) 4]↓
) (反应速度相当缓慢,如有Zn2+存在时,Co2+与试剂的反应加快。
四、铜、银、汞的氧化还原性。 内容 操作 现象 解释
0.5 mL 0.2 mol·L-1 CuSO4 →过量 6 mol·L-1 NaOH→ → 1mL 10% 葡 萄糖溶液△→ ↓→ 两份 (黄↓→红↓) 2 mol·L-1 H2SO4 →静置→△ 1mL 浓氨水→静 置
[问题讨论] 1、使用汞应注意什么?为什么要用水封存?
1、 选用什么试剂溶解? 物质 试剂 Cu(OH)2 稀 HCl CuS 热稀HNO3 CuBr2 氨水 AgI Na2S2O3
4、区别:Hg(NO3)2 、Hg2(NO3)2、AgNO3 物质 KI 液 过量氨水 Hg(NO3)2 红色↓ 白色↓ Hg2(NO3)2 灰色↓ 灰黑色↓ AgNO3 黄色↓ 先产生白色↓后溶解
2、Hg2+ 转化为Hg22+ 0.2 mol·L-1 Hg2+ →1 滴金属汞 清夜→0.2 mol·L-1NaCl 清夜→0.2 mol·L-1NH3·H2O
金属汞溶解 白色↓ 灰色↓
Hg2+ + Hg=Hg22+ Hg22+ +2Cl =Hg2Cl2↓白色
-
Hg22++2NH3+NO3-=[ NH2 Hg] NO3↓+2Hg↓+NH4+
Ag+
Ag2O 褐↓
HNO3 溶 溶 无色
氨水 溶 NaOH 不溶
Ag2O+ 4NH3 + H2O =2Ag(NH3)2+ +2OH
锌及其化合物及其化合物

锌及其化合物及其化合物Company number:【WTUT-WT88Y-W8BBGB-BWYTT-19998】二十九、锌及其化合物一、锌单质1、组成:Zn2、结构:晶体类型:金属晶体 化学键:金属键3、物理性质:银白色固体4、化学性质:金属性、还原性、可燃性(1)锌在氧气中燃烧:2Zn +O 2点燃 2ZnO (2)锌在氯气中燃烧:Zn +Cl 2点燃 ZnCl 2 (3)锌和单质硫共热:Zn +S △ ZnS(4)锌与稀硫酸反应:Zn +H 2SO 4===ZnSO 4+H 2↑(5)锌与氢氧化钠溶液反应:Zn +2NaOH ===Na 2ZnO 2+H 2↑(6)锌与浓硫酸反应:Zn +2H 2SO 4===ZnSO 4+SO 2↑+2H 2O(7)锌与稀硝酸反应:3Zn +8HNO 3===3Zn(NO 3)2+2NO ↑+4H 2O(8)锌与浓硝酸反应:Zn +4HNO 3===Zn(NO 3)2+2NO 2↑+2H 2O(9)锌与硫酸铜溶液反应:Zn +CuSO 4===ZnSO 4+Cu(10)少量的锌与氯化铁溶液反应:Zn +2FeCl 3===ZnCl 2+2FeCl 2(11)过量的锌与氯化铁溶液反应:3Zn +2FeCl 3===3ZnCl 2+2Fe5、制法:(12)高温下,氧化锌被一氧化碳所还原:ZnO +CO高温 Zn +CO 26用途:作合金二、氧化锌1、组成:化学式:ZnO2、结构:电子式: Zn 2+[:O :]2- 晶体类型:离子晶体 化学键:离子键 ·· ··3、物理性质:白色固体,不溶于水4、化学性质:两性氧化物、氧化性(1)氧化锌与稀硫酸反应:ZnO +H 2SO 4===ZnSO 4+H 2O(2)氧化锌与氢氧化钠溶液反应:ZnO +2NaOH ===Na 2ZnO 2+H 2O(3)氧化锌在高温下与一氧化碳反应:ZnO +CO高温 Zn +CO 2 5、制法:(3)高温煅烧碳酸锌:ZnCO 3高温 ZnO +CO 2↑6、用途:制备锌三、氢氧化锌1、组成:化学式:Zn(OH)22、结构:电子式:[H :O :]-Zn 2+[:O :H]- 晶体类型:离子晶体 化学键:离子键、极性键3、物理性质:白色固体,不溶于水4、化学性质:两性氢氧化物、不稳定性(1)氢氧化锌与稀盐酸反应:Zn(OH)2+2HCl ===ZnCl 2+2H 2O(2)氢氧化锌与氢氧化钠溶液反应:Zn(OH)2+2NaOH ===Na 2ZnO 2+2H 2O(3)氢氧化锌受热分解:Zn(OH)2 △ +H 2O5、制法:(4)硫酸锌溶液和偏锌酸钠溶液混合:ZnSO 4+Na 2ZnO 2+2H 2O ===2Zn(OH)2↓+Na 2SO 46、用途:制备硫酸锌、氯化锌四、硫酸锌1、组成:化学式:ZnSO 4 皓矾:ZnSO 4·7H 2O2、结构:晶体类型:离子晶体 化学键:离子键、极性键·· ···· ··3、物理性质:白色固体,易溶于水4、化学性质:盐、水溶液呈酸性(1)硫酸锌溶于水:ZnSO 4+2H2O Zn(OH)2+H2SO4(2)硫酸锌溶液和氯化钡溶液混合:ZnSO4+BaCl2===ZnCl2+BaSO4↓(3)硫酸锌溶液中加少量氢氧化钠溶液:ZnSO4+2NaOH===Zn(OH)2↓+Na2SO4(4)硫酸锌溶液中加过量量氢氧化钠溶液:ZnSO4+4NaOH===Na2ZnO2+Na2SO4+2H2O(5)硫酸锌溶液中加氨水溶液:ZnSO4+2NH3·H2O===Zn(OH)2↓+(NH4)2SO4(6)硫酸锌溶液中加入硫化钠溶液:ZnSO4+Na2S===ZnS↓+Na2SO4(7)硫酸锌溶液与偏锌酸钠溶液反应:ZnSO4+Na2ZnO2+2H2O===2Zn(OH)2↓+Na2SO4(8)铝和硫酸锌溶液反应:2Al+3ZnSO4===2Al2(SO4)3+3Zn5、制法:(9)锌与稀硫酸反应:Zn+H2SO4===ZnSO4+H2↑6、用途:制备涂料、作电镀液五、偏锌酸钠1、组成:化学式:Na2ZnO22、结构:晶体类型:离子晶体化学键:离子键、极性键3、物理性质:白色固体,易溶于水4、化学性质:盐,水溶液呈碱性:(1)偏锌酸钠溶于水:Na 2ZnO2+2H2O Zn(OH)2+2NaOH(2)偏锌酸钠溶液滴加少量的盐酸:Na2ZnO2+2HCl===Zn(OH)2↓+2NaCl(3)偏锌酸钠溶液滴加过量的盐酸:Na2ZnO2+4HCl===ZnCl2↓+2NaCl+2H2O(4)偏锌酸钠溶液通入少量二氧化碳气体:Na2ZnO2+CO2+H2O===Zn(OH)2↓+Na2CO3(5)偏锌酸钠溶液通入过量二氧化碳气体:Na2ZnO2+2CO2+2H2O===Zn(OH)2↓+2NaHCO3(6)偏锌酸钠溶液和硫酸锌溶液混合:ZnSO4+Na2ZnO2+2H2O===2Zn(OH)2↓+Na2SO45、制法:(7)锌和氢氧化钠溶液反应:61、原因是()A、纯锌和稀硫酸不反应B、纯锌和稀硫酸反应不产生氢气C、粗锌构成原电池,可加快反应进行D、纯锌易形成氧化膜阻碍反应进一步反应2、实验室通常用粗锌和稀硫酸反应而不采用镁、铁和稀硫酸反应制备氢气,理由是()A、镁、铁和稀硫酸不反应B、镁、铁和稀硫酸反应但不生成氢气C、制备等质量的氢气消耗镁、铁的质量大D、镁反应过快,铁反应太慢3、下列各组物质间一定能反应且一定能生成氢气的是()A、铜和稀硝酸B、锌和硫酸溶液C、铁和盐酸D、铜和浓盐酸4、已知氢氧化锌具有两性,是两性氢氧化物,则下列说法不正确的是()A、氢氧化锌与盐酸反应时表现二元碱性质B、氢氧化锌与氢氧化钠溶液反应时表现二元酸的性质C、氢氧化锌与氢氧化钠溶液反应时表现一元酸的性质D、偏锌酸钠的化学式为Na2ZnO25、锌和铝类似,既能和盐酸反应,又能和氢氧化钠溶液反应,下列离子方程式不正确的是()A、锌与氢氧化钠溶液反应:2Zn+2OH-+2H2O===2ZnO2-+3H2↑B、氢氧化锌溶于稀盐酸:Zn(OH)2+2H+===Zn2++2H2OC、氧化锌溶于氢氧化钠:ZnO+2OH-===ZnO22-+H2OD、氧化锌溶于稀硫酸:ZnO+2H+===Zn2++H2O6、为了除去ZnCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂①NH3·H2O;②NaOH;③ZnO;④ZnCl2;⑤Na2CO3;⑥Zn(OH)2;⑦ZnCO3。
铜丝上有银折出的化学方程式

铜丝上有银折出的化学方程式
铜丝上有银折出的化学方程式是指在铜丝表面生成一层银膜的化学反应。
这个反应涉及到铜和银之间的电化学反应,可以用以下化学方程式来描述:
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
在这个方程式中,Cu表示铜,AgNO3表示硝酸银,Cu(NO3)2表示硝酸铜,Ag表示银。
这个反应是通过将铜丝浸泡在含有硝酸银的溶液中进行的。
在溶液中,硝酸银会分解成银离子(Ag+)和硝酸根离子(NO3-)。
当铜丝与银离子接触时,银离子会被还原成纯银,同时铜会被氧化成铜离子。
这个过程是一个氧化还原反应,铜被氧化失去电子,而银被还原获得电子。
在这个反应中,铜丝表面的银膜是通过铜离子和银离子在铜丝表面的反应生成的。
银离子在铜丝表面得到电子还原成纯银,并且与铜离子结合形成银膜。
这个银膜可以起到保护铜丝的作用,防止铜丝被氧化或腐蚀。
这个化学反应在实际应用中具有重要意义。
铜丝上的银膜可以改善铜丝的化学稳定性和电导性能,从而提高铜丝的使用寿命和性能。
银膜可以用于制备电子元件、电路板和导电材料等。
此外,银膜还可以在化学分析和传感器中用作催化剂和电极材料。
总结起来,铜丝上有银折出的化学方程式描述了铜和银之间的电化学反应,通过浸泡铜丝在含有硝酸银的溶液中,使铜被氧化而银被还原生成银膜。
这个反应在实际应用中具有重要意义,可以改善铜丝的性能和使用寿命,广泛应用于电子和化学领域。
铜银锌镉汞实验报告

铜银锌镉汞实验报告篇一:实验七 ds区金属(铜、银、锌、镉汞)实验七 ds区金属(铜、银、锌、镉、汞)一. 目的要求了解铜锌铬汞氧化物氢氧化物的酸碱性。
硫化物的溶解性了解Cu(?)Cu(?)重要化合物的性质及相互转化条件。
试验并熟悉铜银锌铬汞的配位能力及Hg(?)和Hg(?)的转化二. 实验原理三. 操作步骤四. 思考题篇二:无机化学实验二十一 ds区元素(铜银锌镉汞)的性质实验11 ds区元素(铜、银、锌、镉、汞)的性质一、实验目的1、掌握铜、锌氢氧化物的酸碱性;2、掌握铜、银、锌、汞的配合物的生成和性质; 6、掌握铜、银、锌、汞离子的分离与鉴定方法。
二、实验原理IB IIBCu Zn Cu(,2,,1) Zn(+2) Ag Cd Ag(,1)Cd(+2) AuHg Au(,1,,3) Hg(+2,,1)蓝色的Cu(OH)呈现两性,在加热时易脱水而分解为黑色的CuO。
AgOH在常温下极易脱水而转化为棕2色的AgO。
Zn(OH)呈两性,Cd(OH)显碱性,Hg(I, II)的氢氧化物极易脱水而转变为黄色的HgO(II)和黑色222的HgO(I)。
2易形成配合物是这两副族的特性,Cu、Ag、Zn、Cd与过量的氨水反应时分别生成[Cu(NH)]、342++2+2+2+[Ag(NH)]、[Zn(NH)]、[Cd(NH)]。
但是Hg和Hg323434+2+2+2+2+2与过量氨水反应时,如果没有大量的NH存在,4+并不生成氨配离子。
如:HgCl, 2NH, Hg(NH)Cl?白, 2 NHCl2324HgCl, 2NH, Hg(NH)Cl?白, Hg?黑,NHCl (观察为灰色)22324Cu具有氧化性,与I反应,产物不是CuI,而是白色的CuI: 22+,Cu2+, I, 2CuI?白, I2,-将CuCl溶液与铜屑混合,加入浓盐酸,加热可得黄褐色[CuCl] 的溶液。
将溶液稀释,得白色CuCl22沉淀:Cu , Cu,2+, 4Cl, 2[CuCl]2,, ,[CuCl]?稀释?CuCl?白, Cl2卤化银难溶于水,但可利用形成配合物而使之溶解。
铜银锌及其化合物的化学方程式和离子方程式

铜银锌及其化合物的化学方程式和离子方程式一、铜1、铜在氯气中燃烧:Cu+Cl2CuCl22、铜和氧气加热:2Cu+O22CuO3、铜与硫共热:2Cu+S Cu2S4、铜绿的形成:2Cu+O2+CO2+H2O Cu2OH2 CO34、铜与浓硫酸共热:Cu+2H2SO4CuSO4+SO2↑+2H2O5、铜与浓硝酸反应:Cu+4HNO3CuNO32+2NO2↑+2H2OCu+4H++2NO3-Cu2++2NO2↑+2H2O6、铜和稀硝酸反应:3Cu+8HNO33CuNO32+2NO ↑+4H2O3Cu+8H++2NO3-3Cu2++2NO ↑+4H2O7、铜与硝酸银溶液反应:Cu+2AgNO3CuNO32+2AgCu+2Ag+Cu2++2Ag8、铜与氯化铁溶液反应:Cu+2FeCl32FeCl2+CuCl2Cu+2Fe3+2Fe2++Cu2+二、氧化铜1、氢气通过灼热的氧化铜:CuO+H2Cu+H2O2、铝与氧化铜高温反应:3CuO+2Al3Cu+Al2O33、一氧化碳与氧化铜共热:CuO+CO Cu+CO24、碳粉与氧化铜共热:2CuO+C2Cu+CO2↑5、氧化铜与硫酸反应:CuO+H2SO4CuSO4+H2OCuO+2H+Cu2++H2O6、氧化铜与氯化铁溶液反应:3CuO+2FeCl3+3H2O2FeOH3+3CuCl23CuO+2Fe3++3H2O2FeOH3+3Cu2+三、氢氧化铜1、氢氧化铜溶于稀硫酸:CuOH2+H2SO4CuSO4+2H2OCuOH2+2H+Cu2++2H2O2、氢氧化铜与氯化铁溶液反应:3CuOH2+2FeCl32FeOH3+3CuCl23CuOH2+2Fe3+2FeOH3+3Cu2+3、加热氢氧化铜:CuOH2CuO+H2O四、硫酸铜1、硫酸铜溶液与氯化钡溶液反应:CuSO4+BaCl2CuCl2+BaSO4↓Ba2++SO42-BaSO4↓2、硫酸铜溶液与硫化钠溶液反应:CuSO4+Na2S CuS↓+Na2SO4Cu2++S2-CuS ↓3、硫酸铜与碳酸钠溶液反应:CuSO4+Na2CO3CuCO3↓+Na2SO4Cu2++CO32-CuCO3↓4、硫酸铜溶液呈酸性:CuSO4+2H2O CuOH2+H2SO4Cu2++2H2O CuOH2+2H+5、硫酸铜溶液与氢氧化钠溶液反应:CuSO4+2NaOH CuOH2↓+Na2SO4Cu2++2OH-CuOH2↓6、硫酸铜溶液中加入氨水:CuSO4+2NH3·H2O CuOH2↓+NH42SO4Cu2++2NH3·H2O CuOH2↓+2NH4+7、硫酸铜溶液和偏铝酸钠溶液混合:CuSO4+2NaAlO2+4H2O CuOH2↓+2AlOH3↓+Na2SO4Cu2++2AlO2-+4H2O CuOH2↓+2AlOH3↓8、硫酸铜溶液中加入锌:Zn+CuSO4ZnSO4+CuZn+Cu2+Zn2++Cu9、铁和硫酸铜溶液反应:Fe+CuSO4FeSO4+CuFe+Cu2+Fe2++Cu10、加热硫酸铜晶体:CuSO4·5H2O CuSO4+5H2O11、水蒸气通过无水硫酸铜:CuSO4+5H2O CuSO4·5H2O五、银1、银与浓硝酸反应:Ag+2HNO3AgNO3+NO2↑+H2OAg+2H++NO3-Ag++NO2↑+H2O2、银与稀硝酸反应:3Ag+4HNO33AgNO3+NO ↑+2H2O3Ag+4H++NO3-3Ag++NO↑+2H2O六、硝酸银1、硝酸银溶液与氯化钠溶液反应:AgNO3+NaCl AgCl↓+NaNO3Ag++Cl-AgCl↓2、硝酸银溶液与溴化钠溶液反应:AgNO3+NaBr AgBr↓+NaNO3Ag++Br-AgBr↓3、硝酸银溶液与碘化钾溶液反应:AgNO3+KI AgI↓+KNO3Ag++I-AgI↓4、硝酸银溶液和硫化钠溶液反应:2AgNO3+Na2S Ag2S↓+2NaNO32Ag++S2-Ag2S↓5、硝酸银溶液呈酸性:AgNO3+H2O AgOH+HNO3Ag++H2O AgOH+H+6、向硝酸银溶液加入氢氧化钠溶液:AgNO3+NaOH AgOH↓+NaNO3Ag++OH-AgOH↓7、硝酸银溶液中加入少量氨水:AgNO3+NH3·H2O AgOH↓+NH4NO3Ag++NH3·H2O AgOH↓+NH4+8、硝酸银溶液加入过量氨水:AgNO3+2NH3·H2O AgNH32NO3+2H2OAg++2NH3·H2O AgNH32++2H2O9、铜与硝酸银溶液反应:Cu+2AgNO 3CuNO32+2AgCu+2Ag +Cu2++2Ag见光或受热10、硝酸银见光分解:2AgNO 32Ag+2NO2↑+O2↑七、锌1、锌在氯气在燃烧:Zn+Cl2ZnCl22、锌与氧气共热:2Zn+O22ZnO3、锌与硫共热:Zn+S ZnS4、锌与浓硫酸反应:Zn+2H2SO4ZnSO4+SO2↑+2H2O5、锌与浓硝酸反应:Zn+4HNO3ZnNO32+2NO2↑+2H2OZn+4H++2NO3-Zn2++2NO2↑+2H2O6、锌和稀硝酸反应:3Zn+8HNO33ZnNO32+2NO ↑+4H2O3Zn+8H++2NO3-3Zn2++2NO ↑+4H2O 7、锌与硝酸银溶液反应:Zn+2AgNO3ZnNO32+2AgZn+2Ag+Zn2++2Ag8、硫酸铜溶液中加入锌:Zn+CuSO4ZnSO4+CuZn+Cu2+Zn2++Cu9、少量的锌和氯化铁溶液反应:Zn+2FeCl32FeCl2+ZnCl2Zn+2Fe3+2Fe2++Zn2+10、过量的锌与氯化铁溶液反应:3Zn+2FeCl33ZnCl2+2Fe3Zn+2Fe3+3Zn2++2Fe八、氧化锌1、氢气通过灼热的氧化锌:ZnO+H2Zn+H2O2、铝与氧化锌高温反应:3ZnO+2Al3Zn+Al2O33、一氧化碳与氧化锌高温反应:ZnO+CO Zn+CO24、碳粉与氧化锌高温反应:2ZnO+C2Zn+CO2↑5、氧化锌与硫酸反应:ZnO+H2SO4ZnSO4+H2OZnO+2H+Zn2++H2O6、氧化锌与氯化铁溶液反应:3ZnO+2FeCl3+3H2O2FeOH3+3ZnCl23ZnO+2Fe3++3H2O2FeOH3+3Zn2+九、氢氧化锌1、氢氧化锌溶于稀硫酸:ZnOH2+H2SO4ZnSO4+2H2OZnOH2+2H+Zn2++2H2O2、氢氧化锌与氯化铁溶液反应:3ZnOH2+2FeCl32FeOH3+3ZnCl23ZnOH2+2Fe3+2FeOH3+3Zn2+3、加热氢氧化锌:ZnOH2ZnO+H2O十、硫酸锌1、硫酸锌溶液与氯化钡溶液反应:ZnSO4+BaCl2ZnCl2+BaSO4↓Ba2++SO42-BaSO4↓2、硫酸锌溶液与硫化钠溶液反应:ZnSO4+Na2S ZnS↓+Na2SO4Zn2++S2-ZnS ↓3、硫酸锌与碳酸钠溶液反应:ZnSO4+Na2CO3ZnCO3↓+Na2SO4Zn2++CO32-ZnCO3↓4、硫酸锌溶液呈酸性:ZnSO4+2H2O ZnOH2+H2SO4Zn2++2H2O ZnOH2+2H+5、硫酸锌溶液与氢氧化钠溶液反应:ZnSO4+2NaOH ZnOH2↓+Na2SO4Zn2++2OH-ZnOH2↓6、硫酸锌溶液中加入氨水:ZnSO4+2NH3·H2O ZnOH2↓+NH42SO4Zn2++2NH3·H2O ZnOH2↓+2NH4+7、硫酸锌溶液和偏铝酸钠溶液混合:ZnSO4+2NaAlO2+4H2O ZnOH2↓+2AlOH3↓+Na2SO4Zn2++2AlO2-+4H2O ZnOH2↓+2AlOH3↓8、硫酸锌溶液中加入镁:Mg+ZnSO4MgSO4+ZnMg+Zn2+Mg2++Zn。
锌与盐酸的离子方程式

锌与盐酸的离子方程式
锌与稀盐酸反应的离子方程式;Zn + 2H+ = Zn2+ + H2↑。
锌(Zinc)是一种化学元素,它的化学符号是Zn,它的原子序数是30,在化学元素周期表中位于第4周期、第ⅡB族。
锌是一种浅灰色的过渡金属,也是第四"常见"的金属。
基本信息
锌,它的名称“zinc”来源于拉丁文Zincum,意思是“白色薄层”或“白色沉积物”。
化学符号是Zn,它的原子序数是30,原子量为65.38。
锌是一种银白色略带淡蓝色金属,密度为7.14g/cm3,熔点为419.5℃。
在室温下,性较脆;100~150℃时,变软;超过200℃后,又变干。
锌的化学性质活泼,在常温下的空气中,表面生成一层薄而致密的碱式碳酸锌膜,可阻止进一步氧化。
当温度达到225℃后,锌剧烈氧化。
锌在空气中很难燃烧,在氧气中发出强烈白光。
锌表面有一层氧化锌,燃烧时冒出白烟,白色烟雾的主要成分是氧化锌,不仅阻隔锌燃烧,会折射焰色形成惨白光芒。
锌易溶于酸,也易从溶液中置换金、银、铜等。
锌的氧化膜熔点高,但金属锌熔点却很低,所以在酒精灯上加热锌片,锌片熔化变软,却不落下,正是因为氧化膜的作用。
锌主要用于钢铁、冶金、机械、电气、化工、轻工、军事和医药等领域。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
铜银锌及其化合物的化学方程式和离子方程式
一、铜
1、铜在氯气中燃烧:Cu+Cl2CuCl2
2、铜和氧气加热:2Cu+O22CuO
3、铜与硫共热:2Cu+S Cu2S
4、铜绿的形成:2Cu+O2+CO2+H2OCu2(OH)2 CO3
4、铜与浓硫酸共热:Cu+2H2SO4CuSO4+SO2↑+2H2O
5、铜与浓硝酸反应:Cu+4HNO3Cu(NO3)2+2NO2↑+2H2O
Cu+4H++2NO3-Cu2++2NO2↑+2H2O
6、铜和稀硝酸反应:3Cu+8HNO33Cu(NO3)2+2NO ↑+4H2O
3Cu+8H++2NO3-3Cu2++2NO ↑+4H2O
7、铜与硝酸银溶液反应:Cu+2AgNO3Cu(NO3)2+2Ag
Cu+2Ag+Cu2++2Ag
8、铜与氯化铁溶液反应:Cu+2FeCl32FeCl2+CuCl2
Cu+2Fe3+2Fe2++Cu2+
二、氧化铜
1、氢气通过灼热的氧化铜:CuO+H2Cu+H2O
2、铝与氧化铜高温反应:3CuO+2Al3Cu+Al2O3
3、一氧化碳与氧化铜共热:CuO+CO Cu+CO2
4、碳粉与氧化铜共热:2CuO+C2Cu+CO2↑
5、氧化铜与硫酸反应:CuO+H2SO4CuSO4+H2O
CuO+2H+Cu2++H2O
6、氧化铜与氯化铁溶液反应:3CuO+2FeCl3+3H2O2Fe(OH)3+3CuCl2
3CuO+2Fe3++3H2O2Fe(OH)3+3Cu2+
三、氢氧化铜
1、氢氧化铜溶于稀硫酸:Cu(OH)2+H2SO4CuSO4+2H2O
Cu(OH)2+2H+Cu2++2H2O
2、氢氧化铜与氯化铁溶液反应:3Cu(OH)2+2FeCl32Fe(OH)3+3CuCl2
3Cu(OH)2+2Fe3+2Fe(OH)3+3Cu2+
3、加热氢氧化铜:Cu(OH)2CuO+H2O
四、硫酸铜
1、硫酸铜溶液与氯化钡溶液反应:CuSO4+BaCl2CuCl2+BaSO4↓
Ba2++SO42-BaSO4↓
2、硫酸铜溶液与硫化钠溶液反应:CuSO4+Na2SCuS↓+Na2SO4
Cu2++S2-CuS ↓
3、硫酸铜与碳酸钠溶液反应:CuSO4+Na2CO3CuCO3↓+Na2SO4
Cu2++CO32-CuCO3↓
4、硫酸铜溶液呈酸性:CuSO 4+2H2O Cu(OH)2+H2SO4
Cu2++2H 2O Cu(OH)2+2H+
5、硫酸铜溶液与氢氧化钠溶液反应:CuSO4+2NaOHCu(OH)2↓+Na2SO4
Cu2++2OH-Cu(OH)2↓
6、硫酸铜溶液中加入氨水:CuSO4+2NH3·H2OCu(OH)2↓+(NH4)2SO4
Cu2++2NH3·H2OCu(OH)2↓+2NH4+
7、硫酸铜溶液和偏铝酸钠溶液混合:
CuSO4+2NaAlO2+4H2OCu(OH)2↓+2Al(OH)3↓+Na2SO4
Cu2++2AlO2-+4H2OCu(OH)2↓+2Al(OH)3↓
8、硫酸铜溶液中加入锌:Zn+CuSO4ZnSO4+Cu
Zn+Cu2+Zn2++Cu
9、铁和硫酸铜溶液反应:Fe+CuSO4FeSO4+Cu
Fe+Cu2+Fe2++Cu
10、加热硫酸铜晶体:CuSO4·5H2O CuSO4+5H2O
11、水蒸气通过无水硫酸铜:CuSO4+5H2OCuSO4·5H2O
五、银
1、银与浓硝酸反应:Ag+2HNO3AgNO3+NO2↑+H2O
Ag+2H++NO3-Ag++NO2↑+H2O
2、银与稀硝酸反应:3Ag+4HNO33AgNO3+NO ↑+2H2O
3Ag+4H++NO3-3Ag++NO↑+2H2O
六、硝酸银
1、硝酸银溶液与氯化钠溶液反应:AgNO3+NaClAgCl↓+NaNO3
Ag++Cl-AgCl↓
2、硝酸银溶液与溴化钠溶液反应:AgNO3+NaBrAgBr↓+NaNO3
Ag++Br-AgBr↓
3、硝酸银溶液与碘化钾溶液反应:AgNO3+KIAgI↓+KNO3
Ag++I-AgI↓
4、硝酸银溶液和硫化钠溶液反应:2AgNO3+Na2SAg2S↓+2NaNO3
2Ag++S2-Ag2S↓
5、硝酸银溶液呈酸性:AgNO 3+H2O AgOH+HNO3
Ag++H2OAgOH+H+
6、向硝酸银溶液加入氢氧化钠溶液:AgNO3+NaOHAgOH↓+NaNO3
Ag++OH-AgOH↓
7、硝酸银溶液中加入少量氨水:AgNO3+NH3·H2OAgOH↓+NH4NO3
Ag++NH 3·H2O AgOH↓+NH4+
8、硝酸银溶液加入过量氨水:AgNO3+2NH3·H2OAg(NH3)2NO3+2H2O
Ag++2NH3·H2OAg(NH3)2++2H2O
9、铜与硝酸银溶液反应:Cu+2AgNO3Cu(NO3)2+2Ag
Cu+2Ag+Cu2++2Ag
见光或受热
10、硝酸银见光分解:2AgNO 32Ag+2NO2↑+O2↑
七、锌
1、锌在氯气在燃烧:Zn+Cl2ZnCl2
2、锌与氧气共热:2Zn+O22ZnO
3、锌与硫共热:Zn+S ZnS
4、锌与浓硫酸反应:Zn+2H2SO4ZnSO4+SO2↑+2H2O
5、锌与浓硝酸反应:Zn+4HNO3Zn(NO3)2+2NO2↑+2H2O
Zn+4H++2NO3-Zn2++2NO2↑+2H2O
6、锌和稀硝酸反应:3Zn+8HNO33Zn(NO3)2+2NO ↑+4H2O
3Zn+8H++2NO3-3Zn2++2NO ↑+4H2O
7、锌与硝酸银溶液反应:Zn+2AgNO3Zn(NO3)2+2Ag
Zn+2Ag+Zn2++2Ag
8、硫酸铜溶液中加入锌:Zn+CuSO4ZnSO4+Cu
Zn+Cu2+Zn2++Cu
9、少量的锌和氯化铁溶液反应:Zn+2FeCl32FeCl2+ZnCl2
Zn+2Fe3+2Fe2++Zn2+
10、过量的锌与氯化铁溶液反应:3Zn+2FeCl33ZnCl2+2Fe
3Zn+2Fe3+3Zn2++2Fe
八、氧化锌
1、氢气通过灼热的氧化锌:ZnO+H2Zn+H2O
2、铝与氧化锌高温反应:3ZnO+2Al3Zn+Al2O3
3、一氧化碳与氧化锌高温反应:ZnO+CO Zn+CO2
4、碳粉与氧化锌高温反应:2ZnO+C2Zn+CO2↑
5、氧化锌与硫酸反应:ZnO+H2SO4ZnSO4+H2O
ZnO+2H+Zn2++H2O
6、氧化锌与氯化铁溶液反应:3ZnO+2FeCl3+3H2O2Fe(OH)3+3ZnCl2
3ZnO+2Fe3++3H2O2Fe(OH)3+3Zn2+
九、氢氧化锌
1、氢氧化锌溶于稀硫酸:Zn(OH)2+H2SO4ZnSO4+2H2O
Zn(OH)2+2H+Zn2++2H2O
2、氢氧化锌与氯化铁溶液反应:3Zn(OH)2+2FeCl32Fe(OH)3+3ZnCl2
3Zn(OH)2+2Fe3+2Fe(OH)3+3Zn2+
3、加热氢氧化锌:Zn(OH)2ZnO+H2O
十、硫酸锌
1、硫酸锌溶液与氯化钡溶液反应:ZnSO4+BaCl2ZnCl2+BaSO4↓
Ba2++SO42-BaSO4↓
2、硫酸锌溶液与硫化钠溶液反应:ZnSO4+Na2SZnS↓+Na2SO4
Zn2++S2-ZnS ↓
3、硫酸锌与碳酸钠溶液反应:ZnSO4+Na2CO3ZnCO3↓+Na2SO4
Zn2++CO32-ZnCO3↓
4、硫酸锌溶液呈酸性:ZnSO 4+2H2O Zn(OH)2+H2SO4
Zn2++2H 2O Zn(OH)2+2H+
5、硫酸锌溶液与氢氧化钠溶液反应:ZnSO4+2NaOHZn(OH)2↓+Na2SO4
Zn2++2OH-Zn(OH)2↓
6、硫酸锌溶液中加入氨水:ZnSO4+2NH3·H2OZn(OH)2↓+(NH4)2SO4
Zn2++2NH3·H2OZn(OH)2↓+2NH4+
7、硫酸锌溶液和偏铝酸钠溶液混合:
ZnSO4+2NaAlO2+4H2OZn(OH)2↓+2Al(OH)3↓+Na2SO4
Zn2++2AlO2-+4H2OZn(OH)2↓+2Al(OH)3↓
8、硫酸锌溶液中加入镁:Mg+ZnSO4MgSO4+Zn
Mg+Zn2+Mg2++Zn。
