乙炔炔烃
乙炔 炔烃

乙炔炔烃【重点】1.乙炔的结构和化学性质2.炔烃的通式和性质【重点讲解】一、乙炔的结构、实验室制法和化学性质:1.结构(1)四式:分子式:C2H2电子式:结构式:H-C≡C-H结构简式:CH≡CH(2)空间构型:直线型,呈对称结构故为非极性分子。
(3)键参数:键长:1.20×10-10m(比单键和双键都短)键角:180°键能:812kJ/mol(不等于三个单键键能之和,分子中有两个键比较弱)2.实验室制法:(1)药品:电石(CaC2碳化钙)和水(2)装置:固+液→气(不加热)与H2、CO2、H2S制取装置相似(3)反应原理:(4)收集:由于乙炔的分子量(26)略小于空气的平均分子量,故不用排气法收集;乙炔微溶于水,可用排水取气法收集。
(5)注意事项:a.原理和特点:尽管它是用块状固体与液体反应且不需加热,但实验室不能用启普发生器其原因有三点:①该反应较剧烈,不易控制。
②反应放出的大量热,易损坏启普发生器(受热不均而炸裂)。
③反应后生成的石灰乳是糊状,可夹带少量CaC2进入启普发生器底部,堵住球形漏斗和底部容器之间的空隙,使启普发生器失去作用。
b.因此实验室一般用简易装置制备乙炔。
一般情况下用电石得的乙炔气中夹杂着H2S、PH3、AsH3等特殊臭味的气体,可用CuSO4溶液或NaOH溶液除去杂质气体。
c.为得到平稳乙炔气流,控制反应速度,可用饱和食盐水代替水,用分液漏斗控制流速,并加棉花,防止泡沫喷出。
3.化学性质:(1)氧化反应:a.可燃性:2C2H2+5O24CO2+2H2O(液)+2600kJ现象:火焰明亮、带浓烟, 燃烧时火焰温度很高(>3000℃),用于气焊和气割。
其火焰称为氧炔焰。
b.被KMnO4氧化:能使紫色酸性高锰酸钾溶液褪色。
(2)加成反应:可以跟Br2, H2, HX等多种物质发生加成反应。
如:现象:溴水褪色或Br2的CCl4溶液褪色所以可用酸性KMnO4溶液或溴水褪色区别烷烃。
乙炔炔烃课件(增加多场景)

乙炔炔烃课件一、乙炔概述乙炔,化学式为C2H2,是一种无色、易燃、有刺激性气味的烃类化合物。
在常温常压下,乙炔是一种气体,但可以通过压缩或冷却的方式转化为液态。
乙炔分子由两个碳原子和两个氢原子组成,分子结构为直线型,碳原子之间通过三键连接,属于炔烃类化合物。
乙炔的相对分子质量为26.04,密度约为1.17kg/m³,沸点为-84℃,熔点为-103℃。
乙炔在空气中的爆炸极限为2.5%-80%,与空气混合时容易发生爆炸。
二、乙炔的制备1.电石法:电石(CaC2)与水反应乙炔,是目前工业上主要的乙炔制备方法。
反应方程式为:CaC2+2H2O→C2H2+Ca(OH)2。
该反应放热,产生的乙炔气体需经过净化、干燥等处理,才能用于后续的化学反应。
2.煤焦油裂解法:将煤焦油加热至700℃左右,通过热裂解反应乙炔。
该方法在20世纪初曾广泛用于乙炔的生产,但由于环境污染和资源浪费等问题,逐渐被电石法所取代。
3.天然气部分氧化法:将天然气与氧气混合,在高温、高压条件下进行部分氧化反应,乙炔。
该方法的优点是原料来源广泛,但设备投资较高。
4.石油裂解法:在石油裂解过程中,部分烃类化合物经高温裂解乙炔。
该方法在石油化工领域得到广泛应用。
三、乙炔的化学性质1.加成反应:乙炔分子中的三键容易发生加成反应,如与氢气、卤素、水等反应。
加成反应是乙炔在工业上的重要应用之一。
2.聚合反应:乙炔可以通过聚合反应聚乙炔,聚乙炔是一种导电聚合物,具有广泛的应用前景。
3.氧化反应:乙炔可以与氧气发生氧化反应,二氧化碳和水。
乙炔燃烧时,火焰明亮,温度较高,可用于焊接、切割金属等。
4.酸碱反应:乙炔分子中的三键容易与路易斯酸发生反应,形成加成产物。
乙炔还可以与碱金属反应,乙炔基金属化合物。
四、乙炔的应用1.金属焊接与切割:乙炔与氧气混合燃烧,产生的火焰温度高达3200℃,可用于焊接和切割金属。
2.化工原料:乙炔是合成许多重要化学品的重要原料,如聚乙烯醇、聚氯乙烯、氯丁橡胶等。
乙炔及炔烃

将气体通过装有NaOH溶液或CuSO4溶液的洗气瓶。
知识应用: 1.如何用最简单的方法鉴别CH4,C2H4,C2H2?
2.以电石、食盐、水及必要的催化剂为原料,制 备聚氯乙烯。写出各步反应的化学方程式。
二、炔烃 1、分子中含有-C≡C- (碳碳三键)的不饱和烃。 2、链状单炔烃的通式:CnH2n-2(n≥2) Ω=2
C2H2 + 2KMnO4 + 3H2SO4→ 2CO2+2MnSO4+ K2SO4+4H2O
⑵加成反应——乙炔能使溴水褪色。
CH≡CH + Br2 → CHBr=CHBr
1, 2—二溴乙烯
1, 1, 2, 2—四溴乙烷
若乙炔与足量的溴水反应: CH≡CH + 2Br2 → CHBr2CHBr2
1, 1, 2, 2—四溴乙烷
(2)碳链异构 (3)三键位置异构
思考:
1、写出C5H8的同分异构体。 2、写出相对分子质量是82的属于炔烃的同分 异构体的结构简式,并用系统命名法命名。
请你接招:
1、含有一个三键的炔烃,加氢后产物的结构简
式为
碳碳三键只能
在伯仲之间,
碳碳双键不在
此炔烃可能的结构有( B )
季碳周围。
A.1种 B.2种 C.3种 D.4种
A. 异丁烷 C. 丙烷
B. 乙烷 D. 丁烷
CH3—CH—CH—C ≡ CH CH3 CH3
— CH ≡ C—CH—CH CH3
CH3 C2H5
3,4-二甲基-1-己炔
⑷
— CH3—CH2—CH—CH CH2—CH3
CH3 C
乙炔炔烃PPT课件13 人教版

两个不牢固的共价键易断裂
实验一:将乙炔气体通入酸性高锰酸钾中
现象:酸性的高锰酸钾溶液褪色
实验二:将乙炔气体通入溴水中
现象: 溴水褪色
实验三:将乙炔气体点燃,观察火焰颜色 (验纯后再点燃)
为什么?
现象: 火焰比乙烯明亮,会有浓浓烈的黑烟
小 知
氧炔焰:乙炔燃烧放出大量的热,在O2中燃
识 烧,产生的氧炔焰温度高达3000℃以上,可
1.药品:碳化钙(CaC2、俗名:电石)、水 2.反应原理:CaC2+2H2O→ HC≡CH ↑+Ca(OH)2 3.装置:固-液不加热制取气体装置
可供选用的装置
A
B
C
为什么不用启普发生器制取乙炔?
1、 因为碳化钙与水反应剧烈,启普发生器不 易控制反应; 2、反应放出大量热,启普发生器是厚玻璃壁 仪器,容易因胀缩不均,引起破碎 ;
•
6、小组同学利用器官图片来摆一摆, 一起讨 论这些 器官怎 样协同 工作的 。现在 开始吧 。
氯乙烯
n CH2=CH 催化剂 -CH2-CH-n
Cl
Cl
聚氯乙烯
聚氯乙烯是一种合成树脂,用于制备塑料和合成 纤维。
五.乙炔的用途
小结
本节主要学习乙炔的结构、重要性质。
O2
氧化反应 点燃
CO2 + H2O
酸性
乙
KMnO4溶液
褪色
炔
(BCr2l2)CHBr=CHBr(BCrl22)CHBr2-CHBr2
用于切割、焊接金属。
氧炔焰切割金属
焊枪
甲烷 淡蓝色火焰
乙烯
乙炔
火焰明亮有黑烟 火焰明亮有浓烈黑烟
(1) 氧化反应
高二化学乙炔炔烃知识点

高二化学乙炔炔烃知识点炔烃是烃类化合物中的一类,具有双键或三键的碳链结构。
在炔烃中,我们重点学习的是乙炔。
乙炔(C2H2)是一种有机化合物,也被称为乙炔气。
乙炔是无色、有刺激气味的气体,具有高燃烧性和不稳定性。
在化学中,乙炔是非常重要的一种物质,具有广泛的应用。
本文将介绍乙炔炔烃的相关知识点。
一、乙炔的物理性质乙炔是无色气体,具有特殊的气味。
它的密度比空气小,能够溶于乙炔解气器中的有机溶剂。
乙炔的熔点为-80.8℃,沸点为-84℃。
乙炔可以被液化,并且在常温下可以被压缩。
由于乙炔是不稳定的,容易聚集形成爆炸性的混合物,因此在储存和使用乙炔时需要特别谨慎。
二、乙炔的制取方法乙炔的制取方法主要有两种:一种是通过煤炭焦化产生的煤气制取乙炔,另一种是通过石油cracking过程中的副产物制取乙炔。
其中较为常用的是通过煤炭焦化产生的煤气制取乙炔的方法。
该方法是将煤气经过净化处理后,再通过加热去饱和来制取乙炔。
三、乙炔的化学性质1. 燃烧性:乙炔具有高燃烧性,能与空气中的氧气发生剧烈反应,产生大量的热和光。
乙炔的燃烧反应是一个放热反应,释放出的热量可以使石棉变红并熔化。
乙炔燃烧生成的产物有水和二氧化碳。
2. 加氢反应:乙炔可以与氢气发生加氢反应,生成乙烯,并放出大量的热量。
这个反应是一个吸热反应,需要在催化剂的存在下进行。
3. 反应性:由于乙炔中碳原子上的双键非常活泼,因此乙炔具有较高的反应活性。
它可以与卤素直接反应,生成相应的卤代烃。
乙炔还可以通过加成反应生成醇、醛、酮等化合物。
四、乙炔的应用领域1. 焊接和切割:乙炔可以与氧气在高温条件下进行燃烧,产生高温火焰,因此被广泛应用于金属焊接和切割的行业。
乙炔的高温火焰可以熔化金属,并将其焊接在一起,同时也可以切割金属。
2. 化学合成:乙炔是有机化学合成中的重要原料。
它可以通过加成反应合成醇、醛、酮等化合物,也可以通过聚合反应生成聚乙炔等高分子化合物。
3. 实验室研究:由于乙炔的独特性质,它在实验室中被广泛用于研究和分析。
乙炔和炔烃
1)乙炔的实验室制法:
A.原料:CaC2 (电石)与H2O
B、反应原理:
CaC2+ 2H2O C2H2↑+Ca(OH)2 ;△H<0
Ca2+ C C
2
CaC2,属于离子化合物,电子式为
2C: HOH 2+ Ca + HOH C:
C H + Ca(OH)2 C H
C.装置: E.净化:
D.收集方法
学与问
石油分馏是利用石油中各组分的沸点不 同而加以分离的技术。 分为常压分馏和减压分馏, 常压分馏可以得到石油气、汽油、煤油、 柴油和重油;重油再进行减压分馏可以得到 润滑油、凡士林、石蜡等。 减压分馏是利用低压时液体的沸点降低 的原理,使重油中各成分的沸点降低而进行 分馏,避免高温下有机物的炭化。
五、炔烃
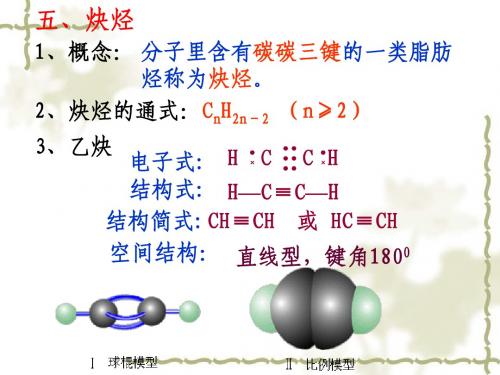
1、概念: 分子里含有碳碳三键的一类脂肪 烃称为炔烃。 2、炔烃的通式:CnH2n-2 (n≥2) 3、乙炔 电子式: H C C H 结构式: H—C≡C—H 结构简式: CH≡CH 或 HC≡CH 空间结构: 直线型,键角1800
● × ● × ●● ●● ●●
乙炔分子中碳碳叁键的键能比三个单键的 键能要小,也比一个单键和一个双键键能之 和小。因此乙炔分子中的碳碳叁键里的两个 键容易断裂。
石油的催化裂化是将重油成分(如石油) 在催化剂存在下,在460~520℃及100kPa~ 200kPa的压强下,长链烷烃断裂成短链烷烃和 烯烃,从而大大提高汽油的产量。
石油裂解是深度的裂化,使短链的烷 烃进一步分解生成乙烷、丙烷、丁烯等重 要石油化工原料。 石油催化重整的目的有两个:提高汽 油的辛烷值和制取芳香烃。
下列哪种装置可以用来做为乙炔的收集装置?
乙炔 炔烃
10. .由A、B两种烃组成的混合物,当 混合物总质量一定时,无论A、B以何 种比例混合,完全燃烧消耗氧气的质 量为一恒量。对A、B两种烃有下面几 种说法:①互为同分异构体;②互为 同系物;③具有相同的最简式;④两 种烃中碳的质量分数相同。正确的结 论是 ) D( A.①②③④ B.①③④ C.②③④ D.③④
13.在相同条件下,相同体积的 两种烃蒸气,完全燃烧生成的 CO2体积比为1∶2,生成水蒸气 的体积比为2∶3,则这种烃可能 的组合是(1)________和________; (2)________和________; (3)________和________。
3.通式为CnH2n-2的一种气态烃完
全燃烧后生成CO2和H2O的物质 的量之比为4∶3,这种烃的链状 同分异构体有( B ) A.5种 C.3种 B.4种 D.2种
4. 任取两种烃混合,完全燃烧后 生成 CO2 的物质的量小于水的物 质的量,则两种烃的组合不可能 是( D ) A.烷+烷 B.烷+烯 C.烷+炔 D.烯+烯
•甲烷的部分氧化法 2 CH4 1500 ℃ CHCH + 3ห้องสมุดไป่ตู้2
0.01~0.1s
4 CH4 + O2 CHCH + 2CO + 7H2
乙炔的物理性质 纯净的乙炔是没有颜色、没有臭味、 比空气稍轻、微溶于水、易溶于有机溶 剂的气体。
纯乙炔是无色无臭的气体,由电 石生成的乙炔因常混有PH3、H2S等杂 质而有特殊难闻的臭味,把混合气体 通过盛有碱(常用氢氧化钠)溶液的 洗气瓶,就可以得到较纯净的乙炔气
乙炔的化学性质
• • • • •
1、氧化反应: a.使高锰酸钾酸性溶液紫色褪去。 b.乙炔的可燃性: 2C2H2+5O2→4CO2+2H2O 其现象是:火焰明亮,同时冒浓烟,放热。
必修乙炔炔烃
3)可用简易装置代替,但在导管口应放一团棉 花,避免泡沫从导管中喷出。
Ca2+
C C
2
5、除杂 电石中含有少量硫化钙、砷化钙、磷化钙等杂 质,与水作用时生成H2S、PH3、AsH3等气体 使乙炔有恶臭味。 方法:通常将气体通过CuSO4溶液除去H2S和 PH3,再通过碱石灰除去水蒸气。 了解:电石工业制法-生石灰和焦炭在电炉中高 温反应 高温 CaCO3 CaO + CO2
CaO + 3C
电炉
CaC2 + CO
反应原理: CaC2+2H—OH C2H2↑+Ca(OH)2 +127KJ
练:CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等都 同属离子型碳化物,请通过对CaC2制C2H2的 反应进行思考,从中得到必要的启示,写出下 列反应的产物:
A.ZnC2水解生成: C2H2
△
(低聚)
烃 烷 烃
结构特点
通
式
不饱和度
仅含“C—C” 链状
CnH2n+2 (n≥1) CnH2n (n≥2) 1
烯 烃
含一个“C= C” 单烯烃 链状 二烯烃 环烷烃 炔 烃 含二个“C= C” 链状 仅含“C—C” 环状 含“C≡ C” 链状
CnH2n -2 (n≥3) CnH2n (n≥3)
(3)一定条件下与HX加成
催化剂 CH CH HCl CH 2 CHCl
nCH 2 CHCl — CH 2 — CH — n 聚氯乙烯 加压 | Cl (4)与HCN加成生成丙烯腈
催化剂
催化剂 CH CH HCN CH 2 CH — CN (丙烯腈)
乙炔 炔烃
我国主要 能源资源
煤 石油 天然气 水力
以煤炭为主要能源结构相当一段时间 难以改变. 难以改变.
形成: 形成 煤
远古时代植物经过漫长复杂的变化. 远古时代植物经过漫长复杂的变化.
组成: 组成 由有机物和无机物组成复杂的混合物 C H O S N 微量的 Si Al Ca Fe
氧化剂可用空气,水蒸气. 氧化剂可用空气,水蒸气. 煤的气化. 煤的气化. 得空气煤气或水煤气 (1).将煤炭转化成可替代石油的 (1).将煤炭转化成可替代石油的
乙炔:直线 乙炔:
乙炔 结构表示方法
分子式
C2H2
电子式
H× C C ×H
− ≡ − 结构式 H−C≡C−H
结构简式 CH≡CH
非极性分子(在同一直线上) 非极性分子(在同一直线上)
键能和键长大小比较 键能 键长
C≡C C=C
810.92 Kj/mol 614.46Kj/mol
1.20×10-10 m 1.33×10-10m × 1.54×10-10m ×
溴水和酸性高锰酸钾溶液只能检验饱和键与不饱和键
五、乙炔的用途 1、化工原料 、 2、电石气用于高温切割金属及焊接金属 、
六、炔烃
1、炔烃-----分子里含有 、炔烃 分子里含有C≡C 三键的不饱和烃 分子里含有 2、通式:CnH2n-2 n≥2 、通式: - 3、炔烃物理性质递变规律 、 (1)状态: C2-C4为 气态 )状态: (2)熔沸点与密度:随碳原子数增多熔沸 )熔沸点与密度: 点升高 、密度增大 (3)溶解性:不溶于水,易溶于乙醚、苯、 )溶解性:不溶于水,易溶于乙醚、 四氯化碳等有机溶剂
乙炔
1、物理性质 、 无色、 无色、无臭味气体
炔烃
43乙炔炔烃
43乙炔炔烃一、乙炔的分子组成与结构:1、分子式:C2H22、结构式:H—C≡C—H3、结构简式:CH≡CH4、电子式:H C C H5、空间结构:线形分子,键角为180 °其二氯代物只有一种且为非极性分子。
拓展:凡是叁键周围的4个原子都在一条直线上.如HCN二、物理性质:纯净的乙炔是无色、无臭气体,比空气轻,微溶于水,易溶于有机溶剂。
三、乙炔的化学性质:1、乙炔的氧化反应:①燃烧:现象(火焰明亮,产生浓烟,产物为水及二氧化碳),有何应用?(鉴别乙烯、乙炔)及氧炔焰。
点燃前须验纯。
②由于“—C≡C—”的存在,乙炔可被酸性KMnO4溶液氧化并使其褪色思考:等物质的量乙烷、乙烯、乙炔分别在足量氧气中燃烧,放出的热量谁最多?为什么?谁火焰温度最高?为什么?(乙烷最多,含H原子最多,但火焰温度最高的是乙炔,因为含H原子最少,生成的水最少,水气化吸收的热量最少)2、加成反应逐步加成炔烃的加成反应是由于“—C≡C—”的不饱和性引起的,其加成可以控制条件使其仅停留在加1mol的反应物,当然也可以使叁键与2mol反应物发生加成反应.①加X2(其中可以使溴水褪色). Br2CHBr2CHBr2(溴水的CCl4溶液褪色)注:乙炔使Br2的CCl4溶液褪色与使Br2水褪色现象的不同之处是:使Br2的CCl4溶液褪色后形成均匀液体;使Br2水褪色后得到上下分层的液体,上层为水状,下层为油状。
②加HCl: HCl CH2=CHCl(氯乙烯)③加H2: 2H2CH3CH3④加H2O: (工业制乙醛的方法) H2O CH3CHO(乙醛)思考:如何制取CH2―CHCl? (先将CH=CH与HCl加成,注意条件,再将加成产物与Br2加成)Br Br3、加聚反应:2CH≡CH CH2=CH—C≡CH 3CH≡CHn CH≡CH CH2=CH2四、乙炔的制法1、工业制法:从石油裂解气中分离;利用电石与水作用。
2、实验室制法:①药品:电石与饱和食盐水。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(3)因电石中含有 CaS、Ca3P2等,也会与水 反应,产生H2S、PH3等气体,所以所制乙炔气 体会有难闻的臭味;
(4)如何去除乙炔的臭味呢?请选择合适的装 置和试剂。
NaOH溶液
三、乙炔的化学性质:
1、氧化反应: 明亮的火焰,浓烟
a、点燃燃烧:
2C2H2+5O2→4CO2+2H2O
放出大量的热,温度达3000。C以上,用于气割气焊。
2、药品: 电石(CaC2)和水 注意:
3、装置: 固+液→气
实验室中使用分液漏 斗而不使用长颈漏斗, 因为长颈漏斗不能控 制水的用量。水加太 多,反应会太剧烈。
1、为什么不用启普发生器制取乙炔?
因为碳化钙与水反应剧烈,启普 发生器不易控制反应; 反应放出的热量较多,容易使启 普发生器炸裂。
反应的产物中还有糊状的Ca(OH)2, 它能夹带未反应的碳化钙进入发生器 底部,或堵住球型漏斗和底部容器间的 空隙,使发生器失去作用。
结构式: H—C C—H 结构简式:HC CH
乙炔的空间结构是什么样的?
平面结构:直线型
二、乙炔的物理性质
纯的乙炔是没有颜色、没有气
味的气体。密度是1.16克/升,
比空气稍轻。微溶于水,易溶
于有机溶剂。 思考:根据乙炔物理性质如何收集乙炔气 体?
三、乙炔的实验室制法
1、原理: CaC2+2H-OH→Ca(OH)2+C2H2↑
CH2=CH2 + H2
CHCH + HCl
催化剂 催化剂
CH3CH3
nCH2=CH Cl
催化剂 加温、加压
CH2=CHCl 制备塑料、纤维
CH2CH n Cl
小结
本节学习乙炔的结构、制法、重要性 质和主要用途。
乙炔结构
是含有CC叁键的直线型分子
化学性质
很活泼,可以发生氧化、加成等反应。
注意
乙炔跟空气的混合物遇火会发生爆炸, 在生产和使用乙炔时,必须注意安全。 使酸性KMnO4溶液褪色
b、 被氧化剂氧化
乙烷、乙烯、乙炔的燃烧
2.加成反应
a.与溴的加成
1, 2—二溴乙烯
1, 1, 2, 2—四溴乙烷
b、与H2、HCl等加成,请写出有关加成反应的 化学方程式。 制聚乙烯塑料
催化剂 CHCH + H2 CH2=CH2
复习思考
写出乙烷、乙烯的分子式、电子式、结构式和 结构简式。 乙烷 乙烯 分子式: 电子式 结构式 结构简式: C 2H 6
H H H:C:C:H H HC 2HΒιβλιοθήκη 4H:C::C:H H H
H H
H H
H H
H—C—C—H
C—C —
H H
CH3CH3
CH2=CH2
一、乙炔的分子组成和结构
分子式: C2H2 电子式: H∶C C∶H
