乙炔 炔烃
炔烃
HC
CCH2CH=CH2
4-甲基-2-己炔 4-2-
1-戊烯-4-炔
炔烃分子中同时含有双键和叁键时的命名规则 命名规则: 命名规则 选择含C=C和C≡C的最长碳链为主链,母体称”某烯炔” = 编号:谁近谁优先,相同烯在先
炔
烃
课堂练习
写出下列化合物的结构式或命名 (1) (CH3)3CC CCH2C(CH3)3 (2) C4H9 C C CH3 2,2,6,6-四甲基-3-庚炔 2-庚炔
CH3
CHBr2
Br Br HBr CH C CH2 3 C CH3 Br
炔
4、加水 、
烃
为什么呢? 为什么呢
条件: 条件:5%硫酸汞水溶液和10%硫酸溶液 所生成的烯醇式(CH2=CH–OH)不稳定,将发生分子内重排反应
CH CH + HOH
乙炔
HgSO4 H2SO4
CH2 CH OH
分子重排
CH3 C H O
炔烃是否有顺反异构? 炔烃是否有顺反异构?
杂化的碳上只连接一个基团。 无!因为炔烃的sp杂化的碳上只连接一个基团。
炔 烃烃 炔
二、炔烃的异构现象和命名
炔烃的同分异构现象与烯烃相似 碳链异构 位置异构(无顺反异构) 无顺反异构) 官能团异构 【例如】 1-丁炔 2-丁炔 HC≡C-CH2CH3 CH3-C≡C-CH3
氯化亚铜氨溶液
CH3 C
CCu + NH3 + NH4Cl
此反应可鉴别乙炔和推测端基炔结构
炔
烃
炔烃与卤代烷作用可在炔烃分子中引入烷基: 炔烃与卤代烷作用可在法
炔
烃
课堂练习
写出下列反应的产物: 写出下列反应的产物: (1) CH3CH2CH2C CH + HBr(过量)
乙炔与炔烃及其强化练习

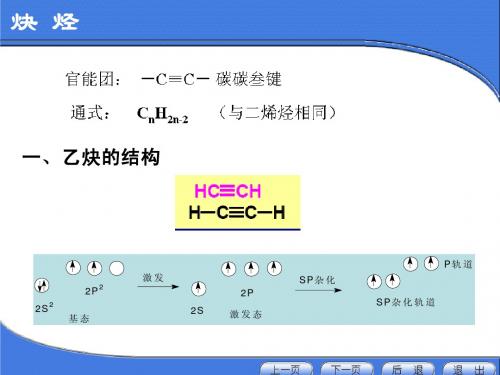
乙炔与炔烃一、组成:分子式:C2H2炔烃的通式:C2n H2n+n n≥2二:结构:电子式:结构式:H—C C—H 结构简式:HC CH 几何构型:直线形官能团:—C C—炔烃的结构特征:含有一个碳碳三键,形成链状,剩余价键与氢原子结合。
炔烃同系列有:CH CH、CH3C CH、CH3CH2C CH炔烃既有碳链异构,如CH3CH2CH2C CH与CH3 CHC CHCH3也有位置异构,如CH3CH2C CH与CH3C CCH3含有类别异构,如1—丁炔与1,3—丁二烯、环丁烯三、物理性质:乙炔是一种无色无味比空气略轻难溶于水的气体。
炔烃中C4以内的,在常温下呈气态。
四、化学性质1、氧化反应:①可以燃烧:2C2H2+5O24CO2+2H2O C3H4+4O23CO2+2H2O②能使酸性高锰酸钾溶液褪色。
C2H2+2KMnO4+3H2SO42CO2+K2SO4+2MnSO4+4H2O5CH3C CH+8KMnO4+12H2SO45CH3COOH+5CO2+8MnSO4+4K2SO4+12H2O2、加成反应:HC CH+H2催化剂△CH2=CH2HC CH+2H2催化剂△CH3CH3HC CH+Br2BrCH=CHBrHC CH+2Br2 BrCH—CHBrBr BrCH3C CH+2H2催化剂△CH3CH2CH3CH3C CH+2Br2催化剂△CH3CBr2CHBr2HC CH+HCl 催化剂△CH2=CHClnCH2=CHCl CH—CH2ClCH3C CH+HCl 催化剂△CH3CH=CHClCH3C CH+HCl 催化剂△CH3CHCl=CH2HC CH+H2O 催化剂CH3CHO点燃点燃催化剂n H :C C :HCH 3 C CH +H 2O催化剂 CH 3CH 2CHO CH 3C CH +H 2O 催化剂 CH 3COCH 33、加聚反应:nHC CH CH = CH nCH 3C CH C = CH CH 3五、实验室制法:CaC 2+2H 2O Ca(OH)2+C 2H 2↑ 六、用途:氧炔焰用于切割金属或者焊接金属;制备乙醛;制备氯乙烯、聚氯乙烯。
乙炔、炔烃(上课用)2011-587360

C H
结构式: HCCH
HCCH
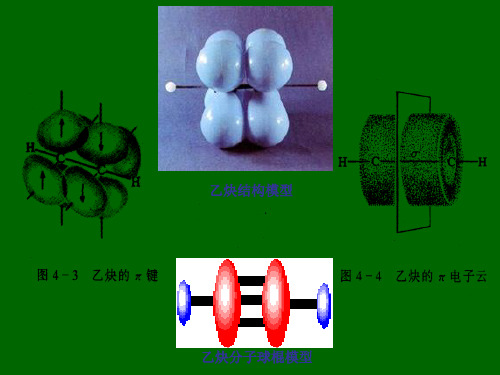
乙炔直线型分子,键角为180O,4个原子都在同一直 线上,非极性分子
描述CH3—CH = CH—C≡C—CF3分子结构的 下列叙述中正确的是( BC )
A.6个碳原子有可能都在一条直线上
B.6个碳原子不可能都在一条直线上 C.6个碳原子有可能都在同一平面上 D.6个碳原子不可能都在同一平面上
图 47-2 ―→ b ―→ ―→ d (电石、水) ( ) ( ) (溴水) (5)为验证这一反应是加成而不是取代,丙同学提出可用 pH 试纸来测试反应后溶液的酸性,理由是__________。
2、某烃经催化加氢后得到 2甲基丁烷,该烃不可能
是( AC ) A.2甲基2丁炔 C.2甲基1丁炔 B.3甲基1丁烯 D.3甲基1丁炔
CH 2 — CH — n nCH 2 CH — CN — | CN
催化剂
聚丙烯腈(俗称人造羊毛,又称腈纶)
3.加聚反应
nCHCH
催化剂 加温、加压
CH=CH
n
聚乙炔
聚乙炔:导电塑料
催化剂
3CH≡CH
(低聚)
低聚为主 能高聚
想一想:以石灰石,焦炭,饱和食盐水作为原料, 制备聚氯乙烯,写出各有关的方程式。 注意: 2NaCl + 2H2O 电解 H2↑ + Cl2↑ + 2NaOH
聚氯乙烯制品
“PVC食品保鲜 膜主要有两个方面对 人造成危害:氯乙烯 单体含量高,会挥发 出来;PVC保鲜膜用 的增塑剂主要成分是 乙基己基胺 (DEHA)。” --国家塑料制品监督检验中心主任翁云宣
⑤与HCN加成
催化剂 CH CH HCN CH 2 CH — CN
乙炔基本化学知识点总结

乙炔基本化学知识点总结乙炔基本化学知识点总结乙炔是一种有机化合物,化学式为C2H2,它的结构式为H-C≡C-H。
乙炔是最简单的炔烃,也是一种重要的工业原料和有机合成中的重要中间体。
本文将对乙炔的基本化学知识进行总结,包括乙炔的制备、性质及反应等方面。
一、制备乙炔乙炔的制备方法有多种,其中较为常见的有以下几种:1. 石灰石法:将石灰石(CaCO3)与焦炭(C)加热至高温,然后通过输送氮气或空气进行高温分解反应,生成氧化钙(CaO)和一氧化碳(CO)。
接着,将二氧化钙(CaO)与焦炭(C)加热至1400℃左右,反应生成乙炔。
CaCO3 + C → CaO + COCaO + C → CaC2 + CO2. 乙炔仪法:利用乙炔仪将水合乙酸或乙腈等物质电解制备出乙炔。
CH3COOH + H2O → C2H2 + CO22CH3CN + 2H2O → C2H2 + 2NH33. 液体乙炔法:通过各类液体烃类(如乙烯)的脱氢反应,得到乙炔。
二、乙炔的性质乙炔是无色、无臭的气体,与空气具有较大的爆炸范围。
乙炔可以溶解于水、酒精、丙酮、苯等有机溶剂中,不溶于丙酮和水。
乙炔具有较强的不稳定性,在高温、高压、阳光等条件下容易发生爆炸。
乙炔的燃烧产生高温和暴露的炽热火焰,可用于切割金属。
三、乙炔的反应乙炔具有丰富的化学反应性,主要反应有:1. 加成反应:在适当的条件下,乙炔可以和H2、Cl2、Br2、HCl、HBr等发生加成反应。
例如,乙炔与H2发生加成反应生成乙烯:C2H2 + H2 → C2H42. 氢化反应:乙炔可以通过催化加氢反应得到乙烯。
常用的催化剂有铂、钯等贵金属。
C2H2 + H2 → C2H43. 氧化反应:乙炔可以与氧气发生燃烧反应,生成二氧化碳和水。
当乙炔含有不完全燃烧产物时,也可能生成一氧化碳等有毒气体。
2C2H2 + 5O2 → 4CO2 + 2H2O4. 卤素化反应:乙炔与卤素(Cl2、Br2)反应可以生成卤代烃。
乙炔、炔烃PPT课件 人教版

41、从现在开始,不要未语泪先流。 42、造物之前,必先造人。 43、富人靠资本赚钱,穷人靠知识致富。 44、顾客后还有顾客,服务的开始才是销售的开始。 45、生活犹如万花筒,喜怒哀乐,酸甜苦辣,相依相随,无须过于在意,人生如梦看淡一切,看淡曾经的伤痛,好好珍惜自己、善待自己。 46、有志者自有千计万计,无志者只感千难万难。 47、苟利国家生死以,岂因祸福避趋之。 48、不要等待机会,而要创造机会。 49、如梦醒来,暮色已降,豁然开朗,欣然归家。痴幻也好,感悟也罢,在这青春的飞扬的年华,亦是一份收获。犹思“花开不是为了花落,而是为了更加灿烂。 50、人活着要呼吸。呼者,出一口气;吸者,争一口气。 51、如果我不坚强,那就等着别人来嘲笑。 52、若不给自己设限,则人生中就没有限制你发挥的藩篱。 53、希望是厄运的忠实的姐妹。 54、辛勤的蜜蜂永没有时间悲哀。 55、领导的速度决定团队的效率。 56、成功与不成功之间有时距离很短只要后者再向前几步。 57、任何的限制,都是从自己的内心开始的。 58、伟人所达到并保持着的高处,并不是一飞就到的,而是他们在同伴誉就很难挽回。 59、不要说你不会做!你是个人你就会做! 60、生活本没有导演,但我们每个人都像演员一样,为了合乎剧情而认真地表演着。 61、所谓英雄,其实是指那些无论在什么环境下都能够生存下去的人。 62、一切的一切,都是自己咎由自取。原来爱的太深,心有坠落的感觉。 63、命运不是一个机遇的问题,而是一个选择问题;它不是我们要等待的东西,而是我们要实现的东西。 64、每一个发奋努力的背后,必有加倍的赏赐。 65、再冷的石头,坐上三年也会暖。 66、淡了,散了,累了,原来的那个你呢? 67、我们的目的是什么?是胜利!不惜一切代价争取胜利! 68、一遇挫折就灰心丧气的人,永远是个失败者。而一向努力奋斗,坚韧不拔的人会走向成功。 69、在真实的生命里,每桩伟业都由信心开始,并由信心跨出第一步。 70、平凡的脚步也可以走完伟大的行程。 71、胜利,是属于最坚韧的人。 72、因害怕失败而不敢放手一搏,永远不会成功。 73、只要路是对的,就不怕路远。 74、驾驭命运的舵是奋斗。不抱有一丝幻想,不放弃一点机会,不停止一日努力。 75、自己选择的路,跪着也要走完。 76、当你的希望一个个落空,你也要坚定,要沉着! 77、蚁穴虽小,溃之千里。 78、我成功因为我志在成功! 79、凡真心尝试助人者,没有不帮到自己的。 80、相信自己,你能作茧自缚,就能破茧成蝶。 81、偶尔,只需要一个鼓励的微笑,就可以说服自己继续坚强下去。 82、年轻是本钱,但不努力就不值钱。 83、一时的忍耐是为了更广阔的自由,一时的纪律约束是为了更大的成功。 84、在你不害怕的时间去斗牛,这不算什么;在你害怕时不去斗牛,也没有什么了不起;只有在你害怕时还去斗牛才是真正了不起。 85、能把在面前行走的机会抓住的人,十有八九都会成功。 86、天赐我一双翅膀,就应该展翅翱翔,满天乌云又能怎样,穿越过就是阳光。 87、活鱼会逆流而上,死鱼才会随波逐流。 88、钕人总是把男人的谎言当作誓言去信守。 89、任何业绩的质变都来自于量变的积累。 90、要战胜恐惧,而不是退缩。
炔烃

B.2种
C.3种
D.4种
5、某气态烃1mol与2mol HCl发生加成 反应,所得的加成产物1mol又能与 8molCl2反应,最后得到一种只含C、 Cl两种元素的有机物,则该气态烃为 ( BD ) A 丙炔 B 1—丁炔
C 丙烯
D 1,3—丁二烯
实验中为 什么要采 用分液漏 斗?
实验中采用块状 CaC2和饱和食盐水, 为什么?
制出的乙炔气 体为什么先通 入硫酸铜溶液?
饱和食盐 水减缓反 应速率 棉花防止 产生的泡 沫涌入导 管 块状电石 减缓反应 速率
硫酸铜溶液除去反应时 少量杂质硫化钙、砷化 钙、磷化钙与水作用生 成H2S、AsH3、PH3等有 特殊的气味的气体
裂,有一个键较稳定。2.含有叁键
结构的相邻四原子在同一直线上。 3.链烃分子里含有碳碳叁键的不饱
C H
● ×
和烃称为炔烃。4.乙炔是最简单的 炔烃。
结构简式: CH≡CH 或 HC≡CH 空间结构: 直线型,键角1800
练习
1、所有原子都在同一直线上的是 ( BD ) A. C2H4 B. C2H2
三、炔烃
1、概念:分子里含有碳碳三键的一类脂肪烃 称为炔烃。乙炔是最简单的炔烃。
2、炔烃的通式:CnH2n-2 (n≥2)
3、乙炔的物理性质:无色无味气体,微溶于 水,易溶有机溶剂
4、乙炔 1)乙炔的分子结构: 结构式: H—C≡C—H 电子式: H C
● × ●● ●● ●●
1.C≡C的键能和键长并不是C-C的 三倍,也不是C=C和C—C之和。说 明三键中有两个键不稳定,容易断
禁用启普发生器,因:a反 应剧烈,难控制 b反应放热, 易使启普发生器炸裂。
五、脂肪烃的来源及其应用 脂肪烃的来源有石油、天然气和煤等
第4章炔烃
HCl
CuCl NH4Cl HCl
CH2 CH C CH2 Cl
2-氯-1,3-丁二烯
16
三聚 四聚
3 CH CH Ni(CO)2 [Ph3P]2 苯
4 CH
CH
50
C
Ni(CO)2 ,1.5~2.0MPa
环己四烯
生成聚乙炔
催化剂
nCH CH
—CH=CH— n
聚乙炔
17
三、氧化
与烯烃相似,炔烃也可被氧化剂氧化,往往可以使叁键断裂, 最后得到完全氧化的产物——羧酸或二氧化碳。例如:
3CH CH + 10KMnO4 + 2H2O
6CO2+ 10KOH + 10MnO2
R—C
C—R' KMnO4
过量
R—COOH + R'—COOH
RCCR’
KMnO4(冷,稀,H2O,PH7-5)
OO RC CR
KMnO4(H2O,过量)
RCOOH + R’COOH
(1) O3 (2) H2O, Zn
炔烃的物理性质和烷烃、烯烃相似。低级的炔烃在常温常 压下是气体,但沸点比相同原子数的烯烃略高些。随着碳原子 数的增多,它们的沸点也升高。
炔烃不溶于水,但易溶于极性小的有机溶剂,如石油醚、 苯、乙醚、四氯化碳等。
纯的乙炔是无色、无臭味的气体。 液态乙炔受到震动会发生爆炸,所以在乙炔钢瓶中既要填 入多孔性物质,如硅藻土、石棉等,又要加入丙酮作为溶剂, 这样储存、运输、使用可以避免危险。 乙炔与空气组成的爆炸气体的组成范围比其他烃类要大的 多。在生产、使用时必须注意。
RCOOH + R’COOH
18
炔烃与芳香烃

炔烃与芳香烃烃是一类化合物,由碳和氢组成。
根据碳原子链的类型,烃可以分为两大类:炔烃和芳香烃。
炔烃是一类具有炔键(碳碳三键)的烃化合物。
炔烃的通式为CnH2n-2,其中n代表碳原子的个数。
最简单的炔烃是乙炔(C2H2),由两个碳原子和两个氢原子组成。
除了乙炔,还有丙炔(C3H4)、丁炔(C4H6)等等。
炔烃在化学反应中具有一定的活性。
其中最有代表性的反应是与卤素发生加成反应。
例如,乙炔与氯气反应,可以得到1,2-二氯乙烷:C2H2 + Cl2 → C2H2Cl2另外,炔烃还可以与水发生加成反应,生成醇。
乙炔与水反应,可以得到乙醇:C2H2 + H2O → C2H5OH除了加成反应,炔烃还可以发生环化反应,形成环状化合物。
例如,乙炔经过两次的环化反应可以生成苯:3C2H2 → C6H6芳香烃是一类具有芳香性质的烃化合物。
芳香烃的分子结构中含有至少一个苯环(由六个碳原子和六个氢原子组成)。
芳香烃的通式为CnH2n-6,其中n代表碳原子的个数。
最简单的芳香烃就是苯(C6H6),由一个苯环组成。
除了苯,还有甲苯(C6H5CH3)、苯乙烯(C6H5CH=CH2)等等。
芳香烃具有强烈的香气,并且多数具有不饱和性。
芳香烃在化学反应中也有一定的活性。
最常见的反应是取代反应,即一个或多个氢原子被其他取代基取代。
例如,苯在氯气的作用下,可以发生取代反应生成氯苯:C6H6 + Cl2 → C6H5Cl + HCl此外,芳香烃还可以进行加成反应和环化反应。
加成反应通常发生在苯环上的双键处,环化反应则会形成其他环状化合物。
总结来说,炔烃和芳香烃分别是由碳和氢组成的化合物。
炔烃具有炔键,而芳香烃则具有苯环。
炔烃在化学反应中具有较高的活性,可以进行加成反应和环化反应。
芳香烃具有芳香性,可以发生取代反应、加成反应和环化反应。
这些化合物在有机化学研究和工业应用中具有重要的地位。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第四节乙炔炔烃
[情境引入]复习碳碳原子之间成键方式,根据乙烷、乙烯之间规律,制作乙炔球棒模型。
一、乙炔的分子结构
分子式:电子式结构式
结构简式:
乙炔分子含,是分子
空间结构:,2C和2H处上,是非极性分子,键角。
例1、描述CH3-CH=CH-C≡C-CF3分子结构的下列叙述中,正确的是()
A、6个碳原子有可能都在一条直线上
B、6个碳原子不可能在一条直线上
C、6个碳原子有可能都在同一平面上
D、6个碳原子不可能都在同一平面上
思考:该分子结构中至少可以有____ 个原子在同一个平面,最多可以有_____个原子在同一个平面。
最多可以有_____个碳原子在同一个平面上。
二、实验室制法:
1、原料:
2、原理:
3、装置:属于型,与制装置类似。
4、收集:
注意:
1、制乙炔不能用启普发生器的原因?
2、为获得平稳乙炔气流采用的方法?
3、电石产生的乙炔因常混有PH3、H2S等杂质而有特殊难闻的臭味。
除掉方法?
思考:CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等都同属离子型碳化物,请通过对CaC2制C2H2的反应进行思考,从中得到必要的启示,写出下列反应的产物:
A.ZnC2水解生成()B.Al4C3水解生成()
C.Mg2C3水解生成()D.Li2C2水解生成()
三、乙炔性质:
(一)物理性质
纯的乙炔是色味的气体,比空气密度略小,溶于水,易溶于有机溶剂。
(二)化学性质:
[探究预测]
实验一:把乙炔通入酸性的高锰酸钾溶液中预测:
实验二:把乙炔通入溴的四氯化碳溶液(或溴水) 预测:
实验三:把乙炔气体点燃预测:
结论:
1、氧化反应:
(1)可燃性:
乙炔在空气中燃烧,火焰并伴有。
方程式:
说明:C% ,产生的烟。
氧炔焰温度可达3000℃以上,用来焊接或切割金属。
(2)可使酸性KMnO4溶液褪色,此性质可用来检验乙炔。
2、加成反应:
乙炔可使溴水褪色,反应中,乙炔叁键中的两个键可分别断裂,1mol乙炔分子最多可与Br2分子发生加成反应。
方程式:
乙炔还可和氢气、氯化氢等发生加成反应。
CH≡CH+H2
CH2=CH2+H2
CH≡CH+HCl
nCH2=CH
聚氯乙烯是一种合成树脂,用于制备塑料和合成纤维。
3、聚合反应:
四、炔烃:
1、概念:分子里含有碳碳叁键的一类链烃。
例CH≡C-CH3 CH3-CH2-C≡CH
2、通式:
3、同分异构体:
符合通式C n H2n-2的物质有:碳原子数相等时,互为同分异构体例写出C4H6的所有的同分异构体。
4、物理性质:
(1)均难溶于水,液态时密度均小于水。
(2)随碳原子数递增,熔沸点逐渐升高,常温时,碳原子数为2,3,4的炔烃为气态。
5、化学性质:同乙炔,易发生氧化反应和加成反应。
★缺氢指数(不饱和度)。
