2017-2018学年高中化学(人教版)选修四课堂10分钟达标: 3.3.2 盐类水解反应的利用 Word版含解析
2017-2018学年高中化学 课堂10分钟达标 2.3.化学平衡2 新人教版选修4

2.3.化学平衡21.在一定温度不同压强(p 1<p2)下,可逆反应2X(g)2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(φ)与反应时间(t)的关系有以下图示,正确的是( )【解析】选B。
p2>p1,则p2条件下的反应速率较大,达到平衡所需的时间要短,且平衡逆向移动,Z的体积分数比p1的要低。
2.(2016·苏州高二检测)下列叙述及解释正确的是( )A.2NO 2(g)(红棕色)N2O4(g)(无色) ΔH<0,达平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅H<0,达平衡后,对平衡体系采取增大容积、减小压强的措施,B.H因为平衡不移动,故体系颜色不变C.FeCl 3+3KSCN Fe(SCN)3(红色)+3KCl,达平衡后,加少量KCl,因为平衡向逆反应方向移动,故体系颜色变浅D.对于N 2+3H22NH3,平衡后,在压强不变的条件下充入O2,平衡左移【解析】选D。
A项,缩小体积,平衡右移,但c(NO2)浓度仍增大,颜色变深,A错;B项,扩大容积,平衡不移动,但由于c(I2)减小,故体系颜色变浅,B错;C项,由于KCl没有参与反应,故对平衡无影响,C错;D项,压强不变,充入O2(注:O2不参与反应),体积扩大,平衡左移。
3.下图是恒温下某化学反应的反应速率随反应时间变化的示意图。
下列叙述与示意图不相符合的是( )A.反应达平衡时,正反应速率和逆反应速率相等B.该反应达到平衡态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡态ⅡC.该反应达到平衡态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡态ⅡD.同一种反应物在平衡态Ⅰ和平衡态Ⅱ时浓度不相等【解析】选C。
C项达到平衡态Ⅰ后,减小反应物浓度,正反应速率减小,逆反应速率瞬间不变,图象应为4.温度一定时,在密闭容器中发生可逆反应mA(g)+nB(g)pC(g),达到平衡后,若将混合气体的体积压缩到原来的,当再次达到平衡时,C的浓度为原平衡时C的浓度的1.9倍,则下列叙述中,正确的是( )A.平衡向逆反应方向移动B.C气体的体积分数增大C.气体A的转化率增大D.m+n>p【解析】选A。
人教版高中化学选修四课堂10分钟达标: 4.2 化学电源 Word版含解析

此套题为Word版,请按住Ctrl,滑动鼠标滚轴,调节合看比例,答案解析附后。
课堂10分钟达标1.(2016·太原高二检测)锌锰干电池的两极分别为碳棒和锌皮,在放电时电池总反应方程式可以表示为Zn+2MnO2+2N Zn2++Mn2O3+2NH3+H2O。
根据上述信息,下列结论正确的是( )A.放电时正极发生反应的物质为NB.Zn为负极,碳为正极C.工作时,电子由碳极经外电路流向Zn极D.长时间连续使用该电池时,内装糊状物不会流出【解析】选B。
在电池的正极上发生的是得电子的还原反应,是总反应中氧化剂发生反应的电极。
由锌锰干电池的总反应式可知,MnO2与N发生的反应为正极反应。
根据原电池的工作原理可知,相对活泼(指金属性)的一极为负极,相对不活泼的一极为正极,B项正确;在外电路,电子从负极流向正极,C项错误;长时间连续使用该电池,由于锌皮慢慢溶解而破损,糊状物很可能流出而腐蚀用电器,D项错误。
【补偿训练】(2016·聊城高二检测)某同学在超市看到一种电池外壳的纸层包装,印有如图所示的文字。
下列有关说法错误的是( )A.该电池不是可充电干电池B.该电池用过之后不可以随意丢弃,要集中回收处理C.该电池含有重金属元素D.该电池工作时,外电路中每通过0.2mol e-,锌的质量理论上减少3.25g【解析】选D。
电池工作时,锌失去电子,电极反应为Zn-2e-Zn2+,外电路每通过0.2mol电子,锌的质量理论上应减少6.5g,所以D项错误。
2.(2016·济宁高二检测)关于铅蓄电池的说法正确的是( )A.在放电时,正极发生的反应是Pb(s)+S(aq)PbSO4(s)+2e-B.在放电时,该电池的负极材料是铅板C.在充电时,电池中硫酸的浓度不断变小D.在充电时,阳极发生的反应是PbSO4(s)+2e-Pb(s)+S(aq) 【解析】选B。
A项中电池放电时正极应发生还原反应,电极反应为PbO2+4H++S+2e-PbSO4+2H2O;C项中电池充电时硫酸的浓度应不断增大;D项中电池充电时阳极反应应为放电时正极反应的逆反应,即应发生氧化反应。
高中化学课堂10分钟达标2.4化学反应进行的方向新人教版选修4(2021学年)

2017-2018学年高中化学课堂10分钟达标2.4 化学反应进行的方向新人教版选修4编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2017-2018学年高中化学课堂10分钟达标 2.4化学反应进行的方向新人教版选修4)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2017-2018学年高中化学课堂10分钟达标 2.4化学反应进行的方向新人教版选修4的全部内容。
2.4 化学反应进行的方向1。
(2016·廊坊高二检测)下列过程是非自发的是()A。
水由高处向低处流ﻩﻩB.天然气的燃烧C.铁在潮湿的空气中生锈ﻩD。
水在室温下结冰【解析】选D.自然界中水由高处向低处流、天然气的燃烧、铁在潮湿的空气中生锈、冰在室温下融化,都是自发过程,其逆过程都是非自发过程。
2.(2016·沂州高二检测)下列变化中,ΔS〈0的是( )A。
-10℃液态水结冰B.金属钠与水反应C.干冰(CO2)的升华D。
CaCO3(s)分解为CaO(s)和CO2(g)【解析】选A。
气体液化、液体凝固是体系混乱度减小的过程,故A项ΔS<0;固体溶解、气体扩散和固体熔化、升华均为体系混乱度增加的过程,故C项ΔS〉0;B项中有H2生成,D项中CaCO3固体分解有CO2气体生成,均为熵增过程,ΔS>0.【补偿训练】下列关于化学反应的自发性叙述中正确的是()A。
焓变小于0而熵变大于0的反应肯定是自发的B.焓变和熵变都小于0的反应肯定是自发的C.焓变和熵变都大于0的反应肯定是自发的D。
熵变小于0而焓变大于0的反应肯定是自发的【解析】选A。
ΔH—TΔS的数值判断反应进行的方向。
【高中化学】高中化学选修四高效课堂教学设计:3.3.2盐溶液的酸碱性
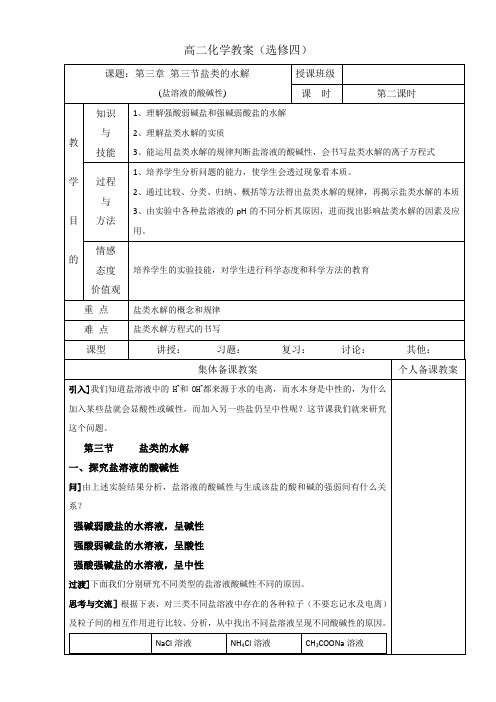
高二化学教案(选修四)C(H+)和C(OH-)相对大小C(H+)=C(OH-)C(H+)>C(OH-)C(H+)<C(OH-)溶液中的粒子Na+、Cl-、H+、OH-、H2O NH4+、Cl-、H+、NH3·H2O、OH-、H2OCH3COO H-、Na+、H+、OH-、H2O、CH3COOH有无弱电解质生成无有有相关化学方程式H2O H++OH-NaCl =Na+ + Cl-H2O H++OH-NH4++ OH-NH3·H2OH2O H++OH-CH3COO- + H+CH3COOH二、盐溶液呈现不同酸碱性的原因讲]CH3COONa溶于水之后,完全电离。
(因为CH3COONa是强电解质。
)投影]CH3COONa ═ CH3COO- + Na+………⑴问]把CH3COONa溶于水之后,溶液中存在哪些电离平衡?投影] H2O H+ + OH-………⑵讲]我们知道,CH3COOH是一种弱酸,在溶液中部分电离,溶液中既然存在CH3COO-和H+,根据,可逆反应,反应物和生成物同时共存,那么就一定有CH3COOH。
投影]CH3COO- + H+ CH3COOH………⑶讲]把⑴⑵⑶式联立,可得到投影]水解方程式:CH3COONa + H2O CH3COOH + NaOH讲]这说明CH3COONa溶于水后,反应有NaOH生成,所以溶液显碱性。
把上述化学方程式改写成离子方程式。
投影]CH3COO- + H2O CH3COOH + OH-讲]随着CH3COONa的加入,对水的电离有什么影响呢?促进了水的电离,可以看作是使水分解了。
醋酸钠与水反应的实质是:醋酸钠电离出的醋酸根离子和水电离出的氢离子结合生成弱电解质醋酸的过程。
投影]1、弱酸强碱盐,水解显碱性 CH3COONa = CH3COO−+ Na+投影]2、强酸弱碱盐,水解显酸性 NH4Cl = NH4+ + Cl−投影]3、强酸强碱盐:不水解4、弱酸弱碱盐:双水解,水解程度增大。
2017-2018学年高中化学 课堂10分钟达标 2.3.化学平衡3 新人教版选修4

2.3.化学平衡31.(2016·鄂州高二检测)关节炎是因为在关节滑液中形成了尿酸钠晶体,尤其是在寒冷季节易诱发关节疼痛,其化学机理如下:①HUr+H 2O Ur-+H3O+尿酸尿酸根离子②Ur-(aq)+Na+(aq)NaUr(s)。
下列对反应②的叙述正确的是( )A.正反应为吸热反应B.正反应为放热反应C.升高温度,平衡向正反应方向移动D.降低温度,平衡向逆反应方向移动【解析】选B。
题意中明确指出“尤其是在寒冷季节易诱发关节疼痛”,说明温度降低,反应②的平衡向正反应方向移动,可知其正反应为放热反应。
【易错提醒】忽视题意“在寒冷季节易诱发关节疼痛”,会导致选择错误选项。
2.将H 2(g)和Br2(g)充入恒容密闭容器中,恒温下发生反应H2(g)+Br2(g)2HBr(g) ΔH<0,平衡时HBr(g)的体积分数为a;若初始条件相同,绝热下进行上述反应,平衡时HBr(g)的体积分数为b。
a与b的关系是( )A.a>bB.a=bC.a<bD.无法确定【解析】选A。
两反应的温度不同,后者为绝热条件,相对于前者相当于升高了温度,HBr(g)的体积分数减小。
【补偿训练】如图曲线a表示放热反应X(g)+Y(g)Z(g)+M(g)+N(s) ΔH<0进行过程中Z的物质的量随时间变化的关系。
若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )A.升高温度B.加大X的投入量C.缩小体积D.增大体积【解析】选C。
由于该反应是等体积反应,缩小体积,平衡不移动,但能缩短达到平衡所用时间。
3.(2016·郑州高二检测)已知汽车尾气无害化处理反应为2NO(g)+2CO(g)N2(g)+2CO2(g)。
下列说法不正确的是( )A.升高温度可使该反应的逆反应速率降低B.使用高效催化剂可有效提高正反应速率C.反应达到平衡后,NO的反应速率保持恒定D.单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡【解析】选A。
人教版高中化学选修四课件高二化学知识梳理3.3.2盐类水解的应用

溶液蒸干 ②水解生成挥发性酸的盐(如AlCl3) ――→ 氢氧化物 灼烧 ――→氧化物 溶液蒸干 ③较低温度下受热分解的盐[如Ca(HCO3)2] ――→ 盐 的分解产物 (4)金属与盐溶液反应产生H2 例如:金属镁与FeCl3、AlCl3、NH4Cl溶液均能反应产 生H2,因为这些盐水解显酸性。
解析: AlCl3 发生如下水解: AlCl3+3H2O Al(OH)3+
3HCl,生成的 HCl 挥发,而使水解平衡向右移动,致使生成 Al(OH)3 沉淀,它被灼烧得 Al2O3。NaHCO3、KMnO4 受热后分 别分解得到 Na2CO3、K2MnO4 和 MnO2,只有 Fe2(SO4)3 蒸干后
•
• 思路指引: 解答本题应注意以下三点: • (1)分析氯水的成分及几种平衡关系。 • (2) 注意醋酸根离子的水解,碳酸根离子的分 步水解。 • (3)注意电荷守恒和原子守恒。
•
氯水中存在的平衡关系有: Cl2+H2O HClO H++ClO-,H2O
HClO+Cl-+H+,
H++OH-,由此可知氯水中氯元
•
• 4.用盐作净水剂 • 例如:利用 FeCl3 、明矾在水溶液中发生水解 产生的胶体,能吸附水中悬浮的杂质,起到净 水的作用。 • 5.泡沫灭火器原理 •大量 AlCO ) 溶液与小苏打溶液发生水解相互促进 2(SO 4 3 2气体和Al(OH)3沉淀 反应,产生,将燃烧物质与空气隔离开来。离 子 方 程 式 为 Al3 + + 3HCO3 - ===Al(OH)3↓ + 3CO2↑。
素的存在形式有 Cl2、Cl-、ClO-、HClO,由于 HClO 部分电 离,故 c(H )>c(Cl )>c(ClO )>c(OH ),A、B 均不正确;由于 CH3COO-水解生成 CH3COOH,使得 c(Na+)>c(CH3COO-), C 项错误; Na2CO3 溶液存在两种水解平衡: CO32 + H2O
2017-2018学年高中化学课堂10分钟达标2.3.化学平衡4新人教版选修4

23化学平衡41. (2016 •邵武高二检测)下列关于化学平衡常数的叙述正确的是()A. 化学平衡常数与温度无关B. 两种物质反应,不管怎样书写化学方程式,平衡常数不变C. 化学平衡常数等于某时刻生成物浓度幕之积与反应物浓度幕之积的比值D. 温度一定,对于给定的化学反应,正、逆反应的平衡常数互为倒数【解析】选Do化学平衡常数与温度有关,不同温度下,K值不同,同时平衡常数还与化学方程* ]式的书写方式有关,故A、B两项错误。
K值的计算必须用平衡浓度,故C项错误。
化学平衡常数的大小定量反映了可逆反应进行程度的大小,它只是一个温度函数,与浓度、压强、催化剂均无关。
【易错提醒】化学平衡常数必须是可逆反应达到化学平衡状态时的常数。
表达式中各物质的浓度必须是平衡状态下的浓度,不能用任一时刻的浓度值。
2. 某温度下的密闭容器中发生如下反应:2M(g)+N(g)—2E(g)。
若开始时只充入2 mol E(g),A .达到化学平衡时,混合气体的压强比开始时增大了20%;若开始时只充入2 mol M(g)和1 molN(g)的混合气体,则达到化学平衡时M的转化率是I、( )A. 20%B.40%C.60%D.80%【解析】选C。
题中充入2 mol E(g)与充入2 mol M(g)、1 mol N(g)属于等效平衡。
根据同温同容下,压强之比等于物质的量之比,所以平衡时混合气体的物质的量增加了△ n=2 mol x 20%=0.4 mol。
根据方程式可得n(M)=2 △ n=2 x0.4 mol=0.8 mol 。
当只充入2 mol M 和1 mol N的混合气体达平衡时,剩余M的物质的量也应该为0.8 mol,反应的M的物质的量为2 mol-0.8 mol=1.2 mol, 所以M的转化率为1.2molA.正向移动B.逆向移动3.(2016 •常德高二检测)1 000 K 时反应 C(s)+2H 2(g) — CH(g)的 K =8.28 x 107,当各气体物质的量浓度分别为 H 20.7 mol • L -1、CH0.2 mol • L -1时,上述反应2molx 100%=60%分析下图可以得出的正确结论是A.正反应是吸热反应 m+n>p +qB.正反应是吸热反应 m+n<p +qC.正反应是放热反应 m+n>p +qD.正反应是放热反应m+n<p+q z 鼻【解析】 选A 。
高中化学课堂10分钟达标2.3.化学平衡1新人教版选修4(2021学年)

2017-2018学年高中化学课堂10分钟达标2.3.化学平衡1新人教版选修4编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2017-2018学年高中化学课堂10分钟达标2.3.化学平衡1 新人教版选修4)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2017-2018学年高中化学课堂10分钟达标 2.3.化学平衡1新人教版选修4的全部内容。
2。
3.化学平衡11。
(2016·大连高二检测)在密闭容器中进行如下反应:X2(g)+Y2(g)2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L—1、0.2 mol·L—1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是()A。
Z为0.3 mol·L—1B.X2为0.2 mol·L—1C.Y2为0.4 mol·L-1D.c(X2)+c(Y2)+c(Z)=0.55 mol·L—1【解析】选A。
可逆反应中,反应体系中各物质一定共存,如果B、C选项中的数据存在,则Z的浓度为0,这是不可能的,A选项符合题意;又因为该反应是总体积不变的反应,达到平衡时,不论X2、Y2、Z怎么变化,总物质的量不会改变,总浓度也不会改变,即:c(X2)+c(Y2)+c(Z)=0。
6 mol·L-1。
【易错提醒】可逆反应中,反应物与生成物同时存在;任一组分的转化率都小于100%。
2。
(2016·白山高二检测)在一定条件下体积不变的密闭容器中,反应2A(g)+2B(g)3C(g)+D(g)达到平衡状态的标志是 ( )A.单位时间内生成2nmol A,同时生成nmol DB.容器内压强不随时间而变化C.单位时间内生成nmol B,同时消耗1。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
温馨提示:此套题为Word版,请按住Ctrl,滑动鼠标滚轴,调节合适的观看比例,答案解析附后。
关闭Word文档返回原板块。
课堂10分钟达标1.(2016·聊城高二检测)下列哪组离子能在水溶液中大量共存( )A.K+、C、HS-、S2-、Al3+、AlB.Mn、Na+、S、K+、Cl-C.S、Ag+、S、S2-、Al、K+D.Fe2+、Cl-、H+、N【解析】选B。
A中有能发生相互促进水解反应的离子,C中有能形成沉淀的离子,D中的Fe2+、H+、N可发生氧化还原反应。
2.(2016·太原高二检测)下列关于盐类水解的应用中,说法正确的是( )A.加热蒸干Na2CO3溶液,最后可以得到NaOH和Na2CO3的混合固体B.除去MgCl2中的Fe3+,可以加入NaOH固体C.明矾净水的反应:Al3++3H 2O Al(OH)3(胶体)+3H+D.加热蒸干KCl溶液,最后得到KOH固体(不考虑CO2的反应)【解析】选C。
A项,加热蒸发Na2CO3溶液得不到NaOH。
虽然加热促进C水解,但生成的NaHCO3又与NaOH反应生成了Na2CO3;B项,Mg2+和Fe3+均可与OH-反应生成沉淀,且引入了新杂质Na+;D项,KCl不水解,不可能得到KOH固体。
3.(2016·长春高二检测)相同物质的量浓度的下列铵盐中,c(N)最大的是( )A.NH4HCO3B.NH4HSO4C.NH4NO3D.CH3COONH4【解析】选B。
先找出对N水解无影响的阴离子,再看是促进的还是抑制的,并排出顺序。
NH4NO3中N的水解不受影响,NH4HSO4电离出H+抑制N水解,c(N)大,HC、CH 3COO-对N的水解都有促进作用,c(N)小。
4.(2016·连云港高二检测)把0.02mol·L-1CH3COOH溶液和0.01mol·L-1NaOH溶液以等体积混合,混合溶液中粒子浓度关系正确的是( )A.c(CH3COO-)>c(Na+)B.c(CH3COOH)>c(CH3COO-)C.2c(H+)=c(CH3COO-)-c(CH3COOH)D.c(CH3COOH)+c(CH3COO-)=0.02 mol·L-1【解析】选A。
溶液混合后,二者反应,但CH3COOH过量,故为CH3COONa 和CH3COOH的混合体系。
CH3COOH和CH3COO-相互抑制,但以CH3COOH电离为主,溶液显酸性,即c(H+)>c(OH-),由电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则有c(CH3COO-)>c(Na+),A正确;CH3COOH电离程度大于CH3COO-水解程度,B不正确;对于C项:由于存在c(H+)+c(Na+)=c(OH-)+c(CH3COO-)的电荷守恒①和2c(Na+)= c(CH3COO-)+c(CH3COOH)的物料守恒②,联立①②两式可得:2c(H+)=c(CH3COO-)- c(CH3COOH)+2c(OH-),所以C错;D项看似是物料守恒,但溶液的体积是原来的2倍,则c(CH3COOH)+c(CH3COO-)=0.01 mol·L-1,D错误。
5.(双选)25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )A.1L0.1mol·L-1(NH4)2Fe(SO4)2·6H2O溶液中:c(N)+c(Fe2+)+c(H+)=c(OH-)+ c(S)B.0.1mol·L-1的NH4Cl与0.1mol·L-1的NH3·H2O等体积混合:c(N)+2c(H+)= c(NH3·H2O)+2c(OH-)C.pH=9.4、浓度均为0.1mol·L-1的HCN与NaCN的混合溶液中:c(Na+)>c(CN-)> c(HCN)>c(OH-)D.0.1mol·L-1CH3COONa溶液与0.05mol·L-1盐酸等体积混合后的酸性溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)【解析】选B、D。
根据电荷守恒可以判断A错误;根据电荷守恒和物料守恒可知B正确;pH=9.4说明水解大于电离,所以c(HCN)的浓度大于c(CN-)故C错误;0.1mol·L-1CH3COONa溶液与0.05mol·L-1盐酸等体积混合后溶液中有CH3COOH为0.025mol·L-1、CH3COONa为0.025mol·L-1所以有c(CH3COO-)>c(Cl-)>c(CH3COOH)> c(H+)故D正确。
6.(2016·厦门高二检测)常温下,0.2mol·L-1的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )A.HA为强酸B.该混合液pH=7C.该混合溶液中c(A-)+c(Y)=c(Na+)D.图中X表示HA,Y表示OH-,Z表示H+【解析】选C。
做图象题首先要弄清横、纵坐标轴所代表的意义,本题所给图象的纵坐标为浓度,横坐标为各组分,即本图象给出的是各组分的浓度大小关系。
其中,A-浓度最大,X、Y、Z浓度依次减小,由题意知,HA与NaOH反应生成0.1mol·L-1的NaA溶液。
A项,由于A-浓度小于0.1mol·L-1,说明A-水解,即HA是弱酸,错误;B项,由于A-水解,水解后溶液呈碱性,错误;D项,混合溶液中粒子浓度大小关系为c(Na+)>c(A-)>c(OH-)>c(HA)>c(H+),因此X表示OH-,Y表示HA,Z表示H+,错误;C项,根据物料守恒可知,c(A-)+c(HA)=c(Na+),即c(A-)+c(Y)=c(Na+),正确。
【易错提醒】弱酸与强碱溶液混合后,若呈碱性,可能是碱过量,也可能是碱适量,还可能是碱稍微少量。
7.现有常温下的六份溶液:①0.01mol·L-1CH3COOH溶液;②0.01mol·L-1HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01mol·L-1CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;⑥0.01mol·L-1HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)其中水的电离程度最大的是________(填序号,下同),水的电离程度相同的是________。
(2)若将②、③混合后所得溶液pH=7,则消耗溶液的体积:②________③(填“>”“<”或“=”)(3)将六份溶液同等稀释10倍后,溶液的pH:①________②,③________④,⑤________⑥(填“>”“<”或“=”)。
(4)将①、④混合,若有c(CH3COO-)>c(H+),则混合溶液可能呈________(填序号)。
A.酸性B.碱性C.中性【解析】①0.01mol·L-1CH3COOH溶液中pH大于2;②0.01mol·L-1HCl溶液中pH=2;③pH=12的氨水中氨水浓度大于0.01mol·L-1;④pH=12的NaOH溶液中氢氧化钠浓度等于0.01mol·L-1;⑤0.01mol·L-1CH3COOH溶液与pH=12的氨水等体积混合后所得溶液,氨水过量,溶液呈碱性;⑥0.01mol·L-1HCl溶液与pH=12的NaOH溶液等体积混合所得溶液,二者恰好反应生成氯化钠,溶液呈中性。
(1)酸或碱抑制水电离,含有弱酸根或弱碱离子的盐促进水电离,①②③④⑤抑制水电离,⑥既不促进水电离也不抑制水电离,所以水的电离程度最大的是⑥;酸中氢离子浓度和碱中氢氧根离子浓度相等时,水的电离程度相同,②中氢离子浓度和③、④中氢氧根离子浓度相等,所以水的电离程度相同的是②③④。
(2)②0.01mol·L-1HCl溶液中pH=2,③pH=12的氨水中氨水浓度大于0.01mol·L-1,若等体积混合,则溶液呈碱性,要使二者混合溶液呈中性,则酸的量稍微大于碱。
(3)将这几种溶液稀释相同的倍数时,加水稀释促进弱电解质的电离,①中醋酸电离程度小于②,所以②中氢离子浓度大于①,所以①的pH>②;③④中氢氧根离子浓度相等,加水稀释促进一水合氨电离,导致③中氢氧根离子增多,所以③的pH>④;⑤中加水稀释后溶液仍然呈碱性;⑥的混合溶液呈中性,所以pH⑤>⑥。
(4)将①、④混合,若有c(CH3COO-)>c(H+),如果溶液中c(OH-)>c(H+),则混合溶液呈碱性,如果c(OH-)<c(H+),混合溶液呈酸性,如果c(OH-)=c(H+),混合溶液呈中性。
答案:(1)⑥②③④(2)>(3)>>>(4)A、B、C8.【能力挑战题】25℃时0.1mol·L-1的醋酸溶液的pH约为3,当向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大,对上述现象有两种不同的解释:甲认为:醋酸钠水解呈碱性,c(OH-)增大了,因而溶液的pH增大;乙认为:醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H +)减小,因此溶液的pH 增大。
(1)为了验证上述哪种解释正确,继续做如下实验:向0.1mol ·L -1的醋酸溶液中加入少量下列物质中的________(填写编号),然后测定溶液的pH 。
(已知25℃时,CH 3COONH 4溶液呈中性)。
A.固体CH 3COOK B.固体CH 3COONH 4 C.气体NH 3 D.固体NaHCO 3(2)加入(1)中物质后,若甲的解释正确,溶液的pH 应__________;若乙的解释正确,溶液的pH 应________(填“增大”“减小”或“不变”)。
(3)常温下将0.010mol CH 3COONa 和0.004mol HCl 溶于水,配制成0.5L 混合溶液。
判断:①溶液中共有________种粒子。
②其中有两种粒子的物质的量之和一定等于0.010mol,它们是________和________。
③溶液中n(CH 3COO -)+n(OH -)-n(H +)=________mol 。
【解析】(1)CH 3COONH 4溶液中,CH 3COO -和N都发生水解,且水解程度相等,CH 3COONH 4溶液呈中性,将CH 3COONH 4加入0.1mol ·L -1醋酸中使pH 增大,说明CH 3COO -抑制了醋酸的电离,其他物质的水溶液都呈碱性,不能用于证明。
