紫外-可见光谱分析数据-HCl
2紫外吸收光谱分析
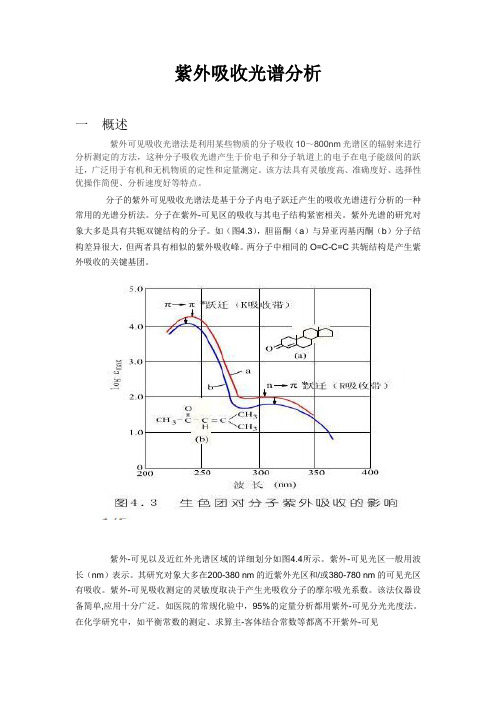
紫外吸收光谱分析一概述紫外可见吸收光谱法是利用某些物质的分子吸收10~800nm光谱区的辐射来进行分析测定的方法,这种分子吸收光谱产生于价电子和分子轨道上的电子在电子能级间的跃迁,广泛用于有机和无机物质的定性和定量测定。
该方法具有灵敏度高、准确度好、选择性优操作简便、分析速度好等特点。
分子的紫外可见吸收光谱法是基于分子内电子跃迁产生的吸收光谱进行分析的一种常用的光谱分析法。
分子在紫外-可见区的吸收与其电子结构紧密相关。
紫外光谱的研究对象大多是具有共轭双键结构的分子。
如(图4.3),胆甾酮(a)与异亚丙基丙酮(b)分子结构差异很大,但两者具有相似的紫外吸收峰。
两分子中相同的O=C-C=C共轭结构是产生紫外吸收的关键基团。
紫外-可见以及近红外光谱区域的详细划分如图4.4所示。
紫外-可见光区一般用波长(nm)表示。
其研究对象大多在200-380 nm的近紫外光区和/或380-780 nm的可见光区有吸收。
紫外-可见吸收测定的灵敏度取决于产生光吸收分子的摩尔吸光系数。
该法仪器设备简单,应用十分广泛。
如医院的常规化验中,95%的定量分析都用紫外-可见分光光度法。
在化学研究中,如平衡常数的测定、求算主-客体结合常数等都离不开紫外-可见二基本原理紫外可见吸收光谱的基本原理是利用在光的照射下待测样品内部的电子跃迁,电子跃迁类型有:(1)σ→σ* 跃迁指处于成键轨道上的σ电子吸收光子后被激发跃迁到σ*反键轨道(2)n→σ* 跃迁指分子中处于非键轨道上的n电子吸收能量后向σ*反键轨道的跃迁(3)π→π* 跃迁指不饱和键中的π电子吸收光波能量后跃迁到π*反键轨道。
(4)n→π* 跃迁指分子中处于非键轨道上的n电子吸收能量后向π*反键轨道的跃迁。
电子跃迁类型不同,实际跃迁需要的能量不同:σ→σ* ~150nmn→σ* ~200nmπ→π* ~200nmn→π* ~300nm吸收能量的次序为:σ→σ*>n→σ*≥π→π*>n→π*特殊的结构就会有特殊的电子跃迁,对应着不同的能量(波长),反反映在紫外可见吸收光谱图上就有一定位置一定强度的吸收峰,根据吸收峰的位置和强度就可以推知待测样品的结构信息三特点1、紫外可见吸收光谱所对应的电磁波长较短,能量大,它反映了分子中价电子能级跃迁情况。
第二章 可见紫外吸收光谱分析1

由于玻璃可吸收紫外光,所以玻璃棱镜只能用于
用于可见光域内。 石英棱镜可使用的波长范围较宽,可从185- 4000nm,即可用于紫外、可见和近红外三个光域。
光栅是利用光的衍射与干涉作用制成的。
它可用于紫外、可见及红外光域,而且
在整个波长区具有良好的、几乎均匀一 致的分辨能力。
它具有色散波长范围宽、分辨本领高、 成本低、便于保存和易于制备等优点。 缺点是各级光谱会重叠而产生干扰。
它是分光光度法定量分析的依据。
吸光系数
朗伯-比耳定律中,当c以克/升,液层厚 度b以厘米表示时,常数K以a表示,称 为吸光系数。 a的单位为升/克.厘米。 朗伯-比耳定律 :A=abc
摩尔吸光系数
朗伯-比耳定律中,浓度用摩尔/升,液 层厚度b用厘米为单位表示,则K用另一 符号ε来表示。 ε称为摩尔吸光系数(或克分子消光系数), 单位为升/摩尔.厘米。 它表示物质的浓度为1摩尔/升,液层厚 度为1厘米时溶液的吸光度。 朗伯-比耳定律 : A=εbc
72型 721型
751型 WFD-8型
760 40000
~
硅碳棒或 辉光灯
岩盐或萤 石棱镜
WFD-3型 WFD-7型
一、组成部件
光源
单色器
样品池
记录装置
检测器
(一)光源
对光源的基本要求是应在仪器操作所 需的光谱区域内能够发射连续辐射,有足 够的辐射强度和良好的稳定性,而且辐射 能量随波长的变化应尽可能小。 常用的光源有热辐射光源(如钨丝灯 和卤钨灯)和气体放电光源(如氢灯和氘 灯)两类。
1)非单色光的影响: 光吸收定律的重要前提是入射光
分析化学实验智慧树知到课后章节答案2023年下温州医科大学

分析化学实验智慧树知到课后章节答案2023年下温州医科大学温州医科大学第一章测试1.为使天平读数从0.000g切换为0.0000g,应采取下列哪个步骤()A:长按cal/1/10键 B:长按ON/OFF键 C:短按cal/1/10键 D:短按ON/OFF键答案:短按cal/1/10键2.称量在空气中性质不稳定的试样时,应采用下列哪种称量方法()A:选项均可 B:差减法 C:直接法 D:定量法答案:差减法3.电子天平的水平泡如果偏向右边,说明右边低了,要升高右边的脚或降低左边的脚。
()A:错 B:对答案:错4.用容量瓶准确配制溶液时,最后的定容应该放置在水平的桌面上完成。
()A:对 B:错答案:错5.分析天平平衡读数时,必须关好天平的左右两侧边门。
()A:对 B:错答案:对第二章测试1.移液管在取液前需要用待取液润洗两到三次。
()A:对 B:错答案:对2.在用移液管移取液体时,当液面升高到刻度线以上时,立即用食指按住移液管上口,将移液管提起离开液面,先用滤纸擦掉移液管外壁上的液膜,然后将移液管的末端靠在容器内壁上,调好液面高度。
()A:错 B:对答案:对3.使用吸量管分别移取不同体积的同一溶液时,应尽量使用同一支吸量管。
()A:对 B:错答案:对4.在平行实验中,第一份样品滴定完成后,如果滴定管中的标准溶液还留下一半以上,可以继续用来滴定第二份样品,以免浪费试剂。
()A:对 B:错答案:错5.盐酸滴定氢氧化钠,到终点时消耗的滴定剂的体积,记录正确的是()A:24.00 mL B:24 mL C:24.0 mL D:24.0000 mL答案:24.00 mL第三章测试1.紫外分光光度计不需要经常鉴定的项目是()A:杂散光 B:波长的准确度 C:pH对测定的影响 D:吸收度准确性答案:pH对测定的影响2.紫外分光光度计的定量原理()A:摩尔吸收系数表示 B:透射光比率 C:与入射光强度、吸收介质厚度与浓度成正比 D:透射光除以入射光答案:与入射光强度、吸收介质厚度与浓度成正比3.使用紫外分光光度计测定时,取吸收池,手指应拿毛玻璃面的两侧,使用挥发性溶液时应加盖,透光面要用擦镜纸由上而下擦拭干净。
仪器分析_紫外-可见分光光度和红外光谱法习题及参考答案

第三章紫外可见吸收光谱法一、选择题1、人眼能感觉到的可见光的波长范围是()。
A、400nm~760nmB、200nm~400nmC、200nm~600nmD、360nm~800nm2、在分光光度法中,透射光强度(I)与入射光强度(I0)之比I/I0称为( )。
A、吸光度B、吸光系数C、透光度D、百分透光度3、符合朗伯-比尔定律的有色溶液在被适当稀释时,其最大吸收峰的波长位置( )。
A、向长波方向移动B、向短波方向移动C、不移动D、移动方向不确定·4、对于符合朗伯-比尔定律的有色溶液,其浓度为c0时的透光度为T0;如果其浓度增大1倍,则此溶液透光度的对数为( )。
A、T0/2B、2T0C、2lgT0D、5、在光度分析中,某有色物质在某浓度下测得其透光度为T;若浓度增大1倍,则透光度为( )。
A、T2B、T/2C、2TD、T1/26、某物质的摩尔吸光系数很大,则表明( )。
A、该物质溶液的浓度很大B、光通过该物质溶液的光程长C、该物质对某波长的光的吸收能力很强D、用紫外-可见光分光光度法测定该物质时其检出下限很低7、在用分光光度法测定某有色物质的浓度时,下列操作中错误的是( )。
A、比色皿外壁有水珠B、待测溶液注到比色皿的2/3高度处)C、光度计没有调零D、将比色皿透光面置于光路中8、下列说法正确的是( )。
A、透光率与浓度成正比B、吸光度与浓度成正比C、摩尔吸光系数随波长而改变D、玻璃棱镜适用于紫外光区9、在分光光度分析中,常出现工作曲线不过原点的情况。
与这一现象无关的情况有( )。
A、试液和参比溶液所用吸收池不匹配B、参比溶液选择不当C、显色反应的灵敏度太低D、被测物质摩尔吸光系数太大10、质量相等的A、B两物质,其摩尔质量M A>M B。
经相同方式发色后,在某一波长下测得其吸光度相等,则在该波长下它们的摩尔吸光系数的关系是( )。
A、εA>εBB、εA<εBC、εA=εBD、2εA>εB11、影响吸光物质摩尔吸光系数的因素是( )。
紫外分光光度法测定食盐中的碘含量

Cl,3.0 mL10 % NaCl溶液,再分别加入0,
0.5,1.0,2.0,3.0,4.0,5.0 mL 10.0 μ g / mL的KIO3标准使用液,用水冲至刻 度,摇匀。以空白溶液作为参比,分别在 最大吸收峰285nm和351nm 处测定吸光度值。 浓度为横坐标,对应的吸光度值为纵坐标, 绘制工作曲线或进行线性回归,求得线性
四.实验步骤
1.仪器与试剂
仪器:岛津UV-1700型分光光度计 KIO3标准溶液(储备液):1.0
mg / mL(以KIO3
计),使用时 稀释为10.0μ g / mL 的使用液。
KI溶液:0.05 HCl溶液:0.1 NaCl溶液:10
mol / L mol / L %
四.实验步骤
度,摇匀。分别在285nm和351nm 处测定吸光度值,记录实验数据。
五.数据处理
由线性回归方程求得含量或在工作曲线上查 得含量,计算食盐样品中的碘含量。
A 0.8 0.6 0.4 0.来自 0 0 0.5 u g/ml 1 1.5
y = 0.598x + 0.0836 R 2 = 0.9995
六.思考题
A=lg(I0/It)=kbc
吸光度 介质厚度(cm)
二.紫外分光光度法简介
2 、光学光谱区
远紫外
(真空紫外)
近紫外 可见
近红外
中红外
远红外
10nm~200nm 200nm ~380nm
380nm ~ 780nm
780 nm ~ 2.5 m
2.5 m ~ 50 m
50 m ~300 m
紫外分光光 度法工作区
2.实验流程
吸收曲线绘制
工作曲线绘制 样品测定 吸收曲线的绘制 取步骤[2]中任一标准溶液 在分光光度计上从250 nm 至
《环境仪器分析》第五章 紫外-可见吸收光谱法 (2)

碘钨灯:波长范围340-1200 nm。无论钨灯或碘钨灯, 在可见区发射的能量与工作电压4次方成正比,因此,预 使光源稳定,必须由一个很好的稳定电源。
紫外区:气体放电光源,如氢、氘灯。适用的波长 范围185~400 nm的连续光谱。
光栅是利用光的衍射与 干涉作用制成的,它可用 于紫外、可见及近红外光 域,而且在整个波长区具 有良好的、几乎均匀一致 的分辨能力。
优点:色散波长范围宽 、分辨本领高、成本低、 便于保存和易于制备等;
缺点:各级光谱会重叠 而产生干扰。
2019/10/31
6
3、样品室
样品室(吸收池,常用比色皿)
紫外区:必须是石英池 可见和近红外区:玻璃 池或石英池
2019/10/31
7
4、检测器(光电倍增管)
光
电子倍增极
敏
阴
极
电子倍 增极
光
R1
R2
R3
R4
负电压
阳
R
极
mA
R5
5、读数装置: 记录仪、数字显示器
2019/10/31
8
二、常用紫外-可见仪器类型
单光束紫外-可见分光光度计 双光束紫外-可见分光光度计 双波长分光光度计
例如:0.2M Na2SO4 溶解偶氮基—N=N—染料(甲基橙), 可以选择0.2 M Na2SO4作为溶剂参比。
2019/10/31
36
(2)试剂参比
如果显色剂或其他试剂在测定波长有吸收, 按显色反应条件下,只是不加入试样,同样加 入试剂和溶剂作为参比,可消除试剂中的组分 产生吸收的影响。
Fe2+ + 邻二氮菲 → 橙红色络合物
分析化学课后习题答案(第六版-李发美)
第十章紫外-可见分光光度法1.名词解释:吸光度、透光率、吸光系数(摩尔吸光系数、百分吸光系数)、发色团、助色团、红移、蓝移。
2.什么叫选择吸收?它与物质的分子结构有什么关系?物质对不同波长的光吸收程度不同,往往对某一波长(或波段)的光表现出强烈的吸收。
这时称该物质对此波长(或波段)的光有选择性的吸收。
由于各种物质分子结构不同,从而对不同能量的光子有选择性吸收,吸收光子后产生的吸收光谱不同,利用物质的光谱可作为物质分析的依据。
3.电子跃迁有哪几种类型?跃迁所需的能量大小顺序如何?具有什么样结构的化合物产生紫外吸收光谱?紫外吸收光谱有何特征?电子跃迁类型有以下几种类型:σ→σ*跃迁,跃迁所需能量最大;n →σ*跃迁,跃迁所需能量较大,π→π*跃迁,跃迁所需能量较小;n→ π*跃迁,所需能量最低。
而电荷转移跃迁吸收峰可延伸至可见光区内,配位场跃迁的吸收峰也多在可见光区内。
分子结构中能产生电子能级跃迁的化合物可以产生紫外吸收光谱。
紫外吸收光谱又称紫外吸收曲线,是以波长或波数为横坐标,以吸光度为纵坐标所描绘的图线。
在吸收光谱上,一般都有一些特征值,如最大吸收波长(吸收峰),最小吸收波长(吸收谷)、肩峰、末端吸收等。
4.Lambert-Beer定律的物理意义是什么?为什么说Beer定律只适用于单色光?浓度C与吸光度A线性关系发生偏离的主要因素有哪些?朗伯-比耳定律的物理意义:当一束平行单色光垂直通过某溶液时,溶液的吸光度A与吸光物质的浓度c及液层厚度l成正比。
Beer定律的一个重要前提是单色光。
也就是说物质对单色光吸收强弱与吸收光物质的浓度和厚度有一定的关系。
非单色光其吸收强弱与物质的浓度关系不确定,不能提供准确的定性定量信息。
浓度C与吸光度A线性关系发生偏离的主要因素(1)定律本身的局限性:定律适用于浓度小于0.01 mol/L的稀溶液,减免:将测定液稀释至小于0.01 mol/L测定(2)化学因素:溶液中发生电离、酸碱反应、配位及缔合反应而改变吸光物质的浓度等导致偏离Beer定律。
液体紫外分析实验---苯及其衍生物的紫外吸收光谱的测绘及溶剂对紫外吸收光谱的影响实验
苯及其衍生物的紫外吸收光谱的测绘及溶剂对紫外吸收光谱的影响实验一、目的要求1.了解不同的溶剂对苯甲醛的紫外吸收光谱的影响。
2.观察溶剂极性对苯甲醛的吸收光谱的影响。
3.学习并掌握紫外可见分光光度计的使用方法。
二、实验原理1、紫外吸收光谱的产生紫外吸收光谱法是由于物质吸收了一定波长的紫外光引起分子中价电子能级跃迁而形成的一种分析方法。
不同物质分子中电子类型、分布和结构不同,紫外光谱就不同,因此紫外光谱可用于定性和结构分析。
有机分子中有几种不同性质的价电子:形成单键的σ电子、形成双键的π电子以及氧、氮等杂原子所含的未成键的n电子。
可能产生的主要电子跃迁以及所需能量大小顺序如下:σ→σ*>n→σ*≥π→π*>n→π*其中,σ→σ*、n→σ*和孤立双键的π→π*跃迁所需能量较大,吸收带波长较短,一般出现在远紫外区(10~200 nm),在普通的紫外可见分光光度计的检测范围(200~1000 nm)之外。
共轭效应所形成的大π键各能级间距离较近,使π→π*跃迁能量下降,吸收带向长波方向移动到仪器检测范围内。
所以紫外吸收光谱研究的重点是共轭体系中π→π*和与双键相连接的杂原子(C=O、C=N、S=O等)上未成键的孤对电子的n→π*跃迁的结果。
紫外吸收光谱是带状光谱,吸收带的位置用吸收强度最大处的波长,即最大吸收波长(λmax)表示,吸收带的强度用该波长处的摩尔吸收系数(ɛmax)表示。
分子中有些吸收带已被指认,其中由共轭体系中π→π*产生的吸收带称为K带,其特点是吸收强度大,ɛmax在104 L•mol-1•cm-1左右,λmax随着共轭体系中双键数增加而增大,在217~280 nm范围内变化;n→π*产生的吸收带称为R带,是弱吸收带,ɛmax<100 L•mol-1•cm-1;在芳香族化合物中,环状共轭体系的π→π*产生E1、E2和B三个吸收带,其中E2和B带的吸收波长大于200 nm,能被仪器所检测。
紫外光谱在有机化合物结构分析中的应用
紫外光谱在化合物结构分析中的应用【摘要】紫外-可见光谱(ultraviolet一Visiblespeetroseopy,UV-Vis),也简称为紫外光谱(UV),属于吸收光谱的一种。
由于紫外光谱本身有许多特点:测量灵敏和准确度高,应用范围广,对很多金属元素和非金属元素及其化合物都能进行测定,也能定性或定量的测定大部分有机化合物;此外,仪器的价格比较便宜,操作简便、快速,易于普及推广,至今仍是有机化合物结构鉴定的重要工具。
因此,本文首先介绍紫外光谱用于定性分析的依据和一般规律,然后归纳了影响紫外-可见光谱的一些因素,最后举例说明紫外光谱在化合物结构分析中的应用。
【关键词】紫外-可见光谱定性分析影响因素结构分析光谱数据前言紫外吸收光谱是分子中最外层价电子在不同能级轨道上跃迁而产生的,它反映了分子中价电子跃迁时的能量变化与化合物所含发色基团之间的关系。
UV谱图的特征首先取决于分子中含有的双键数目、共轭情况和几何排列,其次取决于分子中的双键与未成键电子的共轭情况和其周围存在的饱和取代基的种类和数目,它主要提供了分子内共轭体系的结构信息[1]。
通常UV谱图组成比较简单,特征性不是很强,但用它来鉴定共轭发色基团却有独到之处。
UV吸收谱带的位置和摩尔消光系数的数值,一般无法判断官能团的存在,但它能提供化合物的结构骨架及构型、构象情况,因此至今仍为一项重要的测试分子结构的有用手段。
紫外-可见吸收光谱是化学分析中常用的一种快速、简便的分析方法,广泛用于有机[2-3]、无机[4]、生化[5]、涂料[6]、药物[7]等领域和国民经济部门[8]。
紫外光谱用于定性分析的依据和一般规律利用紫外光谱定性分析应同时考虑吸收谱带的个数、位置、强度以及形状。
从吸收谱带位置可以估计被测物结构中共轭体系的大小;结合吸收强度可以判断吸收带的类型,以便推测生色团的种类。
注意所谓吸收带的形状主要是指其可反映精细结构,因为精细结构是芳香族化合物的谱带特征。
第十一章紫外可见分光光度法第十一章紫外
第十一章紫外-可见分光光度法第十一章紫外-可见分光光度法第一节概述1.电磁辐射和电磁波谱在仪器分析中,根据物质发射的电磁辐射或物质与辐射的相互作用所建立起来分析方法,统称为光学分析法。
根据物质与辐射能间作用的性质不同,光学分析法又分为光谱法和非光谱法。
当物质与辐射能相互作用时,物质内部发生能级跃迁,根据能级跃迁所产生的辐射能强度随波长变化所得的图谱称为光谱(spectrum)。
利用物质的光谱进行定性、定量和结构分析的方法称为光谱分析法(spectroscopic analysis),简称光谱法。
光谱分析法从不同的角度分为不同的类别。
如按作用物是分子或原子,可分为分子光谱法和原子谱法;物质与辐射能间的转换方向(能级跃迁方向),可分为吸收光谱法和发射光谱法;按辐射源的波长不同,可分为红外光谱法、可见光谱法、紫外光谱法、X-射线光谱法等。
非光谱分析法是物质受辐射线照射时,改变电磁波的传播方向、速度等物理性质所建立起来的分析方法。
这种方法不涉及能量转移和物质内部的能级跃迁,如折光分析法、旋光分析法、X-射线衍射法等。
2.物质对光的选择性吸收当辐射能通过某些吸光物质时,物质的原子或分子吸收与其能级跃迁相应的能量由低能态跃迁至较高的能态,这种由物质对辐射能的选择性吸收而得到的原子或分子光谱称为吸收光谱。
几种常用的吸收光谱是:原子吸收光谱、分子吸收光谱、核磁共振光谱等。
各种色光的波长范围在可见光中,紫色光的波长最短能量最大,红色光的波长最长能量最小。
除此之外,波长小于400nm 的光称为紫外光,波长大于760nm 的光称为红外光。
如果适当选配两种颜色的光按一定的强度比例混合,也可以获得白光,则这两种色光称为互补色光。
如图11-1所示,处于直线相连的两种色光互为补色光,如绿色光与紫色光互补,蓝色光与黄色光互补等等。
第二节 基本原理1.吸收光谱光照射某物质,物质能够吸收光,使原有的基态转为激发态,只有当分子红橙黄绿青青蓝蓝紫白光的能量(hν)与被照射物质粒子的基态和激发态能量之差(∆E)相等时才能被吸收。
