离子通道研究技术的最新进展_全自动膜片钳技术
膜片钳技术的发展和应用

膜片钳的发展和应用1.背景细胞是生物的基本组成单元,细胞外围有一层薄膜,彼此分离又互相联系,细胞间与细胞内的通信、信号传递依靠其膜上的离子通道来进行,离子和离子通道是细胞兴奋性的基础,亦是产生生物电的基础。
生物电信号通常是用电学或电子学的方法进行测量。
早期多采用双电极电压钳技术作胞内记录,近年来逐渐被膜片钳所取代,这项技术为从细胞和分子水平了解生物膜离子单通道“开启”和“关闭”的门控动力学及各种不同离子通道的通透性和选择性等膜信息提供了最直接的手段。
膜片钳记录(patch clamp recording)是利用玻璃微电极吸引封接面积仅为几个um2的细胞膜片,在10-12A水平,记录单个或几个通道的离子电流,已达到当今电子测量的极限。
此技术广泛用于细胞膜离子通道电流的测量和细胞分泌、药理学、病理生理学、神经科学、脑科学、植物细胞的生殖生理等领域的研究。
从而点燃了细胞和分子水平的生理学研究的生命之火,并取得了丰硕的成果。
2.膜片钳技术简介2.1 基本原理和记录方法电压钳(V oltage-clamp)是由英国学者Huxley和Katz最先应用的[1]。
其实质是通过负反馈微电流放大器在兴奋性细胞膜上外加电流,保持细胞跨膜电位不变,并迅速控制其数值,以观察在不同膜电位条件下膜电流的情况。
膜电流的改变反映了膜电阻和膜电容的变化,因此电压钳可用来研究整个细胞膜或一大块细胞膜上所有离子通道的活动,但该技术由于在细胞内插人两根电扳,对细胞损伤很大,在小细胞中难以实现,又因细胞形态复杂,很难保持细胞膜各处生物特性的一致,而逐渐被膜片钳所取代。
膜片钳技术(patch-clamp)是在电压钳基础上发展起来一种新技术,与电压钳的主要区别有二:一是钳制膜电位的方法不同;二是电位固定的细胞膜面积不同,即所研究的离子通道数目不同。
与电压钳一样,膜片钳也是利用负反馈电子线路,将微电板尖端所吸附的一个至几个平方微米的细胞膜电位固定在一定水平,观察流过通道的离子电流。
膜片钳的发展与应用

膜片钳技术的发展与应用崔梦梦(生命科学学院 1241410026)摘要:膜片钳技术是在电压钳技术的基础上发展起来的,该技术的核心是能够记录单一离子通道的电流。
膜片钳可以测量到0.06pA的电流,它具有1um的空间分辨率和10us的时间分辨率。
作为先进的细胞电生理技术,膜片钳一直被奉为研究离子通道的“金标准”。
应用膜片钳技术可以证实细胞膜上离子通道的存在并能对其电生理特性、分子结构、药物作用机稍等进行深入的研究。
此外,将膜片钳技术与其他一些先进的技术结合,使其在药理学、病理学、神经科学、脑科学、细胞生物学和分子生物学等生物科学方面,,得到了越来越广泛的应用。
关键词:膜片钳;离子通道;发展与应用在细胞膜上存在有许多的离子通道,这些离子通道是细胞兴奋性的基础,对细胞内以及细胞之间的信息传递起着非常重要的作用。
为探究离子通道的功能和结构,许多电生理技术被发明创造。
英国学者Huxley和Katz最早应用电压钳来研究细胞膜上离子通道的电流变化,但由于该技术钳制的细胞膜面积很大,包含着大量随机开放和关闭着的离子通道,因而不能测定单一离子通道电流。
所以在1976年德国神经生物学家Erwin Neher和Bert Sakmann 建立起一种新的技术,即膜片钳技术,并且逐渐取代了电压钳技术。
随着膜片钳技术的不断完善,自1981年以来, 该技术已经在不同动物的肝、脾、胃肠、心肌、骨骼肌、神经系统、内分泌等各类细胞上应用并取得了研究成果。
膜片钳技术点燃了细胞和分子水平的生理学研究的革命之火,给生命科学研究带来了巨大的前进动力。
一、膜片钳技术的基本原理膜片钳技术是利用玻璃微电极尖端经抛光后贴附于神经元膜上,与玻璃微电极尖端相接的膜仅含1—3个离子通道,然后通过负压吸引将这片膜与周围的膜实行高阻封接,因此在电极尖端覆盖下的那片膜,在电学上已于膜的其他部分相互分隔。
电极尖端下的膜通道开放所产生的电流流进玻璃微电极吸管,通过一极其敏感的膜片钳放大器,就可测量得到单一离子通道电流。
膜片钳前期调研综述

膜片钳前期调研综述膜片钳技术是一种以记录通过离子通道的离子电流来反映细胞膜上单一的(或多个)离子通道分子活动的技术。
作为先进的细胞电生理技术,膜片钳一直被奉为研究离子通道的“金标准”。
应用膜片钳技术可以证实细胞膜上离子通道的存在并能对其电生理特性、分子结构、药物作用机制等进行深入的研究。
1.膜片钳技术原理膜片钳技术(patch-clamp technique)是在电压钳技术的基础上发展起来的,采用记录流过离子通道的离子电流,来反映细胞膜上单一的(或多个的)离子通道分子活动的技术。
该技术将一尖端经加热抛光的玻璃微电极管吸附在只有几平方微米的细胞膜上,通过在玻璃电极尖端边缘与细胞膜之间形成高阻封接,使与微电极尖开口处相连的细胞膜的小区域(膜片)与其周围的细胞膜在电学上完全分隔。
将膜片内开放所产生的电流流进玻璃吸管,用一个膜片钳放大器测量此电流强度,就得到单一离子通道电流。
原理(见图1)2.膜片钳技术发展历史膜片钳技术是在电压钳(voltageclamp)技术的基础上发展起来的,电压钳技术由Cole和Marment设计,后经Hodgkin和Huxley改进并成功地应用于神经纤维动作电位的研究。
1976年德国马普生物物理化学研究所Neher和Sakmann首次在青蛙肌细胞上用双电极钳制膜电位的同时,记录到ACh激活的单通道离子电流,从而产生了膜片钳技术。
1981年Hamill和Neher等人对最早的膜片钳方法和电子线路做了较大的改进和完善,使其电流测量的灵敏度达到1pA,时间和空间分辨率分别达到10μs和1μm,并已逐步发展出几种适合不同需要的记录模式。
根据膜片与电极之间的关系,将这些记录模式分为四种:细胞吸附式、膜内面向外模式、膜外面向外模式、全细胞模式四种。
3.膜片钳技术优缺点膜片钳技术对细胞膜通道电流的记录具有很高的分辨率,信息含量大;能够改变细胞膜电位,进行单细胞记录,同时可以控制改变细胞的内外溶液成分,灵活性好;应用范围广,可以分析检测所有的离子通道类型;能记录到pA级电流变化和单通道开关状态,因此具有很高的高灵敏性;相对于荧光标记和放射性标记等手段具有更高权威性和精确性。
上海细胞生物学膜片钳电生理技术原理及步骤

上海细胞生物学膜片钳电生理技术原理及步骤细胞生物学是研究细胞结构、功能和生理过程的学科,而膜片钳电生理技术是细胞生物学中的一种重要技术手段。
本文将介绍上海细胞生物学膜片钳电生理技术的原理及步骤。
一、原理膜片钳电生理技术是一种用于研究细胞膜离子通道的技术。
其原理是利用玻璃微管制成的膜片钳,将其吸附在细胞膜上,形成一个微小的封闭空间,即膜片钳。
通过在膜片钳上施加一定的电压,可以控制细胞内外液体的离子浓度,从而研究细胞膜离子通道的电生理特性。
二、步骤1. 制备膜片钳制备膜片钳需要用到玻璃微管,将其拉制成细长的管状,然后用火烧制成膜片钳。
制备好的膜片钳需要经过严格的检测,确保其质量符合要求。
2. 细胞培养需要选取适合的细胞进行培养,一般选择小鼠神经元或人类癌细胞等。
细胞需要在培养皿中进行培养,保证其生长繁殖。
3. 细胞贴壁将培养好的细胞移植到实验室制备好的培养皿中,让其自然贴壁。
贴壁后的细胞需要进行一定的处理,如加入酶类物质,使其膜片变得柔软。
4. 制备膜片钳将制备好的膜片钳放置在细胞膜上,通过吸附的方式将其固定在细胞膜上。
制备好的膜片钳需要经过严格的检测,确保其质量符合要求。
5. 施加电压通过在膜片钳上施加一定的电压,可以控制细胞内外液体的离子浓度,从而研究细胞膜离子通道的电生理特性。
在施加电压的过程中,需要注意控制电压的大小和时间,以避免对细胞造成损伤。
6. 数据分析通过对实验数据的分析,可以得出细胞膜离子通道的电生理特性,如离子通道的开放概率、电导率等。
这些数据可以为后续的研究提供重要的参考。
上海细胞生物学膜片钳电生理技术是一种重要的细胞生物学研究手段,通过制备膜片钳和施加电压等步骤,可以研究细胞膜离子通道的电生理特性,为细胞生物学研究提供了重要的工具和方法。
膜片钳技术及其应用

膜片钳技术可以用于研究细胞信号转导过程中离子通道和受体的变 化,了解信号转导的机制。
细胞功能调控的研究
膜片钳技术可以用于研究细胞功能调控的机制,例如细胞兴奋性的 调节和细胞内离子浓度的变化。
04 膜片钳技术的优势与局限 性
膜片钳技术的优势
高灵敏度
细胞无损
膜片钳技术具有高灵敏度,能够检测单 个离子通道的活动,从而提供关于细胞 膜电位和离子通道功能的重要信息。
膜片钳技术可以在保持细胞完整性的 情况下进行实验,不会对细胞造成严 重损伤或干扰细胞的正常功能。
实时监测
膜片钳技术可以对细胞膜电位进行实时 监测,从而了解离子通道的动态变化, 有助于深入理解细胞生理和病理过程。
膜片钳技术的局限性
1 2 3
实验条件要求高
膜片钳技术需要高精度的实验设备和条件,包括 低温、低噪声和低阻抗等,这增加了实验的难度 和成本。
03
04
05
膜片钳放大器
微操纵器
细胞培养皿或显 微镜载玻片
电极溶液
细胞内和细胞外 灌流液
用于放大细胞膜电信号, 提高信号的检测灵敏度。
用于精确控制电极的移动 ,以便在细胞膜上定位和 进行膜片钳实验。
用于培养和固定细胞,以 便进行膜片钳实验。
用于填充电极,以保持电 极的湿润和导电性。
用于维持细胞内外环境的 稳定,并排除干扰实验的 物质。
03
在单细胞水平上研究细胞信号转导和离子通道功能,深入了 解细胞生理和病理过程。
膜片钳技术与其他技术的联合应用
结合光学成像技术,利用膜片钳技术对神经元电生理特性进行同时监测和成像,实现多参数的同时测 量。
与基因编辑技术结合,利用膜片钳技术对特定基因表达的离子通道进行功能研究,深入了解基因与离子 通道的关系。
膜片钳技术及其在星形胶质细胞钾离子通道研究中的应用

等-进一步完善 了该项技术 , 4 使小片膜孤立并使吸 管与细胞膜之间的连接更 为紧密, 形成 电隔离和机 械 隔离 , 减少 记录 的背景 噪音水平 , 对拓宽 记录频 相
位又可记录膜电流。这种膜片用以研究细胞外物质 对细胞膜上所有通道 的作用 , 可在 同一细胞上观察
几 种不 同通 道 的情况 。
1 2 1 细胞 贴 附式 (el t c e a h 。。 cla ah dp t ) t c
发育、 突触传递、 组织修复与再生、 神经免疫等方面 , 都起 着 十分重 要 的作 用 … 。研究 还 表 明星 形胶 质 细胞与疼 痛 也 有着 非 常 密 切 的关 系 - 。 细胞 膜 上 2 J
带 范 围 , 高 了时间 、 间及 电流分辨 率 。 提 空
1 2 膜 片钳技 术记 录方式 .
膜 片钳 技术 目前 已发 展 出许多适 合不 同需 要 的 记 录形式 -6。根 据 不 同 的研 究 目的 , 选 择 不 同 5 . J 可 的膜 片构型 。主要 有 以下几种 类型 。
高阻 封接形成 后 , 将微 管 电极 轻轻 提起 , 再 使其 与 细胞分离 , 电极 端形成 密封 小泡 , 在空气 中短 暂暴
露几 秒钟后 , 泡 破 裂再 回 到 溶 液 中就 得 到 “ 面 小 内
床 医学 的广泛重 视 , 现就 膜 片钳 技 术及 其 在 星形 胶 质 细胞 钾 离子通道 研究 中 的应用 进行综 述 。 1 膜片钳 技术
是用玻 璃微 电极 吸管 的尖端 , 过 抛光 处 理后 使 其 经
膜外侧面接触浴槽液。这种膜片多用予研究细胞外 物质 、 药物 等对单 通道 的作用 , 录到 的是单 通道 电 记
流。
膜片钳技术
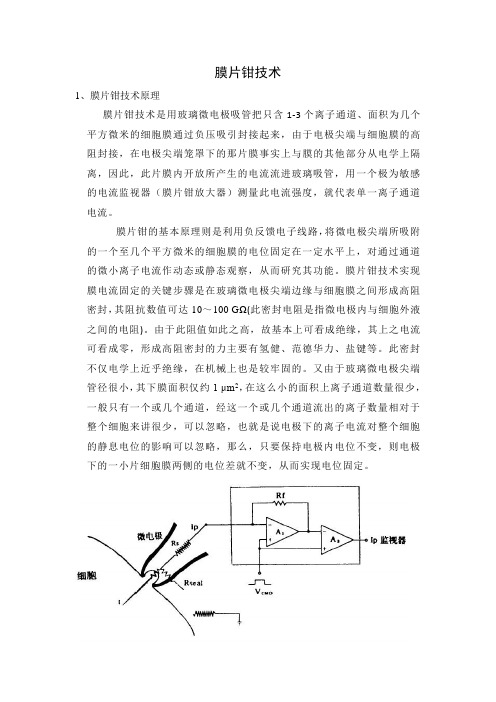
膜片钳技术1、膜片钳技术原理膜片钳技术是用玻璃微电极吸管把只含1-3个离子通道、面积为几个平方微米的细胞膜通过负压吸引封接起来,由于电极尖端与细胞膜的高阻封接,在电极尖端笼罩下的那片膜事实上与膜的其他部分从电学上隔离,因此,此片膜内开放所产生的电流流进玻璃吸管,用一个极为敏感的电流监视器(膜片钳放大器)测量此电流强度,就代表单一离子通道电流。
膜片钳的基本原理则是利用负反馈电子线路,将微电极尖端所吸附的一个至几个平方微米的细胞膜的电位固定在一定水平上,对通过通道的微小离子电流作动态或静态观察,从而研究其功能。
膜片钳技术实现膜电流固定的关键步骤是在玻璃微电极尖端边缘与细胞膜之间形成高阻密封,其阻抗数值可达10~100 GΩ(此密封电阻是指微电极内与细胞外液之间的电阻)。
由于此阻值如此之高,故基本上可看成绝缘,其上之电流可看成零,形成高阻密封的力主要有氢健、范德华力、盐键等。
此密封不仅电学上近乎绝缘,在机械上也是较牢固的。
又由于玻璃微电极尖端管径很小,其下膜面积仅约1 μm2,在这么小的面积上离子通道数量很少,一般只有一个或几个通道,经这一个或几个通道流出的离子数量相对于整个细胞来讲很少,可以忽略,也就是说电极下的离子电流对整个细胞的静息电位的影响可以忽略,那么,只要保持电极内电位不变,则电极下的一小片细胞膜两侧的电位差就不变,从而实现电位固定。
膜片钳技术的原理图[51]Rs是与膜片抗阻串联的局部串联电阻(或称入路阻抗),Rseal是封接阻抗。
RS通常为1~5MΩ,如果Rseal高达10GΩ以上是成为Ip/I=Rseal/(Rs+Rseal)-1。
此Ip可作为I~V转换器(点线)内的高阻抗负反馈电阻(Rf)的电压下降而被检测出。
实际上这是场效应管运算放大器(A1)的输出中包括着膜电阻成分,这部分将在通过第二级场效应管运算放大器(A2)时被减掉。
本实验采用的是全细胞记录模式。
全细胞记录构型(whole-cell recording)高阻封接形成后,继续以负压抽吸使电极管内细胞膜破裂,电极胞内液直接相通,而与浴槽液绝缘,这种形式称为“全细胞”记录。
膜片钳技术在各学科研究中的应用

膜片钳技术在各学科研究中的应用在神经科学领域,膜片钳技术被广泛应用于研究神经元和突触的电生理特性。
通过使用膜片钳技术,科学家可以记录神经元膜通道的电流,研究神经信号的传递和调节机制。
例如,陈教授和他的研究团队利用膜片钳技术发现了一种新的神经调节机制,他们发现了一种离子通道蛋白,可以调节神经元的兴奋性,从而对神经信号的传递产生影响1。
在细胞生物学领域,膜片钳技术被用于研究细胞的跨膜运输和信号转导机制。
科学家可以记录细胞膜通道的开放和关闭,研究物质进出细胞的方式和调控机制。
例如,张教授和他的研究团队利用膜片钳技术发现了新的钙离子通道,并研究了其在对细胞生长和凋亡的调控中的作用2。
在代谢疾病领域,膜片钳技术也被用于研究代谢过程中细胞膜通道的变化。
例如,糖尿病患者的肾小管上皮细胞钠通道存在异常,导致钠重吸收增加,从而影响血糖的排泄和代谢。
李教授和他的研究团队利用膜片钳技术发现了这一现象,为糖尿病的治疗提供了新的思路3。
膜片钳技术在各学科研究中都具有广泛的应用前景。
然而,随着科学技术的发展,膜片钳技术仍然面临着一些挑战,例如通道蛋白多样性和复杂性的问题,以及实验数据的分析和解读问题。
未来,随着膜片钳技术的不断改进和新技术的应用,我们相信这些问题会逐渐得到解决。
微光学器件在光通信、生物医学、军事等领域的应用越来越广泛。
传统的微光学器件制造技术如光刻、干法刻蚀等存在加工成本高、设备复杂等问题,难以满足某些特定场景下的制造需求。
因此,研究一种新型的微光学器件制造技术具有重要的现实意义。
气动膜片式微滴喷射制造技术作为一种具有潜力实现微光学器件高效、低成本制造的技术,逐渐受到研究者的。
气动膜片式微滴喷射制造技术基于气动学原理,通过控制气体和液体的流速、压力等参数,实现液滴的精确喷射。
该技术具有以下优点:可实现高效、低成本的制造,有望替代传统微光学器件制造技术;可通过计算机控制系统实现精确控制,提高制造精度;适用范围广,可用于各种形状和材料的光学器件制造。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
优 点
缺 点
A高信息量 :能改变细胞膜电位 ,单细胞记录 B高灵敏性 :能记录到 pA级电流变化和单通道 开关状态 C灵活性好 :可以控制改变细胞膜内外的溶液成分 D应用范围广 :可以分析检测所有的离子通道类型 E相对于荧光标记和放射性标记等手段具有更高权 威性和精确性 〔1〕
图 1 多种膜片钳技术实现的原理及过程图示〔4〕 ( a) 传统膜片钳 :移动玻璃微电极至选定的细胞膜上 ; ( b) 平 板微阵列膜片钳 :通过负压的作用把自动细胞摆放在微电极记录尖 端 ; ( c) 翻转膜片钳 :细胞从管顶端注入微管内部并被冲到管底 。
1. 2 封接的质量问题 一般而言 ,能达到 1GΩ 以上的封接都能够满足
在进行药物粗筛时 ,通常制药公司会选择投入 10~20万欧元以完成一百万个化合物的测试 。而 在进行第二次药物化合物筛选和药物安全性测试中 (如 hERG早期安全性测试 ) ,为尽早得到药物的药 理和毒理相关的高质量的数据 ,用户愿意投入 5 ~ 10欧元 /数据点 。目前而言 ,使用 Flyion 公司 Fly2 screenµ 8500的耗材价格相对比较便宜 ,平均每获 得一个数据点大约需要投入 5欧元左右 。其他几个 公司分别为 : Nanion 公司的 PatchL iner NPCκ 216 需 要花费 10欧元以上 /数据点 ; Molecular Devices公司 的 Ionworks HT和 PatchXp ress 7000A 也分别需要投 入 10欧元左右以获得一个数据点 。 1. 6 各款仪器的其它优点
47
现代仪器 (www. moderninstrs. org. cn)
二 ○○七年 ·第二期
Flyion 公司采用的是翻转膜片钳技术 ( FL IP2 THE2TIP) ,全部操作过程由软件设定机器人完成 。 流程如下 :机器人自动将细胞注入 Flip tip 微管 ( Fly2 ion公司专利技术 ) ,然后自动把细胞冲洗到管尖底 部 ,在负压的吸引下形成传统的吉欧封接 。自动判 断封接形成是否良好并自动破膜形成全细胞模式 。 随后 ,药物化合物等可以被自动应用到管内进行全 细胞模式实验 。这种方式形成的膜片钳完全排除显 微镜和显微操作 ,从而革命性的实现膜片钳技术的 全自动化〔7, 8〕。各自的膜片钳实现原理 (见图 1) 。
片需要每隔一小段时间进行手工替换 ,因此在全自 动的性能表现方面还需要提高 。 Ionworks HT是目 前市场上面通量表现最高的仪器 ,且由于其独特的 “PPC”技术 ,在实验的成功率方面表现也很优秀 。 PatchXp ress 7000A 的通量表现和实验数据质量方面 也是表现良好 。
拟筛选技术进行初筛 ,把初筛结果再结合全自动膜 片钳技术进行实验上的验证 。虚拟筛选技术〔3〕,即 把已经测定三维结构的小分子化合物或者是多肽化 合物与已经测定三维结构的生物大分子靶标 (如离 子通道 ) ,通过分子对接软件进行计算机模拟 ,最后 得到小分子 - 受体复合物的三维结构 ,而进行筛选 研究 。虚拟筛选的目的同样是从数十万到数百万化 合物库中筛选出可能的小分子化合物 ,再进一步进 行实验研究 。把全自动膜片钳技术结合以离子通道 为靶标的高通量虚拟筛选研究技术 ,无疑将会极大 的缩短研究时间和节省大量的研究经费 。
A 需要受过良好训练的电生理学专家 B通量很低 ,一天的实验数据量不超过 10 C劳动力投入密集 ,试验操作过程复杂 D不适合药物粗筛 /二次筛选 E技术自动化非常困难 ,且不能进行平行检测
1 多款全自动膜片钳系统分析
1. 1 技术实现原理 Nanion 公司的 PatchL iner NPCκ 216 , Molecular
同时 ,根据该规章的要求美国 FDA 撤除由于致 QT 间期延长的处方药 ,约为全部从市场撤除处方药的 40% 。为此 ,新的早期药物安全评测方式需要引入 制药研发过程中 ,以便及早发现候选化合物潜在的 心脏毒性 ,尽可能减少新药研发的投资与风险 ,而采 用全自动膜片钳技术正是解决该问题的最佳选择 。
引言
细胞是通过细胞膜与外界隔离的 ,在细胞膜上 有很多种离子通道 ,细胞通过这些通道与外界进行 离子交换 。离子通道在许多细胞活动中都起关键作
病主要 有 : 癫 痫 ( ep ilep sy) 、心 律 失 常 ( Cardiac ar2 rhythm ia ) 、糖 尿 病 ( diabetes) 、高 血 压 ( hyperten2 sion) 、舞蹈症 (Huntington’s disease) 、帕金森症 ( Par2 kinson’s disease) ……。
2 应用与分析
3 总结与展望
全自动膜片钳技术一个重要的应用方向是检测
早期药物化合物对 hERG的毒副作用 。 hERG ( hu2 man ether2a2go2go related gene) 通道产生的电流是 心室复极中最重要的电流 。通道被药物后抑制直接
导致 Long QT综合症 ,很可能演变成尖端扭转型室 性心动过速 ,心室纤颤 ,直至猝死 。目前发现几乎所 有的 临 床 药 物 所 至 的 LQT 或 者 TdP 都 作 用 于 hERG,且导致 hERG抑制的药物在化学结构上没有 明显的共性 ,从而很难预测 ,仅有通过实验的方式给 予解决〔2〕。2004年 , ICH 和美国 FDA 都颁布关于非 临床检测 Ikr(其中主要是 hERG)的规章 ,要求药物 上市时必须提供作用于离子通道的电流变化数据 。
二 ○○七年 ·第二期
仪器评介
011MΩ 左右 ,并且阻值大小和微管形状能够根据客 户的意愿进行定制〔7〕。 PatchL iner N PCκ 216 在快速 换液和微量加药方面同样表现很突出 ,膜片钳的工 作方式是全细胞膜片钳 ,该系统在易用性上表现良 好 。但是该仪器在试验中所使用的耗材玻璃平板芯
调查显示 ,大部分用户希望能够获得 20000 数 据点 /天 (8h工作日时间 ) 。目前的制药公司在进行
48
药物粗筛时 ,一般要达到 50 ~100 万数据点 /天 ,而 且在未来 5年内这一数值还会进一步提高 。根据目 前的全自动膜片钳系统通量来看 ,其主要适合于小 规模或者中等规模的药物筛选 。目前市场上通量表 现最高的膜片钳仪器为 3000 数据点 /天 ( Ionworks HT) 。其他的几款仪器通量分别为 : Flyscreenµ 8500 300~1000 /天 , PatchL iner NPCκ 216 250 /天 , PatchX2 p ress 7000A 1000 /天 。 1. 4 对电压门控通道和配体门控通道研究的兼容性
当前研究需要 。 Flyion公司的全自动膜片钳机器人 所采用的 Flip tip 微管技术在试验中封接数值一般 分布在 1 ~10GΩ 范围内 ,封接的成功率在 70% ~ 90%并且对近 20 个细胞系有效 (如 CHO , L929, JurkatCHL , LTK, HEK293 ) 。较高的成功率和封接 质量源于使用玻璃管式的微管技术 ,因为传统的玻 璃管在烧熔过程中具有超洁净 、超光滑 、高阻抗和低 成本的特性 ,至今还没有任何材料可以替代 。
除上述共同特征之外 ,这四款仪器还有各自的 优点 。 Flyscreenµ 8500在药物微量加样方面表现非 常优秀 ,每次加样体积最低可以控制在 5μL 左右 , 极大的有利于节省珍贵或者稀有药物 ;其膜片钳的 工作方式除全细胞膜片钳方式外 ,还有穿孔膜片钳 方式 ,且能稳定工作约 30m in左右 ; Flip稳定在 019 ±
PatchL iner NPCκ 216和 PatchXp ress 7000A 都采 用的是 16孔玻璃平板微阵列技术 ,在通常的情况下 也对多个细胞系达到吉欧封接 ,一般地实验成功几 率在 60% ~80%左右 。但是 Ionworks HT在封接质 量上面表现有待提高 ,它采用的是 384孔的塑料平 板微阵列技术 ,试验中平均封接阻值一般在 100 ~ 200MΩ 左右 。但由于其采用 PPC ( Population Patch Clamp )技术 ,即同时对多个细胞进行膜片钳试验然 后取均值作为一个细胞的实验结果 ,这样达到较高 的实验成功率 (最高可达 90%左右 ) ,但是却以更高 的消耗为代价〔8〕。 1. 3 通量表现
离子通道的实验研究最初主要来源于生理学实
用 ,它是生物电活动的基础 ,在细胞内和细胞间信号 验 。1949~1952 年 , Hodgkin 等发展的“电压钳技 传递中起着重要作用 。随着基因组测序工作的完 术 ”为离子通透性的研究提供技术条件 。60年代中 成 ,更多的离子通道基因被鉴定出来 ,离子通道基因 期 ,一些特异性通道抑制剂的发现为离子通道的研 约占 1. 5% ,至少有 400 个基因编码离子通道 。相 究提供有力武器 。 1976 年 Neher和 Sakmann 发展 应的由于离子通道功能改变所引起的中枢及外周疾 的膜片钳技术直接记录离子单通道电流 ,为从分子 病也越来越受到重视 。以离子通道作为靶标的药物 水平上研究离子通道提供直接手段 。80年代中期 , 现占总靶标的 5% ,而潜在的离子通道靶标药物将 生化技术的进步 ,分子生物学以及基因重组技术的 占总靶标的 25% ,因此开发离子通道为靶标的药物 发展 ,使人们能够分离纯化许多不同的通道蛋白 ,直 将具有广阔的市场前景 。已知与离子通道有关的疾 接研究离子通道的结构与功能关系 (见表 1) 。
Devices公司的 Ionworks HT 和 PatchXp ress 7000A 全部采用的是平板微阵列技术 。其技术特点如下 : 在平板电极上打磨或者使用金属离子轰击成孔 ,每
孔都是大小均一的直径约 1 ~2μm 的小孔 ,每个小 孔下面有电极连接到放大器 ,可对实验过程中的电 流变化进行记录 。将细胞悬浮液加载到平板玻璃孔 上 ,通过调节压力和吸力 ,一个细胞便可以自动定位 在小孔上 (相当于微管电极的尖端 ) ,自动进行封 接 ,自动判断封接并进一步施加负压破膜以进行全 细胞模式实验〔4, 5〕。
