化学平衡常数、电离平衡常数、溶度积常数的专题练习
备考突破 高三化学专题强化集训——溶度积常数的相关计算(精编解析)

备考突破2020高三化学专题强化集训——溶度积常数的相关计算(精编解析)一、单选题(本大题共25小题,共50分)1.侯德榜是近代化学工业的奠基人之一,是世界制碱业的权威。
某同学在实验室模拟侯氏制碱法生产的纯碱中含有少量NaCl,下列说法正确的是A. 相同温度下,碳酸钙在纯碱溶液中的溶度积小于在水中的溶度积B. 用标准盐酸滴定一定质量的样品,可以测量出纯碱的纯度C. 用托盘天平称取样品配制溶液进行实验D. 只用硝酸银溶液,即可鉴别样品溶液中是否含有氯离子2.《环境科学》刊发了我国科研部门采用零价铁活化过硫酸钠,其中S为价去除废水中的正五价砷的研究成果,其反应机制模型如图所示。
设阿伏加德罗常数的值为,。
下列叙述正确的是A. 过硫酸钠含个过氧键B. 若参加反应,共有个被还原C. 室温下,中间产物溶于水所得饱和溶液中为D. pH越小,越有利于去除废水中的正五价砷3.常温下,用溶液分别滴定浓度均为的KCl、溶液,所得的沉淀溶解平衡图像如图所示不考虑的水解。
下列叙述正确的是A. 的数量级等于B. n点表示AgCl的不饱和溶液C. 向的混合液中滴入溶液时,先生成沉淀D. 的平衡常数为4.已知: 时,,。
下列说法正确的是A. 若向饱和溶液中加入固体,则有固体析出B. 反应的平衡常数C. 相同条件下,CuS在水中的溶解度大于在水中的溶解度D. 溶液中含固体,则溶液中的物质的量浓度为5.已知298K时下列物质的溶度积下列说法正确的是A. 等体积浓度均为的和溶液混合能产生沉淀B. 浓度均为的和混合溶液中慢慢滴入溶液时,先沉淀C. 在悬浊液中加入盐酸发生反应的离子方程式:D. 298K时,上述四种饱和溶液的物质的量浓度:6.设为阿伏加德罗常数的值,下列说法正确的是A. 时,的溶液中含有的数目为B. 的乙醇溶液中含氧原子C. 与过量氯气发生取代反应,生成气体为D. 时,则该温度下饱和溶液中含有个7.常温下,,,下列叙述不正确的是A. 浓度均为的溶液和NaCl溶液等体积混合,有白色沉淀产生B. 将的溶液滴入的KCl和的混合溶液中,先产生AgCl沉淀C. 的溶液中要产生沉淀,溶液的pH要控制在9以上D. 其他条件不变,向饱和水溶液中加入少量溶液,溶液中减小8. ,为研究用溶液将混合溶液中的和沉淀分离,绘制了 时AgCl和两种难溶化合物的溶解平衡曲线。
微专题 四大平衡常数的计算与应用(原卷版)--2025年高考化学微专题
四大平衡常数的计算与应用考情分析真题精研D .pH=10时,()()+-13c Ag+c CH COOAg =0.08mol L⋅2.(2024·安徽·高考真题)环境保护工程师研究利用2Na S 、FeS 和2H S 处理水样中的2+Cd 。
已知25℃时,2H S 饱和溶液浓度约为-10.1mol L ⋅,()-6.97a12K H S =10,()-12.90a22K H S =10,-17.20sp K (FeS)=10,-26.10sp K (CdS)=10。
下列说法错误的是A .2Na S 溶液中:()()()()()+--2-c H+c Na =c OH +c HS +2c S +B .-120.01mol L Na S ⋅溶液中:()()()()+2---c Na >c S >c OH >c HSC .向()2+-1c Cd=0.01mol L⋅的溶液中加入FeS ,可使()2+-8-1c Cd <10mol L ⋅D .向()2+-1c Cd=0.01mol L⋅的溶液中通入2H S 气体至饱和,所得溶液中:()()+2+c H >c Cd注意:(1)四大平衡的基本特征相同,包括逆、动、等、定、变,其研究对象均为可逆变化过程。
(2)溶解平衡有放热反应、吸热反应,升高温度后K sp 可能变大或变小;而电离平衡、水解平衡均为吸热过程,升高温度K a (或K b )、K h 均变大。
规律·方法·技巧A .pH=6.5时,溶液中()()2-2+3c CO <c PbB .()()2+3δPb=δPbCO 时,()2+c Pb <1.010×()-1M lg c /mol L ⋅(M 代表+Ag 、-Cl 或2-4CrO )随加入NaCl 溶液体积(V)的变化关系如图所示(忽略溶液体积变化)。
下列叙述正确的是经典变式练核心知识精炼(1)A、C、B三点均为中性增大(2)D点为酸性溶液,E点为碱性溶液(1)a、c点在曲线上,a→c Na2SO4固体,但K sp不变基础测评1.(2024·陕西商洛·模拟预测)室温下,用-10.1mol L ⋅的二甲胺()32CH NH 溶液(二甲胺在水中的电离与一水合氨相似)滴定-110.00mL0.1mol L ⋅盐酸溶液。
2020高考化学冲刺核心素养专题 四大平衡常数(Ka、Kh、Kw、Ksp)的综合应用含解析
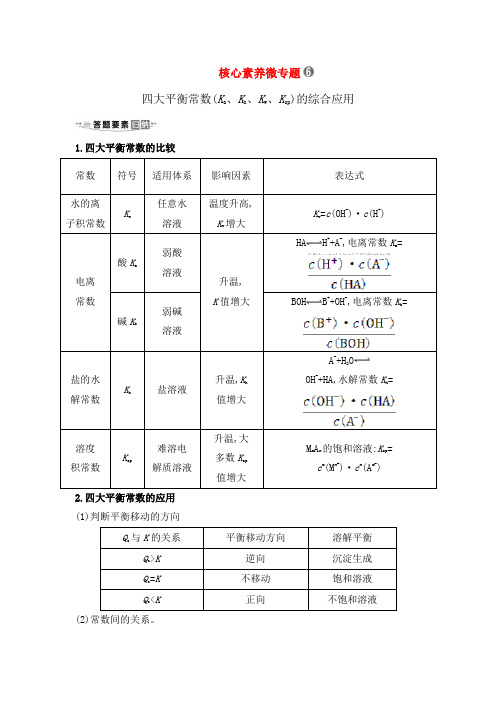
核心素养微专题四大平衡常数(K a、K h、K w、K sp)的综合应用1.四大平衡常数的比较常数符号适用体系影响因素表达式水的离子积常数Kw任意水溶液温度升高,Kw增大Kw=c(OH-)·c(H+)电离常数酸K a弱酸溶液升温,K值增大HA H++A-,电离常数K a= 碱K b弱碱溶液BOH B++OH-,电离常数K b=盐的水解常数Kh盐溶液升温,K h值增大A-+H2OOH-+HA,水解常数K h=溶度积常数Ksp难溶电解质溶液升温,大多数K sp值增大M m A n的饱和溶液:K sp=c m(M n+)·c n(A m-)2.四大平衡常数的应用(1)判断平衡移动的方向Qc与K的关系平衡移动方向溶解平衡Qc>K逆向沉淀生成Qc=K不移动饱和溶液Qc<K正向不饱和溶液(2)常数间的关系。
①K h=②K h=(3)判断离子浓度比值的大小变化。
如将NH3·H2O溶液加水稀释,c(OH-)减小,由于电离平衡常数为,此值不变,故的值增大。
(4)利用四大平衡常数进行有关计算。
【典例】(2019·武汉模拟)(1)用0.1 mol·L-1 NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
①滴定醋酸的曲线是________(填“Ⅰ”或“Ⅱ”)。
②V1和V2的关系:V1________V2(填“>”“=”或“<”)。
(2)25 ℃时,a mol·L-1的醋酸与0.01 mol·L-1的氢氧化钠溶液等体积混合后呈中性,则醋酸的电离常数为________。
(用含a的代数式表示)。
【审题流程】明确意义作判断,紧扣关系解计算【解析】(1)①醋酸为弱酸,盐酸为强酸,等浓度时醋酸的pH大,曲线Ⅱ为滴定盐酸曲线,曲线Ⅰ为滴定醋酸曲线,答案填Ⅰ;②醋酸和氢氧化钠恰好完全反应时,得到的醋酸钠溶液显碱性,要使溶液pH=7,需要醋酸稍过量,而盐酸和氢氧化钠恰好完全反应,得到的氯化钠溶液显中性,所以。
(综合版)弱电解质的电离平衡与溶解度积的关系练习题

(综合版)弱电解质的电离平衡与溶解度积的关系练习题问题一:已知某弱电解质(简称A)的电离平衡方程为:$$A_{(aq)} \rightleftharpoons A^+_{(aq)} + A^-_{(aq)}$$该电离平衡的离子浓度为0.10 M,求该弱电解质的溶解度积(Ksp)。
解答一:溶解度积(Ksp)定义为弱电解质在溶液中达到电离平衡时,离子浓度的乘积。
根据电离平衡方程,离子浓度满足以下关系式:$$Ksp = [A^+] \times [A^-]$$其中,$[A^+]$ 表示离子 A^+ 的浓度,$[A^-]$ 表示离子 A^- 的浓度。
已知电离平衡的离子浓度为0.10 M,则:$$[A^+] = 0.10 M$$$$[A^-] = 0.10 M$$将上述值代入关系式可求得该弱电解质的溶解度积:$$Ksp = 0.10 M \times 0.10 M = 0.01$$因此,该弱电解质的溶解度积为0.01。
问题二:已知某弱电解质(简称B)的溶解度积(Ksp)为0.02,求该弱电解质在溶液中的离子浓度。
解答二:溶解度积(Ksp)与离子浓度的关系可以表示为:$$Ksp = [B^+] \times [B^-]$$已知溶解度积(Ksp)为0.02,要求解离子浓度,即求$[B^+]$ 和 $[B^-]$ 的值。
由于该弱电解质为弱电解质,可假设 $[B^+]$ 和 $[B^-]$ 的值很小,可近似为 $x$。
代入关系式可得:$$0.02 = x \times x$$$$0.02 = x^2$$解以上方程可得:$$x = \sqrt{0.02} = 0.1414$$因此,该弱电解质在溶液中的离子浓度为0.1414。
---以上为关于弱电解质的电离平衡与溶解度积的关系练习题的解答。
希望对您有帮助!。
历届高考中的化学平衡常数试题及其答案和详解

1.(1982年高考全国卷第8题)(12分)将9.2克N 2O 4晶体放入容积为2升的密闭容器中,升温到25℃时N 2O 4全部气化,由于N 2O 4发生如下分解反应:N 2O 42NO 2 △H=+56.848kJ/mol ,平衡后,在25℃时测得混和气体(N 2O 4和NO 2)的压强P 为同温下N 2O 4(g)尚未分解时压强的1.2倍,试回答下列问题: (1).平衡时容器内混和气体的压强P 是多少大气压? (2).平衡时容器内NO 2同N 2O 4的物质的量之比是多少? (3).平衡时该反应的平衡常数K 是多少?(4).如改变影响平衡的一个条件(如压力、温度或浓度)时,试将NO 2同N 2O 4的物质的量之比平衡常数K 的变化情况,选用增大、减小或不变等词句填下表:1.[答案] (1)1.47大气压;(2)21;(3)0.01; (4)[解析](1)。
先求混和气体的总物质的量n :设n 1、P 1分别是纯N 2O 4(g)的物质的量和压强,n 、P 分别是混和气体的总物质的量和压强;则PP 1=112.1P P ⨯=nn 1=n922.9 ;n=0.12 mol (2分);再利用PV=nRT 求混和气体的压强P=VnRT =2298082.012.0⨯⨯=1.47大气压(1分)。
(2)设0.1摩尔N 2O 4中有x 摩尔分解,则有如下的对应关系是:N 2O 42NO 2 △H=+56.848kJ/mol起始物质的量:0.1mol 0 变化物质的量: xmol 2xmol 平衡物质的量:0.1-x 2x平衡后,在25℃时测得混和气体(N 2O 4和NO 2)的压强P 为同温下N 2O 4(气)尚未分解时压强的1.2倍,混和气体的总物质的量:0.12mol ;则:0.1-x+2x=0.12;∴ x=0.02mol (2分);平衡时容器内NO 2同N 2O 4的物质的量之比:摩尔数摩尔数422O N NO =02.01.0202.0-⨯=21(1分)(3)k=][][4222O N NO =]21.0[]22[2LX L x -]04.0[]02.0[2=0.01(3分)(平衡常数表示式、平衡时物质的浓度和计算结果各给1分)(4)(每一空格给0.5分,共3分);k 是温度的函数,改变压强和改变浓度都不会改变平衡常数;N 2O 42NO 2△H=+56.848kJ/mol ,正反应是吸热反应,升高温度有利于平衡向正向移动,k 值增大;增大压强,平衡逆向移动,NO 2物质的量减小,N 2O 4物质的量增大,物质的量之比422O N NO 减小;升高温度,平衡正向移动,N 2O 4物质的量减小,NO 2物质的量增大,物质的量之比422O N NO 增大;增加N 2O 4的浓度平衡正向移动,平衡移动N 2O 4物质的量减小,N 2O 4物质的量净增加值大,平衡移动NO 2物质的量增大,物质的量之比422O N NO 减小。
高中化学复习考点知识专题训练30---电离平衡常数(含答案解析)

A. NaHCO3 + NaHS = Na2CO3 + H2S ↑
B. H2S + Na2CO3 = NaHS + NaHCO3
4 / 25
C. Na 2S + H2O + CO2 = Na 2CO3 + H2S
D. H2S + NaHCO3 = NaHS + H2CO3
10.HR 是一元酸。室温时,用 0.250 mo·L-1NaOH 溶液滴定 25.0 mLHR 溶液时,溶液 的 pH 变化情况如图所示。其中,b 点表示两种物质恰好完全反应。下列叙述正确的 是( )
pKa
=
− lg Ka ,
y
=
lg c(X- ) c(HX)
或 lg c(Y− ) c(HY)
得到
y 和溶液
pH
的变化关系如图所示,下列
有关叙述错误的是( )
A.常温下, Ka (HX) = 10−4 , Ka (HY) = 10−8.5 B.a 点溶液中, c(X- ) = c(HX) > c(Na+ ) > c(H+ ) > c(OH- )
A.NaHB+H2A H2B+NaHA C.H2B+Na2A Na2B+H2A
B.Na2B+H2A H2B+Na2A D.H2B+NaHA NaHB+H2A
14.对于碳酸溶液中的电离平衡,电离常数的表达式中正确的是( )
( ) ( ) A.
c K=
CO32− ⋅ c H+
c (H2CO3 )
( ) ( ) B.
A.H2A 溶液中 c(H+)= c(OH- )+ c(HA-)+ c( A2-) B.NaHA 溶于水能促进水的电离 C.H2A 的第二步电离常数 Ka2=1.0×10-3 D.0.1 mol·L-1 Na2A 溶液中存在 c( A2-)>c(HA-)>c(OH- )>c(H+) 16.NaOH 溶液滴定邻苯二甲酸氢钾(邻苯二甲酸 H2A 的 Ka1=1.1×10−3 , Ka2=3.9×10−6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中 b 点为反应 终点。下列叙述错误的是( )
平衡常数专题复习

(用K1、K2表示)。
2、平衡常数与温度的关系(K只与T有关)
(2014海南)将BaO2放入密闭的真空容器中, 反应2BaO2(s) 2BaO(s)+O2(g)达到平衡。 保持温度不变,缩小容器容积,体系重新达到 平衡,下列说法正确的是 A.平衡常数减小 B.BaO量不变 C.氧气压强不变 D.BaO2量增加
2014北京 2014山东 2014江苏 2014浙江 2014四川
用三段式计算平衡常数K
K与温度的关系 K的表达式;K与浓度改变无关;改变K的方法 利用K判断平衡移动方向 K的表达式 利用三段式计算K;利用K来计算平衡状态
通过对近两年高考试题分析,总结高考考点如下:
1、平衡常数表达式的书写 2、平衡常数与温度的关系 3、平衡常数的计算 4、平衡常数判断平衡移动方向 5、平衡常数大小的意义
2
1、平衡常数表达式的书写(新型)
(2014山东)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下 反应: 2NO2(g)+NaCl(s) 2NO(g)+Cl2(g) NaNO3(s)+ClNO(g) K1 ∆H < 0 (I) 2ClNO(g) K2 ∆H < 0 (II)
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g) 的平衡常数K= K12/ K2 (用K1、K2表示)。 (2014浙江)(2)对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的 平衡压强p(B)代替该气体物质的量浓度c(B),则 CaSO4(s)+4CO(g) CaS(s) + 4CO2(g) Δ H2= -175.6kJ·mol-1(反应Ⅱ)
化学反应的平衡常数计算练习题

化学反应的平衡常数计算练习题
1. 问题描述:
给定以下化学反应:
2H2(g) + O2(g) ⇌ 2H2O(g)
求该反应的平衡常数。
2. 解决方案:
平衡常数(K)表示了反应物和生成物在平衡时的浓度关系。
对于上述反应,平衡常数的计算可以通过以下步骤进行:
步骤 1: 写出平衡方程式
对于给定的反应,平衡方程式为:
2H2(g) + O2(g) ⇌ 2H2O(g)
步骤 2: 表示平衡常数
平衡常数(K)的表示方式为:
其中,[] 表示浓度。
步骤 3: 计算平衡常数
对于给定的反应,根据平衡常数的定义,我们可以得到以下等式:
K = [H2O]^2 / ([H2]^2 * [O2])
其中,[H2O]、[H2] 和 [O2] 分别表示水、氢气和氧气的浓度。
步骤 4: 确定浓度值
假设在平衡时,水的浓度为 x M,氢气的浓度为 y M,氧气的浓度为 z M。
步骤 5: 替换浓度值并求解
将浓度值代入平衡常数的计算公式中,并求解方程:
K = (x)^2 / ((y)^2 * (z))
K = x^2 / (y^2 * z)
以此计算得到的结果即为平衡常数的值。
3. 答案:
通过以上计算步骤,可以求得该化学反应的平衡常数。
注意:具体的浓度值需要根据实际情况进行测量或估计,并进行代入计算。
总结:
本文档介绍了如何计算化学反应的平衡常数。
根据平衡常数的定义和计算公式,我们可以根据给定的化学反应方程式和浓度值,求解平衡常数的值。
这个过程对于理解和研究化学反应的平衡性具有重要意义。
