第十八章 原子结构 复习学案(8)
最新-九年级物理 18章复习课学案 人教新课标版 精品

复习巩固课:九年物理第十一章——学案【课前热身】(3分钟)1.原子是由哪些粒子组成的?2.保持物质原来的性质的最小粒子是什么?【导学提纲】一、宇宙和微观世界1.宇宙:由运动和发展的 组成,而物质又是由 或 组成。
保持了物质原来的性质。
2.原子及其结构(1)原子具有 结构,一般用 来量度。
(2)原子组成:位于中心的带正电的 和绕核运动带负电的 组成二、质量1.定义:物体所含 的多少。
它不随物质的 、 、 、温度的改变而改变。
2.托盘天平的是使用方法:(1)用前:观察天平的 及标尺上的 。
(2)调节:一放 ,二调 ,三调 成平衡。
(3)测量: 盘放物体, 盘放砝码,添加砝码的顺序是由 到 。
(4)读数:右盘砝码质量与游码在标尺上的示数 。
三、密度及其测量1.概念:单位 某种物质的 ,它是物质的一种属性,不同物质密度一般 。
2.公式: ,所以可用 和 测量物质的密度。
3.水的密度是 ,物理意义: 。
4.用天平和量筒测固体的密度(1)用 测出固体的质量m 。
(2)在 中倒入适量的水,其体积为V 1.(3)把固体浸没在量筒的水中,二者体积为V 2.(4)固体的密度: 5.用天平和量筒测液体的密度(1)用天平测出烧杯和 的总适量m 1(2)把烧杯中适量液体倒入 中,用天平测出 液体和烧杯的总质量m 2(3)读出量筒中液体的体积V (4)液体的密度 四、密度与社会生活1.鉴别物质:利用密度公式 计算车物质的密度,再与密度表对照比较,便可鉴别物质m Vm ==ρV V m ==ρ的种类。
2.密度与温度:(1)温度能够改变物质的密度(2)水的反常膨胀:时水的密度最大;高于4℃时,随着温度的升高,水的密度;温度低于4℃时,随着温度的降低,水的密度也。
水凝固成冰时,体积。
【达标测评】(测试时间:8分钟,试题满分:10分)1.如图2所示,一架重型运输直升机在执行救灾任务时,通过钢缆将一质量为9×118Kg的货物悬吊着往下放。
高二物理选修第十八章 原子结构18.1导学案
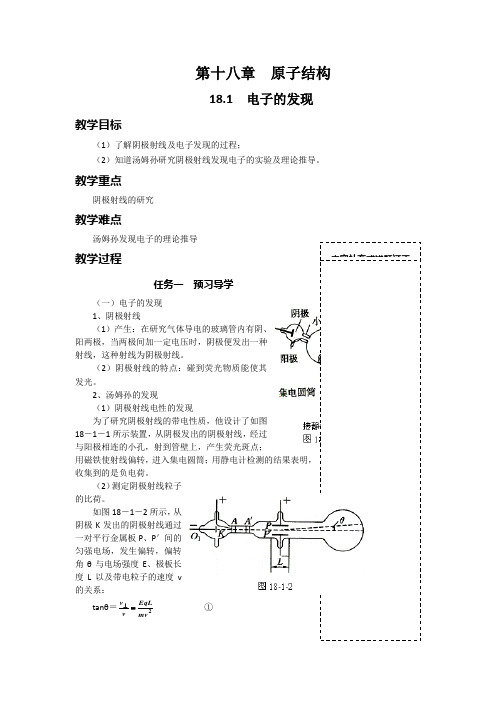
第十八章 原子结构18.1 电子的发现教学目标(1)了解阴极射线及电子发现的过程;(2)知道汤姆孙研究阴极射线发现电子的实验及理论推导。
教学重点阴极射线的研究教学难点汤姆孙发现电子的理论推导教学过程任务一 预习导学(一)电子的发现 1、阴极射线(1)产生:在研究气体导电的玻璃管内有阴、阳两极,当两极间加一定电压时,阴极便发出一种射线,这种射线为阴极射线。
(2)阴极射线的特点:碰到荧光物质能使其发光。
2、汤姆孙的发现(1)阴极射线电性的发现为了研究阴极射线的带电性质,他设计了如图18-1-1所示装置,从阴极发出的阴极射线,经过与阳极相连的小孔,射到管壁上,产生荧光斑点;用磁铁使射线偏转,进入集电圆筒;用静电计检测的结果表明,收集到的是负电荷。
(2)测定阴极射线粒子的比荷。
如图18-1-2所示,从阴极K 发出的阴极射线通过一对平行金属板P 、P '间的匀强电场,发生偏转,偏转角θ与电场强度E 、极板长度L 以及带电粒子的速度v 的关系:tanθ=mv EqLv v =⊥ ①电场力与磁场力平衡,不发生偏转,由BEv =② 为Kg /C me1110≈ 1898这种粒子的“身份”子,物理学家把这种粒子叫做电子。
②现在测得电子的比荷为e/m =1.75881×1011电子的电荷量为e =1.60219×10-19C ,从而计算出电子的质量为m =9.10953×10-31kg.③电子的质量约为氢原子质量的18361任务二 合作探究【例1】一只阴极射线管,正下方,放一通电直导线AB ( )A .导线中的电流由A 流向B B .导线中的电流由B 流向AC 流方向来实现D .电子束的径迹与AB 中的电流方向无关【例2】一种测定电子比荷的实验装置如图空玻璃管内、阴极发出的电子经阳极A 与阴极K 度进入两极板C 、D 荧光屏上的O 点;若在两极板间施加电压U 的电子将打在荧光屏上的P 直于纸面向外、磁感应强度为B 上产生的光点又回到O ,已知极板的长度l =5.00cm 距离d =1.50cm ,极板区的中点M L =12.50cm ,U =200V ,B =6.3×10-4T ,P 点到0试求电子的比荷。
高三化学一轮复习学案:《原子结构》学案(新人教版)正式版

高三化学一轮复习学案:原子结构学习目的:1、掌握原子的结构和核外电子的排布。
2、掌握元素、核素、同位素的含义。
3、了解原子的最外层电子排布与元素性质的关系。
基础知识一、原子的结构1、原子的结构2、质量数(1)概念:(2)关系式:原子中核电荷数(Z)=质子数=核外电子数质量数(A)=质子数(Z)+中子数(N)阳离子中AZ X n+:核外电子数= Z-n质量数(A)=质子数(Z)+中子数(N)阴离子中AZ X m-:核外电子数= Z+m质量数(A)=质子数(Z)+中子数(N)3、原子结构的表示方法:二、核素1、元素:具有相同质子数的同一类原子的总称。
2、核素:把具有一定数目质子和一定数目中子的一种原子称为核素。
一种原子就是一种核素,一种元素可能包括几种核素。
3、同位素:质子数相同而中子数不同的同一元素的不同核素互称为同位素。
(1)氢元素的三种核素(2)性质:a、同位素的化学性质相同,物理性质有一定差别。
b、天然存在的同一元素的各同位素所占的百分组成不变。
(3)应用:①金属探伤②消除静电③治疗肿瘤④示踪原子,跟踪研究化学反应⑤作核燃料⑥用14C考古⑦环保治污等4、元素的相对原子质量(1)定义:由各种天然核素相对原子量与其原子百分组成计算出的平均值。
(2)计算式: M =M1×n1 % + M2×n2 % + M3×n3 % +…同位素3517Cl的相对原子质量为34.969,在自然界占75.77%(原子数的百分含量),3717Cl为36.966,在自然界中占24.23%,则Cl的相对原子质量为:34.969×75.77%+36.966×24.23% =35.45(3)元素的近似相对原子质量:用质量数代替核素的相对原子质量,求其平均值。
例如氯元素的近似相对原子质量为:35ⅹ75.77%+37ⅹ24.23%=35.48三、核外电子的分层排布1.核外电子运动特征:(1)核外电子的特征:a:电子的质量极___(____kg);b:电子绕核运动是在_______的空间(原子的直径约___m)中进行;c:电子绕核作__速运动(运动的速度接近__,约为__)。
高二物理人教版选修35导学案:第十八章原子结构

学案5章末总结一、对α粒子散射实验及核式结构模型的理解1.实验结果:α粒子穿过金箔后,绝大多数α粒子仍沿原来的方向前进;少数α粒子有较大的偏转;极少数α粒子的偏转角度超过90°,有的甚至被弹回,偏转角达到180°.2.核式结构学说:在原子的中心有一个很小的原子核,原子的全部正电荷和几乎全部质量都集中在原子核内,电子绕核运转.3.原子核的组成与尺度(1)原子核的组成:由质子和中子组成,原子核的电荷数等于原子核中的质子数.(2)原子核的大小:实验确定的原子核半径的数量级为10-15 m,而原子的半径的数量级是10-10 m.因而原子内部十分“空旷”.例1关于α粒子散射实验现象的分析,下列说法正确的是()A.绝大多数α粒子沿原方向运动,说明正电荷在原子内均匀分布,使α粒子受力平衡的结果B.绝大多数α粒子沿原方向运动,说明这些α粒子未受到明显的力的作用,说明原子内大部分空间是空的C .极少数α粒子发生大角度偏转,说明原子内质量和电荷量比α粒子大得多的粒子在原子内分布空间很小D .极少数α粒子发生大角度偏转,说明原子内的电子对α粒子的吸引力很大解析 在α粒子散射实验中,绝大多数α粒子沿原方向运动,说明这些α粒子未受到原子核明显的力的作用,也说明原子核相对原子来讲很小,原子内大部分空间是空的,故A 错,B 对;极少数α粒子发生大角度偏转,说明会受到原子核明显的力的作用的空间在原子内很小,α粒子偏转而原子核未动,说明原子核的质量和电荷量远大于α粒子的质量和电荷量,电子的质量远小于α粒子的质量,α粒子打在电子上,不会有明显偏转,故C 对,D 错.答案 BC二、对玻尔原子模型及原子能级跃迁的理解1.玻尔原子模型(1)原子只能处于一系列能量不连续的状态中,具有确定能量的稳定状态叫做定态,能量最低的状态叫基态,其他的状态叫做激发态.(2)频率条件当电子从能量较高的定态轨道(E m )跃迁到能量较低的定态轨道(E n )时会放出能量为hν的光子,则:hν=E m -E n .反之,当电子吸收光子时会从较低的能量态跃迁到较高的能量态,吸收的光子能量同样由频率条件决定.(3)原子的不同能量状态对应电子的不同运行轨道.2.氢原子能级跃迁(1)氢原子的能级原子各能级的关系为:E n =E 1n 2(n 为量子数,n =1,2,3,…)对于氢原子而言,基态能级:E 1=-13.6 eV .(2)氢原子的能级图氢原子的能级图如图1所示.图1例2 已知氢原子基态的电子轨道半径为r 1=0.528×10-10 m ,量子数为n 的能级为E n =-13.6n 2 eV .(1)求电子在基态轨道上运动的动能;(2)有一群氢原子处于量子数n =3的激发态,画一张能级图,在图上用箭头标明这些氢原子能发出的光谱线.(3)计算这几种光谱线中最短的波长.(静电力常量k =9×109 N·m 2/C 2,电子电荷量e =1.6×10-19 C ,普朗克常量h =6.63×10-34 J·s ,真空中光速c =3×108 m/s)解析 (1)核外电子绕核做匀速圆周运动,库仑引力提供向心力,则ke 2r 21=m v 2r 1,又知E k =12m v 2,故电子在基态轨道上运动的动能为:E k =ke 22r 1=9×109×(1.6×10-19)22×0.528×10-10J ≈2.18×10-18 J ≈13.6 eV . (2)当n =1时,能级为E 1=-13.612 eV =-13.6 eV .当n =2时,能级为E 2=-13.622 eV =-3.4 eV .当n =3时,能级为E 3=-13.632 eV ≈-1.51 eV .能发出的光谱线分别为3→2、2→1、3→1共3种,能级图如图所示(3)由E3向E1跃迁时发出的光子频率最大,波长最短.hν=E3-E1,又知ν=cλ,则有λ=hcE3-E1=6.63×10-34×3×108[-1.51-(-13.6)]×1.6×10-19m≈1.03×10-7 m.答案见解析三、原子的能级跃迁与电离1.能级跃迁包括辐射跃迁和吸收跃迁,可表示如下:高能级E m辐射光子hν=E m-E n吸收光子hν=E m-E n低能级E n.2.当光子能量大于或等于13.6 eV时,也可以被处于基态的氢原子吸收,使氢原子电离;当处于基态的氢原子吸收的光子能量大于13.6 eV时,氢原子电离后,电子具有一定的初动能.3.原子还可吸收外来实物粒子(例如自由电子)的能量而被激发.由于实物粒子的动能可全部或部分被原子吸收,所以只要入射粒子的能量大于或等于两能级的能量差(E=E m-E n),均可使原子发生能级跃迁.例3如图2所示,A、B、C分别表示三种不同能级跃迁时放出的光子.由图可以判定()图2A.用波长为600 nm的X射线照射,可以使稳定的氢原子电离B.用能量是10.2 eV的光子可以激发处于基态的氢原子C.用能量是2.5 eV的光子入射,可以使基态的氢原子激发D用能量是11.0 eV 的外来电子,可以使处于基态的氢原子激发解析“稳定的氢原子”指处于基态的氢原子,要使其电离,光子的能量必须大于或等于13.6 eV,而波长为600 nm的X射线的能量为E=h cλ=6.63×10-34×3×1086 000×10-10×1.6×10-19eV≈2.07 eV<13.6 eV,A错误.因ΔE=E2-E1=(-3.4) eV-(-13.6) eV=10.2 eV,故10.2 eV的光子可以使氢原子从基态跃迁到n=2的激发态,B正确;2.5 eV的光子能量不等于任何其他能级与基态的能级差,因此不能使氢原子发生跃迁,C错误;外来的电子可以将10.2 eV的能量传递给氢原子,使它激发,外来电子还剩余11.0 eV-10.2 eV=0.8 eV的能量,D 正确.答案BD针对训练一个氢原子处于基态,用光子能量为15 eV的电磁波去照射该原子,问能否使氢原子电离?若能使之电离,则电子被电离后所具有的动能是多大?答案能 1.4 eV解析氢原子从基态n=1被完全电离至少需要吸收13.6 eV的能量.所以15 eV的光子能使之电离,由能量守恒可知,完全电离后还剩余动能E k=15 eV-13.6 eV=1.4 eV.1.(对核式结构模型的理解)在α粒子散射实验中,当α粒子最接近金原子核时,下列说法正确的是()A.动能最小B.电势能最小C.α粒子和金原子核组成的系统的能量最小D.加速度最小答案A解析在α粒子散射实验中,当α粒子接近金原子核时,金原子核对α粒子的作用力是斥力,对α粒子做负功,电势能增加,动能减小,当α粒子离金原子核最近时,它们之间的库仑力最大,α粒子的动能最小.由于受到的金原子核外电子的作用相对较小,与金原子核对α粒子的库仑力相比,可以忽略,因此只有库仑力做功,所以机械能和电势能整体上是守恒的,故系统的能量可以认为不变.综上所述,正确选项应为A.2.(对氢原子能级跃迁的理解)如图3所示是玻尔理论中氢原子的能级图,现让一束单色光照射一群处于基态的氢原子,受激发的氢原子能自发地辐射出三种不同频率的光,则照射氢原子的单色光的光子能量为()图3A.13.6 eV B.12.09 eVC.10.2 eV D.3.4 eV答案B解析受激发的氢原子能自发地辐射出三种不同频率的光,说明激发的氢原子处于第3能级,则照射氢原子的单色光的光子能量为E=E3-E1=12.09 eV,故B正确.3.(原子的能级跃迁和电离问题)氢原子能级的示意图如图4所示,大量氢原子从n =4的能级向n=2 的能级跃迁时辐射出可见光a,从n=3的能级向n=2的能级跃迁时辐射出可见光b,则()图4A.可见光光子能量范围在1.62 eV到2.11 eV之间B.氢原子从n=4的能级向n=3的能级跃迁时会辐射出紫外线C.a光的频率大于b光的频率D.氢原子在n=2的能级可吸收任意频率的光而发生电离答案C解析由能级跃迁公式ΔE=E m-E n得:ΔE1=E4-E2=-0.85 eV-(-3.4 eV)=2.55 eVΔE2=E3-E2=-1.51 eV-(-3.4 eV)=1.89 eV故A错;据ΔE=hc=hν知,C对;ΔE3=E4-E3=-0.85 eV-(-1.51 eV)=0.66 eV,λ所以氢原子从n=4的能级向n=3的能级跃迁时能量差对应的光子处于红外线波段,B错;氢原子在n=2的能级时能量为-3.4 eV,所以只有吸收光子能量大于等于3.4eV时才能电离,D错.4.(氢原子的能级跃迁)如图5所示为氢原子能级的示意图.现有大量的氢原子处于n=4的激发态.当向低能级跃迁时将辐射出若干不同频率的光.关于这些光,下列说法正确的是()图5A.最容易表现出衍射现象的光是由n=4能级跃迁到n=1能级产生的B.频率最小的光是由n=2能级跃迁到n=1能级产生的C.这些氢原子总共可辐射出3种不同频率的光D.用n=2能级跃迁到n=1能级辐射出的光照射逸出功为6.34 eV的金属箔能发生光电效应答案D解析在该题中,从n=4的激发态跃迁到基态的能级差最大,即发出的光子能量最大,频率最大,对应波长最小,是最不容易发生衍射的,A错误;从n=4的激发态跃迁到n=3的激发态的能级差最小,发出光子的频率最小,B错误;可辐射出的光子频率的种类数为C24=6种,C错误;从n=2的激发态跃迁到基态时,辐射出光子的能量ΔE=E2-E1>6.34 eV,因而可以使逸出功为6.34 eV的金属箔发生光电效应,D正确.。
人教版高中物理选修3-5第十八章 原子结构(自主学习学案)

第十八章原子结构课前自主学习(学案)一、请学生自主复习教材第十八章原子结构P46至P63。
二、结合复习的内容思考如下问题:1、人类对原子结构认识的历史是从电子的发现开始的。
1890年英国物理学家汤姆孙研究阴极射线发现了电子。
在研究原子结构时,他提出了枣糕模型,请说出这种模型的特点。
2、1909年--1911年,英国物理学家卢瑟福和他的助手做α粒子轰击金箔的实验,即著名的“α粒子散射实验”,该实验的结果是什么?(注意几个关键词)3、请绘制一幅简图,描绘原子核式结构模型的α粒子散射的图景。
4、原子核式结构模型与经典电磁理论的矛盾主要体现在哪两个方面?1913年丹麦的物理学家玻尔提出了原子结构的三个基本假设,建立了玻尔原子模型,请说出玻尔原子模型的三个基本假设的内容。
5、请用玻尔理论解释:为什么原子的发射光谱都是一些分立的亮线?如果大量氢原子处在n=4能级,可辐射出几种频率的光?其中波长最短的光是在哪两个能级之间跃迁时发出的?三、自主解答几道题目:1、卢瑟福原子核式结构理论的主要内容有()A.原子的中心有个核,叫原子核B.原子的正电荷均匀分布在整个原子中C.原子的全部正电荷和几乎全部质量都集中在原子核里D.带负电的电子在核外绕着核旋转2、α粒子散射实验中,不考虑电子和α粒子的碰撞影响,是因为()A.α粒子与电子根本无相互作用B.α粒子受电子作用的合力为零,是因为电子是均匀分布的C.α粒子和电子碰撞损失能量极少,可忽略不计D.电子很小,α粒子碰撞不到电子3、卢瑟福通过_______________实验,发现了原子中间有一个很小的核,并由此提出了原子的核式结构模型,平面示意图中的四条线表示α粒子运动的可能轨迹,在图中完成中间两条α粒子的运动轨迹.4.一个氢原子中的电子从一半径为r a的轨道自发地直接跃迁至另一半径为r b的轨道,已知r a>r b,则在此过程中()A.原子发出一系列频率的光子B.原子要吸收一系列频率的光子C.原子要吸收某一频率的光子D.原子要辐射某一频率的光子参考答案:1.ACD 2.C 3 .4.D课堂主体参与(教案)【学习目标】1、知道并理解原子核式结构模型,了解科学家探究原子结构的过程2、知道原子的能级的概念,并能进行一些简单的应用【重点、难点】1、核式结构模型对α粒子散射实验的解释2、玻尔的原子模型【学习内容】一、课前自主学习检查1、原子结构的认识过程是非常曲折的,请回答核式结构和玻尔模型提出的背景分别是:①___________________________________________________________②___________________________________________________________2、如图所示为卢瑟福和他的同事们做α粒子散射实验的装置示意图,荧光屏和显微镜分别放在图中的A、B、C、D四个位置时,下述对观察到现象的说法中正确的是()A.放在A位置时,相同时间内观察到屏上的闪光次数最多B.放在B位置时,相同时间内观察到屏上的闪光次数只比A位置时稍少些C.放在C、D位置时,屏上观察不到闪光D.放在D位置时,屏上仍能观察到一些闪光,但次数极少3、氢原子的能级和电子可能轨道半径公式分别是:①氢原子的能级公式E n=________E1(其中E1为基态能量,E1=-13.6eV)②氢原子的电子轨道半径公式: r n= ________r1(其中r1内基态半径,r1=0.53×10-10m)4.氢原子的能级图,如图:(1)能级图中的横线表示_____________________(2)横线左端的数字“1,2,3…”表示__________,右端的数字“一13.6,一3.4,…”表示__________________.(3)相邻横线间的距离,表示相邻的能级差,量子数越大,相邻的能级差越_________. (4)带箭头的竖线表示原子由较高能级向较低能级跃迁,原子跃迁条件为:_____________. 5.根据玻尔理论,某原子的电子从能量为E 的轨道跃迁到能量为E ’的轨道,辐射出波长为γ的光,以h 表示普朗克常量,c 表示真空中的光速,求能量E ’. 参考答案:1.①汤姆孙的“枣糕模型”无法解释α粒子散射实验②卢瑟福的核式结构无法解释原子的稳定性和原子光谱的分立特性 2.AD 3.21n ;n 4.氢原子可能的能量状态——定态;量子数;氢原子的能级;小;h γ=E m -E n5.解析:根据玻尔理论,原子从一种定态(设能量为E)跃迁到另一种定态(设能量为E ’)时,它辐射(或吸收)一定频率的光子,光子的能量由这两种定态的能量差决定,即 h γ=E -E ’,又光在真空中传播时λcv =,联立得E'=E 一λch二、构建知识框架,剖析典型概念1.人类对原子结构的认识史是从电子的发现开始的。
高三化学原子结构复习学案

高三化学原子结构复习学案一、基础知识:(1)知识体系(概括说明):横:周期结构纵:族元素周期律编排元素周期表元素在周期表的位置、性质及原子结构三者间的关系周期性质子 2个变原子核同位素化中子(A-Z)个原子结构AX核外电子运动的特征—电子云Z相核外电子互核外电子排布的规律作用化学键:离子键共价键金属键晶体结构:离子晶体分子晶体原子晶体金属晶体(二)知识要点:1、 原子结构[1] 原子组成:原子组成符号:A Z X原子核 原子 核外电子 ① ②③④[2]电子层的表示方法电子层数符号最多容纳电子数(2n 2)能量大小 < < < < < <[3] 几种关系:① 质量数(A )= +② 质子数=核电荷数A :若质子数=核外电子数( )B :若质子数>核外电子数( ) (阴离子)质子数+电荷数=C :若质子数<核外电子数( ) (阳离子)质子数-电荷数=③ 原子量、质量数、元素原子量原子量________________________________________元素原子量___________________________________________近似原子量____________________________________________练习:1.已知X 有两种同位素,A1Z X 、A2Z X ,,它们的质量分别为w 1、w 2 ,在自然界中原子百分数分别为a%、(100-a )%;一个126 C 原子的质量为w kg ,求X 的两种同位素的原子量、X 的原子量、X 近似原子量。
2.某元素构成的双原子分子有三种,其式量分别为158、160、162。
在天然单质中,此三种单质的物质的量之比为1∶1∶1。
由此推断以下结论中,正确的是A .此元素有三种同位素B .其中一种同位素质量数为80C .其中质量数为79的同位素原子占原子总数的1/2D .此元素的单质的平均式量为160。
原子结构和化学键复习导学案

原子结构和化学键复习导学案一、原子结构1.原子基本结构-原子核:由质子和中子组成,质子带正电,中子不带电,两者都集中在原子的核心位置。
-电子壳层:围绕原子核运动的电子所在的能层,分为K层、L层、M 层等。
不同层次的电子能量不同,离核心位置越近的能量越低。
-电子轨道:电子在每个能层上的运动轨迹。
2.原子的电子排布-约瑟夫·约瑟夫逊的原子模型:电子围绕原子核以规定轨道运动,每个轨道能容纳一定数量的电子。
-普朗克的量子假说:电子在轨道上只能具有一些特定的能量值,即能量量子化。
-赫兹堡-伦纳德原理:多个电子在同一个轨道上运动时,要遵守泡利不相容原理,即每个电子的四个量子数(n、l、m、s)不能完全相同。
3.原子的量子数-主量子数(n):表示电子所处的能层,数值为1、2、3、4等。
-角量子数(l):表示电子在原子轨道上的运动状态,与轨道形状有关,取数值范围为0到n-1-磁量子数(m):表示电子在原子轨道上的具体位置,取数值范围为-l到l。
-自旋量子数(s):表示电子自转方向,取值为+1/2或-1/24.原子的填充原理-电子按照能量由低到高的顺序填充到不同的轨道上,先填充能量低的轨道。
-每个轨道能容纳的电子数按照2n^2规则增加,即第K层能容纳的电子数为2,第L层为8,以此类推。
二、化学键1.化学键的定义-化学键是化学元素之间形成的相互连接的力,包括共价键、离子键和金属键。
2.共价键-共价键是两个非金属原子通过电子的共享形成的连接。
-共价键的形成需要满足八个电子结构稳定规则,即通过共享电子使原子外层电子数达到8个(或2个)。
-共价键的强度一般较强,不易断裂。
3.离子键-离子键是金属和非金属之间通过电荷的吸引形成的连接。
-离子键的形成是由于金属原子将电子转移给非金属原子,形成带正电荷的金属离子和带负电荷的非金属离子。
-离子键的强度一般较强,但比共价键强度稍弱。
4.金属键-金属键是金属原子内外层电子的离域形成的连接。
九年级化学全册原子构成学案2018新版鲁教版

原子的构成1课标与教材剖析:“原子的构成〞这一节的主要内容是认识原子的构造和相对原子质量,第一课时主假如原子的构造和电子的知识。
小结时要点应放在原子、分子的主要差别上,也就是看两种微粒在化学反应里可否再分,能够采纳总结、对比、议论的方法促使理解。
在上一节的学习中,学生已经掌握了相关化合反应、分解反应的看法,这是指引学生从分子认识原子的十分有效的根基知识。
经过物质的分解反应能够从宏观上察看到一种物质分解成两种或两种以上的其余物质,再从“分子是保持物质化学性质的微粒〞来剖析,能推测出分子是可分的,进而引出原子可否可分的问题。
依据本课题的地位和作用,内容及学生的状况,我确定了以下教课重难点:要点是原子的构成。
难点是原子的构成学情剖析:对已进入初三的学生来说,他们的抽象思想能力和归纳归纳能力均已初步形成,在讲堂上他们厌烦教师的独自说教灌注,希望教师能创建便于他们自主学习的环境,给他们发布自己看法和表现自己才干的机遇。
因此本节课我设置了很多活动:比方,“畅所欲言〞、“你会做吗?〞等。
这样,不只能让学生在整节课的学习中一直处于踊跃的学习状态,并且还可以让学生在研究中学会学习。
学习目标:1.知识与技术:①理解原子的看法,掌握原子、分子之间的相像、相异和互相关系;②用原子和分子的看法加深对化学反应实质的理解;③认识原子的构成,认识核电荷数、质子数和核外电子数的关系;2.过程与方法:培育学生的察看能力、剖析综合能力和抽象综合能力。
感情态度价值观:培育量变惹起质变的辨证唯心主义看法。
学习方法与媒体:议论法,利用多媒体将抽象的粒子形象化。
知识链接:1.构成物质的根本粒子有和,水是由构成,水分子由构成。
2、在化学变化中,是不可以再分的学习过程:一、自主学习、合作研究:学生活动一:议论原子能不可以再分?【多媒体展现】:①汤姆森原子模型图②卢瑟福的α粒子轰击金箔的实验〔α粒子,即氦原子的原子核〕【学生察看】现象:1、绝全局部的α粒子沿着本来的前进方向,没有发生偏转;2、少局部α粒子的运动方向有所改变;3、甚至有很少量的α粒子有很大的偏转,甚至是180度。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十八章原子结构复习学案18.1 电子的发现【学习目标】1.知道电子是怎样发现的及其对人类探索原子结构的重大意义.2.知道阴极射线及其产生方法,了解汤姆孙发现电子的研究方法.3.能熟练运用所学知识解决电子在电场和磁场中运动问题.【重点难点】1.电子的发现过程.2.电子在电场和磁场中运动的有关计算.【易错问题】误认为气体压强越小辉光现象越明显.【自主学习】一、阴极射线阴极射线是从阴极射线管的阴极发出的高速运动的粒子流,这些微观粒子是_____.对于阴极射线的本质,有大量的科学家作出大量的科学研究,主要形成了两种观点。
(1)电磁波说:代表人物,赫兹。
认为这种射线的本质是一种电磁波的传播过程。
(2)粒子说:代表人物,汤姆孙。
认为这种射线的本质是一种高速粒子流。
二、电子的发现1897年英国物理学家_______通过研究_________发现了电子;1910年美国物理学家_________通过著名的____实验精确测定了电子的电荷量.电子是原子的组成部分,是比原子更基本的物质单元,电子的电荷量约为__________C,电子的质量约为__________kg.任何带电体所带电量只能是电子电量的_______.【课堂达标】1.关于电子的发现者,下列说法正确的是( )A.英国的汤姆孙B.德国的普吕克尔C.德国的戈德斯坦D.美国的密立根2.汤姆孙对阴极射线的探究,最终发现了电子,由此被称为“电子之父”,关于电子的说法正确的是( )A.物质中可能有电子,也可能没有电子B.不同的物质中具有不同的电子C.电子质量是质子质量的1836倍 D.电子是一种粒子,是构成物质的基本单元3.关于电荷量下列说法不.正确的是( )A.电子的电量是由密立根通过油滴实验测得的 B.物体的带电量可以是任意值C.物体带电量的最小值为1.6×10-19C D.电子所带的电荷量称为元电荷4.图18-1-8如图18-1-8所示,在阴极射线管正上方平行放一根通有强电流的长直导线,则阴极射线将( ) A.向纸内偏转B.向纸外偏转C.向下偏转D.向上偏转5.图18-1-9是电子射线管示意图.接通电源后,电子射线由阴极沿x轴方向射出,在荧光屏上会看到一条亮线.要使荧光屏上的亮线向下(z轴负方向)偏转,在下列措施中可采用的是( )图18-1-9A .加一磁场,磁场方向沿z 轴负方向B .加一磁场,磁场方向沿y 轴正方向C .加一电场,电场方向沿z 轴负方向D .加一电场,电场方向沿y 轴正方向6.图18-1-10为示波管中电子枪的原理示意图.示波管内被抽成真空,A 为发射热电子的阴极,K 为接在高电势点的加速阳极,A 、K 间电压为U .电子离开阴极时的速度可以忽略,电子经加速后从K 的小孔中射出时的速度大小为v .下面的说法中正确的是( )图18-1-10A .如果A 、K 间距离减半而电压仍为U 不变,则电子离开K 时的速度变为2vB .如果A 、K 间距离减半而电压仍为U 不变,则电子离开K 时的速度变为v2C .如果A 、K 间距离保持不变而电压减半,则电子离开K 时的速度变为v2D .如果A 、K 间距离保持不变而电压减半,则电子离开K 时的速度变为22v图18-1-117.如图18-1-11所示,光电管的阴极被某种频率的光照射后,能产生光电效应.阴极K 上的电子被激发逸出表面(初速度为零),经加速电压U 加速后达到阳极A 上,并立即被A 吸收.若电子电荷量为e ,质量为m .则A 极在单位时间内所受的冲量为________.8.图18-1-12测量油滴带电荷量的装置如图18-1-12所示,两块水平放置的平行金属板与电源连接,上、下板分别带正、负电荷.油滴从喷雾器喷出后,由于摩擦而带电,油滴进入上板中央小孔后落到匀强电场中,通过显微镜可以观察到油滴的运动情况.两金属板间的距离为d ,忽略空气对油滴的浮力和阻力.调节两金属板间的电势差u ,当u =U 0时,使得某个质量为m 1的油滴恰好做匀速运动,该油滴所带电荷量q 为多少?思维方法是解决问题的灵魂,是物理教学的根本;亲自实践参与知识的发现过程是培养学生能力的关键,离开了思维方法和实践活动,物理教学就成了无源之水、无本之木。
学生素质的培养就成了水中月。
18.2 原子的核式结构模型【学习目标】1.知道α粒子散射实验的现象.2.知道卢瑟福的原子核式结构模型的主要内容,理解模型提出的主要思想.3.知道原子核的核电荷数的意义及原子核的尺度.【重点难点】1.α粒子散射实验现象及其解释.2.卢瑟福的原子核式结构模型.【易错问题】误认为任何情况下核外电子数都等于核内质子数.【自主学习】一、汤姆孙的原子模型汤姆孙于1898年提出了原子模型,他认为原子是一个_____、______弥漫性地均匀分布在整个球体内,____镶嵌在球中.汤姆孙的原子模型,小圆点代表正电荷,大圆点代表电子.汤姆孙的原子模型被称为西瓜模型或枣糕模型.该模型能解释一些实验现象,但后来被_________实验否定了.二、α粒子散射实验1.α粒子:是从放射性物质中发射出来的快速运动的粒子,实质是失去两个电子的__________,带__________电荷,质量为_______质量的4倍.2.实验结果(1)________α粒子穿过金箔后,基本沿原方向前进.(2)_____ α粒子发生大角度偏转,偏转角甚至大于90°.3.卢瑟福通过α粒子散射实验,否定了汤姆孙的原子模型,建立了_________模型.三、卢瑟福的核式结构模型核式结构模型:1911年由卢瑟福提出,在原子中心有一个很小的核,叫________.它集中了原子全部的_______和几乎全部的_____,_____在正电体的外面运动.四、原子核的电荷与尺度1.电荷:原子核是由_____和______组成的.原子核的电荷数就是核中的_______.2.尺度:对于一般的原子核,实验确定的核半径R的数量级为______m.而整个原子半径的数量级是_____m.两者相差十万倍之多.可见原子内部是十分“空旷”的.【课堂达标】1.关于α粒子散射实验,下列说法正确的是( )A.该实验在真空环境中进行B.带有荧光屏的显微镜可以在水平面内的不同方向上移动C.荧光屏上的闪光是散射的α粒子打在荧光屏上形成的D.荧光屏只有正对α粒子源发出的射线方向上才有闪光2.在α粒子散射实验中,使少数α粒子发生大角度偏转的作用力是原子核对α粒子的( ) A.万有引力B.库仑力 C.磁场力 D.核力3.原子核式结构学说,是卢瑟福根据以下哪个实验现象提出的( )A.光电效应实验B.α粒子散射实验C.汤姆孙发现电子的阴极射线实验D.密立根实验4.从α粒子散射实验结果出发,推出的下述结论中正确的是( )A.说明金原子的内部大部分是空的B.说明α粒子的质量比金原子质量还大C.说明金原子也是个球体D.说明α粒子的速度很大5.卢瑟福的原子核式结构模型认为,核外电子绕核运动.设想氢原子的核外电子绕核做匀速圆周运动,氢原子中电子离核最近的轨道半径r1=0.53×10-10m,用经典物理学的知识,试计算在此轨道上电子绕核转动的加速度大小.巩固练习:1.α粒子散射实验中,不考虑电子和α粒子的碰撞影响,是因为( )A.α粒子与电子根本无相互作用B.α粒子受电子作用的合力为零,电子是均匀分布的C.α粒子和电子碰撞损失能量极少,可忽略不计D.电子很小,α粒子碰撞不到电子2.当α粒子穿过金箔发生大角度偏转的过程中,下列说法正确的是( )A.α粒子先受到原子核的斥力作用,后受原子核的引力的作用B.α粒子一直受到原子核的斥力作用C.α粒子先受到原子核的引力作用,后受到原子核的斥力作用D.α粒子一直受到库仑斥力,速度一直减小3.下列对原子结构的认识中,正确的是( )A.原子中绝大部分是空的,原子核很小B.电子在核外运动,库仑力提供向心力C.原子的全部正电荷都集中在原子核里D.原子核的直径大约是10-10 m图18-2-64.用α粒子轰击金箔,α粒子在接近金原子核时发生偏转的情况如图18-2-6所示,则α粒子的路径可能是( )A.aB.bC.cD.a、b、c都是不可能的图18-2-75.如图18-2-7所示为α粒子散射实验中α粒子穿过某一金原子核附近时的示意图,A、B、C三点分别位于两个等势面上,则以下说法正确的是( )A.α粒子在A处的速度比在B处速度小B.α粒子在B处的速度最大C .α粒子在A 、C 处的速度大小相等D .α粒子在B 处速度比在C 处速度小6.正电子是电子的反粒子,它跟电子电量相等,而电性相反,科学家设想在宇宙的某些部分可能存在完全由反粒子构成的物质——反物质.1997年年初和年底,欧洲和美国的科学研究机构先后宣布他们分别制造出了9个和7个反氢原子.这是人类探索反物质的一大进步,你推测反氢原子的结构是( )A .由一个不带电的中子与一个带负电荷的电子构成B .由一个带负电荷的质子与一个带负电荷的电子构成C .一个带正电荷的质子与一个带负电荷的电子构成D .一个带负电荷的质子和一个带正电荷的电子构成7.在α粒子散射实验中,当α粒子最接近金原子核时,α粒子符合下列哪种情况( ) A .动能最小 B .电势能最小C .α粒子与金原子核组成的系统能量很小D .所受金原子核的斥力最大8.1911年卢瑟福依据α粒子散射实验中α粒子发生了________(选填“大”或“小”)角度散射现象,提出了原子的核式结构模型.若用动能为1 MeV 的α粒子轰击金箔,则其速度约为________ m/s.(质子和中子的质量均为1.67×10-27 kg,1 MeV =1×106eV)图18-2-89.如图18-2-8所示,M 、N 为原子核外的两个等势面,已知U NM =100 V .一个α粒子以2.5×105m/s 的速率从A 点运动到B 点,求:(1)α粒子在B 点时速度的大小;(2)α粒子与核相距最近处C 与A 点的电势差;(3)如果此原子核为金原子核(已知金原子核的核电荷数为79),且α粒子与金原子核以v =2×107m/s 的速度发生对心正碰,试估算金原子核的大小.(电势能表达式ε=kq 1q 2r,m α=6.64×10-27kg)10.已知金的原子序数为79,α粒子离金原子核的最近距离约为2×10-14m ,则 (1)α粒子离金核最近时受到的库仑斥力是多大? (2)此力对α粒子产生的加速度是多大? (3)估算金原子核的平均密度为多少?(已知q α=2e ,m α=6.64×10-27 kg ,M Au =3.3×10-25kg)18.3 氢原子光谱【学习目标】1.知道什么是光谱,什么是线状谱,什么是连续谱. 2.知道光谱分析的应用.3.知道氢原子光谱的实验规律及巴尔末公式,知道经典电磁理论的困难. 【重点难点】1.线状谱与连续谱的区别. 2.氢原子光谱的实验规律.【易错问题】误认为连续光谱只要通过气体就能产生暗线光谱. 【自主学习】 一、光谱1.定义:按照光的_____和强度分布的展开排列的记录,即光谱.2.分类:有些光谱是一条条的亮线,这样的亮线叫____,这样的光谱叫_______.有的光谱不是一条条分立的谱线,而是连续在一起的光带,这样的光谱叫做______.3.特征光谱:各种原子的发射光谱都是线状谱,说明原子只发射_________的光.不同原子发射的线状谱的亮线位置不同,说明不同原子________是不一样的,因此这些_____称为原子的特征光谱.4.光谱分析:利用原子的________来鉴别物质和确定物质的组成成分,这种方法叫做光谱分析.二、氢原子光谱的实验规律1.许多情况下光是由原子内部电子的运动产生的,因此光谱研究是探索________的重要途径.2.巴耳末公式:1λ=R (122-1n2)(n =3、4、5…)3.巴耳末公式的意义:以简洁的形式反映了氢原子的线状光谱,即辐射波长的____特征. 三、经典理论的困难1.核式结构模型的成就:正确地指出了原子核的存在,很好地解释了_______实验. 2.困难:经典物理学既无法解释原子的______又无法解释原子光谱的________. 【核心突破】一、光谱和光谱分析1.光谱分类⎩⎨⎧发射光谱⎩⎪⎨⎪⎧连续谱线状谱吸收光谱(1)连续谱①产生:炽热的固体、液体和高压气体的发射光谱是连续谱,如电灯丝发出的光、炽热的钢水发出的光都形成连续谱.②特点:其光谱是连在一起的光带.【课堂达标】1.关于光谱和光谱分析,下列说法中正确的是( ) A .光谱包括连续谱和线状谱B .太阳光谱是连续谱,氢光谱是线状谱C .线状谱和吸收光谱都可用作光谱分析D .光谱分析帮助人们发现了许多新元素 2.下列光谱中哪些是线状谱( ) A .霓虹灯发光形成的光谱 B .白炽灯产生的光谱C .酒精灯中燃烧的钠蒸气所产生的光谱D.蜡烛火焰产生的光谱3.关于光谱,下列说法中正确的是( )A.炽热的液体发射连续谱B.发射光谱一定是连续谱C.线状谱和暗线谱都可以对物质成分进行分析D.霓虹灯发光形成的光谱是线状谱巩固练习1.关于光谱,下列说法正确的是( )A.一切光源发出的光谱都是连续谱B.一切光源发出的光谱都是线状谱C.稀薄气体发出的光谱是线状谱D.月亮的光谱是连续谱2.通过光栅或棱镜获得物质发光的光谱,光谱( )A.按光子的频率顺序排列B.按光子的质量大小排列C.按光子的速度大小排列 D.按光子的能量大小排列3.有关原子光谱,下列说法正确的是( )A.原子光谱反映了原子结构特征B.氢原子光谱跟氧原子光谱是不同的C.太阳光谱是连续谱D.鉴别物质的成分可以采用光谱分析4.对于光谱,下面的说法中正确的是( )A.大量原子发光的光谱是连续谱,少量原子发光的光谱是线状谱B.线状谱是由不连续的若干波长的光所组成C.太阳光谱是连续谱D.太阳光谱是线状谱5.关于光谱分析,下列说法错误的是( )A.光谱分析的依据是每种元素都有其特征谱线B.光谱分析不能用连续光谱C.光谱分析既可以用线状谱也可以用吸收光谱D.分析月亮的光谱可得知月球的化学组成6.以下说法中正确的是( )A.进行光谱分析,可以用连续光谱,也可以用吸收光谱B.光谱分析的优点是非常灵敏而且迅速C.分析某种物质的化学组成,可以使这种物质发出的白光通过另一种物质的低温蒸气取得吸收光谱进行分析D.摄下月球的光谱,可以分析出月球上有哪些元素每种原子都有自己的特征谱线,我们可以利用它来鉴别物质和确定物质的组成成分,它非常灵敏.光谱分析只能用线状谱或吸收光谱,而不能用连续光谱.7.在太阳的光谱中有许多暗线,这表明( )A.太阳内部含有这些暗线所对应的元素B.太阳大气层中缺少这些暗线所对应的元素C.太阳大气层中含有这些暗线所对应的元素D.地球的大气层中含有这些暗线所对应的元素8.有关氢原子光谱的说法正确的是( )A.氢原子的发射光谱是连续谱B.氢原子光谱说明氢原子只发出特定频率的光C.氢原子光谱说明氢原子能级是分立的D.氢原子光谱线的频率与氢原子能级的能量差无关9.图18-3-2如图18-3-2甲所示的abcd 为四种元素的特征谱线,图乙是某矿物的线状谱,通过光谱分析可以确定该矿物中缺少的元素为( )A .a 元素B .b 元素C .c 元素D .d 元素10.氢原子光谱除了巴耳末系外,还有莱曼系、帕邢系等,其中帕邢系的公式为1λ=R (132-1n2),n =4,5,6,…,R =1.10×107 m -1.若已知帕邢系的氢原子光谱在红外线区域,试求:(1)n =6时,对应的波长?(2)帕邢系形成的谱线在真空中的波速为多少?n =6时,传播频率为多大?18.4 玻尔的原子模型【学习目标】1.知道玻尔原子理论的基本假设.2.知道能级、能级跃迁,会计算原子能级跃迁时辐射或吸收光子的能量.3.知道玻尔对氢光谱的解释以及玻尔理论的局限性.【重点难点】1.玻尔原子理论的基本假设.2.会计算原子能级跃迁时辐射或吸收光子的能量.【易错问题】1.电子与原子碰撞发生能级跃迁时,误认为电子的能量必须等于能级之差.2.对能级跃迁与电离的区别认识不清.【自主学习】1.电子与原子碰撞发生能级跃迁时,误认为电子的能量必须等于能级之差.2.对能级跃迁与电离的区别认识不清.一、玻尔原子理论的基本假设1.轨道量子化围绕原子核运动的电子轨道半径只能是某些_______、_______数值,这种现象叫做轨道量子化.2.能量量子化(1)定态:电子在不同的轨道对应不同的____,在这些状态中尽管电子在做变速运动,却不向外________,在这些状态中原子是_____.(2)能量量子化:电子在不同轨道对应不同的状态,原子在不同的状态中具有不同的____,因轨道是量子化的,所以原子的能量也是_________,____________实验充分说明了这一点.(3)能级:把量子化的_______称为能级,其中能量最低的状态叫做基态,其他的状态叫做_______.处于____的原子最稳定.3.跃迁条件(1)跃迁:当电子由能量较高(较低)的定态轨道跳到能量较低(较高)的定态轨道的过程.(2)电磁辐射:当电子在不同的定态轨道间跃迁时就会放出或吸收一定频率的______,光子的能量值为:hν=________ (其中h是普朗克常量,ν是光子的频率,Em是高能级能量,En是低能级能量).4.几个基本概念(1)量子数:现代物理学认为原子的可能状态是________,各状态的标号1,2,3,4,……,叫做______,一般用n表示.(2)基态:原子能量_____的状态.(3)激发态:原子能量较____的状态(相对于基态).(4)电离:原子丢失____的过程.二、玻尔理论对氢光谱的解释原子从较高的能态向低能态跃迁时,放出光子的能量等于前后两个能级之差,由于原子的能级是分立的,所以放出的光子的能量也是分立的,因此原子的发射光谱只有一些分立的亮线.三、玻尔模型的局限性1.玻尔理论的成功之处玻尔理论第一次将_____观念引入原子领域.提出了定态和____的概念,成功解释了氢原子光谱的实验规律.2.玻尔理论的局限性过多地保留了经典理论,即保留经典粒子的观念,把电子的运动看做经典力学描述下的轨道运动. 3.电子云原子中的电子没有确定的____值,我们只能描述电子在某个位置出现_____的多少,把电子这种概率分布用疏密不同的点表示时,这种图像就像云雾一样分布在原子核周围,故称电子云.核心突破】一、玻尔氢原子理论 1.轨道量子化围绕原子核运动的电子轨道半径只能是某些分立的数值,这种现象叫轨道量子化, 例如:r 1=0.053 nm ,r 2=0.212 nm ,r 3=0.477 nm…,即rn =n 2r 1,n =1,2,3, 2.定态及原子能量量子化不同的电子轨道对应着不同的原子状态,在这些状态中不向外辐射能量,这就是定态.原子在不同的定态中具有不同的能量,能量是量子化的.例如:E 1=-13.6 eV ,E 2=-3.4 eV ,E 3=-1.51 eV…,即E n =E 1n2,n =1,2,3….3.原子的能级跃迁原子从一个定态跃迁到另一个定态,它辐射或吸收一定频率的光子,即h ν=E m -E n ,从高能级向低能级跃迁时辐射能量,反之吸收能量,辐射或吸收的能量为两能级的能级差.二、原子跃迁注意的几个问题 1.跃迁与电离跃迁是指原子从一个定态到另一个定态的变化过程,而电离则是指原子核外的电子获得一定能量挣脱原子核的束缚成为自由电子的过程.2.原子跃迁条件与规律原子的跃迁条件h ν=E 初-E 终适用于光子和原子作用而使原子在各定态之间跃迁的情况,以下两种情况则不受此条件限制.(1)光子和原子作用而使原子电离的情况 原子一旦电离,原子结构即被破坏,因而不再遵守有关原子结构的理论.如基态氢原子的电离能为13.6 eV ,只要大于或等于13.6 eV 的光子都能被基态的氢原子吸收而发生电离,只不过入射光子的能量越大,原子电离后产生的自由电子的动能越大.(2)实物粒子和原子作用而使原子激发的情况当实物粒子和原子相碰时,由于实物粒子的动能可全部或部分地被原子吸收,所以只要入射粒子的动能大于或等于原子某两定态能量之差,均可以使原子受激发而向较高能级跃迁,但原子所吸收的能量仍不是任意的,一定等于原子发生跃迁的两个能级间的能量差.3.直接跃迁与间接跃迁原子从一种能量状态跃迁到另一种能量状态时,有时可能是直接跃迁,有时可能是间接跃迁.两种情况下辐射(或吸收)光子的频率可能不同.4.一个原子和一群原子氢原子核外只有一个电子,这个电子在某个时刻只能处在某一个可能的轨道上,在某段时间内,由某一轨道跃迁到另一个轨道时,可能的情况只有一种,但是如果容器中盛有大量的氢原子,这些原子的核外电子跃迁时就会有各种情况出现了.即:一群氢原子处于量子数为n 的激发态时,可能辐射出的光谱条数为N =n n -2=C 2n ,而一个氢原子处于量子数为n 的激发态上时,最多可辐射出n -1条光谱线.5.跃迁时电子动能、原子势能与原子能量的变化当轨道半径减小时,库仑引力做正功,原子的电势能E p 减小,电子动能增大,原子能量减小向外辐射能量.反之,轨道半径增大时,原子电势能增大,电子动能减小,原子能量增大,从外界吸收能量.【课堂达标】1.玻尔在他提出的原子模型中所作的假设有( )A.原子处在具有一定能量的定态中,虽然电子做变速运动,但不向外辐射能量B.原子的不同能量状态与电子沿不同的圆轨道绕核运动相对应,而电子的可能轨道的分布是不连续的C.电子从一个轨道跃迁到另一个轨道时,辐射(或吸收)一定频率的光子D.电子跃迁时辐射的光子的频率等于电子绕核做圆周运动的频率2.氢原子的核外电子由离原子核较远的轨道跃迁到离核较近的轨道上时,下列说法中正确的是( ) A.氢原子的能量增加B.氢原子的能量减少C.氢原子要吸收一定频率的光子D.氢原子要放出一定频率的光子3.仔细观察氢原子的光谱,发现它只有几条不连续的亮线,其原因是( )A.氢原子只有几个能级B.氢原子只能发出平行光C.氢原子有时发光,有时不发光D.氢原子辐射的光子的能量是不连续的,所以对应的光的频率也是不连续的4.根据玻尔的氢原子理论,电子在各条可能轨道上运动的能量是指( )A.电子的动能B.电子的电势能C.电子的电势能与动能之和D.电子的动能、电势能和原子核能之和5.氢原子辐射出一个光子后( )A.电子绕核旋转半径增大B.电子的动能增大C.氢原子的电势能增大D.原子的能级增大6.如图18-4-6中画出了氢原子的4个能级,并注明了相应的能量E n.用下列几种能量的光子照射处于基态的氢原子,能使氢原子发生跃迁或电离的是( )图18-4-6A.9 eV的光子B.12 eV的光子C.10.2 eV的光子D.15 eV的光子7.处于基态的氢原子在某单色光束照射下,只能发出频率为ν1、ν2、ν3的三种光,且ν1<ν2<ν3,则该照射光的光子能量为( )A.hν1 B.hν2 C.hν3 D.h(ν1+ν2+ν3)8.氢原子在某三个相邻能级之间跃迁时,可发出三种不同波长的辐射光,已知其中的两个波长分别为λ1和λ2,且λ1>λ2,则另一个波长可能是( )A.λ1+λ2 B.λ1-λ2C.λ1λ2λ1+λ2D.λ1λ2λ1-λ29.图18-4-7图18-4-7所示为氢原子的四个能级,其中E1为基态.若氢原子A处于激发态E2,氢原子B处于激发态E3,则下列说法正确的是( )A.原子A可能辐射出3种频率的光子B.原子B可能辐射出3种频率的光子C.原子A能够吸收原子B发出的光子并跃迁到能级E4D.原子B能够吸收原子A发出的光子并跃迁到能级E410.图18-4-8氢原子的部分能级如图18-4-8所示,已知可见光的光子能量在1.62 eV到3.11 eV之间.由此可推知,氢原子( )A.从高能级向n=1能级跃迁时发出的光的波长比可见光的短B.从高能级向n=2能级跃迁时发出的光均为可见光C.从高能级向n=3能级跃迁时发出的光的频率比可见光的高D.从n=3能级向n=2能级跃迁时发出的光为可见光11.有一群氢原子处于n=4的能级上,已知氢原子的基态能量E1=-13.6 eV,普朗克常量h=6.63×10-34J·s,求:(1)这群氢原子的光谱共有几条谱线?(2)这群氢原子发出的光子的最大频率是多少?12.氢原子基态能量E1=-13.6 eV,电子绕核做圆周运动的半径r1=0.53×10-10m.求氢原子处于n =4激发态时:(1)原子系统具有的能量.(2)电子在n=4轨道上运动的动能.(3)要使n=4激发态的电子电离,至少要用多大频率的光照射?(已知能量关系E n=1n2E1,半径关系r n =n2r1,k=9.0×109N·m2/c2)。
