配位化学发展简史及基本概念
配位化学发展简史及基本概念精选幻灯片

Zn-N配位键形成的分子盒
8
Fe-N配位键组装成的超分子
9
配位化学所涉及的化合物类型及数量之多、 应用之广,使之成为许多化学分支的汇合口。 现代配位化学几乎渗透到化学及相关学科的 各个领域,例如分析化学、有机金属化学、 生物无机化学、结构化学、催化化学、物质 的分离与提纯、原子能工业、医药、电镀、 染料等等。因此,配位化学的学习和研究不 但对发展化学基础理论有着重要的意义,同 时也具有非常重要的实际意义。
13
微量元素与人体健康的问题是世界各国普遍关心 的问题,也是生物无机化学研究的重点课题。新 近发现,许多无机元素在人体中具有极其重要的 作用。如: 缺硒与“克山病”的联系; 铜的超氧化物岐化酶(SOD)可清除超氧离子; 钒与人体中胰岛素的作用有密切关系; “顺铂”配合物可作治癌药物; 铝与老年痴呆症的联系等
4
1987年诺贝尔化学奖
C. Pedersen J-M. Lehn D. Cram 发现冠醚化合物 发现穴醚化合物并提出 超分子概念 主客体化学先驱者
5
• 超分子是指由两种或两种以上分子依靠分子间相 互作用结合在一起,组成复杂的、有组织的聚集 体,保持一定的完整性,使它具有明确的微观结 构和宏观特性。
NH
NH
Fe
NH NH
N HN
咪唑基
15
血红蛋白
肌红蛋白
H2C CH 叶绿素
X CH2CH3
NH
NH
Mg
NH H3C R H3CO2C O NH CH3
应用研究方面:抗癌药物(顺铂), 稀土放疗,艾兹病(杂多酸),营养 滋补品(各类补钙、铁、锌、锗、硒 制剂)。生物无机化学是配位化学、 生物化学、医学、营养化学、环境科 学等学科相互渗透互相融合的产物。
高等无机-配位化学

二、配合物的组成
1、内界、外界、中心体、配体、配位原子 内界:中心体(原子或离子)与配位体,以配位键成键 外界:与内界电荷平衡的相反离子
[Co(NH3)6]Cl3
中心 原子 配体
K3[Fe(CN)6]
外界
︸ 内界
配位数
2、配体的分类
A、按配体所含配位原子的数目分:
单齿配体:只含一个配位原子的配体(NH3,H2O等)
双核锰 配合物
值得一提的是无机生物固氮,现在知道固氮酶是由铁蛋白和 钼铁蛋白构成的。在这些蛋白中, Fe、S、Mo 都是功能元素。通 过模型化合物的研究发现:Fe、Mo蛋白的结构是由组成为 MFe3S3 的两个开口 “网斗”口对口地被三个S原子相桥联。附图中上半部 那个MFe3S3(口朝下)的M为Fe原子,而下半部那个MFe 3S3(口朝上) M则为Mo原子。结 的 构中存在一个由6个 配位不饱和Fe 原子 组成的三棱柱体,
O O N O O N
EDTA配合物的结构
H2N
NH2
NH3
H2N
H N
HN
NH
HN
NH
NH
NH2
HN NH HN NH NH
H2N
H N
N H
○热力学
已能准确测定或计算配合物形成和转化的热力学数据。
○动力学 ★配合物形成和转化的动力学知识也获得了迅速的发展。 ★利用经特别设计的配位体去合成某种模型化合物(配合
物), 用于研究配位反应的机理, 确定反应的类型。
○新型配合物的合成
在维尔纳时代, 几个已知的羰基化合物被看作
化学珍奇。现在, 金属羰基化合物及类羰基配位体(如 N2、NO+、PR3、SCN-等 ) 的金属化合物的研究已发 展成为现代化学的一个重要分支。
第一章配位化学简史和基本概念
NH3-Cl Co-NH3-NH3-NH3-NH3-Cl NH3-Cl (1)
Cl Co-NH3-NH3-NH3-NH3-C NH3-Cl (2)
Cl Co-NH3-NH3-NH3-NH3-Cl Cl (3)
Cl Co-NH3-NH3-NH3-Cl Cl (4)
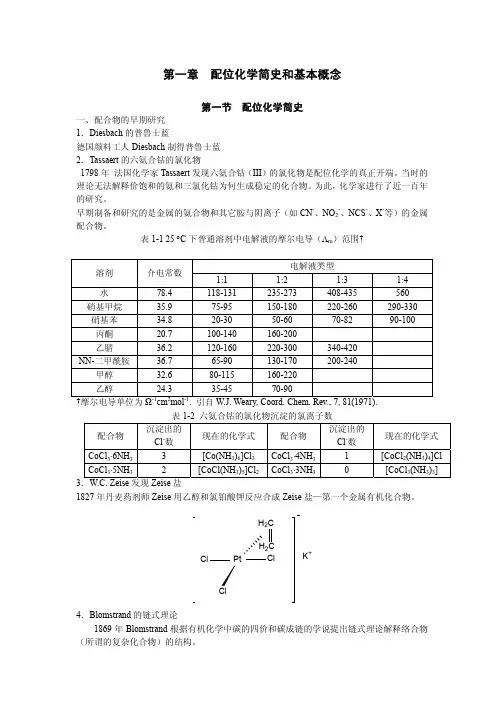
Blomstrand 和他的学生 S.M. Jorgensen 认为:连接在 Co 上的氯不易离解成 Cl-,据此解 释表 1-2 中的实验事实。根据这种假定,可以推测配合物(4)CoCl3⋅3NH3 应与配合物(3) 相似。但 Jorgensen 未能制得 CoCl3⋅3NH3,却制得类似物 IrCl3⋅3NH3,实验证明,该配合物 不导电,加 AgNO3 不产生沉淀。因此他推翻了自己和老师先前的看法,指出链式理论是不 正确的。 二、Werner 的配位理论 瑞士 26 岁的化学家 Werner 1893 年在德国《无机化学学报》发表题目为“对无机化合 物结构的贡献”的论文提出了配位化学的主要概念奠定了现代配位化学发展的基础。1913 年荣获 Nobel 化学奖。 理论要点: 1.大多数元素表现有两种形式的原子价即主价和副价(相当于现代的氧化态和配位数) 2.每种元素倾向于既满足主价又满足副价 3.副价具有方向性,指向空间的确定位置 Werner 认为直接与金属连接的配体处于配合物的内界,结合牢固,不易离解。不作为配体 的离子或分子远离金属离子,与金属结合弱,处于配合物的外界。据此将上述四个配合物依 次表示为:
氮氧配体
氮氧硫配体
磷或砷配体
此外,特殊的多齿配体有:大环配体卟啉、三脚架型配体如 N(CH2CH2NH2)3。 注意:为形成稳定的五元或六元螯环,两个配位原子必须间隔两个或三个其它原子。 (3)根据配位原子的 Lewis 碱性软硬度可将多齿配体分为两类:
配位化学发展简史与现状

在配合物中部分分子或离子与中心离子较紧 密地结合在一起,组成在溶液中能够稳定存 在的整体,称为“内界”。与中心离子结合 不够紧密的离子则处于“外界”。在溶液中 外界离子易于离解,内界分子或离子则难于 离解。
副价指向空间的确定位置,配合物有确定的
几何构型。
精品课件
Werner提出副价概念,藉以补充当时不完善 的原子价理论,这是他的重要贡献之一。正 是为了满足副价的要求,主价已经饱和的分 子、离子可以进一步反应生成配合物。
精品课件
中心原子(或离子)有空的价电子轨道; 配位体含有孤对电子或键电子; 中心原子(或离子)与配休相结合形成具有
一定组成和空间构型的配位个体。 ·
配合物可定义为: • 凡是由两个或两个以上含有狐对电子或
键电子电子的分子或离子(通常称为配体) 与具有空的价电子轨道的中心愿子(或离子) 组合而成的结构单元称为配位个体,含有 配位个体的化合物叫做配位化合物
• 从配位化学的发展史看,真正只有重要意义 的是1790年法国化学家所发现的配合物三氯 化六氨合钻 [Co(NH3)6] C13。标志配位化学 的真正开始。
• 对经典化合价理论提出了尖锐挑战:化合价 已经饱和的CoCl3和NH3为什么还能相互结合生 成很稳定的“复杂化精合品课物件 ”?
• 在众多的研究者中,影响较大的是 A.Werner,近代配位化学的奠基人。由 于当时的经典原子价理论不能对这类新 化合物的形成和成键特征提出圆满的解 释,因而激励着他们去进行更深入的研 究,以增加各自观点的论据。
适合于研究配位化学的物理化学方法取得了可喜的 成果。
社会生产和科学技术发展的需要结配位化学的发展 以巨大的推动力。近40年来,配位化学在社会需要
的推动下获得了迅猛的精发品课展件 ,
配位化学发展简史及基本概念

黄色氯化钴[Co(NH3)6]Cl3 紫色氯化钴[Co(NH3)5Cl]Cl2
配合物中金属是如何与中性分子或有机基团结合呢?对此 先后有多种的解释,其中包括利用19世纪已经确立的有机 属性与结构的关系作解释,但无法从根本上对配 位化合物的结构给予说明。
础。
NH3 Cl
NH3
NH3
NH3
Cl
Co
NH3
NH3
NH3 Cl
NH3
NH3
Cl
Co
NH3
NH3
NH3 Cl
5
6
Cl
Cl
NH3
NH3
Cl
Co
NH3
NH3
Co
NH3
Cl
Cl
Cl
NH3
NH3
7
整理ppt
8
31
Werner对立体化学的贡献—确定六配位配合物的八面 体结构
已知的异构体数与理论上三种不同结构可能异构体数
4、应用:催化反应用于有机合成、金属酶的模拟、分子识别、 金属药物、非线性光学材料、分子磁体、介孔材料、分子机器 等。
整理ppt
13
微量元素与人体健康的问题是世界各国普遍关心 的问题,也是生物无机化学研究的重点课题。新 近发现,许多无机元素在人体中具有极其重要的 作用。如:
缺硒与“克山病”的联系;
项目
配合物 MA5B MA4B2 MA3B3
已知异 构体数
1 2 2
1
6
2
5
3
4
1
2
1
3
5
2
4
5
4
3
5
6
平面六角 形
三角棱柱体
八面体
配位化学教材全文最新版

第1章配位化学导论配位化学(coordination chemistry)是无机化学的一个重要分支学科。
配位化合物(coordination compounds)(有时称络合物complex)是无机化学研究的主要对象之一。
配位化学的研究虽有近二百年的历史,但仅在近几十年来,由于现代分离技术、配位催化及化学模拟生物固氮等方面的应用,极大地推动了配位化学的发展。
它已广泛渗透到有机化学、分析化学、物理化学、高分子化学、催化化学、生物化学等领域,而且与材料科学、生命科学以及医学等其他科学的关系越来越密切。
目前,配位化合物广泛应用于工业、农业、医药、国防和航天等领域。
1.1 配位化学发展简史历史上记载的第一个配合物是普鲁士蓝。
它是1704年由柏林的普鲁士人迪斯巴赫(Diesbach)制得,它是一种无机颜料,其化学组成为Fe4[Fe(CN)6]3·nH2O。
但是对配位化学的了解和研究的开始一般认为是1798年法国化学家塔萨厄尔(B.M.Tassaert)报道的化合物CoCl3·6NH3,他随后又发现了CoCl3·5NH3、CoCl3·5NH3·H2O、CoCl3·4NH3以及其他铬、铁、钴、镍、铂等元素的其他许多配合物,这些化合物的形成,在当时难于理解。
因为根据经典的化合价理论,两个独立存在而且都稳定的分子化合物CoCl3和NH3为什么可以按一定的比例相互结合生成更为稳定的“复杂化合物”无法解释,于是科学家们先后提出多种理论,例如,布隆斯特兰德(W.Blomstrand)在1869年、约尔更生(S.M.Jørgensen)在1885年分别对“复杂化合物”的结构提出了不同的假设(如“链式理论”等),但由于这些假设均不能圆满地说明实验事实而失败。
1893年,年仅27岁的瑞士科学家维尔纳(A.Werner)发表了一篇研究分子加合物的论文“关于无机化合物的结构问题”,改变了此前人们一直从平面角度认识配合物结构的思路,首次从立体角度系统地分析了配合物的结构,提出了配位学说,常称Werner配位理论,其基本要点如下:(1) 大多数元素表现有两种形式的价,即主价和副价;(2) 每一元素倾向于既要满足它的主价又要满足它的副价;(3) 副价具有方向性,指向空间的确定位置。
配位化学简史和基本概念
(2)多齿配体:一个配位体和中心原子以两个
或两个以上的配位键相结合称为多齿配体。 (配体
中含有两个或两个以上配位原子)。 例如:乙二胺(en)、EDTA 、 C2O42-
乙二胺(en)
联吡啶(bpy)
1,10-二氮菲(邻菲咯啉)
-双酮
多齿配体
- OOC
COONCH2CH2N COO-
-
六齿配体 EDTA
2. Werner配位理论的成功之处 (1) 该理论有丰富的实验成果作为实践基础。
(2) Werner在科学研究工作中思想比较解放,他在 继承前人已经取得的科学成果的同时,能够摆脱经 典化合价理论的束缚,而敢于提出创新的见解,对 配位化学的发展作出了重大贡献。
3. Werner配位理论的不足之处 由于时代的局限,Werner配位理论未能说 明配位键的本质。 Werner配位理论是配位化学早期发展过程中的里程 碑。1913年Werner获得诺贝尔化学奖。
利用晶体场-配位场理论、MO理论可以对配合物 的形成、配合物的整体电子结构如何决定配合物的磁学的、 光谱学的性质等理论问题作出说明。
○热力学
已能准确测定或计算配合物形成和转化的热力学数据。
○动力学 ★配合物形成和转化的动力学知识也获得了迅速的发展。 ★利用经特别设计的配体去合成某种模型化合物(配合物),
三、 配位化学当前发展情况 20世纪50、60年代,无机化学最活跃的领域是配位化学
○结构:
利用现代物理测试手段已经能定量地确定配合物结构的细节
○成键理论:
1893年维尔纳提出主价和副价理论 1929年Bethe提出晶体场理论 1930年鲍林提出价键理论 对晶体场理论的修正是配位场理论 1935年Van Vleck用 MO理论处理了配合物的化学键问题
配位化学 概论 (Introduction)
配
工业化学 鞣革 染色 催化化学 环境化学 能源化学 冶金 原子能 火箭 超导 化肥 现代理论化学 农业化学 计算机化学 现代计算技术 现代测量技术 营养化学
化学分析 有机化学—微量元素分析化学 医药 药物化学 高分子化学 化学仿生 物理化学 结构化学 量子化学 有机合成 有机合成化学—金属有机化学 生物化学—生物无机化学 材料合成化学 半导体化学
外界条件的影响
a)配体浓度:一般而言,增加配体的浓度, a)配体浓度:一般而言,增加配体的浓度,有利 配体浓度 于形成高配位数的配合物。 于形成高配位数的配合物。 b)温度:温度越高,配位数降低。 b)温度:温度越高,配位数降低。 温度 c)空间位阻:位阻越大则配位数小。 c)空间位阻:位阻越大则配位数小。 空间位阻 综上所述,影响配位数的因素是复杂的, 综上所述,影响配位数的因素是复杂的,但一般 地讲,在一定范围的条件下, 地讲,在一定范围的条件下,某中心离子有一个 特征的配位数。 特征的配位数。
配体对配位数的影响
配体电荷:配体负电荷增加, 配体电荷:配体负电荷增加,一方面增加中心阳离子对配体 的吸引力,但同时也增加了配体间的斥力,总的结果为C.N. 的吸引力,但同时也增加了配体间的斥力,总的结果为C.N. 数减小。 数减小。如:SiF62-,SiO42-;[Zn(NH3)6]2+,[Zn(CN)4]2配体体积:配体体积越大, 配体体积:配体体积越大,则中心离子周围可容纳的配体数 越少,C.N.数减小 数减小。 越少,C.N.数减小。[AlF6]3-,[AlCl4]-
3. 有关配合物的术语
内界(inner sphere): 即方括号内的部分,也即配 位实体。
外界(outer sphere): 方括号外的部分,即电 荷平衡离子。 [Co(NH3)6]Cl3 K3[Fe(CN)6]
第一章 配位化学简介
配体体积越大,则中心离子周围可容纳的配体数越 少,配位数减小。 [AlF6]3-、 [AlCl4]-
外界条件指配体浓度、反应温度等,他们也会影响 配位数的大小
综上所述,影响配位数的因素是复杂的,但一般地 讲,在一定条件范围下,某中心离子有一个特征的 配位数
1.2.3 配合物的分类
(Types of Coordination Complex)
第一章 配位化学简介
1.1 配位化学的发展简史 1.2 配合物的基本概念 1.3 配合物的命名法 1.4 配合物的应用
1.1 配位化学的发展简史
(The History of Coordination Chemistry)
国外最早记载的配合物-普鲁士蓝染料。1704年普鲁士 染料厂工人迪斯巴赫把兽皮或牛血和碳酸钠在铁锅中 煮沸得到的蓝色沉淀,后经证明为[NaFeIII(CN)6FeII]x
按照配体中配位原子的个数分类
单齿配体(monodentate ligand)
只含有一个配位原子的配体。如X-、OH-和NH3等 双齿和多齿配体(bidentate and polydentate ligand)
含有两个或两个以上配位原子并能同时和中心离子相 结合的配体
N
N
CH2 H2N
CH2 NH2
(2) 配体(ligand)
在配合物中与中心离子结合的阴离子或分子称 为配位体(简称配体);在配体中直接与中心 离子相结合的原子称为配位原子
X
H2
O
O H( 羟基) C N C O (羰基)
N
H3
N
O(2 硝基)
N
CS( 异硫氰根)
第1章 配位化学发展简史及基本概念
1.1 配位化学及其研究内容
(4)次层配位: [Co(en)33H2O]Cl3:第一层配体虽和中心原子配位,但还可以通过残余力量和第 二层的离子或分子作用,进行次层配位。 氢键、偶极等作用力
1905年,《无机化学新概念》,系统地阐述了配位学说。 1911年,《无机化学领域的新贡献》,分子识别,其创新论点和卓越远见为 超分子化学奠定了基础。 1913年,获得诺贝尔化学奖。
red paraquat dication (PQT2+) 百草枯
Docking in Metal-Organic Frameworks Science 2009, 325, 855
1.1 配位化学及其研究内容 1.1.1. 配合物的定义:
由可以给出孤对电子或多个不定域电子的离子或分子(配体),和具有 接受孤对电子或多个不定域电子的空位的原子或离子(中心原子),按一 定的组成和空间构型所形成的化合物。
1.1 配位化学及其研究内容
1.1.3. 配位化学的形成和发展
1.1 配位化学及其研究内容
1.1 配位化学及其研究内容
1.1 配位化学及其研究内容
交叉偶联反应 (2010 Nobel 化学奖:Richard F. Heck、Ei-ichi Negishi 和 Akira Suzuki ,似天然有机物、药物合成)
1.1 配位化学及其研究内容
单分子磁体(SMMs):[Mn12O12(O2CR)16(H2O)4](高密度信息存储材料) 催化剂:
1.1 配位化学及其研究内容
2001年诺贝尔化学奖:不对称合成
威廉· 诺尔斯(W. S. Knowles) 野依良治(Ryoji Noyori) 巴里· 夏普雷斯(K. B. Sharpless) (s)-BINAP-Rh+
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
螯合物(s,红)
Co2+ KNCS
K2Co(NCS)4(丙酮,蓝)
Cu2+ K4[Fe(CN)6] Cu2[Fe(CN)6](s,红褐)
Zn2+ (NH4)2[Hg(SCN)4] Zn[Hg(SCN)4](s,白)
K+ Na3[Co(NO2)6] K2Na[Co(NO2)6](s,黄)
Na+ K[Sb(OH)6] Na[Sb(OH)6](s,白)
血红素
O2 卟啉环
高自旋亚铁脱氧 低自旋正铁氧合
Fe-N 218pm
Fe-N 201pm
NH NH
Fe
NH NH
N HN
咪唑基
血红蛋白
肌红蛋白
应用研究方面:抗癌药物(顺铂), 稀土放疗,艾兹病(杂多酸),营养 滋补品(各类补钙、铁、锌、锗、硒 制剂)。生物无机化学是配位化学、 生物化学、医学、营养化学、环境科 学等学科相互渗透互相融合的产物。
微量元素与人体健康的问题是世界各国普遍关心 的问题,也是生物无机化学研究的重点课题。新 近发现,许多无机元素在人体中具有极其重要的 作用。如:
缺硒与“克山病”的联系;
铜的超氧化物岐化酶(SOD)可清除超氧离子;
钒与人体中胰岛素的作用有密切关系;
“顺铂”配合物可作治癌药物;
铝与老年痴呆症的联系等
金属离子在生命体中的生理生化行为,是目前十 分重要的研究领域。如:血红素,细胞色素,叶 绿素,维生素,铁蛋白,钼铁蛋白,锌蛋白,硒 蛋白,钙调蛋白及几十种重要的金属酶的结构与 存在形式,生理生化功能,毒副作用及化学模拟 生物固氮等。
徐光宪:“21世纪的配位化学是出于现代化学中心地位的二 级学科”,北京大学学报(自然科学版),2002,38(2), 149-152
到了21世纪,配位化学已经远远超过无机化学的 范围,正在形成一个新的二级学科,并且正处在 现代化学的中心地位。 如果把21世纪的化学 比作一个人,那么物理化学、理论化学和计算化 学是脑袋,分析化学是耳目,配位化学是心腹, 无机化学是左手,有机化学和高分子化学是右手, 材料科学(包括光电磁功能材料结构材料催化剂 及转能材料等)是左腿,生命科学是右腿,通过 这两条腿使化学学科坚定地站在国家目标的地坪 上。
配位化学的研究内容
研究各类配合物的合成、结构、性质和应用。
配合物的合成是重点,结构与性质研究是难点,研 究方法是关键。应用是落脚点。
1.新型配合物的合成和合成方法研究 2.配合物在溶液中的平衡和反应性能研究 3.生物无机化学 4 功能配合物及其材料的研究 5 配合物的结构和成键理论研究
1、合成方法:有机和无机化学的合成技术,特别是现今发展 起来的水热技术、微波技术、微乳技术、超临界技术等。
Zn-N配位键形成的分子盒
Fe-N配位键组装成的超分子
配位化学所涉及的化合物类型及数量之多、 应用之广,使之成为许多化学分支的汇合口。 现代配位化学几乎渗透到化学及相关学科的 各个领域,例如分析化学、有机金属化学、 生物无机化学、结构化学、催化化学、物质 的分离与提纯、原子能工业、医药、电镀、 染料等等。因此,配位化学的学习和研究不 但对发展化学基础理论有着重要的意义,同 时也具有非常重要的实际意义。
• 分子间相互作用 非共价键
超分子和超分子化学通常包括 两个领域
1. 受体和底物在分子识别原则基础上, 分子 间缔合成分立的低聚分子物种
2. 数量多而不确定的组分缔合成超分子聚集 体
a. 组成和结合形式不断变动的薄膜、囊泡、 胶束、介晶相等
b. 组成确定,具有点阵结构-晶体研究这种 超分子:晶体工程
配合物在定性分析上的应用
Fe2+ K3[Fe(CN)6] Fe3[Fe(CN)6]2(s,蓝)
(赤血盐)
(滕氏蓝)
邻菲罗啉 螯合物(s,桔红)
Fe3+ KNCS K4[Fe(CN)6] (黄血盐)
Fe(NCS)3 Fe4[Fe(CN)6]3(s,蓝)
(普鲁氏蓝)
Al3+ 铝试剂
螯合物(s,红)
Ni2+ 镍试剂
主要参考书目
1. 配位化学 杨帆、林纪筠等 华东师范大学出版社
2. 配位化学----原理与应用 章慧等 化学工业出版社 , 2008 3. 配位化学,孙为银,化学工业出版社,2003. 4. 配位化合物的结构和性质 游效曾编著 科学出版社 5. 配位化学,罗勤慧,科学出版社,2012
配位化学是研究配位化合物的组成、结构、 性质及其反应内在规律的一门化学分支学科。 它是在无机化学的基础上发展起来的一门独 立的、同时也与化学各分支学科以及物理学、 生物学等互相渗透的具有综合性的学科。
配位化学-原理及应用 章慧
现代配位化学是研究金属原子或离子(中 心金属)同其它分子或离子(配位体)形 成的配合物(包括分子、生物大分子和超 分子)及其凝聚态的组成、结构、性质、 化学反应及其规律和J-M. Lehn
D. Cram
发现冠醚化合物 发现穴醚化合物并提出 超分子概念 主客体化学先驱者
• 超分子是指由两种或两种以上分子依靠分子间相 互作用结合在一起,组成复杂的、有组织的聚集 体,保持一定的完整性,使它具有明确的微观结 构和宏观特性。
• 由分子到超分子和分子间相互作用的关系,正如 由原子到分子和共价键的关系。
2、结构研究:元素分析、紫外光谱、红外光谱、质谱、核 磁共振、荧光光谱、X-衍射等。
3、性质研究:电位滴定、循环伏安、磁天平、变温磁化率、 交流磁化率、电子顺磁共振、光电子能谱、E-扫描、催化性质、 凝胶电泳、园二色谱、核磁共振研究与细胞及DNA的作用。
4、应用:催化反应用于有机合成、金属酶的模拟、分子识别、 金属药物、非线性光学材料、分子磁体、介孔材料、分子机器 等。
H2C CH 叶绿素 X
NH NH
Mg
CH2CH3
NH NH
H3C
CH3
R
H3CO2C
O
H3N
Cl
Pt
H3N
Cl
配位化学的讲授内容(36课时)
第一章 配位化学发展简史及基本概念 第二章 配合物的立体结构和异构现象 第三章 配合物的化学键理论 第四章 配合物在溶液中的稳定性 第五章 配合物的电子光谱和磁学性质 第六章 配合物的反应动力学 第七章 配合物的合成与表征 第八章 配合物与新材料
