常见气体的制取和检验共20页
常见的气体制取与净化

千里之行,始于足下。
常见的气体制取与净化
常见的气体制取与净化方法有:
1. 空气分离法:通过空气分离装置将空气中的氮气、氧气等组分分离出来,得到高纯度的氮气、氧气等气体。
2. 化学合成法:根据不同气体的物理性质和化学性质,通过化学反应生成目标气体。
例如,氢气可以通过水电解反应或碳一烯饱和蒸馏法制取。
3. 燃烧法:某些气体可以通过燃烧反应制取,如氢气可以通过金属与酸的反应或铝水与水的反应制取。
4. 吸附法:利用吸附剂(如活性炭)将气体分子吸附在表面上,从而实现气体的净化。
例如,对空气中的有害气体进行净化。
5. 洗涤法:将气体与液体接触,通过溶解、循环冲洗等方法,去除气体中的杂质。
例如,对氯气进行液体洗涤以去除其中的杂质。
6. 膜分离法:利用特殊材料的膜进行分离,根据气体分子的大小、形状和亲疏水性等特性来实现气体的分离和纯化。
例如,利用膜分离技术可以将二氧
化碳从天然气中分离出来。
7. 冷凝法:通过降低气体温度使其冷凝,从而分离出目标气体。
例如,液化空气工艺中通过降低空气温度来分离出液态氧气和液态氮气。
这些方法在工业生产和实验室研究中被广泛应用,以满足不同领域的气体
制取和净化需求。
第1页/共1页。
常见气体的制备和检验

标准装置
(2)固+液,不加热 不加热
适用气体:氢气、硫化氢、 适用气体:氢气、硫化氢、二氧化碳
启普发生器: 启普发生器
注意事项: 注意事项: (1)启普发生器只适用 启普发生器只适用 块状固体与液体在 于块状固体与液体在 不加热条件下制取难 不加热条件下制取难 溶于该液体的气体如 CO2、H2(不可用于制 C 2H 2) (2)操作时应注意: 操作时应注意: 操作时应注意 a.检验装置的气密性 . b.长颈漏斗插入液面下 .
为重新设计的喷泉装置。 (2)图B为重新设计的喷泉装置。 ) 为重新设计的喷泉装置 在图B的锥形瓶中分别加入足量如下物质 的锥形瓶中分别加入足量如下物质, ①在图 的锥形瓶中分别加入足量如下物质, 反应后可能产生喷泉的是( 反应后可能产生喷泉的是( B ) A、NaHSO4与NaOH溶液 、 溶液 B、NH4HCO3和稀盐酸 、 C、MnO2固体与浓盐酸 、 D、稀NH4Cl溶液与稀 溶液与稀NaOH溶液 、 溶液与稀 溶液 形成这种喷泉的反应条件是 常温条件下反应产生气体 ②在图B中锥形瓶外放一大烧杯,锥形瓶中加入酒 在图 中锥形瓶外放一大烧杯, 中锥形瓶外放一大烧杯 大烧杯中加入冷水后,再加入足量下列物质, 精,大烧杯中加入冷水后,再加入足量下列物质, 结果也产生了喷泉,大烧杯中加入的物质可( 结果也产生了喷泉,大烧杯中加入的物质可( C ) A、食盐 B、硝酸铵 C、浓硫酸 D、(NH4)2SO4 、 、 、 、 (3)比较图 和图 两套装置,从产生喷泉原理来分析,它们的不 比较图A和图 两套装置, 比较图 和图B两套装置 从产生喷泉原理来分析, : 同点是: 同点是: 图A:减小上部烧瓶内气体压强 图B:增大下部锥形瓶内气体压强 : 装置原理相似的现象有: (4)在自然界和人类社会中,与上述图 装置原理相似的现象有: )在自然界和人类社会中,与上述图B装置原理相似的现象有 人造喷泉和火山喷发
常见气体的制取和检验(氧气、二氧化碳)

常见气体的制取和检验(氧气、二氧化碳)课型:新上课时间2011年4月2日主史正红审核:化学备课组班级姓名组名第号辩手组长签名_________ 家长签名_________[复习目标]掌握实验室制取氧气、二氧化碳的反应原理、实验装置、实验操作、检验方法;归纳制取气体的方法、思路和实验注意事项。
[复习导航]一、经典回顾,清晰网络[活动1] 实验原理(化学方程式表示)制氧气:1、___________________________________2、__________________________________3、___________________________________制二氧化碳:____________________________________________________________________[活动2]实验装置(结合图1装置回答问题)⑴写出图1中指定仪器的名称:①_______ ②_______③_______④_______⑤______⑥_______。
⑵用图1装置代号填下表:气体药品名称发生装置收集装置O2过氧化氢、二氧化锰氯酸钾、二氧化锰高锰酸钾CO2大理石和稀盐酸图1[活动3]实验操作1.步骤:制氧气的步骤:_____________________________________________________________________________________________________________________________________________________ ____制二氧化碳的步骤___________________________________________________________________2.制取氧气操作中的追问⑴气体发生装置组装好后,为什么先要检查气密性,后装药品?如何检验?________________________________________________________________________⑵为什么要将药品平铺在试管底部?⑶给试管内的固体加热时,为什么要先预热,再定点加热有药品的部位?⑷给试管内的固体加热时,为什么试管口要略向下倾斜?⑸实验室制取氧气时,试管内的导管为什么不宜过长?⑹用高锰酸钾制取氧气时,为什么要在试管口放一团棉花?⑺用排水法收集氧气实验完毕,为什么要先撤导管,后撤酒精灯?⑻用向上排空气法收集氧气时,为什么导管要伸到集气瓶的底部?⑼为什么收集满氧气的集气瓶,要盖好玻璃片正放在桌上?3.制取二氧化碳操作中的追问⑴实验室制CO2气体为什么不能用浓盐酸代替稀盐酸?制出的CO2气体通入澄清石灰水为什么不变浑浊?⑵为什么不能用粉末状的碳酸钙或碳酸钠代替块状的石灰石?⑶为什么不能用稀硫酸代替稀盐酸?⑷为什么只能用向上排空气法收集CO2气体?⑸实验室要制备干燥的CO2气体,应选择用什么做干燥剂?⑹如何检验实验室制备CO2气体装置的气密性?[活动4] 实验检验(验满和证明)验满:⑴使用排水集气法收集氧气,如何知道氧气是否收集满?_____________________________⑵使用排空气法收集氧气,如何知道氧气是否收集满?⑶使用排空气法收集二氧化碳气体,如何知道二氧化碳气体是否收集满?证明:如何证明氧气_______________________________________________________________________如何证明二氧化碳___________________________________________________________________[预习自评1]通电1、从安全、环保、节能、简便等方面考虑,实验室制取氧气的最佳方法是)MnO2 A.通电使水分解:2H2O2H2↑ + O2↑B.过氧化氢催化分解:2H2O22H2O + O2↑MnO2 C.高锰酸钾加热分解:2KMnO4K2MnO4 + MnO2 + O2↑D.氯酸钾加热分解:2KClO32KCl + 3O2↑2、实验室制取氧气的主要步骤有:①固定装置、②装入药品、③加热、④检查装置的气密性、⑤用排水法收集。
常见气体的制取和检验
收集装置:集气瓶;玻璃片;水槽(排水集气法);
几种常见的制取 气体的发生装置
例题精选
实验室制取HCl气体的方法:浓硫酸和氯化钠固体 共热,反应如下: △ 2NaCl+H2SO4====Na2SO4+2HCl↑。 已知氯化氢气体易溶于水,密度比空气大。请你 选择合适的仪器组合成制取和收集氯化氢气体的装 置。
(二)实验室制气体的装置
实验室制气体装置模型
A
C
B
A:有唯一出口的“封闭”装置,是发生化学反应产生气体的场 所,称为反应的发生装置。根据化学反应的条件合理组合仪器; B :收集气体的装置,称为收集装置。根据气体的性质合理选择 收集的方法; C :连接发生装置和收集装置的仪器,由玻璃导管和橡皮管连接。 发生装置:反应容器(试管、锥形瓶、广口瓶、烧瓶等);带孔 橡皮塞(单孔或双孔);导管(玻璃);酒精灯(反应需要加热 的实验);长颈漏斗;分液漏斗
3、水蒸气 检验:白色的硫酸铜粉末遇水会变成 蓝色。
除水蒸气:气体通过浓硫酸、生石灰、 固体氢氧化钠等。
4、氢气的检验
思考题:如何检验一氧化碳气体的存在?
例题精选
1、草酸是植物特别是草本植物常具有的成分,多以钾盐或钙盐的形式存 在。草酸的化学式为H2C2O4。草酸有毒,对皮肤、粘膜有刺激及腐蚀作用, 极易经表皮、粘膜吸收引起中毒。草酸遇浓硫酸会分解生成二氧化碳、一氧 化碳和水。根据以上信息,结合初中所学科学知识,解答下列问题: (1)草酸属于 有机物 。(选填“有机物”;“无机化合物”;“混合物”) (2)实验室利用草酸遇浓硫酸会分解生成二氧化碳、一氧化碳和水来制取 浓硫酸 一氧化碳。写出该反应的化学方程式: H2C2O4======H2O+CO↑+CO2↑ 。 该反应的发生装置可以采用 A 装置。(选填A或B) A.过氧化氢和二氧化锰制氧气的装置 B.氯酸钾和二氧化锰混合加热 制氧气的装置 (3)下图为小明设计的收集一氧化碳的装置:其中a与发生装置相连,b和 c相连。则甲瓶的作用是 除去二氧化碳气体 。 防止草酸沾在皮肤上; (4)上述实验在操作中要注意哪些问题?请说出一点: 。
高中化学常见气体的制取装置图和方程式
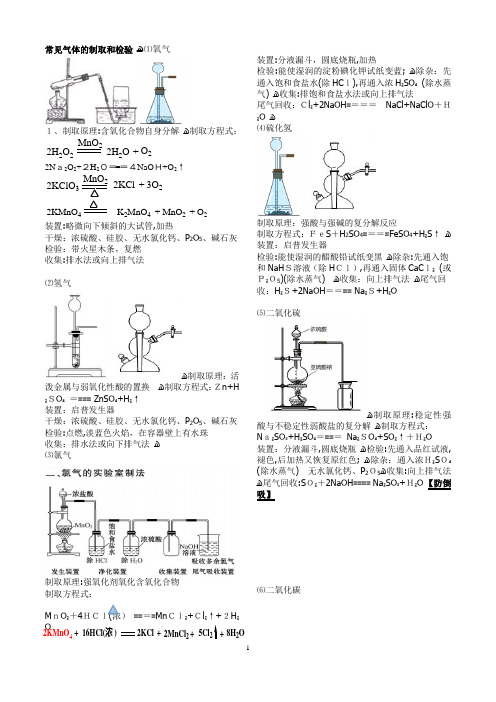
常见气体的制取和检验 ﻫ⑴氧气1、制取原理:含氧化合物自身分解 ﻫ制取方程式: MnO 2O 2+2H 2O 22H 2O2N a2O 2+2H 2O===4NaO H+O 2↑2KClO 3MnO 22KCl +3O 22KMnO 4MnO 2K 2MnO 4+O 2+装置:略微向下倾斜的大试管,加热干燥:浓硫酸、硅胶、无水氯化钙、P 2O 5、碱石灰 检验:带火星木条,复燃 收集:排水法或向上排气法⑵氢气ﻫ制取原理:活泼金属与弱氧化性酸的置换 ﻫ制取方程式:Zn+H ₂SO ₄ ==== ZnSO ₄+H ₂↑ 装置:启普发生器干燥:浓硫酸、硅胶、无水氯化钙、P 2O 5、碱石灰 检验:点燃,淡蓝色火焰,在容器壁上有水珠 收集:排水法或向下排气法 ﻫ ⑶氯气制取原理:强氧化剂氧化含氧化合物 制取方程式:M nO ₂+4HCl(浓) ====Mn Cl₂+Cl ₂↑+2H ₂O装置:分液漏斗,圆底烧瓶,加热检验:能使湿润的淀粉碘化钾试纸变蓝; ﻫ除杂:先通入饱和食盐水(除HC l),再通入浓H ₂SO ₄ (除水蒸气) ﻫ收集:排饱和食盐水法或向上排气法尾气回收:Cl ₂+2NaOH ==== NaCl+NaClO +H₂O ﻫ ⑷硫化氢制取原理:强酸与强碱的复分解反应制取方程式:FeS +H 2SO 4====FeSO 4+H ₂S ↑ ﻫ装置:启普发生器检验:能使湿润的醋酸铅试纸变黑 ﻫ除杂:先通入饱和NaH S溶液(除H Cl),再通入固体CaC l₂ (或P₂O5)(除水蒸气) ﻫ收集:向上排气法 ﻫ尾气回收:H ₂S+2NaOH ==== Na ₂S+H ₂O⑸二氧化硫ﻫ制取原理:稳定性强酸与不稳定性弱酸盐的复分解 ﻫ制取方程式: N a₂SO ₃+H ₂SO ₄==== Na ₂SO ₄+SO ₂↑+H₂O 装置:分液漏斗,圆底烧瓶 ﻫ检验:先通入品红试液,褪色,后加热又恢复原红色; ﻫ除杂:通入浓H₂S O₄ (除水蒸气) 无水氯化钙、P 2O5ﻫ收集:向上排气法 ﻫ尾气回收:S O₂+2NaOH ==== Na ₂SO ₃+H₂O 【防倒吸】⑹二氧化碳+16HCl(浓)2KCl +2MnCl 25Cl 28H 2O ++2KMnO 4ﻫ制取原理;稳定性强酸与不稳定性弱酸盐的复分解ﻫ制取方程式:CaCO₃+2HCl====CaCl₂+CO₂↑+H₂O 装置:启普发生器ﻫ检验:通入澄清石灰水,变浑浊ﻫ除杂:通入饱和NaHCO₃溶液(除HCl),再通入浓H₂SO₄(除水蒸气)收集:排水法或向上排气法ﻫ⑺氨气ﻫ制取原理:固体铵盐与固体强碱的复分解制取方程式:Ca(OH)₂+2NH₄Cl₂+2NH₃↑+2H ₂O①直接加热浓氨水;②浓氨水中加生石灰(或碱石灰)。
常见气体的制取、净化和检验

(3)根据我们所学的知识,你认为A装置 和____D____装置相连并产生什么现象时就 足以说明鸡蛋壳的主要成分是碳酸盐?
澄清石灰水变浑浊
CO2 + Ca(OH)2 == CaCO3↓ + H2O
(4)该同学想要收集一瓶纯净的该气体,进
一步验证它的性质。连接上述装置的顺序是: (填写各接口字母)_____a_→__d_e_→_b_c_→_g__。其中,
(3)若某同学用c装置收集一瓶较纯净氧气, 当观察到气__泡__连__续__均__匀__大__量__冒__出_时开始收集。
思路点拨1
小窍门:气体在哪儿聚集, 就从哪儿进气
密度比空气大: 长导管进气
密度比空气小: 短导管进气
排水法:盛满水正 放,短导管进气
变式训练1.请根据下列装置,回答问题: 。
还记得吗?
(1)酥脆的饼干在空气中会变软,说明空气中有 H2O(气;)
(2)最轻的气体,科学家预言其会成为未来理想的能源
H2 ; (3)西气东输工程输送的天然气的主要成分是 CH4 ;
(4)久置空气中的石灰水表面形成一层白膜是因为空气
中有 CO2
;
(5)医院里急救病人,给病人输入的气体主要是 O2 ;
HCl NaOH溶液
AgNO3溶液
O2 灼热的铜网
除CO2中HCl用饱 和NaHCO3溶液 水
2.干燥
浓硫酸
可干燥 CO2、SO2、HCl等酸性气体
H2、O2、N2、CO、CH4等中性气体
不可干燥 碱性气体NH3
碱石灰(CaO和NaOH的混合物)
可干燥 碱性气体NH3 H2、O2、N2、CO、CH4等中性气体
(1)由①可知原混合气体中肯定不含___C_O__2___; ((23))由最②终可 收知 集原 到混 的合 气气体体是中__一__定_N_含_2_有_________;C_H__4___;
人教九年级化学上册第六单元实验活动2 气体的制取与收集(共20张)

B.H2、CO2、CO D.H2、CH4、CO
第五页,共21页。
习题2.NO在常温下是一种气体,难难溶溶于于水,密度 比(m空ìd气ù)的比略空大气的能略与大空,气能中与的空氧气气中(y的ǎ氧ng气q迅ì)迅速速(反m反应ìd 生成NO2气体。应现要收集一瓶NO气体,应采用ù的) 收
集方法是A( )
(2)假设样品中杂质不参加反应,且B、C、E装置
吸收是完全的。若样品为10g,完全反应后,E装E置装的置质
的量增质加量了增2加.7了g2,.7则g样品中氧化铁的质量分数为 (zhuāng
_______8__0_____。
ì)
(3%)若(2)中实验所得数据是BB、、CC装装置置颠颠倒倒后
测出的,那么计算出的结果比实际样品中氧化铁的质量
如氧体气的、密一氧度化明碳显、(一m氧ín化g氮x等iǎ。n)小于空气,则
可用 收集. 第三页,共21页。
倾斜 (qīng xié)
液封
A
B
C
D
E
第四页,共21页。
习题1.下列各组气体中,可用同一种方法收集,且 该方法是组内每种气体的最佳(zuì jiā)收集方法,这
样的一组是(D )
A.H2、O2、CO2 C.CH4、O2、CO2
端通入
②若用排空气(kōngqì)法收集O2时, O2应从装置的____
端通入
③若用排水法收集 CO 时,瓶内先装满水,
CO气体从____端通入;
④若要用水将装置中的CO排出来进行实验时,水应从____
端通入;
❖
❖a ①若b 用排空气(kōngqì)法收集O2时, O2应从装置的____端 通入;
❖ ②若用排水法收集O2时, O2应从装置的____端通入。
常见气体的制取和检验(课件PPT)

问题3:要制取纯净、干燥的一氧化碳,正
确的实验装置连接顺序是 AFGH
。
活动二 练一练、想一想
问题4:要制取纯净、干燥的气体应添加哪 些装置?
发生 装置
净化 装置
干燥 装置
收集 装置
总结二: 制取纯净、干燥的气体,选择装置的思路
活动三 探究新问题
问题3:若某混合气体中,可能含有二氧
问化题碳12和:一如此氧何方化检法碳验检,一验能氧一否化氧用碳化此?碳方,法实确质定就混是合 把气一体氧中化一碳定转有化一为氧C化O碳2 ?来检验。
用该反应来制取CO,
发
生装置应选 A(填字母);收集装置应选
(C填或字H母)。
问题2:用该方法制取的一氧化碳符合实 验室要求吗?混有哪些杂质气体呢?
活动二 练一练、想一想
已知:实验室常用装有浓硫酸的洗气瓶干燥 气体(除去混合气体中的水蒸气),用装有 氢氧化钠溶液的洗气瓶除去混合气体中的二 氧化碳。
验满方法 将燃着的木条放在集气瓶口,若熄灭,则收集满
实验室制取二氧化碳的实验
药品 稀盐酸和大理石(或石灰石)
反应原理 CaCO3+2HCl=CaCl2+H2O+CO2
发生装置
收集装置
装置
固液不加热
向上排空气法
操作步骤
查装收验
检验方法 将气体通入澄清石灰水,若变浑浊,则该气体是二氧化碳
验满方法 将燃着的木条放在集气瓶口,若熄灭,则收集满
①③
④②④
③⑤
① ①①③⑥
双孔 双孔塞
单孔塞 双孔玻璃双片孔塞
②②⑦ ④②④ ⑧③⑥③ ③⑤④⑨⑦ ④④ ⑤⑧④⑩④ ⑤
双孔 双孔塞
⑧⑥⑥⑤
