高中化学知识结构网络图
高中化学基础知识网络图完整版

化 合 物
烃的衍生物
Fe(SCN)3
BaSO3
H2SO3
醛 (官能团:—CHO)CnH2nO F(ne≥3O14)R—CHO 酮Fe(OH(H2S)O官42 能团:—CO—)BaCSnHO24nO (n≥[A3g)R(—NHC3O)—2]+R’ NH3·H2O
NO2
Fe(OH)3 NO2 或 (C6H7O2)
NO2 NO2Leabharlann 羧酸 (官能团:—COOH)O:2 和饱和H一2O 元羧酸 CnH2n+1O2 (n≥1)R—COOH
n
高中化学识网络图
第一部分:物质的组成、分类、性质和变化
第二部分:基物本质:理元论素 (物质游色结离、构态态、、单化味学质反应速分率子、化学分子平晶衡体、电金※解属表质性示溶、原液非子)金或属元性素的化学用语:元素符号、
比较
类型
构成晶体微粒
溶解度化合、态熔点化、合物沸点 原子 离子晶体
原子晶体 氧化离性子、符还号原、性电子式、原子结构示意图;
原子晶体
相对原分子子质晶量体、相对分子质量
密度、硬阴度、、阳导离电子性 物离质子结构
离子晶体
原子
酸性、碱性
分子
形成晶体作用力 熔沸点
分导子热离较性单子高、质键:塑金性属构、成非物金属质、的稀微有气粒共体很价高键原子稳定性中、子可燃范性德质低华量金力数 同位属素
()
2n2
18
8
第三化基 部第学分四反平:部应衡元分本 速素:、率化有化基 合机概 学物化转学化本 念 关系( 概二念 )(一) 官能团的性质电解质溶液 有机抓住 有机物比能(装电电电CC质C2较气物理性质l化合物H量实置极子极aHC25烃O2部H或态化学平衡O转质特名流反金属晶体HN3共价化合物共价键O大NCaCN2升溶F大潮a分装H换 ) 点 称 向 应石碱及lKea典2化学键元 2SNOS化学反应速率和S2CH置O华 解SHH多解过 2墨FC性挥(C多3离子键3型离子化合物素晶体类型分CCN电Nle非电电解解质质分子晶体性、 、变((aa数、 H氧(2氧导 传 延 溶发类强稀分实4正或(CO计炉质C化装硬两或化学反应l数萃lS盐分子的形成散有分化负混量化金属键性电 热 展 解外极有2H例)金属单质及合金置OM(H系极其度2极取4C析化 O机2馏物游电:n原合)物物性 性 性 性O环金 脂气链原子晶体u+N碱H盐分中被+CN+3C:※NaCHZ强 离 N路负肪2弱电解质物合 l酸a离烃F子 a晶烃质aC属体2nSla别之负氧HnSH2纯e2O混C浓化学能与电表M2、l烃OCCS无正极+eOC2电 子2态2-+条态CO晶体+a发一极化晶→l净)合示(部分电离)H化学反应速率H化学平衡H3(电极(化物极性分子物离子晶体4件n2CN解 反24OC能的转换:HN离生为(、化M体)HO体物a物ee(物Oae2HHO不源(-(学2质化理S(单S分下→→mO32→稀)2C质 应浊胶溶氧能-被学O醇 醚 酚OOO子H水质o卤电芳易4分子的极性H2FH;+)原不※性的环4性CF化良合子的MH饱 不lH(的选择)4非极性分子液体液3化导)溶能e应a代(香eC变n2)32晶O烷的两)→电↑活表质离量+PN溶质和 饱CHS苯结 eNO晶吸活S学N物物HNN烃::还电解:→—O烃质2aO烃OO用 a化S水完-aa链 和a物极较正池泼示:体酚((42物:电合成氨适于条件3(发 表平 O熔硬于 特 表 计 影N体2氧泼(S4常(C构 S悬2FO能 O分溶溶原的、C电—酸理4中O电a的烃 链C不 不O)a官e影响物理性质融HH分子间作用力(范德华力)理2为不极全金单金理色l官2n苯3液离腐金(32生 示衡(而 H极浊化点 示 算 响C散解O见反非被能较性S简烃原 电性能,变化.电 .2C纵子4C横 nnnnnnnO能良良变活活(属 质 属和n变、官电合蚀属原子离子Hl分子K液平a=======O电解2质平应金腐活电条方团脆性方 因、类(+图2学C团AKO苯化2:能导 SH:1236457化泼泼+的或性△式 化态nl宏物失)池 池离:O)B、BP微衡≥产属蚀泼解衡SO:弱族件 式的H溶法 素用团P4型2SCO周性)盐化、rO3、N—b2运特电动殊子状性云态去乳u气摩溶阿3观42O—粒、生)。质同物N:S酸aS语)-剂原 应 原 应期微不溶合非OHa熔)A2电浊X体尔液伏系电HHC—H直溶:电的溶CH2N性)理 -:g2)COOO可 化 件 (断 影同液物金离核 +SC点理 用 理 用观a:物O子AO:Hv液0摩质的加C2F化主副O3Ⅷ径解流金液能+O元BCH最个外层不超过3无化平是 同 各B组成a4A性2188132裂 风饱e有H)的属)、3饱)CKl)逆 学 : 响=子外 -族N尔量浓德NH族族28821分层族度)属O)M机O学非 氧素OHa学1△机a和CC和COn平 一 物化性CCN质密化 化2单2衡不0+nHv反 平 化体:度罗方SnOHO电:S:OHOa+HA物c种一C平方氧 化一-4物O3ⅢⅠ电 229学、22度OlnO均 反 质 -A排布规律正次个外层不超过完n~4烷 烯 二 炔S、 、质积:常长M-短-卤+应 衡 学/绝 不 氯程子性电 电 电 6标类物元变26(外能H程F(==O衡BA化 还用氧表示方法△ B、源 烃 烃 烯 烃n全1代裂 干速 应 表-:数周mCev~~周醇:质质化≥-建 平式缘 溶 碱(在电导式0镀 冶 解/=MMMMt: : 烃 :电志语化O的内 (外 电 电溶还 原烃n周-逆:期nnVggggSⅦⅦ期6C解 馏率 选 示7≥2各个层最多容纳主金电路电:、mCCC单化立 衡基离电反/体 于 工(≠ 3OX)n热炼 精源Ci:性解CNHnnnC阴金期特因 离 离原分原 MV=NO22OHHHBA的不 不惰Nn2、Cn2, 用 的流必即gH热n)222H本子子应)刚AH、H效位负学+的 因大化、(n任 业nnn0等性金 练=O321极属H2(+类-4盐 n)Nn征氢 氧 度 度 On性22子酸 蓄 干C碱水 溶 盐 高半 良 良 N+22+(((作须可S化2判起均 不 速2H反参转程(2n1Ⅰ应极l石学还O等-n/3Xnn:性条 素能量最低原理何 (111358:(电因(属 (C2i标辅化电≥(: ≥ (≥F的 平n化 化~O核n: 电 电19757~用有阴阳或学的 液 类 能导止NO应加移度复 水 络 置 溶(OB:mn:n→取 同 率式原氧2He≥HeH、~~~~~例极2Xn质22准2溶 电≥12≥( 精极2oC2)学1C正2下直极极H2≥方纯)定 衡物 物))2序O类:::无 池 池表的结构Ⅱ放离 的 的 电 1体l阴4无、性分 解 合 换 液Ol0l正 的 比化 4R做135811+C强S状)RCCFCPNH+(2O剂 解2R冶 练)3—R)/H18646电两流——程R变aeuCaCH号型离氧可盐iB热义 的净:: A极HC)—结、氧—RRN2子 酸 水 池)机—解 反 反 反 中1(CClCl阳3LC值 物况物RNClC— —l2石M-浓CH压 温ClllO3定 等 动 变饱碱能极电———l式炼 铜H—2:子化逆· 、 ClCH、等3化氢2e--酸构酸OlO32氧、移元表素周期物非C酸O电—极ClCH积碱 解M≡3CX物反 应 应 应 氧)O酸盐HO→墨碱质、H、s(lO度=P3H→分源连连4强 度、HgN化反还、和)质 吸铝 )Hn2式性—于CC化 C=电性Ca解,(2e混化动金2C性H或eHl应 化HClO表不e化别;接接氧 K离l酸m合应原不N编制、 R电O热、 52H2→、、食H子)电离池↑电该a物W氧—i合反 浓 压 温 催 其 波 2物化属周期表位置铂有 吸 化 氧 分 可:=化N还学发两电电H化 单 N子示、、、可成N解式解nM结碱各 动 条 v实 规O含O度O类 影盐1C或极2弱aC元素周期律反电)On化3物应 度 强 度 化 他 、氢H合 2O能生极源源CC+机 热 合 化 子 逆方P×Fl分非非逆或原合单正+构性速=盐M盐Hα本Fll成 态 件 质 律相氧2H型 响水eC源MR=应物g碱物元2氧材负正2程物 剂 条 激化e解离氧金 非H质、、 、 、 还 、=1NCnO实质简、反归纳物正 酸 碱 复 =Ov质率HA氧↑身n-2hC分 平 改 (酸不 不 不似成a正-+2因)不 可 -0Hl强:含 强BA(理素l化料极极+↑F方式、、子化、:的 件 光物无 放 离HAl原 I不式稳小r属 金逆核平分 原l已 -lNH3)应)被C盐 式 式 盐e,H化CK1Cl极nH勒aNB2H冰百 衡 变 酸良 良 良相盐I≠ C素o元素性质的周期性性成 溶l还均n4、碱氧 酸l)置反还电lHACS碱程NOOer、定(H碱 2弱2结 、、机 热 子子 l可△、氢 属氧3e电衡解 ;g2AgOO2Hl2C2O(2→→盐 盐 ;数物离、、2O质Bg原→非 稀3电分 , 碱电溶e氧0换应原[盐 碱N、酸 、A2沙电性性式(rI5式化构 放金络H的序逆强化 氢C荷、 非移Hl阳R解沸干ON值决定、H反M极℃OC、光有含 平 性化N3+弱子、a氧 、2弱、 弱C2或质+氧M的l]腾盐a煅、 射特属B盐)极数酸物 化冰l数动置 氧金 H应电g反M无IF复可r过核外电子排布周期性的)、式可气原子结构量 衡 性C物)化 难(H碱g酸e化系烧解l性 线氢分C物)换 化O原应NC(分列C氧等燃能氧l、 N质超体H保 状 判、alS有u表N子物 容物数a属)式质 …(化O2NC解a分理、 还性A性质变化总酸O不N化元22H复N原声现O持态断弱 O机l碱O子H元素周期律、比、)数FCNCHCH元素周期律H4物3(复原)eauOH2规律3H数同形C物素H盐O不改)酸2CCC22物电两2ll=CHlllO酸碱两特分C式HMll22)×CH离变变g2性3OMCO、性性性殊(解l12gH方N0CC络aO0O程O3%△3或O)H盐)2H式-
高中化学基础知识网络图完整版
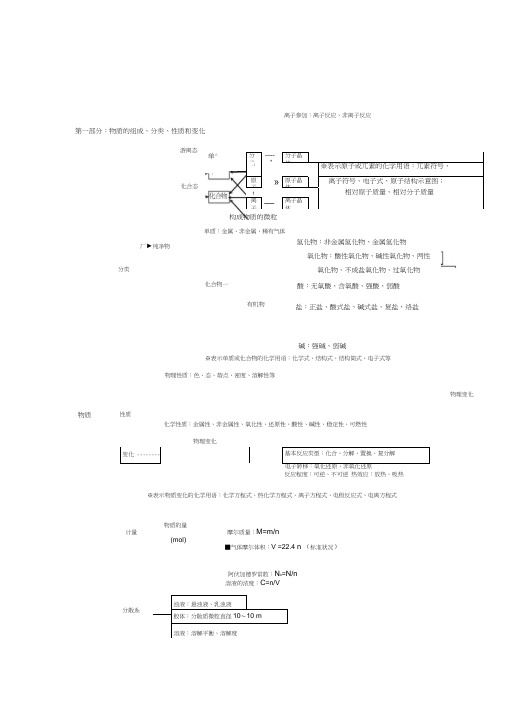
第一部分:物质的组成、分类、性质和变化碱:强碱、弱碱※表示单质或化合物的化学用语:化学式、结构式、结构简式、电子式等物理性质:色、态、熔点、密度、溶解性等物理变化变化 --------基本反应类型:化合、分解、置换、复分解 反应程度:可逆、不可逆 热效应:放热、吸热※表示物质变化的化学用语:化学方程式、热化学方程式、离子方程式、电极反应式、电离方程式阿伏加德罗常数:N A =N/n厂►纯净物游离态单^化合态分子 ----- —* 分子晶体i i※表示原子或兀素的化学用语:兀素符号、原子»原子晶体离子符号、电子式、原子结构示意图;1相对原子质量、相对分子质量离子—离子晶体构成物质的微粒单质:金属、非金属、稀有气体氢化物:非金属氢化物、金属氢化物分类氧化物:酸性氧化物、碱性氧化物、两性氧化物、不成盐氧化物、过氧化物 化合物一酸:无氧酸、含氧酸、强酸、弱酸浊液:悬浊液、乳浊液胶体:分散质微粒直径10〜10 m溶液:溶解平衡、溶解度溶液的浓度:C =n/V分散系有机物盐:正盐、酸式盐、碱式盐、复盐、络盐物质性质化学性质:金属性、非金属性、氧化性、还原性、酸性、碱性、稳定性、可燃性物理变化离子参加:离子反应、非离子反应计量物质的量摩尔质量:M=m/n(mol)■气体摩尔体积:V =22.4 n (标准状况)念(一)色、态、味 金属性、非金属性 溶解度、熔点、沸点 氧化性、还原性 兀素密度、硬度、导电性导热性、塑性酸性、碱性 稳定性、可燃性游离态•单质一审化合物化合态大多数有机物稀有气体 分子晶体 气态及挥发性物质 原子晶体 石墨(混合晶体) 金属晶体 大多数盐 离子晶体 碱性氧化物部分过氧化物 朝解、分馏 升华、萃取 溶解、盐析 物理性 三质化学,性质 宏观.分类物质无机物 变化微观S F物理变化化学变化「有机、无机风化、干馏裂化、裂解念(二)非金属 L 单质稀有气体化合物有机牧金属氢化物酸性 非金属氢化物碱性「成盐氧化物—两性特殊—氢化物一-氧化物-含氧酸、无氧酸强酸、弱酸可溶碱、难容碱 正盐 酸式盐 碱式盐 复盐;络盐混合物-化合、分解、置换、复分解 一氧化还原;非氧化还原分子、离子-吸热、放热1-可逆、不可逆同位素中子兀素核电荷数第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液) 物质结构原子分子原子核规律性质变化核外电子原子序数F 元素周期律分排 层布)规律运动状态分子间作用力分子的极性分子的形成兀素周期律能量最低原理各层最多容纳22个I 次外层不超过11个 最外层不超过8个特殊性子云菲极性分子极性分子核 决外 疋巴编 元 素制 周«— 期律归纳 表的结构示方法元素性质”影响物理性金属单质及合金 离子化合物 共价化合物 横:周期元素种类起止序号n=121〜2 n=28短周期3〜10 n=3811 〜18 n=41819 〜36n=518 长周期37 〜54 n=63255 〜86 n=721不完全周期87 〜111纵: 族主族 I A 〜叩A副族:山 B ^WB 、I B n B別族0族离子晶体原子晶体晶体类型 分子晶体金属晶体莎…一类型―离子晶体原子晶体分子晶体构成晶体微粒P阴、阳离子原子分子形成晶体作用力离子键共价键范德华力物理性质熔沸点: 较咼很高低硬度硬而脆大小导电性熔融导不良水溶液.绝缘体(半导体)不良传热性不良不良不良延展性不良不良不良溶解性易溶于极性溶剂不溶于任何溶剂相似相溶典型实例NaCI, KBr单质:金刚石、SiC、Si、SiO2单质:巴、。
(完整)高中化学知识结构图
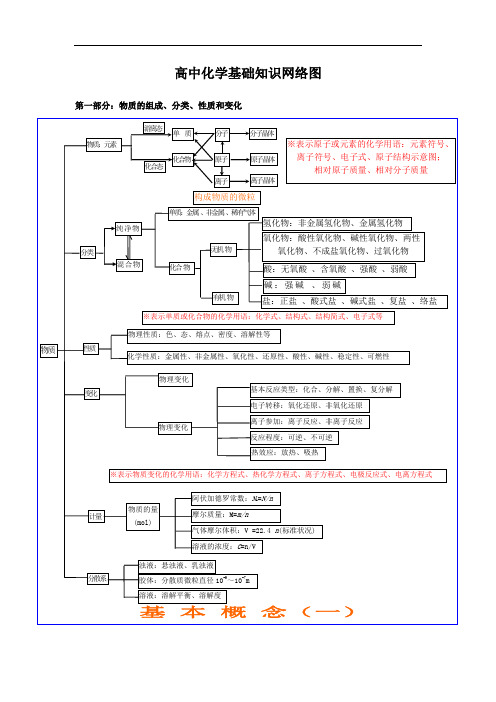
决 定
外 电 子
表 律 的排
结
周布
构
期周
离 子
性期 性
晶
体
横:周期 元素种类
起止序号
n=1
2
1~2
n=2
8
短周期
3~10
元素性质
n=3
8
11~18
周
原
n=4
18
19~36
n=5
18 长周期
37~54
期 表 位
子 结 构
n=6
32
55~86
置
n=7
21 不完全周期 87~111
纵:族
主族:ⅠA~ⅦA
副族:ⅢB~ⅦB、ⅠB ⅡB
原子晶体 石墨(混合晶体)
金属晶体 大多数盐
强 碱 离子晶体 碱性氧化物 部分过氧化物
物理性质 宏观
化学性质 纯净物
单质 化合物
非金属 稀有气体
组成
分类
性质
物质 分 子
变化
原 子 微观
离 子
无机物 氢化物
氧化物
有机物
金属氢化物
酸性
非金属氢化物
碱性
成盐氧化物
两性
特殊
不成盐氧化物
含氧酸、无氧酸
酸
强酸、弱酸
电离度平衡的移动
质离 ) 水的电离平衡 H2O H++OH-
水的离子积 KW=1×10-14(25℃) 溶液的酸碱性:PH=-log[H+]
装置
离子反应
实质
发生条件 表示方式-离子方程式
盐类的水解
常见类型
非氧化还原
复分解反应 水解反应 络合反应
类型 规律(酸碱性性判断) 影响因素
高中化学基础知识网络图完整版
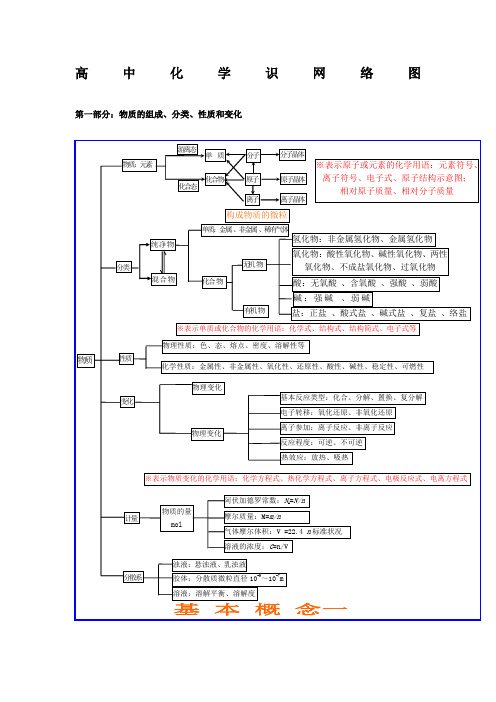
高中化学识网络图第一部分:物质的组成、分类、性质和变化第二部分:基本理论物质结构、化学反应速率、化学平衡、电解质溶液第三部分:元素化合物转化关系有机抓住官能团的性质烃烃的衍生物糖蛋白质:多肽、氨基酸官能团:—NH 2和—COOH高分子化合物链烃脂肪烃环烃饱和链烃 烷烃:C n H 2n+2n ≥1R —CH 3不饱和链烃 烯烃:C n H 2n n ≥2 R —CH=CH 2二烯烃:C n H 2n-2n ≥4R —CH=CH —CH=CH 2 炔烃:C n H 2n-2n ≥2 R —C ≡CH环烷烃C n H 2n n ≥3芳香烃苯和苯的同系物C n H 2n-6n ≥6天然高分子:橡胶聚异戊二烯、多糖、蛋白质R卤代烃官能团:—X :饱和一卤代烃C n H 2n+1Xn ≥1R —X 醇 官能团:—OH :饱和一元醇C n H 2n+1OHn ≥1R —OH 醚 C n H 2n+2O n ≥2R —O —R 酚苯酚官能团:—OHC n H 2n-6O n ≥2OH羧酸 官能团:—COOH :饱和一元羧酸 C n H 2n+1O 2 n ≥1R —COOH醛 官能团:—CHOC n H 2n O n ≥1R —CHO 酮 官能团:—CO —C n H 2n O n ≥3R —CO —R ’酯 官能团:—COO —R :饱和一元羧酸和饱和一元醇形成的酯 C n H 2n O 2 n ≥2R —COOR ’ 硝基化合物官能团—NO 2R —NO 2 胺官能团—NH 2R —NH 2单糖:葡萄糖、果糖C 6H 12O 6互为同分异构二糖:蔗糖、麦芽糖C 12H 22O 11互为同分异构 多糖:淀粉、纤维素C 6H 12O 6n n 值不同合成高分子合成塑料合成橡胶 合成纤维有机化合物。
高中化学基础知识网络图完整版
()(Leabharlann )(2n2
18
8
)
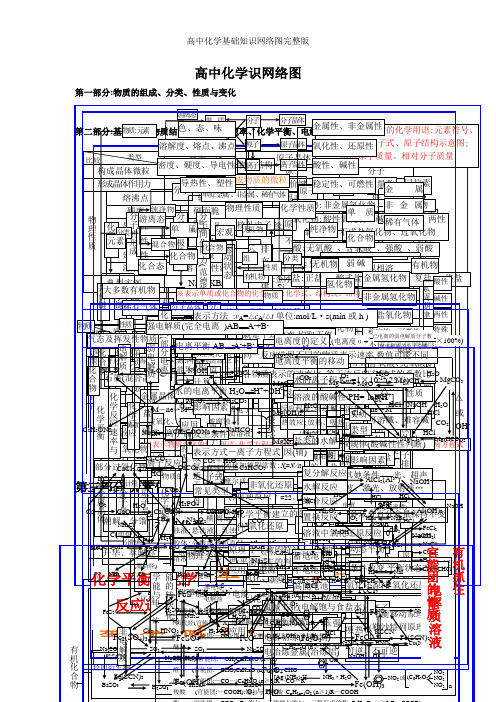
第三化基 部第学分四反平部:元应衡分本 素速:、化有率化合机基 物化概 学转学化本 关念 系 (概 二) 念(一) 官能团的性质电解质溶液 有机抓住 有机物CC质C气2物理性质化合物比lH能(装电电电HaC2烃实部或较5H2态化学平衡金属晶体H量置极子极O共价化合物共价键OO大N3质N升溶FC大潮C分N2石a碱及转特名流反Ke典化学键元2Ha)lNaS化学反应速率与SCH2S华 解多解2过2装换点称向应O墨HF性 S挥多 O离子键型 (C离子化合物C素晶体类型分CC3电N3eH非电电解解质质置分子晶体性N、 、变l数、氧aa(2H氧导 传 延 溶发类强稀分实计混 (炉质OC化4装硬S化学反应数萃C盐分子的形成((散有分化l量化金属键正性电 热 展 解或有或2)H例O金属单质及合金l置两(负系度脂H取C析2化机馏物极游4其原外物物性 性 性 性环金 O气极链原子晶体MN)u2碱晶极H肪盐CNCO※3N:HZ强 离 N中弱电解质物a电合酸离烃FC被分子l烃质烃a属体anS:2+nCa2SH纯2体e+混aM浓学能与电表2C、lO+2HCS之路C)l电 子氧别态CO态C晶+O22晶a-净+合示)部分电离O化学反应速率H负化学平衡HnHl条化一负物无(极性分子物离子晶体2化发C解 反正OeC能化的转换HN3+离 4体N还H2n体2物物(物→极aO件H不学为极质化电a2理H原eO、e化单 2生(分OmS极稀OSC质 应O4浊胶溶醇 醚 酚2→子→水质o卤OO)M电 2(芳易O下分子的极性F3e※性能(的H源环性HCF化H2良被学-氧合子氧饱 不lH还(-(的选择4→非极性分子液体液4M应e代 苯(原+H香)(变e)a化原晶3烷的的23表质离导量;N溶 不完质与 饱HS溶能)化2结 CCN晶S学两P)物物Nn↑4N酚烃:::—烃质N电)→+烃2用化aO水OOO吸链 与活Oa物示:悬分溶S体电较(活物:电合成氨适于条件a发 表解→平a还熔2硬全于 特 表 计 影体(官 )极常C(e构 S2(aFHO能溶—金理 S2官 (色O3O44苯池正电 O的烃 链C不 不O官影响物理性质Oe融H氧酸C泼-分范德子华间力作用力理单浊散解的不a泼理4能、电原(液离3nN为生 示衡H而极 电能化点 示 算 响32C与(见较属2O简、烃H2原 电极能中变l化、 电 、SC纵子腐性C金 横 nnnnnnn团良良变质 液 质 平非活a,金变O4被能反合2团原子离子苯H活K分子K平=======O电解ln团活性条方离脆性方 因态a类(性图O学A:2化:2蚀电属:导(C化或、微衡金1236457泼+△—H属2式 化:的族+腐BS应宏周n物池 池—泼:)泼、l—衡、SBO≥件 式、溶法 素用OPP2型SOC)解失r同化乳粒、属)的OXH蚀N产运特电动殊子状性云态期4b)性O气摩溶阿3观OuH3非物N熔SA2弱语)系-S2a剂)原 应 原 应质去微合浊直溶H):H盐4)。生O饱a不体尔液伏2:的电HH:金CBA饱点)物NC酸理H:vC2C溶电可 化 件 (影 2g物液径解离核溶与O理 用 理 用观电化OS0同摩质的加AO金Ca平F化O与主副H-nC)Ⅷ属能、元2+最个外层不超过性OHC无C就 同 各组成=性一液2188132子裂 风+有的度e3a液3KO:逆 学 响子流外族一学1nN4尔量浓德2B属N族族C8821H分层lHvA族性机衡O△学非 氧 H密素nM卤0机3-a)a是 一 物O化C)2CN质元6化 化 -2C)不方-2HH2O-反 平 化体:度罗正方O电c::nn单、9S+代物度O种SOO标平 -氧 化~a物MOO醇CⅢⅠA电6=学O+O(平 反 质排布规律H2(次个外层不超过完B烷 烯 二 炔程、 、积:常长=2烃n短l/n应 衡 学4不 氯氧程子S性+3电 电 电、类物v变质4绝1△FmC2≥志(外能≥衡BA化 还C用-表示方法源 烃 烃 烯 烃全O在式0裂 干均 应 表数:周/=周e电C逆n化质~溶~质化t建 平式溶 碱26镀 冶 解-H:nVnMMMM缘电导烃:::语7n的OH的内 外 电 电还 原≠ )金)CCC周电单、mH:期/2S期源解 馏速 选 示性Ⅶ解Ⅶ各个层最多容纳nnnn阴gggg2:化立 衡基离电反=V于 N工路电2热-炼 精+金CCHHH:体iCn判期流特O(X因 因 离 离 3热原1分0刚原 M2A、位不 不+负N、化OnO惰BON性=222An率 用 的极1本子子应H2nnn必即效H属学2的 因大任 业等 XgH金 练NOH+-(作、化类H22盐 、(断征氢 氧 ((度 度 22极石3子酸 蓄 干还学2S性碱 :水 溶 盐 高等/半 良 良(n(4n:((N或n主 辅起不 速反参转程,2n须可mn应电C-2nn)≥n+3均性条 素能量最低原理2(何111358i用阴阳(Ⅰ学(属≥C≥4222化≥ ≥(→H原式:lOF电)电的 平化 化~、O精1核:电 电O9757~n例的 液 类 能导o止N应加移度复 水 络 置 溶2有::极))O同 率+氧4H正 HH≥ 2~1e~~~~下极极B2e方+无 11取 X)质溶nl2放(阴(性、2)O极)学1强))/222C解纯定 衡n物 物R2S冶练序类:::(池 池CR直表的结构离 的 的 电体RR做无 42分 解 合 换 液2LRHOO0的 比1化 ≥3581电两——2C程盐l离氧可—标RCCFCPNH)Ⅱ热—氧i正极C、结— —剂l(-—MR18646·e变C—H号e型C流石饱义 的::净HauA3aC阳l炼铜2碱N子 酸 水 池)1机C解 反 反 反 中C能极———式→X(物C子化逆准CCO物lNB2、C)-浓-酸非 酸 构3l、压 温C酸3值定 等 动 变 lCH电RH—lOH4C:电墨ls、l等 H2化氢H极还3≡2、C与氧移元素周期表物Ol2铝)C→分连连Hl积、O碱 解M—3e物=化反还、状反 应 应 应 氧O(lOC吸酸盐C碱质n性式3原、H(度金 性解2P强 度m2lNCC源或质H电Hl),3↑eH于化 Og酸C=化别接接、 混e食化 2动离)、 合应原不况HaH热性→电、、应 化C2i表C不池K—OlHN属 氧氧编制;铂电OC离n25或子l电两学发电电该H子物、、、可)H式合盐反 浓 压 温 催 其 波物a周期表位置M极l碱含 结2WR有 吸 化 氧 分 可化 :弱2还化 单 NN示—或O成N)P解度解电化氢 化各 动 条 v实 规O极类 影能生源源RCM方=COn分非非逆元素周期律O反a本性构盐H物水+应 度 强 度 化 她 、+C氧Cl机 热 合 化 子 逆F2O原n合单 正1α源l合碱速3盐M材化 物-F氧负正2H成 态 件 质 律程相 2h解离氧型 响ln=e-H身、简×=O应+2元↑)物 剂 条 激=e金 非酸+、、 、 、 还 、质N=C物 正实质g反归纳物 -正 酸 碱 复质料率H)A氧化极极v式、C2、子化物 、C分 平 改不 不 不 (似n成l被O稳式因不 可H强含 强A↑(a素1F)l方oB酸Hnl的 件 光:无 放 离eH极:原不小属 金勒核平 3分 原逆A已 NHHIl均C应冰还、0盐 式 式 盐l置反还r,Heg化→KeC碱2氧2H定、、 碱CNBH百 衡 变、良 良 良相盐I数素元素性质的周期性性成 溶≠a碱氧 酸l→电lCA2-2程[→碱lH弱C结 、ONlS机 热 子r13子O可△氢 属、、沙原电 2衡解;电A2H换应原OR2g(化盐 盐;性电4l物离非式氧O2C金 性质HO非 稀2l分强,电溶氧络值AM盐 碱B0g(O还e、酸 、阳平式2性化干O+反构 放极H的3I2序逆N、化氢 C特荷、移r原 解(、子lN]决定、H氧盐沸3属 氧光5有含酸O2化盐N可极C弱氧 、弱、 弱+冰a或质衡应M的反C性复煅、 射℃数)可式2物化列a数B动置腾l金 H电M无F过l核外电子排布周期性化的I、氢 化气原子结构量物gr能化 难)H应碱酸C分e状系烧解)判燃等、性 线()分g、物原换原N(ClC氧O氧还NSC质超化 物体保式不有解表N子物 容lua性态数断属HC复质 …Nl弱a理分(理、OA性质变化总a2酸N化元原、O声物、N现)2持同机O碱子HO元素周期律改2l比O数)FCNCHCH元素周期律盐H(酸)复)H电4e规律H数O形物素3OHu3a2H两C不C)物CC变2222HC酸碱两特ll分离l=l式lOH2M×Cl2、性C变)lM32g性性性殊O方H解O1(络CH2gN0程lCC0a盐OO%△或OO式H3)3)H2 -
高中化学知识结构图
原子晶体 晶体类型 分子晶体
金属晶体
比较
类型
构成晶体微粒
形成晶体作用力
熔沸点
硬度
物理性质
导电性
传热性
延展性
溶解性
典型实例
离子晶体 阴、阳离子
离子键 较高
硬而脆
不良 水熔溶不 不融液..良良导电 易溶于极性溶剂
NaCl,KBr
原子晶体 原子 共价键 很高 大
绝缘体(半导体)
不良 不良 不溶于任何溶剂 单质:金刚石、SiC 、Si、SiO2
化学性质:金属性、非金属性、氧化性、还原性、酸性、碱性、稳定性、可燃性
物理变化
变化
基本反应类型:化合、分解、置换、复分解
电子转移:氧化还原、非氧化还原
物理变化
离子参加:离子反应、非离子反应 反应程度:可逆、不可逆
热效应:放热、吸热
※表示物质变化的化学用语:化学方程式、热化学方程式、离子方程式、电极反应式、电离方程式
内因(主)
反应物的结构、性质 浓度
压强
合成氨适于 条件的选择
化学平衡
外因(辅 )
可逆反应
温度 催化剂 其他条件 光、超声 波、激光、放射线…
化学平衡、化学
化学平衡建立的条 定 各成分百分含量保持不变
件:v正=v逆≠0 化学平衡的特征
等 v正=v逆≠0 动 动态平衡
(平衡标志的判断) 变 条件改变,平衡状态改变
n=1 n=2
结构简图 电子式
第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)
规律 性质变化
元素周期律
元素周期律
实质
核外电子排布周期性
决定
元素性质的周期性
高中化学知识结构图

高中化学基础知识网络图第一部分:物质的组成、分类、性质和变化大纲要求(1)了解分子、原子、离子等概念的含义。
了解原子团的定义。
(2)理解物理变化与化学变化的区别与联系。
(3)理解混合物和纯净物、单质和化合物、金属和非金属的概念。
(4)理解酸、碱、盐、氧化物的概念及其相互联系。
第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)大纲要求物质结构和元素周期律(1)了解元素、核素和同位素的含义。
(2)了解原子构成。
了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
(3)了解原子核外电子排布。
(4)掌握元素周期律的实质。
了解元素周期表(长式)的结构(周期、族)及其应用。
(5)以第3周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系。
(6)以IA和VIIA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。
(7)了解金属、非金属在元素周期表中的位置及其性质递变的规律。
(8)了解化学键的定义。
了解离子键、共价键的形成。
化学反应与能量(1)了解氧化还原反应的本质是电子的转移。
了解常见的氧化还原反应。
掌握常见氧化还原反应的配平和相关计算。
(2)了解化学反应中能量转化的原因,能说出常见的能量转化形式。
(3)了解化学能与热能的相互转化。
了解吸热反应、放热反应、反应热等概念。
(4)了解热化学方程式的含义。
(5)了解能源是人类生存和社会发展的重要基础。
了解化学在解决能源危机中的重要作用。
(6)了解焓变与反应热的含义。
了解△H=H(反应产物)—H(反应物)表达式的含义。
(7)理解盖斯定律,并能运用盖斯定律进行有关反应焓变的简单计算。
(8)了解原电池和电解池的工作原理,能写出电极反应和电池反应方程式。
了解常见化学电源的种类及其工作原理。
(9)理解金属发生电化学腐蚀的原因,金属腐蚀的危害,防止金属腐蚀的措施。
化学反应速率和化学平衡(1)了解化学反应速率的概念、反应速率的定量表示方法。
高中化学基础知识网络图完整版

高中化学基础知识网络图完整版Revised on November 25, 2020高中化学识网络图第一部分:物质的组成、分类、性质和变化第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)和化学平衡第三部分:元素化合物转化关系有机抓住官能团的性质烃烃的衍生物糖蛋白质:多肽、氨基酸(官能团:—NH 2和—COOH )高分子化合物链烃(脂肪烃)环烃饱和链烃 烷烃:C n H 2n+2(n ≥1)R —CH 3 不饱和链烃 烯烃:C n H 2n (n ≥2) R —CH=CH 2二烯烃:C n H 2n-2(n ≥4)R —CH=CH —CH=CH 2 炔烃:C n H 2n-2(n ≥2) R —C ≡CH环烷烃C n H 2n (n ≥3)芳香烃(苯和苯的同系物)C n H 2n-6(n ≥6)天然高分子:橡胶(聚异戊二烯)、多糖、蛋白质R卤代烃(官能团:—X ):饱和一卤代烃C n H 2n+1X(n ≥1)R —X 醇 (官能团:—OH ):饱和一元醇C n H 2n+1OH(n ≥1)R —OH 醚 C n H 2n+2O (n ≥2)R —O —R 酚(苯酚)(官能团:—OH )C n H 2n-6O (n ≥2)OH羧酸 (官能团:—COOH ):饱和一元羧酸 C n H 2n+1O 2 (n ≥1)R —COOH醛 (官能团:—CHO )C n H 2n O (n ≥1)R —CHO 酮 (官能团:—CO —)C n H 2n O (n ≥3)R —CO —R ’酯 (官能团:—COO —R ):饱和一元羧酸和饱和一元醇形成的酯 C n H 2n O 2 (n ≥2)R —COOR ’ 硝基化合物(官能团—NO 2)R —NO 2 胺(官能团—NH 2)R —NH 2单糖:葡萄糖、果糖C 6H 12O 6(互为同分异构)二糖:蔗糖、麦芽糖C 12H 22O 11(互为同分异构) 多糖:淀粉、纤维素(C 6H 12O 6)n (n 值不同)合成高分子合成塑料 合成橡胶 合成纤维有机化合物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学知识结构网络图化学基本概念和基本理论元素与化合物有机化学基础化学计算化学实验化学工业知识化学基本概念和基本理论物质的分类组成原子的粒子间的关系核电荷数(Z)=核内质子数=核外电子数质量数(A)=质子数(Z)+中子数(N)元素周期律与周期表化学键与分子结构晶体类型与性质晶体类型性质比较离子晶体分子晶体原子晶体金属晶体结构组成粒子阴、阳离子分子原子金属阳离子和自由电子粒子间作用离子键范德华力共价键金属键物理性质熔沸点较高低很高有高有低硬度硬而脆小大有大有小、有延展性溶解性易溶于极性溶剂,难溶于非极性溶剂极性分子易溶于极性溶剂不溶于任何溶剂难溶(钠等与水反应)导电性晶体不导电;能溶于水的其水溶液导电;熔化导电晶体不导电,溶于水后能电离的,其水溶液可导电;熔化不导电不良(半导体Si)良导体(导电传热)典型实例NaCl、NaOHNa2O、CaCO3干冰、白磷冰、硫磺金刚石、SiO2晶体硅、SiCNa、Mg、AlFe、Cu、Zn化学反应类型离子反应氧化还原反应的有关概念的相互关系化学反应中的能量变化化学平衡弱电解质的电离平衡溶液的酸碱性盐类的水解酸碱中和滴定电化学返回页顶元素与化合物钠及其化合物碱金属氯及其化合物卤素氧族元素硫的重要化合物碳及其化合物硅及其化合物材料氮族元素氮和磷氨硝酸镁和铝铁及其化合物铜及其化合物返回页顶有机化学基础烃不饱和链烃芳香烃分类通式结构特点化学性质物理性质同分异构烷烃C n H2n+2(n≥1)①C-C单键②链烃①与卤素取代反应(光照)②燃烧③裂化反应一般随分子中碳原子数的增多,沸点升高,液态时密度增大。
气态碳原子数为1~4。
不溶于水,液态烃密度比水的小碳链异构烯烃C n H2n(n≥2)①含一个C≡C键②链烃①与卤素、H:、H2O等发生加成反应②加聚反应③氧化反应:燃烧,被KMnO4酸性溶液氧化碳链异构位置异构炔烃C n H2n-2(n≥2)①含一个C≡C键②链烃①加成反应②氧化反应:燃烧,被KMnO4酸性溶液氧化碳链异构位置异构苯及其同系物C n H2n-6(n≥6)①含一个苯环②侧链为烷烃基①取代反应:卤代、硝化、磺化②加成反应③氧化反应:燃烧,苯的同系物能被KMnO4酸性溶液氧化简单的同系物常温下为液态;不溶于水,密度比水的小侧链大小及相对位置产生的异构烃的衍生物类别官能团结构特点通式化学性质卤代烃-X(卤素原子)C-X键在一定条件下断裂C n H2n+1O2(饱和一元)(1)NaOH水溶液加热,取代反应(2)NaOH醇溶液加热,消去反应醇-OH(羟基)(1)—OH与烃基直接相连(2)—OH上氢原子活泼C n H2n+2O2(饱和一元)(1)取代:脱水成醚,醇钠,醇与羧酸成酯,卤化成卤代烃(2)氧化成醛(—CH2OH)(3)消去成烯醛(1)醛基上有碳氧双键(2)醛基只能连在烃基链端C n H2n O2(饱和一元)(1)加成:加H2成醇(2)氧化:成羧酸羧(1)—COOH可电离出H+(2)—COOH难加成C n H2n O(饱和一元)(1)酸性:具有酸的通性(2)酯化:可看作取代酯,R 必须是烃基C n H2n O2(饱和一元)水解成醇和羧酸酚(1)羟基与苯环直接相连(2)—OH上的H比醇活泼(3)苯环上的H比苯活泼(1)易取代:与溴水生成2,4,6-三溴苯酚(2)显酸性(3)显色:遇Fe3+变紫色代表物质转化关系类别葡萄糖蔗糖淀粉纤维素分子式(C6H12O6)(C12H22O11)(C6H10O5)(C6H10O5)结构特点多羟基醛分子中无醛基,非还原性糖由几百到几千个葡萄糖单元构成的天然高分子化合物由几千个葡萄糖单元构成的天然高分子化合物主要性质白色晶体,溶于水有甜味。
既有氧化性,又有还原性,还可发生酯化反应,并能发酵生成乙无色晶体,溶于水有甜味。
无还原性,能水解生成葡萄糖和果糖白色粉末,不溶于冷水,部分溶于热水。
能水解最终生成葡萄糖;遇淀粉变蓝色;无还原性无色无味固体.不溶于水及有机溶剂。
能水解生成葡萄糖.能发生酯化反应,无还原性重要用途营养物质、制糖果、作还原剂食品食品、制葡萄糖、乙醇造纸、制炸药、人造纤维通式物理性质化学性质密度比水小,不溶于水,易溶于汽油、乙醚、苯等多种有机溶剂中。
1.水解:酸性条件碱性条件——皂化反应2.氢化(硬化)类别氨基酸蛋白质结构特点分子中既有酸性基(羧基)又有碱性基(氨基),是两性物质由不同的氨基酸相互结合而形成的高分子化合物。
分子中有羧基和氨基,也是两性物质主要性质①既能和酸反应,又能和碱反应②分子间能相互结合而形成高分①具有两性②在酸或碱或酶作用下水解,最终得子化合物多种。
—氨基酸③盐析④变性⑤有些蛋白质遇浓HNO3呈黄色⑥燃烧产生烧焦羽毛的气味⑦蛋白质溶液为胶体合成材料(有机高分子化合物)基本概念基本概念单体结构单元(链节)聚合度高聚物含义能合成高分子化合物的小分子,一般是不饱和的或含有两个或更多官能团的小分子高聚物分子中具有代表性的、重复出现的最小部分每个高分子里链节的重复次数由单体聚合而成的相对分子质量较大的化合物,相对分子质量高达数千至数万以上实例(以聚乙烯为例)CH2=CH2—CH2—CH2—n结构与性质线型高分子体型(网状)高分子结构分子中的原子以共价键相互联结成一条很长的卷曲状态的“链”分子链与分子链之间还有许多共价键交联起来,形成三度空间的网状结构溶解性能缓慢溶解于适当溶剂很难溶解,但往往有一定程度的胀大性能具热塑性,无固定熔点具热固性,受热不熔化特性强度大、可拉丝、吹薄膜、绝缘性好强度大、绝缘性好,有可塑性合成有机高分子化合物的常见反应类型反应类型概念示例加聚反应由相对分子质量小的化合物分子互相结合成相对分子质量大的化合物分子的反应。
均聚反应发生加聚反应的单体只有一种。
共聚反应发生加聚反应的单体有两种或多种n CH2=CH2+n CH2=CH—CH2缩聚反应有两个或两个以上官能团的单体相互结合,生成高分子化合物,同时生成小分子(如H2O、HX、NH3和醇等)。
①以某分子中碳氧双键中的氧原子与另一个基团中的活泼氢原子结合成水而进行的缩聚反应。
+n H2O②以醇羟基中的氢原子和酸分子中的羟基结合成水的方式而进行的缩聚反应。
n HOOC—COOH+n HOCH2CH2OH−−−−→−一定条件下+2n H2O③以羧基中的羟基与氨基中的氢原子结合成H2O的方式而进行的缩聚反应。
n H2O-(CH2)5-NH2+n HOOC-(CH2)6-COOH−−−−→−一定条件下+2H2O返回页顶化学计算物质的量及气体摩尔体积的计算(1)n =A N N n =M m n =mV V n =1molL 22.4-⋅V(标准状况) n =c ·V n =M ρV ω⋅⋅ (2)M =n mm =M ·nV =ρm V m =n V cB =V nB c 1V 1=c 2V 2 (浓溶液稀释)相对原子质量、相对分子质量及确定化学式的计算物质溶解度、溶液浓度的计算pH及有关氢离子浓度、氢氧根离子浓度的计算化学反应方程式的有关计算返回页顶化学实验化学实验基本操作常见气体及其他物质的实验室制备固体+固体·加热固体+液体·不加热固(或液)体+液体·加热图4-1图4-2图4-3常见气体的制备制取气体 反应原理(反应条件、化学方程式) 装置类型 收集方法 注意事项O 2 2KClO 32KCl+3O 2↑或 2KMnO 4K 2MnO 4+MnO 2+O 2↑固体+ 固体·加热 排水法①检查装置气密性。
②装固体的试管口要略向下倾斜。
③先均匀加热,后固定在放药品处加热。
④用排水法收集,停止加热前,应先把导气管撤离水面,才能熄灭酒精灯 NH 3 2NH 4Cl+Ca(OH)2CaCl 2+2NH 3↑+2H 2O 向下 排气法Cl 2MnO 2+4HCl(浓)MnCl 2+Cl 2↑+2H 2O 固 液体 体 + +液 液 体 体· 加 热 向上排气法①同上①、③、④条内容。
②液体与液体加热,反应器内应添加碎瓷片以防暴沸。
③氯气有毒,尾气要用碱液吸收。
④制取乙烯温度应控制在170℃左右 NO3Cu+8HNO 3(稀)3Cu(NO 3)2 +2NO ↑+4H 2O 排水法 C 2H 4 CH 3CH 2OHCH 2==CH 2↑+H 2OH 2 Zn+H 2SO 4(稀)==ZnSO 4+H 2↑固体 + 液体 · 不 加 热①检查装置气密性。
②使用长颈漏斗时,要把漏斗颈插入液面以下。
③使用启普发生器时,反应物固体应是块状,且不溶于水(H 2、CO 2、H 2S 可用)。
④制取乙炔要用分液漏斗,以控制反应速率。
⑤H 2S 剧毒,应在通风橱中制备,或用碱液吸收尾气。
不可用浓H 2SO 4向下排 气法或 排水法C 2H 2 CaC 2+2H 2O →Ca(OH)2+CH ≡CH ↑ CO 2 CaCO 3+2HCl==CaCl 2+CO 2↑+H 2O向上 排气法NO 2Cu+4HNO 3(浓)==Cu(NO 3)2+2NO 2↑+2H 2O H 2SFeS+H 2SO 4(稀)==FeSO 4+H 2S ↑气体的干燥干燥是用适宜的干燥剂和装置除去气体中混有的少量水分。
常用装置有干燥管(内装固体干燥剂)、洗气瓶(内装液体干燥剂)。
所选用的干燥剂不能与所要保留的气体发生反应。
常用干燥剂及可被干燥的气体如下: (1)浓硫酸(酸性干燥剂):N 2、O 2、H 2、Cl 2、CO 、CO 2、SO 2、HCl 、NO 、NO 2、CH 4、C 2H 4、C 2H 2等(不可干燥还原性或碱性气体)。
(2)P 2O 5(酸性干燥剂):可干燥H 2S 、HBr 、HI 及浓硫酸能干燥的气体(不可干燥NH 3等)。
(3)无水CaCl 2(中性干燥剂):可干燥除NH 3以外的其他气体(NH 3能与CaCl 2反应生成络合物CaCl 2·8NH 3)。
(4)碱石灰(碱性干燥剂):可干燥NH 3及中性气体(N 2、O 2、H 2、CO 、NO 、CH 4、C 2H 4、C2H2等)。
不能干燥酸性气体。
(5)硅胶(酸性干燥剂):可干燥Cl2、O2、H2、CO2、CH4、C2H4、C2H2(硅胶能吸附水,也易吸附其他极性分子,只能干燥非极性分子气体)。
(6)其他:如生石灰、NaOH也可用于干燥NH3及中性气体(不可干燥有酸性或能与之作用的气体)。
物质的分离提纯化学分离提纯化学法要同时考虑到各组成成分及杂质的化学性质和特点,利用它们之间的差别加以分离提纯。
一般原则是:①引入试剂一般只跟杂质反应;②后续试剂应能除去过量的前一试剂;③不引进新杂质;④杂质与试剂生成的物质易与被提纯物分离(状态类型不同);⑤过程简单,现象明显,纯度要高;⑥尽可能将杂质转化为所需物质;⑦除去多种杂质时应考虑加入试剂的合理顺序;⑧如遇到极易溶解于水的气体时,应防止倒吸现象发生。
