3 自由基聚合-2
合集下载
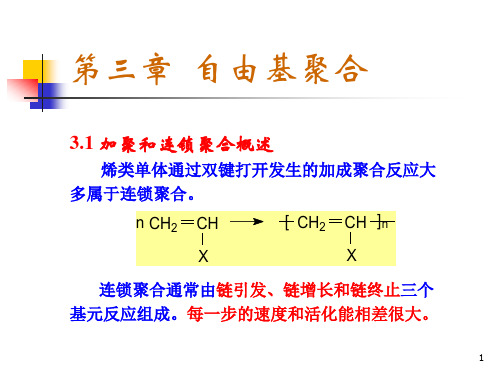
第三章自由基聚合

低,位阻效应大,一般不能自聚合。但有时能与其他单 体共聚,如马来酸酐能与苯乙烯共聚。
HC CH
Cl
O O O
C H
C H
Cl
(3) 三取代、四取代,一般不能聚合,但也有例外:取 代基为小体积的氟代乙烯 。
F F C H C H F F C H C F F F H2C C F F C C F
F
(1) 1, 1 双取代烯类单体CH2=CXY ,通常,比单取代更 易聚合,若两个取代基均体积较大(如1,1-2苯基乙烯), 则只能形成二聚体。
(2) 具有共轭效应的烯类单体 ∏电子云流动性大,易诱导极化,可随进攻试剂 性质的不同而取不同的电子云流向,可进行多种机 理的聚合反应(自由基、阴离子和阳离子聚合)。 如苯乙烯、甲基苯乙烯、丁二烯及异戊二烯等等 。 + + R H2C CH R H2C CH
+
单烯CH2=CHX中取代基电负性不同和聚合倾向的关系图
(二) 位阻效应
位阻效应是由取代基的体积、数量、位置等 所引起的。在动力学上它对聚合能力有显著的影 响,但它不涉及对活性种的选择。
(1) 1, 1 双取代烯类单体CH2=CXY ,通常,比单取代更
易聚合,但两个取代基均体积较大(如1,1-2苯基乙烯),
则只能形成二聚体。
H2C
C
(2) 1,2 双取代的烯类化合物,因结构对称,极化程度
第三章 自由基聚合
1. 单体聚合的选择性 2. 四种基元反应及自由基聚合的特征 3. 引发反应、引发剂种类及其使用条件 4. 聚合速率方程的推导、公式、使用 5. 聚合速率以及分子量的影响因素 6. 分子量的公式及其使用条件 7. 阻聚剂和烯丙基的自阻聚作用
HC CH
Cl
O O O
C H
C H
Cl
(3) 三取代、四取代,一般不能聚合,但也有例外:取 代基为小体积的氟代乙烯 。
F F C H C H F F C H C F F F H2C C F F C C F
F
(1) 1, 1 双取代烯类单体CH2=CXY ,通常,比单取代更 易聚合,若两个取代基均体积较大(如1,1-2苯基乙烯), 则只能形成二聚体。
(2) 具有共轭效应的烯类单体 ∏电子云流动性大,易诱导极化,可随进攻试剂 性质的不同而取不同的电子云流向,可进行多种机 理的聚合反应(自由基、阴离子和阳离子聚合)。 如苯乙烯、甲基苯乙烯、丁二烯及异戊二烯等等 。 + + R H2C CH R H2C CH
+
单烯CH2=CHX中取代基电负性不同和聚合倾向的关系图
(二) 位阻效应
位阻效应是由取代基的体积、数量、位置等 所引起的。在动力学上它对聚合能力有显著的影 响,但它不涉及对活性种的选择。
(1) 1, 1 双取代烯类单体CH2=CXY ,通常,比单取代更
易聚合,但两个取代基均体积较大(如1,1-2苯基乙烯),
则只能形成二聚体。
H2C
C
(2) 1,2 双取代的烯类化合物,因结构对称,极化程度
第三章 自由基聚合
1. 单体聚合的选择性 2. 四种基元反应及自由基聚合的特征 3. 引发反应、引发剂种类及其使用条件 4. 聚合速率方程的推导、公式、使用 5. 聚合速率以及分子量的影响因素 6. 分子量的公式及其使用条件 7. 阻聚剂和烯丙基的自阻聚作用
第二章自由基聚合

2.3.2 自由基聚合反应的特征
1、由链引发、增长、终止、转移等基元反应组成 特征为:慢引发、快增长、速终止。 引发速率最小,是控制总聚合速率的关键。
2、链增长反应使聚合度增加
反应混合物中仅由单体和聚合物组成 聚合度变化小。
自由基聚合过程中分子量 与时间的关系
3、对分子量的影响 凝胶效应将使分子量增大。
2
CH3 2C +N2 CN
AIBN一般在45~65℃ 下使用;它分解后形成的异丁腈自由 基是碳自由基,缺乏脱氢能力,故不能作接枝聚合的引发剂。
2、有机过氧类引发剂
代表物:过氧化二苯甲酰(BPO) BPO中O—O键部分的电子云密度大而相互排斥,容 易断裂,通常在60~80℃ 分解。
★ 均裂成苯甲酸基自由基,有单体存在时,即引发聚合; ★ 无单体存在时,进一步分解成苯基自由基,并析出CO2 但分解不完全。
弱键的离解能一般为100~170kJ/mol
常用的引发剂有:偶氮化合物、有机过氧化合物、无机盐 过氧化合物和氧化-还原引发体系等。
2.4.1.1 引发剂的种类
1、偶氮类引发剂
几乎全部为一级反应,只形成一种自由 基,无诱导分解; 比较稳定,能单独安全保存;
代表物:偶氮二异丁腈(AIBN)
CH3 2C N N C CH3 CN CN
自由基聚合过程中转化率与时间的关系
4、少量(0.01%~0.1%)阻聚剂足以使自由基聚合反应终止。
2.4 链引发反应
自由基聚合反应的首要条件是:在聚合体系中产生自由基, 常用方法是在聚合体系中引入引发剂,其次是采用热、光 和高能辐射等方法。
2.4.1 引发剂和引发作用
引发剂:分子结构上具有弱键,容易分解成自由基。
第二章 自由基聚合-2.4 自由基聚合反应动力学

Rd=d[R·]/dt=2kd[I] Ri =-d[M]/dt=ki[R·][M] Rp1=-d[M]/dt =kp1[M][M1·] Rp2=-d[M]/dt =kp2[M][M2·]
••••••
Rpn=-d[M]/dt=kpn[M][Mn·]
Rtc=-d[Mx·]/dt=ktc[Mx·][My ·]
2.4.1聚合反应动力学研究方法 二、聚合速率的测定-间接法
C% V Vo K
K Vm Vp 100% Vm
其中,Vo为起始体积,△V为t时刻的
体积收缩值,由高度变化计算得到
Rp
d[M ] dt
[M ]2 t2
[M ]1 t1
C2[M ]o C1[M ]o t2 t1
••••••
Rpn=-d[M]/dt=kpn[M][Mn·]
2.4.2自由基聚合初期反应速率 一 动力学方程的推导
d[M ] R dt Ri Rp1 Rp2 ... Rpn
ki[R][M ] k p1[M1][M ] k p2[M 2][M ] ...... k pn[M n ][M ]
(7) Mx • M y • ktcMxy
(8) Mx • M y • ktd Mx M y
(9) M x • XH kts M x H X •
(无活性)
(10) M x • M ktr,M Mx M • (11) Mx • S ktr,s Mx S • (12) M x • I ktr,I M x I •
H
2.4.2自由基聚合初期聚合反应速率 一 动力学方程的推导
空间效应
空间效应对不同链长自由基的活性影响相同
3-自由基聚合(2)

[I] ln [ I ]0
-k t
四价铈盐和醇、醛、酮、胺等组成的氧化-还原体系, 可有效地引发烯类单体聚合或接枝聚合(如淀粉接枝丙烯 腈)。
Ce
4+
+
H C
H C
Ce 3+ +
OH OH
CH + CH O HO
+ H+
26
(ii)油溶性氧化—还原引发体系 氧化剂:氢过氧化物、二烷基过氧化物、二酰基过氧化 物等。 还原剂:叔胺、环烷酸盐、硫醇、有机金属化合物,如 [Al(C2H5)3]、 [B(C2H5)3] 等。
特征:放热反应、活化能低—20-34kJ/mol、速率 常数高、聚合度增大。
6
在链增长反应过程中,不仅研究反应速率,还需 考察增长反应对大分子微结构的影响。
在链增长反H2CH CH2 CH + CH2 X CH X X X or CHCH2 CH2CH X X
Rd
d [I] dt
k d [I]
负号—代表[I]随时间t的增加而减少; kd— 分解速率常数,单位为s-1。
29
将上式积分,得:
[I] ln [ I ]0
-k t
d
[I]0—引发剂的起始浓度, 单位为mol/L
[I] —时间为t时的引发剂 浓度,单位为mol/L
[I] e -k d t [ I ]0
2
C O
2
+ 2 CO2
BPO按两步分解。第一步均裂成苯甲酸基自由基, 有单体存在时,即引发聚合;无单体存在时,进一步 分解成苯基自由基,并放出CO2,但分解不完全。
21
3、无机过氧类引发剂
代表物:无机过硫酸盐,如过硫酸钾K2S2O8和 (NH4)2S2O8,这类引发剂能溶于水,多用于乳液聚合和 水溶液聚合。
03-自由基聚合-总结

阻聚合缓聚
链转移
自由基加 成反应
电荷转移反应
分子量分布
歧化终止
N x = Np x −1 (1 − p)
Wx = xp x −1 (1 − p) 2 W
Xw = 1+ p ≈ 2 Xn
偶合终止
Xw = 1.5 Xn
聚合热力学和聚合上限温度
∆G = ∆H − T∆S
∆H Tc = ∆S
∆H Tc = ∆S 0 + Rln[M]e
引发剂分解
Rd = − d[I] = k d [I] dt
[I] ln = −k d t [I]0
t1 / 2 ln 2 0.693 = = kd kd
引发效率:诱导分解、 引发效率:诱导分解、笼蔽效应
聚合速率
引发 增长 终止 总速率
d[R . ] Ri = = 2 fk d [I] dt
R p = −( d[M] ) p = k p [M]∑ [RM .i ] = k p [M][M . ] dt
V=kp[M]/(2(fkdkt[i])1/2)=3700*10.86/(2*(1*1.16*10-5*7.4*107*0.026*10-3)1/2)= 134483.8 1/Xn=(C/2+D)/v+Cm=(0.1/2+0.9)/134483.8+1.91*10-4=0.000198064048 Xn=1/0.000198064048 =5048
1/2
[M] 1/2 [I]
Xn =
ν
C +D 2
聚合度
Rt 1 [I] [S] = + CM + CI + CS [M] [M] Xn R p
3.2.3 自由基聚合反应机理

相对分子质量 2 倍于链自由基 带 2 个引发剂残基(R-)(fragment) 分子中含一个首ห้องสมุดไป่ตู้—首方式连接结构单元
2 R CH2 CH CH2 n CH R CH2 CH n+1 CH CH2 R n+1
•
单取代乙烯单体聚合时以偶合终止为主。最常见 的 PS 和 PAN 是按照双基偶合方式终止。
表
单体
某些单体自由基的终止方式
聚合温度/℃ 偶合终止/% 歧化终止/% 100 100 81 53 40 32 15 92 68 85 8 ~100 47 60 0 0 19
苯乙烯 0~60 对氯苯乙烯 60、80 对甲氧基苯乙烯 60
80
甲基丙烯酸甲酯 0
25 60
丙烯腈 乙酸乙烯酯
40,60 90
自由基聚合的基元反应
•
自由基聚合反应一般包括三个基元反应:
链引发 链增长 链终止
• 自由基基元反应的特点:慢引发、快增长、
速终止,三者速率常数递增。
3.2.3 自由基聚合反应机理
1.链引发:形成单体自由基的反应 (1)引发剂 I 分解,形成初级自由基
I 2R
吸热反应,活化能 高,反应速率小
(2)初级自由基与单体加成,形成单体自由基
• • •
链终止活化能很低,终止速率常数极高。双基终 止受扩散控制。 链终止和链增长是一对竞争反应。 主要有两种类型: 双基终止:双基偶合终止;双基歧化终止 单分子终止:如链自由基被包藏在聚合物沉淀 中;活性链被反应器壁金属自由 电子终止;链转移终止。
3.2.3 自由基聚合反应机理
3.链终止——双基终止
R
+
CH 2
CHX
2 R CH2 CH CH2 n CH R CH2 CH n+1 CH CH2 R n+1
•
单取代乙烯单体聚合时以偶合终止为主。最常见 的 PS 和 PAN 是按照双基偶合方式终止。
表
单体
某些单体自由基的终止方式
聚合温度/℃ 偶合终止/% 歧化终止/% 100 100 81 53 40 32 15 92 68 85 8 ~100 47 60 0 0 19
苯乙烯 0~60 对氯苯乙烯 60、80 对甲氧基苯乙烯 60
80
甲基丙烯酸甲酯 0
25 60
丙烯腈 乙酸乙烯酯
40,60 90
自由基聚合的基元反应
•
自由基聚合反应一般包括三个基元反应:
链引发 链增长 链终止
• 自由基基元反应的特点:慢引发、快增长、
速终止,三者速率常数递增。
3.2.3 自由基聚合反应机理
1.链引发:形成单体自由基的反应 (1)引发剂 I 分解,形成初级自由基
I 2R
吸热反应,活化能 高,反应速率小
(2)初级自由基与单体加成,形成单体自由基
• • •
链终止活化能很低,终止速率常数极高。双基终 止受扩散控制。 链终止和链增长是一对竞争反应。 主要有两种类型: 双基终止:双基偶合终止;双基歧化终止 单分子终止:如链自由基被包藏在聚合物沉淀 中;活性链被反应器壁金属自由 电子终止;链转移终止。
3.2.3 自由基聚合反应机理
3.链终止——双基终止
R
+
CH 2
CHX
《材化高分子化学》第3章 自由基聚合
E = 105~150 kJ/mol (3—1)
kd = 10-4~10-6 s-1
(3—2)
19
第三章 自由基聚合
b. 单体自由基的形成
R + CH2 CH X
RCH2 CH X
由初级自由基与单体加成产生,为放热反应, 活
化能低,反应速度快。
E = 20 ~ 34 kJ/mol
(3—3)
20
第三章 自由基聚合
(CH3)2C N N C (CH3)2
2 (CH3)2C + N2
CN
CN
CN
优点:
(1)分解只形成一种自由基,无诱导分解。 (2)常温下稳定。80℃以上剧烈分解。
35
第三章 自由基聚合
(2)有机过氧化类引发剂
最简单的过氧化物:过氧化氢。活化能较高, 220kJ/mol,一般不单独用作引发剂。
HO OH 2HO
7
第三章 自由基聚合
分子中含有推电子基团,如烷基、烷氧基、苯基、乙 烯基等,碳=碳双键上电子云增加,有利于阳离子聚合进 行。
δ
CH2 CH Y
注意:丙烯分子上有一个甲基,具有推电子性和超共轭双 重效应,但都较弱,不足以引起阳离子聚合,也不能进行 自由基聚合。只能在配位聚合引发体系引发下进行配位聚 合。
30
第三章 自由基聚合
3.4.2 自由基聚合反应的特征
(1)可分为链引发、链增长、链终止等基元反应。 各基元反应活化能相差很大。其中链引发反应速率 最小,是控制聚合过程的关键。
慢引发、快增长、有转移,速终止。
与逐步缩聚机理特征比较见p75表3-6。
31
第三章 自由基聚合
(2)只有链增长反应使聚合度增加。从单体转化为 大分子的时间极短,瞬间完成。体系中不存在聚合 度递增的中间状态(p75图3-2)。聚合度与聚合时间 基本无关。
第二章 自由基聚合-2.4 自由基聚合反应动力学2

2. Rp∝[I]n
Rp=kp[M][M ·]
=kp[M]Ri/kt′ =kp[M]Ri1/kt =kp(2fkd/kt )[M][I]1
条件II: 低转化率 假设III:自由基稳态 Ri=Rt 条件III:单基终止 Rt=kt[M·][RH]= [M·] kt′ [M·]=Rt/ kt′= Ri/ kt′
2
ER
Ep (29)
Ed 2
(125)
Et 2
(17)
83k J
/
mol
0
2.4.2自由基聚合初期聚合反应速率 三、反应温度对聚合反应速率的影响
2. 分析
ቤተ መጻሕፍቲ ባይዱ
ER
Ep (29)
Ed 2
(125)
Et 2
(17)
83kJ
/ mol
0
• ①ER>0, T反升高, kR增大,且ER越大,升温影响越 显著
2.4.2自由基聚合初期反应速率 一 动力学方程的推导
1
R
k p
fkd kt
2
[M
][
I
1
]2
6.0 2.0
1
Rp104/(mol/L s·)
实验验证Ⅱ
0.6
2
3 0.2
0.06 10-4 10-3 10-2 10-1 [I] /(mol/L)
图3-5 [M]恒定下聚合速率与[I]的关系
Rt=2kt[M·]2
1
R
Rp
k p[M ]
Ri 2kt
2
普适方程
2.4.2自由基聚合初期反应速率 一 动力学方程的推导
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2016/1/25 高分子化学 5
2) 链增长:迅速形成大分子链。
特点: • 放热反应,聚合热约为85kJ/mol;(热量大,散热); • Ep低,约20~34kJ/mol; • 增长速率极快。
2016/1/25 高分子化学 6
3) 链终止
自由基活性高,易相互作用而终止,形成稳定的聚 合物。
半衰期越短,分解速率常数越大,活性越高。
2016/1/25
高分子化学
28
3.5.4 引发剂效率
引发聚合的部份占引发剂分解总量的分数,以 f 表示。 f :一般为0.5~0.8,? 因为引发过程中诱导分解或(和)笼蔽效应伴随的 副反应损耗了一部分的引发剂。 1 . 诱导分解 实质上是自由基向引发剂的转移反应。 转移的结果使自由基终止成稳定分子,产生新自由 基,自由基数目并无增减,但消耗了一分子引发剂, 从而使引发剂效率降低。
2016/1/25
高分子化学
18
3.5.2 氧化—还原体系引发剂 由氧化剂与还原剂组合在一起,通过电子转移 反应(氧化—还原反应),产生自由基而引发单体 进行聚合的引发体系叫氧化—还原体系。 特点: • 活化能低,可以在室温或更低的温下引发聚合; • 引发速率快,活性大; • 诱导期短(Rp=0); • 只产生一个自由基; • 种类多。
特点: • 双分子反应; • 1分子氧化剂形成一个自由基; • 若还原剂过量,进一步与自由基反应,使活性消 失——还原剂的用量一般较氧化剂少。
2016/1/25 高分子化学 21
过硫酸盐体系
亚硫酸盐和硫代硫酸盐与过硫酸盐构成氧化还原体 系——形成两个自由基。
过氧化氢引发体系和过硫酸盐引发体系都属于水溶 性的引发体系,一般用于乳液聚合或水溶液聚合。
分解活化能高,须在较高温下才能分解,一般不单独
用作引发剂。
R O
, O R
R,R’:H、烷基、酰基、碳酸酯等可以相同或不同。
2016/1/25
高分子化学
15
(1) 有机过氧化物——过氧化氢的衍生物 过氧化二苯甲酰(BPO)——过氧类引发剂中最常用 的低活性引发剂,60℃下,kd=10-6 s-1,t1/2= 96 hr。
c.低温下反应,Rp快,副反应少。
光引发聚合有光直接引发、光引发剂引发和光敏 剂间接引发三种。
2016/1/25
高分子化学
35
2. 光引发聚合 1)光直接引发 选用波长较短的紫外光,其能量大于单体的化学 键能,就可能直接引发聚合。 单体吸收一定波长的光量子后,先形成激发态, 后再分解成自由基,引发聚合。 直接光聚合的单体一般含有光敏基团,如丙烯酰 胺、丙烯腈、丙烯酸(酯)、苯乙烯等。
4、聚合过程中,单体逐渐减少,聚合物转化率 4、聚合初期,单体几乎全部缩聚成低聚物,以 相应增加。 后再由低聚物转变成高聚物,转化率变化甚微, 反应程度逐步增加。
5、延长聚合时间,主要是提高转化率,对分子 5、延长缩聚时间主要是提高分子量,而转化率 量影响较少。 变化较少。
6、反应混合物仅由单体、高聚物及微量活性中 6、任何阶段,都由聚合度不等的同系物组成。 心组成。
2016/1/25
高分子化学
23
有机物氧化还原体系:BPO + N,N-二甲基苯胺
2016/1/25
高分子化学
24
3.5.3 引发剂分解动力学
——研究引发剂浓度与时间、温度间的定量关系 一级反应
kd ——分解速率常数,s-1; 物理意义:单位引发剂浓度时的分解速率。 常见引发剂的kd 约10-4~10-6 ·s-1。
7、微量阻聚剂可消灭活性种,而使聚合终止。 7、由于平衡的限制,两单体非等当量比,或温 度过低而使缩聚暂停,这些因素不经消除,反 应又将继续进行。
9
2016/1/25
高分子化学
3.5 引发剂
链引发反应——控制聚合速率的关键。
引发剂——分子结构上具有弱键、易分解产生自 由基、能引发单体聚合的化合物(或物质)。 • 引发剂
2016/1/25 高分子化学 8
自由基聚合与线形缩聚机理特征的比较
自由基聚合 线形缩聚
1、可以明显地区分为链引发、增长、终止等基 1、无所谓链引发、增长、终止。各步反应速率 元反应,其速率常数和活化能并不相同。其中 常数和活化能基本相同。 引发最慢,成为控制总速率的反应。 2、少量活性中心迅速和单体加成,使链增长。 2、任何两物种(单体和聚合物)间均能缩合, 单体相互间,或与聚合物均不反应。 使链增长,无所谓活性中心。 3、链增长反应才能使聚合度增加。从一聚体增 3、单体、低聚物、高聚物间任何两分子都能反 长到高聚物时间极短,不能停留在中等聚合度 应,使分子量逐步增加,反应可以暂时停留在 阶段。在聚合全过程中,由于凝胶效应,先后 中等聚合度阶段。 聚合度稍有变化。
2016/1/25
高分子化学
11
1)偶氮类引发剂
R' R C CN N=N R' C CN R
-C-N=N -C -,-C-N键均裂,分解生成稳定的 N2分 子和自由基。 R 、 R’ 为烷基,结构可对称或不对称, 活性上:对称>不对称,并随着R基团增大,活性增加。
2016/1/25
高分子化学
12
2016/1/25
高分子化学
31
3.5.5 引发剂的选择
۩ 根据聚合方法选择:
•
本体、悬浮和溶液聚合:
偶氮类和过氧类等油溶性引发剂。
•
乳液、水溶液聚合: 过硫酸盐等水溶性引发剂或氧化还原体系 。
2016/1/25
高分子化学
32
۩ 根据聚合温度选择: 为了使自由基的形成速率与聚合速率适中,一般选 择半衰期 t1/2 与聚合时间同数量级或相当的引发剂。
聚合反应一般为双基终止。
双基终止可分为:偶合终止和歧化终止两种方式。
2016/1/25
高分子化学
7
链终止特点: • 双分子反应,双基终止(偶合、歧化); • Et很低,8~21kJ/mol(甚至为零); • 终止速率快, kt > kp ;
• 双基终止受扩散控制。
4) 链转移
自由基从一条大分子链转移给另一分子,形成新的 活性种继续增长,而原来的大分子终止,称为链转 移反应。
聚合温度高,选用低活性或中等活性的引发剂;
聚合温度低,则选用高活性的引发剂。
工业上,通常
采用高—低(中)活性引发剂复合使用;
常温聚合一定时间后,提高聚合温度进行后聚合。
2016/1/25
高分子化学
33
3.6 其它引发作用
1. 热引发聚合 ——直接在热的作用下进行的聚合叫热引发聚合。
苯乙烯的热引发聚合已工业化。
2016/1/25 高分子化学 19
3.5.2 氧化—还原体系引发剂 1) 水溶性氧化—还原体系
氧化剂:过氧化氢、过硫酸盐、氢过氧化物等。
还原剂:无机还原剂和有机还原剂(醇、胺、草酸、 葡萄糖等)。 •主要有过氧化氢体系和过硫酸盐体系。
2016/1/25
高分子化学
20
过氧化氢体系 过氧化氢和亚铁盐组成,5℃下可引发聚合。
热引发机理 先由两个苯乙烯分子形成加成中间体,再与一个 苯乙烯分子反应,生成两个自由基,再引发聚合。 这一理论相对较为合理,被推荐采用。
2016/1/25
高分子化学
34
2. 光引发聚合 ——烯类单体在光(电磁波)的激发下,形成自 由基而进行的聚合。 特点: a.选择性强,某一物质只吸收一定波长范围的光。 b.光照时产生自由基,光暗时即停止。
2016/1/25
高分子化学
16
主要类型: • 氢过氧化物: • 过氧化二烷基: • 过氧化二酰基 : • 过氧化酯类:
R O O H
R
O
O
O
O
R
C R O
R C O
R C O
O
O
R
• 过氧化二碳酸酯类:
R O C O O
O
C O O
R
2016/1/25
高分子化学
17
2) 无机过氧化类引发剂
•最常用的无机过氧化物——过硫酸盐。 •典型代表:水溶性的过硫酸钾(KSP)和过硫酸铵。 •一般用于乳液聚合和水溶液聚合。 •过硫酸盐可单独使用,但更普遍的是与适当的还原剂 构成氧化还原体系,可在室温或更低的温度下引发聚合。
在聚合过程中逐渐被消耗、残基连接在大分子末端、
不能再还原成原来的物质。
• 催化剂 仅在反应中起催化作用,加快反应速度,不参与反应, 反应结束仍以原状态存在于体系中的物质。
2016/1/25 高分子化学 10
3.5.1 引发剂的种类
偶氮类引发剂 过氧类引发剂(无机及有机过氧化物) 氧化—还原引发体系
2016/1/25 高分子化学 25
3.5.3 引发剂分解动力学 积分得:
或
[ I ] [ I ]0 e
kd t
[I]0:引发剂的起始浓度(t=0);
[I] :时间为t 时的引发剂浓度,mol/L。
2016/1/25 高分子化学 26
I I 0
kd 的测定:
:引发剂残留分率。
特点:活性较高(中活性)的偶氮类引发剂。 分解速率较快, Kd=10-4~-5(50~60℃下) 偶氮类引发剂分解时有N2逸出。 • 可用来测定它的分解速率。 • 工业上可用作泡沫塑料的发泡剂。
2016/1/25 高分子化学 14
2)有机过氧类引发剂 (1) 有机过氧化物——过氧化氢的衍生物 过氧化氢(双氧水)均裂形成二个氢氧自由基、
一定的温度下,测得不同t下的引发剂浓度的变化,
ln([I]/[I]0) ~t作图,由斜率求得kd 。
•偶氮类引发剂:测定分解时析出的氮气体积来计算引发 剂分解量;
2) 链增长:迅速形成大分子链。
特点: • 放热反应,聚合热约为85kJ/mol;(热量大,散热); • Ep低,约20~34kJ/mol; • 增长速率极快。
2016/1/25 高分子化学 6
3) 链终止
自由基活性高,易相互作用而终止,形成稳定的聚 合物。
半衰期越短,分解速率常数越大,活性越高。
2016/1/25
高分子化学
28
3.5.4 引发剂效率
引发聚合的部份占引发剂分解总量的分数,以 f 表示。 f :一般为0.5~0.8,? 因为引发过程中诱导分解或(和)笼蔽效应伴随的 副反应损耗了一部分的引发剂。 1 . 诱导分解 实质上是自由基向引发剂的转移反应。 转移的结果使自由基终止成稳定分子,产生新自由 基,自由基数目并无增减,但消耗了一分子引发剂, 从而使引发剂效率降低。
2016/1/25
高分子化学
18
3.5.2 氧化—还原体系引发剂 由氧化剂与还原剂组合在一起,通过电子转移 反应(氧化—还原反应),产生自由基而引发单体 进行聚合的引发体系叫氧化—还原体系。 特点: • 活化能低,可以在室温或更低的温下引发聚合; • 引发速率快,活性大; • 诱导期短(Rp=0); • 只产生一个自由基; • 种类多。
特点: • 双分子反应; • 1分子氧化剂形成一个自由基; • 若还原剂过量,进一步与自由基反应,使活性消 失——还原剂的用量一般较氧化剂少。
2016/1/25 高分子化学 21
过硫酸盐体系
亚硫酸盐和硫代硫酸盐与过硫酸盐构成氧化还原体 系——形成两个自由基。
过氧化氢引发体系和过硫酸盐引发体系都属于水溶 性的引发体系,一般用于乳液聚合或水溶液聚合。
分解活化能高,须在较高温下才能分解,一般不单独
用作引发剂。
R O
, O R
R,R’:H、烷基、酰基、碳酸酯等可以相同或不同。
2016/1/25
高分子化学
15
(1) 有机过氧化物——过氧化氢的衍生物 过氧化二苯甲酰(BPO)——过氧类引发剂中最常用 的低活性引发剂,60℃下,kd=10-6 s-1,t1/2= 96 hr。
c.低温下反应,Rp快,副反应少。
光引发聚合有光直接引发、光引发剂引发和光敏 剂间接引发三种。
2016/1/25
高分子化学
35
2. 光引发聚合 1)光直接引发 选用波长较短的紫外光,其能量大于单体的化学 键能,就可能直接引发聚合。 单体吸收一定波长的光量子后,先形成激发态, 后再分解成自由基,引发聚合。 直接光聚合的单体一般含有光敏基团,如丙烯酰 胺、丙烯腈、丙烯酸(酯)、苯乙烯等。
4、聚合过程中,单体逐渐减少,聚合物转化率 4、聚合初期,单体几乎全部缩聚成低聚物,以 相应增加。 后再由低聚物转变成高聚物,转化率变化甚微, 反应程度逐步增加。
5、延长聚合时间,主要是提高转化率,对分子 5、延长缩聚时间主要是提高分子量,而转化率 量影响较少。 变化较少。
6、反应混合物仅由单体、高聚物及微量活性中 6、任何阶段,都由聚合度不等的同系物组成。 心组成。
2016/1/25
高分子化学
23
有机物氧化还原体系:BPO + N,N-二甲基苯胺
2016/1/25
高分子化学
24
3.5.3 引发剂分解动力学
——研究引发剂浓度与时间、温度间的定量关系 一级反应
kd ——分解速率常数,s-1; 物理意义:单位引发剂浓度时的分解速率。 常见引发剂的kd 约10-4~10-6 ·s-1。
7、微量阻聚剂可消灭活性种,而使聚合终止。 7、由于平衡的限制,两单体非等当量比,或温 度过低而使缩聚暂停,这些因素不经消除,反 应又将继续进行。
9
2016/1/25
高分子化学
3.5 引发剂
链引发反应——控制聚合速率的关键。
引发剂——分子结构上具有弱键、易分解产生自 由基、能引发单体聚合的化合物(或物质)。 • 引发剂
2016/1/25 高分子化学 8
自由基聚合与线形缩聚机理特征的比较
自由基聚合 线形缩聚
1、可以明显地区分为链引发、增长、终止等基 1、无所谓链引发、增长、终止。各步反应速率 元反应,其速率常数和活化能并不相同。其中 常数和活化能基本相同。 引发最慢,成为控制总速率的反应。 2、少量活性中心迅速和单体加成,使链增长。 2、任何两物种(单体和聚合物)间均能缩合, 单体相互间,或与聚合物均不反应。 使链增长,无所谓活性中心。 3、链增长反应才能使聚合度增加。从一聚体增 3、单体、低聚物、高聚物间任何两分子都能反 长到高聚物时间极短,不能停留在中等聚合度 应,使分子量逐步增加,反应可以暂时停留在 阶段。在聚合全过程中,由于凝胶效应,先后 中等聚合度阶段。 聚合度稍有变化。
2016/1/25
高分子化学
11
1)偶氮类引发剂
R' R C CN N=N R' C CN R
-C-N=N -C -,-C-N键均裂,分解生成稳定的 N2分 子和自由基。 R 、 R’ 为烷基,结构可对称或不对称, 活性上:对称>不对称,并随着R基团增大,活性增加。
2016/1/25
高分子化学
12
2016/1/25
高分子化学
31
3.5.5 引发剂的选择
۩ 根据聚合方法选择:
•
本体、悬浮和溶液聚合:
偶氮类和过氧类等油溶性引发剂。
•
乳液、水溶液聚合: 过硫酸盐等水溶性引发剂或氧化还原体系 。
2016/1/25
高分子化学
32
۩ 根据聚合温度选择: 为了使自由基的形成速率与聚合速率适中,一般选 择半衰期 t1/2 与聚合时间同数量级或相当的引发剂。
聚合反应一般为双基终止。
双基终止可分为:偶合终止和歧化终止两种方式。
2016/1/25
高分子化学
7
链终止特点: • 双分子反应,双基终止(偶合、歧化); • Et很低,8~21kJ/mol(甚至为零); • 终止速率快, kt > kp ;
• 双基终止受扩散控制。
4) 链转移
自由基从一条大分子链转移给另一分子,形成新的 活性种继续增长,而原来的大分子终止,称为链转 移反应。
聚合温度高,选用低活性或中等活性的引发剂;
聚合温度低,则选用高活性的引发剂。
工业上,通常
采用高—低(中)活性引发剂复合使用;
常温聚合一定时间后,提高聚合温度进行后聚合。
2016/1/25
高分子化学
33
3.6 其它引发作用
1. 热引发聚合 ——直接在热的作用下进行的聚合叫热引发聚合。
苯乙烯的热引发聚合已工业化。
2016/1/25 高分子化学 19
3.5.2 氧化—还原体系引发剂 1) 水溶性氧化—还原体系
氧化剂:过氧化氢、过硫酸盐、氢过氧化物等。
还原剂:无机还原剂和有机还原剂(醇、胺、草酸、 葡萄糖等)。 •主要有过氧化氢体系和过硫酸盐体系。
2016/1/25
高分子化学
20
过氧化氢体系 过氧化氢和亚铁盐组成,5℃下可引发聚合。
热引发机理 先由两个苯乙烯分子形成加成中间体,再与一个 苯乙烯分子反应,生成两个自由基,再引发聚合。 这一理论相对较为合理,被推荐采用。
2016/1/25
高分子化学
34
2. 光引发聚合 ——烯类单体在光(电磁波)的激发下,形成自 由基而进行的聚合。 特点: a.选择性强,某一物质只吸收一定波长范围的光。 b.光照时产生自由基,光暗时即停止。
2016/1/25
高分子化学
16
主要类型: • 氢过氧化物: • 过氧化二烷基: • 过氧化二酰基 : • 过氧化酯类:
R O O H
R
O
O
O
O
R
C R O
R C O
R C O
O
O
R
• 过氧化二碳酸酯类:
R O C O O
O
C O O
R
2016/1/25
高分子化学
17
2) 无机过氧化类引发剂
•最常用的无机过氧化物——过硫酸盐。 •典型代表:水溶性的过硫酸钾(KSP)和过硫酸铵。 •一般用于乳液聚合和水溶液聚合。 •过硫酸盐可单独使用,但更普遍的是与适当的还原剂 构成氧化还原体系,可在室温或更低的温度下引发聚合。
在聚合过程中逐渐被消耗、残基连接在大分子末端、
不能再还原成原来的物质。
• 催化剂 仅在反应中起催化作用,加快反应速度,不参与反应, 反应结束仍以原状态存在于体系中的物质。
2016/1/25 高分子化学 10
3.5.1 引发剂的种类
偶氮类引发剂 过氧类引发剂(无机及有机过氧化物) 氧化—还原引发体系
2016/1/25 高分子化学 25
3.5.3 引发剂分解动力学 积分得:
或
[ I ] [ I ]0 e
kd t
[I]0:引发剂的起始浓度(t=0);
[I] :时间为t 时的引发剂浓度,mol/L。
2016/1/25 高分子化学 26
I I 0
kd 的测定:
:引发剂残留分率。
特点:活性较高(中活性)的偶氮类引发剂。 分解速率较快, Kd=10-4~-5(50~60℃下) 偶氮类引发剂分解时有N2逸出。 • 可用来测定它的分解速率。 • 工业上可用作泡沫塑料的发泡剂。
2016/1/25 高分子化学 14
2)有机过氧类引发剂 (1) 有机过氧化物——过氧化氢的衍生物 过氧化氢(双氧水)均裂形成二个氢氧自由基、
一定的温度下,测得不同t下的引发剂浓度的变化,
ln([I]/[I]0) ~t作图,由斜率求得kd 。
•偶氮类引发剂:测定分解时析出的氮气体积来计算引发 剂分解量;
