高考总复习课件第8章第4讲《沉淀溶解平衡》(鲁科版)
合集下载
高考化学一轮复习 8.4 沉淀溶解平衡讲解课件 鲁科版

重点(zhòngdiǎn)1
重点(zhòngdiǎn)2
第十六页,共37页。
重点2
沉淀溶解(róngjiě)平衡的应用
例2
变式训练
(xùnliàn)2
2.沉淀的溶解
当 Qc<Ksp 时,就会使沉淀溶解。
加入水、酸、碱、盐或氧化剂、还原剂等与溶解平衡中的相应离子反
应,降低离子浓度,使平衡向溶解方向移动,从而使沉淀溶解。如:CaCO3 溶于
中学化学中涉及的常数均只与温度有关,如电离平衡常数 Ka、化学平衡常数 K、
水的离子积常数 KW、难溶盐的溶度积常数 Ksp 以及水解平衡常数等,只要温度
不变,这些常数都不变。
重点(zhòngdiǎn)1
重点(zhòngdiǎn)2
第十二页,共37页。
重点1
影响Ksp的因素及沉淀溶解、
生成的判断(pànduàn)与计算
质的重要方法之一。沉淀生成的常用方法:
(1)调节 pH,如用 Cu(OH)2 除去含 Cu2+的溶液中的 Fe3+。
(2)加沉淀剂:如沉淀 Cu2+、Hg2+等,以 Na2S、H2S 作沉淀剂。
(3)同离子效应法:向饱和食盐水中通入 HCl 气体,析出食盐晶体,提纯
食盐。
(4)分步沉淀法:如用 AgNO3 溶液分离 Cl-和 I-。
①蒸馏水、②0.1 mol·
L-1 盐酸、③0.1 mol·
L-1 氯化镁溶液、④0.1 mol·
L-1 硝
酸银溶液中,Ag+浓度:①>④=②>③。(
)
提示:氯化银是难溶电解质,溶液中 c(Ag+)很小,所以④中 Ag+浓度最大,
沉淀溶解平衡PPT课件(上课用)鲁教版
质,溶解度差别
a)浓度:①加水
平也衡很右大移。
b)温度:升②温增大相多同数离平子衡通浓对浓向常度于度溶我、溶平解c溶 和 溶们温解、衡方溶质解讲度平易左向时平液的、衡溶移移只衡也电外压来动要。可解因强说是存质包等,饱在做括。在
溶液中进行,可忽略压
强的影响。
交流·研讨
珊瑚虫是海洋中的一种腔肠动物,它们可以从周
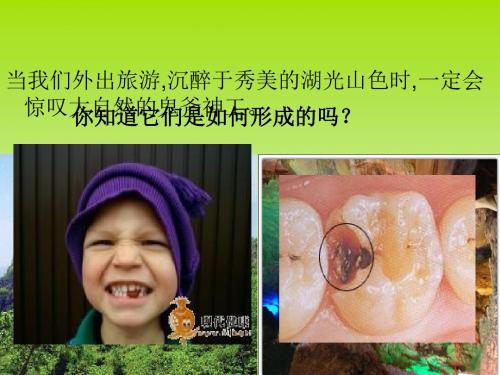
当我们外出旅游,沉醉于秀美的湖光山色时,一定会 惊叹大你自知然道的它鬼们斧是神如工何。形成的吗?
第3章 物质在水溶液中的行为
第3节 沉淀溶解平衡
你这节课的目 一、了标解:难溶电 解质在水中的溶 解情况。
二、能运用平衡 移动原理分析、
解决沉淀的
溶解和生成的问 题。
三、正确理解和 掌握溶度积KSP 的概念和性质。
探究一:
讨论1、 在NaCl的水溶液中,再加入固体 溶质,固体有没有溶解过程?
讨论2、NaCl能不能和盐酸反应?
实验:在饱和NaCl溶液中加入浓盐酸 现象:大现量象白?色沉淀产生
4、你认为白色沉淀是什么物 质呢?产生白色沉淀的原因 是什么?
溶液中存在:Na+ Cl- H+ OH-
NaCl(S)
Na+ + Cl-
10、你的假装努力,欺骗的只有你自己,永远不要用战术上的勤奋,来掩饰战略上的懒惰。 11、时间只是过客,自己才是主人,人生的路无需苛求,只要你迈步,路就在你的脚下延伸,只要你扬帆,便会有八面来风,启程了,人的生命才真正开始。 12、不管做什么都不要急于回报,因为播种和收获不在同一个季节,中间隔着的一段时间,我们叫它为坚持。失败。11、学会学习的人,是非常幸福的人。——米南德
这节课你学到了什么
高考化学总复习 8.4 沉淀溶解平衡课件 鲁科版必修1

锥形瓶内溶液颜色变化 。
第十一页,共42页。
⑥终点判断 等到滴入最后一滴反应液,指示剂变色(biàns,è)且在半分钟 内不恢复原来(yuánlái)的颜色,视为滴定终点,读取最后刻度。 ⑦计算 取两次或多次消耗标准溶液 平均值 ,依方程式求 c(待)。 (4)数据处理 按上述操作重复 2~3 次,求出用去标准盐酸体积的平均值,根 据[NaOH]=VVHCNlaO·[HHC l]计算待测 NaOH 溶液的浓度[NaOH]。
[HCl]·VHCl VNaOH
。
第八页,共42页。
3.实验操作 (1)主要仪器:滴定管(如图所示)
第九页,共42页。
①酸式滴定管:盛装 酸性 溶液或 氧化性 溶液。 ②碱式滴定管:盛装 碱性 溶液。 (2)试剂:标准液、待测液、 酸碱指示剂 。 (3)操作步骤 ①检查仪器 滴定管使用前,应首先 检查活塞是否漏水 。 ②润洗仪器 滴定管在加入酸、碱溶液之前,要分别用 待盛的溶液 润洗 2~3次。
§8.4 沉淀(chéndiàn)溶解平衡
第一页,共42页。
1.了解难溶电解质的沉淀溶解平衡及沉淀转化的本质。 2.了解滴定管的主要用途和使用方法。 3.能对中和滴定的数据进行分析或处理,得出合理结论。
第二页,共42页。
一、沉淀溶解平衡 1.沉淀溶解平衡 (1)概念:在一定温度下,当沉淀 溶解 和 生成 的速率相等时 达到的平衡状态。 (2)表示:氯化银的沉淀溶解平衡可表示为:
小 ④乙实际测得的值较准确
A.①②
B.①③
C.①④
D.②④
第三十页,共42页。
【解析】 中和滴定实验时,所用滴定管均必须用待盛溶液润 洗,否则会将所装溶液稀释,盛待测液的滴定管没用待测液润洗, 会使测定结果偏低;锥形瓶内有少量水不影响滴定结果,但若用待 测液润洗,则会使测定结果偏大;所以,甲操作有两处错误,但其 测定结果不一定比乙小。乙操作没有错误,测定结果较准确。
第十一页,共42页。
⑥终点判断 等到滴入最后一滴反应液,指示剂变色(biàns,è)且在半分钟 内不恢复原来(yuánlái)的颜色,视为滴定终点,读取最后刻度。 ⑦计算 取两次或多次消耗标准溶液 平均值 ,依方程式求 c(待)。 (4)数据处理 按上述操作重复 2~3 次,求出用去标准盐酸体积的平均值,根 据[NaOH]=VVHCNlaO·[HHC l]计算待测 NaOH 溶液的浓度[NaOH]。
[HCl]·VHCl VNaOH
。
第八页,共42页。
3.实验操作 (1)主要仪器:滴定管(如图所示)
第九页,共42页。
①酸式滴定管:盛装 酸性 溶液或 氧化性 溶液。 ②碱式滴定管:盛装 碱性 溶液。 (2)试剂:标准液、待测液、 酸碱指示剂 。 (3)操作步骤 ①检查仪器 滴定管使用前,应首先 检查活塞是否漏水 。 ②润洗仪器 滴定管在加入酸、碱溶液之前,要分别用 待盛的溶液 润洗 2~3次。
§8.4 沉淀(chéndiàn)溶解平衡
第一页,共42页。
1.了解难溶电解质的沉淀溶解平衡及沉淀转化的本质。 2.了解滴定管的主要用途和使用方法。 3.能对中和滴定的数据进行分析或处理,得出合理结论。
第二页,共42页。
一、沉淀溶解平衡 1.沉淀溶解平衡 (1)概念:在一定温度下,当沉淀 溶解 和 生成 的速率相等时 达到的平衡状态。 (2)表示:氯化银的沉淀溶解平衡可表示为:
小 ④乙实际测得的值较准确
A.①②
B.①③
C.①④
D.②④
第三十页,共42页。
【解析】 中和滴定实验时,所用滴定管均必须用待盛溶液润 洗,否则会将所装溶液稀释,盛待测液的滴定管没用待测液润洗, 会使测定结果偏低;锥形瓶内有少量水不影响滴定结果,但若用待 测液润洗,则会使测定结果偏大;所以,甲操作有两处错误,但其 测定结果不一定比乙小。乙操作没有错误,测定结果较准确。
鲁科版《沉淀溶解平衡》课件

25℃时, Ksp= [Pb2+ ][I-]2 练习:BaSO4、Fe(OH)3、Mg(OH)2的溶度积表达式 Ksp(BaSO4)= [Ba2+][SO42-] - 3 3+ Ksp [Fe(OH)3]= [Fe ][OH ] Ksp[Mg(OH)2]= [Mg2+][OH-]2 单位: mol2L-2 单位: mol4L-4 单位: mol3L-3
温故
在学习初中化学时,我们曾根据物质的溶解 度将物质分为易溶、可溶、微溶、难溶等。
20℃时, 溶解度S:
难溶 0.01 微溶 1 可溶 10 易溶
(Sg/100g水)
难溶 ≠ 不溶
探究一、溶度积Ksp的含义及其应用
实验步骤:
滴加几 滴KI溶 液 PbI2
PbI2固体加水
实验现象:
在上层清液中滴 加KI溶液后,有 黄色沉淀产生。
Ca2+
+2HCO3-
CaCO3↓ +CO2↑+H2O
珊瑚周围的藻类植物的生长会促进碳酸钙的产生, 对珊瑚的形成贡献很大。人口增长、人类大规模砍伐 森林、燃烧煤和其他的化石燃料等因素,都会干扰珊 瑚的生长,甚至造成珊瑚虫死亡。
溶度积(Ksp )的性质二
Ksp反映了难溶电解质在水中的溶解度;当化学式 所表示的组成中阴阳离子个数比相同时(相同类 型) Ksp数值越大的难溶电解质在水中的溶解能力 越强即溶解度越大。
ZnS(s) CuS(s)
Zn2+(aq)+S2-(aq) Cu2+(aq)+S2-(aq)
Ksp=1.6×10-24mol2•L-2 Ksp=1.3×10-36mol2•L-2
ZnS与CuS是同类难溶物,Ksp(ZnS) >Ksp(CuS),CuS的溶解 度远小于ZnS的溶解度。
高三化学一轮复习 第八章 第4讲 沉淀溶解平衡课件 鲁科版

1.(1)①AgCl(s) Ag+(aq)+Cl-(aq);② AgClAg++Cl-。
①②两方程式所表示的意义相同吗? (2)Ag+与Cl-按等物质的量之比反应生成AgCl沉淀,该反 应完成后,溶液中有无Ag+、Cl-存在? 【提示】(1)不同。①式表示难溶电解质AgCl在水溶液中 的溶解平衡方程式;②式表示强电解质AgCl在水溶液中的电离方 程式。 (2)Ag+与Cl-反应生成AgCl沉淀达到一定程度也会处于溶 解平衡状态,所以溶液中仍然会有Ag+和Cl-,只不过其浓度很小。
c.其他:向平衡体系中加入可与体系中某些离子反应生成更难 溶或更难电离或气体的离子时,平衡向溶解方向移动,但Ksp不变。
2.溶度积Ksp (1)下列沉淀溶解平衡:MmAn(s) mMn+(aq)+nAm-(aq),固 体纯物质不列入平衡常数,其溶度积为Ksp=[Mn+]m·[Am-]n,AgCl 的Ksp=[Ag+]·[Cl-]。对于相同类型物质Ksp的大小反映了难溶电 解质在溶液中溶解能力的大小,也反映了该物质在溶液中沉淀的难 易。与平衡常数一样,Ksp与温度有关。不过温度改变不大时,Ksp变 化也不大,常温下的计算可不考虑温度的影响。
1.(2009年广东高考)硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线 如下。下列说法正确的是(多选)( )
A.温度一定时,Ksp(SrSO4)随[SO42-]的增大而减小 B.三个不同温度中,313 K时Ksp(SrSO4)最大 C.283 K时,图中a点对应的溶液是不饱和溶液 D.283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液
第4讲 沉淀溶解平衡
最新 展示
1.了解溶解平衡的定义及影响因素。 2.掌握沉淀的溶解和转化的条件及应用。 3.了解溶度积及其有关计算。
2022版新高考化学鲁科版一轮课件:第8章 第4节 沉淀溶解平衡

(3)沉淀溶解平衡的影响因素
第4节 沉淀溶解平衡
1
2
3
4
必备知识·关键能力 热点聚焦·考能提升 真题验收·新题预测 课后限时集训
(4)电解质在水中的溶解性 20 ℃时,电解质在水中的溶解度与溶解性存在如下关系:
第4节 沉淀溶解平衡
[深思考]
1
2
3
4
必备知识·关键能力 热点聚焦·考能提升 真题验收·新题预测 课后限时集训
AgCl(s)溶于水达到平衡:AgCl(s) Ag+(aq)+Cl-(aq)
请填表:
外界条件
移动方向
c(Ag+)
①加 AgCl 固体
_____________ ______________
②加入 Na2S ③通入 HCl
_____________ ______________ _____________ ______________
b.矿物转化:CuSO4 溶液遇 PbS 转化为 CuS,离子方程式为 ___C_u_2_+_(_a_q_)_+__P_b_S_(_s_)=_=__=_C_u_S_(_s_)_+__P_b_2_+_(_a_q_)_____。
第4节 沉淀溶解平衡
[辨易错]
1
2
3
4
必备知识·关键能力 热点聚焦·考能提升 真题验收·新题预测 课后限时集训
如 Mg(OH)2 溶于 NH4Cl 溶液,离子方程式为 __M_g_(_O__H_)_2+__2_N__H_+ 4_=_=_=_M__g_2_+_+__2_N_H__3·_H_2_O____。
第4节 沉淀溶解平衡
1
2
3
4
必备知识·关键能力 热点聚焦·考能提升 真题验收·新题预测 课后限时集训
鲁科版沉淀溶解平衡课件完美版2

加入酸、碱或氧化剂、还原剂或适当的溶剂与溶解 平衡体系中的相应离子反应,降低离子浓度,使平 衡向溶解方向移动。 (2)沉淀的转化 沉淀转化的实质就是沉淀溶解平衡的移动。一般说 来,溶解度小的沉淀转化成溶解度更小的沉淀容易 实现。 根据难溶物质溶解度的大小,难溶物质间可以进行 转化,例如:
AgNO3NaCl,AgCl( 白 色 沉 淀 )NaBr,AgBr( 淡 黄 色 沉
淀)―N―a→I AgI(黄色沉淀)―N―a2→S Ag2S(黑色沉淀)
一定温度下的难溶电解质AmBn在水溶液中达到沉 淀溶解平衡时,其平衡常数Ksp=cm(An+)×cn(Bm -),称为难溶电解质的溶度积。已知下表数据:
对含等物质的量的 CuSO4、FeSO4、Fe2(SO4)3 的混合溶液的说法,不科学的是( ) A.向该混合溶液中逐滴加入 NaOH 溶液,最先 看到红褐色沉淀 B.该溶液中 c(SO24-)∶[c(Cu2+)+c(Fe2+)+c(Fe3 +)]>5∶4 C.向该溶液中加入适量氯水,并调节 pH 到 3~ 4 后过滤,可获得纯净的 CuSO4 溶液
溶度积(Ksp)的相关计算
1.利用溶度积(Ksp)计算溶液中离子的浓度
对于 AaBb 型的难溶电解质
AaBb
aAn++bBm-
Ksp=[An+]a[Bm-]b
[An+]∶[Bm-]=a∶b
计算公式:Leabharlann a+b [An+]=abb·Ksp
a+b [Bm-]=
baa·Ksp
2.溶度积、溶解度和物质的量浓度之间的换算 溶度积 Ksp、溶解度 S 和饱和溶液的物质的量浓度 c 都可以用来衡量沉淀的溶解性,它们彼此关联,可
以互相换算。
以 CaCO3 的溶解平衡 CaCO3 CO23-(aq)为例。
高中化学 沉淀溶解平衡及应用课件 鲁科版选修4

等:V溶解=V析出≠0 定:外界条件一定,溶液中各粒子的
浓度保持不变
变:外界条件改变,溶解平衡发生移动。
10
练一练
1、下列有关AgCl的说法正确的是( D ) A. AgCl难溶于水,溶液中没有Ag+和Cl— B. 在AgCl饱和溶液中,AgCl没有再溶解了 C. AgCl是一种难溶物,所以是弱电解质 D.在AgCl饱和溶液中,AgCl生成和溶解不 断进行,但速率相等。
15
三、溶度积常数
❖ 1、定义: 用于描述难溶电解质在水中的沉淀
溶解平衡的平衡常数。
❖ 2、符号:Ksp ❖ 3、意义: 反映了难溶电解质在水中的溶解能
力;阴离子和阳离子个数比相同的物质, Ksp数值越大,难溶电解质在水中的溶 解能力越强。
16
常见难溶电解质的浓度积常数和溶解度(25℃)
难溶物
AgCl AgBr AgI BaSO4 Fe(OH)3 CaCO3
11
二、影响沉淀溶解平衡的条件
❖ 想一想:我们学过哪些因素能够影响化 学平衡,其中哪一些会对沉淀溶解平衡有影 响呢?
1.内因: 沉淀本身的性质
温度:温度升高,多数溶解平衡向
2.外因:
溶解方向移动。 稀释:向溶解方向移动
浓度:
加入相同的离子,向 同离子效应:生成沉淀的方向移动
12
大展身手
2.石灰乳中存在下列平衡:
7
❖ 3、在上述可逆反应中,我们把正反应的速率 (v正)看成AgCl的溶解过程,正反应速率 (v逆)看成Ag+和Cl-结合成AgCl的过程,那 么,请大家画出将AgCl固体投入水中后,v正 和v逆随时间的变化曲线。(独立完成后展示)
试通过这个图像和课本 上的内容,归纳总结出沉淀 溶解平衡的形成过程。
浓度保持不变
变:外界条件改变,溶解平衡发生移动。
10
练一练
1、下列有关AgCl的说法正确的是( D ) A. AgCl难溶于水,溶液中没有Ag+和Cl— B. 在AgCl饱和溶液中,AgCl没有再溶解了 C. AgCl是一种难溶物,所以是弱电解质 D.在AgCl饱和溶液中,AgCl生成和溶解不 断进行,但速率相等。
15
三、溶度积常数
❖ 1、定义: 用于描述难溶电解质在水中的沉淀
溶解平衡的平衡常数。
❖ 2、符号:Ksp ❖ 3、意义: 反映了难溶电解质在水中的溶解能
力;阴离子和阳离子个数比相同的物质, Ksp数值越大,难溶电解质在水中的溶 解能力越强。
16
常见难溶电解质的浓度积常数和溶解度(25℃)
难溶物
AgCl AgBr AgI BaSO4 Fe(OH)3 CaCO3
11
二、影响沉淀溶解平衡的条件
❖ 想一想:我们学过哪些因素能够影响化 学平衡,其中哪一些会对沉淀溶解平衡有影 响呢?
1.内因: 沉淀本身的性质
温度:温度升高,多数溶解平衡向
2.外因:
溶解方向移动。 稀释:向溶解方向移动
浓度:
加入相同的离子,向 同离子效应:生成沉淀的方向移动
12
大展身手
2.石灰乳中存在下列平衡:
7
❖ 3、在上述可逆反应中,我们把正反应的速率 (v正)看成AgCl的溶解过程,正反应速率 (v逆)看成Ag+和Cl-结合成AgCl的过程,那 么,请大家画出将AgCl固体投入水中后,v正 和v逆随时间的变化曲线。(独立完成后展示)
试通过这个图像和课本 上的内容,归纳总结出沉淀 溶解平衡的形成过程。
