安徽省蚌埠铁中高中化学《电解池金属的电化学腐蚀与防护》全册复习导学案
2022年人教版高二化学选修四 4.4 金属的电化学腐蚀与防护(导学案)

高二化学导学案:编号:使用时间:班级:小组:姓名:组内评价:教师评价:第四章第四节金属的电化学腐蚀和防护编制人:丁花蓉审核人:赵昆元领导签字:【学习目标】1.了解金属腐蚀的危害及金属腐蚀的本质原因;2.了解金属腐蚀的种类,发生腐蚀的反响式的书写;3.掌握金属防护的方法。
【学习重点】金属的电化学腐蚀自主学习一、金属的电化学腐蚀〔一〕金属腐蚀:1.定义:是指金属或合金跟接触的气体或液体发生反响而腐蚀损耗的过程。
2.本质:M – n e- → M n〔氧化反响〕3.类型:〔1〕化学腐蚀——直接反响〔2〕电化学腐蚀——原电池反响两种腐蚀往往发生,但腐蚀更普遍,速度更快,危害更严重。
〔二〕化学腐蚀:1.定义:金属与接触到的枯燥气体〔如、、等〕或非电解质液体〔如等〕直接发生化学反响而引起的腐蚀。
如:钢管被原油中的腐蚀,2.影响因素:与接触物质的氧化性有关和温度越高,化学腐蚀越。
〔三〕电化学腐蚀:1 定义:不纯的金属跟电解质溶液接触时,会发生反响,的金属失去电子而被。
如在潮湿的空气中生锈。
2 类型:以钢铁腐蚀为例〔1〕析氢腐蚀酸性较强的溶液负极: 正极:总方程式:〔2〕吸氧腐蚀碱性、中性或弱酸性溶液负极: 正极:总方程式:FeOH2继续与空气中的氧气作用:铁锈的主要成分是,它〔填“能〞或“不能〞〕阻止钢铁继续腐蚀。
〔四〕影响金属腐蚀快慢的因素:内因:〔1〕金属的活动性:金属越,越容易被腐蚀〔2〕纯度:不纯的金属比纯金属腐蚀,如纯铁比钢腐蚀。
〔难、易〕电化学腐蚀:两电极活动性差异越大,氧化复原反响速率越,活泼金属被腐蚀得越快。
〔3〕氧化膜:如果金属被氧化形成致密的氧化膜,那么会保护内层金属,如、;如果金属被氧化形成疏松的氧化膜,那么不会保护内层金属,如。
外因:环境〔腐蚀性气体,电解质溶液〕〔五〕、化学腐蚀与电化学腐蚀的共同点和不同点:二、金属的防护1.金属的防护:⑴覆盖保护膜〔涂油漆,电镀,钝化等〕⑵改变金属的内部结构〔钢→不锈钢:在钢中参加金属镍和铬〕2.电化学保护⑴牺牲阳的极阴极保护法:〔较活泼金属作极,钢铁作极被保护〕原电池的负极〔也称为阳极〕金属被腐蚀,原电池的正极〔也称为阴极〕金属被保护①原理:形成原电池反响时,让被保护金属做极,不反响,起到保护作用;而活泼金属反而受到腐蚀。
高二化学金属的腐蚀与防护复习导学案

【重点难点】金属的腐蚀和防护、电极式书写。电解的应用
【复习范围】第四章电化学基础
一、电化学腐蚀(1)分别写出析氢腐蚀、吸氧腐蚀的电解质环境、负极电极式、正极电极式以及铁锈形成涉及的方程式(2)右图中铁锈最多的区域是?
(3)支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是
A.温度B.试剂的浓度C.试剂的用量(体积) D.试剂添加的顺序
⑤由上述实验记录可得出的结论是?
⑥若要进行酸性对反应速率的影响的探究实验,你会采取的措施是?
①电解时的两极反应为?为何加时适量NaCl溶液?
②写出Cr2O 转变成Cr3+的离子反应方程式。
③电解过程中Cr(OH)3、Fe(OH)3沉淀是怎样产生的?
④能否用Cu代替Fe为电极?为什么?
⑤电路中每转移12 mol电子,最多有mol Cr2O 被还原
二、速率实验KI溶液在酸性条件下能与氧气反应.现有以下实验记录:
实验编号
①
②
③
④
⑤
温度(℃)304050 Nhomakorabea60
70
显色时间(s)
160
80
40
20
10
回答下列问题:
①该反应的离子方程式为?
②该实验的目的是?
③实验试剂除了1 mol/L KI溶液、0.1 mol/L H2SO4溶液氧气外,还需要的试剂是?实验现象为?
④上述实验操作中除了需要③的条件外,还必须控制不变的是?(填字母).
①通入保护电流使钢管桩表面腐蚀电流接近于零
②通电后外电路电子被强制从高硅铸铁流向钢管桩
③高硅铸铁的作用是作为损耗阳极材料和传递电流
高中化学金属的电化学腐蚀与防护学案

《金属的电化学腐蚀与防护》学案
一、学习目标
1、了解金属腐蚀的概念及本质
2、了解金属腐蚀的类型,正确理解电化学腐蚀
3、理解金属防护的方法
二、自学局部
知识点一金属的腐蚀
1、金属腐蚀〔阅读教材84页第3自然段〕
〔1〕概念:金属与周围接触的发生而引起损耗的现象。
〔2〕分类:和。
①化学腐蚀:金属与接触到的等直接发生而引起的腐蚀
②电化学腐蚀:的金属跟溶液接触时,会发生
反响,比拟的金属电子而被氧化。
1、电化学保护方法:〔原电池原理〕
〔电解原理〕
2、在金属外表覆盖保护层:油、油漆、塑料、搪瓷、镀一层金属
3、改变金属的内部组织结构:如制成合金,不锈钢。
高四化学一轮复习学案——电解池 金属的腐蚀与防护

高四化学一轮复习学案——电解池 金属的腐蚀与防护考纲要求:1.了解电解池的工作原理,能写出电极反应式和电解反应方程式。
2.理解金属发生电化学腐蚀的原因,金属腐蚀的危害,防止金属腐蚀的措施。
考点一| 电解原理[教材知识层面]1.电解使 通过电解质溶液(或熔融的电解质)而在阴、阳两极引起 的过程。
2.电解池(也叫电解槽)(1)概念:电解池是把 的装置。
(2)构成条件:①有与 相连的两个电极。
② (或熔融盐)。
③形成 。
(3)电极名称及电极反应式(如图):总反应方程式:Cu 2++2Cl -=====电解Cu +Cl 2↑ (4)电子和离子移动方向:①电子:从电源 极流向电解池的 极;从电解池的 极流向电源的 极。
②离子:阳离子移向电解池的 极;阴离子移向电解池的 极。
[高考考查层面]命题点1 电解方程式的书写 1.方法步骤(1)首先判断阴、阳极,分析阳极材料是惰性电极还是活泼电极。
(2)再分析电解质水溶液的组成,找全离子并分阴、阳两组(勿忘水溶液中的H +和OH -)。
(3)然后排出阴、阳两极的放电顺序。
阴极:阳离子放电顺序:Ag +>Fe 3+>Cu 2+>H +(酸)>Fe 2+>Zn 2+>H +(水)>Al 3+>Mg 2+>Na +>Ca 2+>K+(水溶液中Al 3+、Mg 2+、Na +、Ca 2+、K +不放电)。
阳极:活泼电极>S 2->I ->Br ->Cl ->OH ->含氧酸根离子(水溶液中含氧酸根离子不放电)。
(4)分析电极反应,判断电极产物,写出电极反应式,要注意遵循原子守恒和电荷守恒。
(5)最后写出电解反应的总化学方程式或离子方程式。
2.注意问题(1)书写电解池中电极反应式时,要以实际放电的离子表示,但书写总电解反应方程式时,弱电解质要写成分子式。
(2)要确保两极电子转移数目相同,且注明条件“电解”。
高中化学《高考化学金属的腐蚀与防护学业水平复习》的教案

高中化学《高考化学金属的腐蚀与防护学业水平复习》的教案章节一:金属腐蚀的基本概念教学目标:1. 了解金属腐蚀的定义和分类。
2. 掌握金属腐蚀的原因和腐蚀过程。
教学内容:1. 金属腐蚀的定义和分类。
2. 金属腐蚀的原因和腐蚀过程。
教学活动:1. 引导学生回顾金属腐蚀的定义和分类。
2. 通过实验或图片展示,让学生观察金属腐蚀的现象。
3. 讲解金属腐蚀的原因和腐蚀过程。
4. 进行小组讨论,让学生分享对金属腐蚀的理解。
章节二:金属的电化学腐蚀教学目标:1. 了解金属的电化学腐蚀原理。
2. 掌握电化学腐蚀的类型和特点。
教学内容:1. 金属的电化学腐蚀原理。
2. 电化学腐蚀的类型和特点。
教学活动:1. 引导学生回顾金属的电化学腐蚀原理。
2. 通过实验或动画演示,让学生理解电化学腐蚀的过程。
3. 讲解电化学腐蚀的类型和特点。
4. 进行小组讨论,让学生分享对电化学腐蚀的理解。
章节三:金属的防护方法教学目标:1. 了解金属的防护方法。
2. 掌握常见金属防护方法的应用和效果。
教学内容:1. 金属的防护方法。
2. 常见金属防护方法的应用和效果。
教学活动:1. 引导学生回顾金属的防护方法。
2. 通过实验或图片展示,让学生了解不同防护方法的应用。
3. 讲解常见金属防护方法的效果和适用范围。
4. 进行小组讨论,让学生分享对金属防护方法的理解。
章节四:金属腐蚀与生活实例教学目标:1. 了解金属腐蚀在日常生活中的应用实例。
2. 分析金属腐蚀对生活的影响和解决方法。
教学内容:1. 金属腐蚀在日常生活中的应用实例。
2. 金属腐蚀对生活的影响和解决方法。
教学活动:1. 引导学生思考金属腐蚀在日常生活中的应用实例。
2. 通过图片或实物展示,让学生观察金属腐蚀对生活的影响。
3. 讲解金属腐蚀对生活的影响和解决方法。
4. 进行小组讨论,让学生分享对金属腐蚀在生活中应用实例的理解。
章节五:金属腐蚀与环境保护教学目标:1. 了解金属腐蚀对环境的影响。
高中化学《高考化学金属的腐蚀与防护学业水平复习》的教案

高中化学《高考化学金属的腐蚀与防护学业水平复习》的教案一、教学目标1. 知识与技能:(1)理解金属腐蚀的定义及分类(化学腐蚀和电化学腐蚀);(2)掌握金属腐蚀的原因及腐蚀速率的影响因素;(3)了解金属的防护方法,如:涂层保护、阴极保护、合金强化等。
2. 过程与方法:(1)通过实例分析,培养学生的观察和分析能力;(2)运用实验方法,探究金属腐蚀的规律;(3)学会运用防护方法解决实际问题。
3. 情感态度与价值观:(1)培养学生对化学学科的兴趣和好奇心;(2)强化学生的实验操作能力和团队协作精神;(3)培养学生关注生产、生活实际,提高学生的社会实践能力。
二、教学内容1. 金属腐蚀的定义及分类(1)化学腐蚀:金属与非金属物质直接反应导致的腐蚀;(2)电化学腐蚀:金属在电解质溶液中发生的腐蚀。
2. 金属腐蚀的原因及腐蚀速率的影响因素(1)金属原子的活泼性;(2)腐蚀介质(如:氧气、水、酸、碱等);(3)温度、压力、腐蚀速率等。
3. 金属的防护方法(1)涂层保护:如涂油、涂漆、镀层等;(2)阴极保护:通过外加电源或牺牲阳极,使金属表面成为阴极,减缓腐蚀速度;(3)合金强化:通过合金化,提高金属的抗腐蚀性能。
三、教学重点与难点1. 教学重点:(1)金属腐蚀的类型及原因;(2)金属的防护方法及应用。
2. 教学难点:(1)电化学腐蚀的原理;(2)阴极保护的原理及应用。
四、教学方法1. 讲授法:讲解金属腐蚀的基本概念、类型、原因及防护方法;2. 实验法:进行金属腐蚀实验,观察腐蚀现象,分析腐蚀原因;3. 案例分析法:分析实际生活中的金属腐蚀问题,探讨解决方案;4. 小组讨论法:分组讨论,分享学习心得和实验结果。
五、教学进程1. 导入新课:通过生活中的金属腐蚀现象,引发学生对金属腐蚀的思考;2. 讲解金属腐蚀的基本概念、类型、原因及防护方法;3. 进行金属腐蚀实验,观察腐蚀现象,分析腐蚀原因;4. 案例分析:分析实际生活中的金属腐蚀问题,探讨解决方案;5. 小组讨论:分组讨论,分享学习心得和实验结果;六、教学评估1. 课堂提问:通过提问了解学生对金属腐蚀与防护知识的掌握情况;2. 实验报告:评估学生在实验过程中的观察、分析、解决问题能力;3. 课后作业:布置相关习题,巩固学生对金属腐蚀与防护知识的理解;4. 小组讨论:评估学生在团队合作中的表现,包括沟通、协作、创新能力。
金属的电化学腐蚀与防护导学案
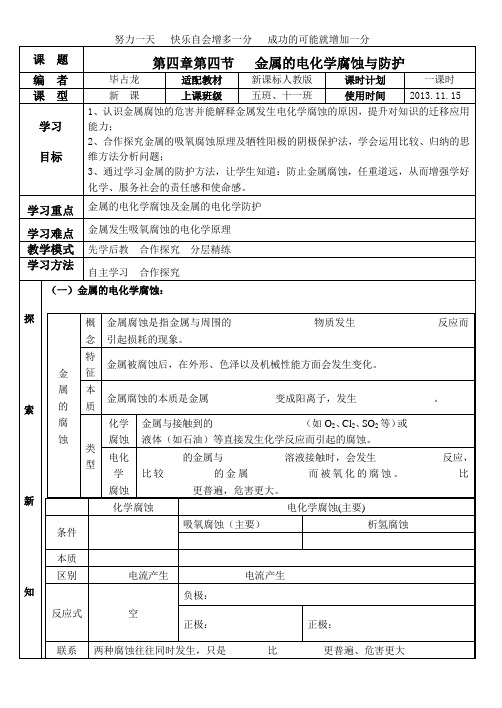
复习巩固二、金属的电化学防护1、牺牲阳极的阴极保护法原理:应用_______原理,让被保护金属作______,另找一种活泼性较强的金属作___________。
2、外加电流的阴极保护法利用________原理,把被保护的钢铁设备作为_______极,用惰性电极作为辅助________极。
在电解质溶液里,接外加_______电源。
改变其内部结构作原电池的__________加保护层作电解池的__________习题精练1、下列事实不能用电化学理论解释的是( )A、轮船水线以下的船壳上装一定数量的锌块B、铝片不用特殊方法保存C、纯锌与稀硫酸反应时,滴入少量的CuSO4溶液后反应速率加快D、镀锌铁(在铁上镀上一层锌)比镀锡铁耐用2、下图各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是( )A、④>②>①>③>⑤B、②>①>⑤>③>④C、⑤>④>②>③>①D、③>⑤>②>④>①3、(选做)钢铁生锈过程发生如下反应,下列说法正确的是( )①2Fe+O2+2H2O===== 2Fe(OH)2②4Fe+(OH)2+O2+2H2O===== 4Fe(OH)3;③2Fe(OH)3===== Fe2O3+3H2OA、反应①、②中电子转移数目相等B、反应①中氧化剂是氧气和水C、与铜质水龙头连接处的钢质水管不易发生腐蚀D、钢铁在潮湿的空气中不能发生电化学腐蚀4、有关上图装置中的叙述正确的是( )A、这是电解NaOH溶液的装置B、这是一个原电池装置,利用该装置可长时间的观察到Fe(OH)2沉淀的颜色C、Pt为正极,其电极反应为:O2+2H2O +4eˉ=4OHˉD、Fe为阴极,其电极反应为:Fe-2eˉ+2OHˉ=2Fe(OH)25、(选做)铜板上铁铆钉处的吸氧腐蚀原理如上图所示,下列有关说法错误的是( )A、正极电极反应式为:2H++2e-===H2↑B、此过程中还涉及到反应:4Fe(OH)2+2H2O+O2===4Fe(OH)3C、此过程中Cu并不被腐蚀D、此过程中电子从Fe移向Cu收获与疑惑被保护的金属。
高中化学 《金属的电化学腐蚀与防护》教案4 新人教版选修4

等直接发生化学反应而引起的腐蚀。如:钢管被原油中的 2、影响因素:与接触物质的氧化性有关和温度越高,化学腐蚀越 (三) 、电化学腐蚀: 1、定义:不纯的金属跟电解质溶液接触时。会发生 被 [过 。如 渡]: 在潮湿的空气中生锈。 反应
的金属失去电子而
钢铁及其制品通常为含碳的铁合金,若在潮湿的环境里或湿度较大的环境里
③、产生 H2
⑤、杂质碳被氧化除去 D. ①②③④⑤
C. ①②③④
新课
一、知识与技能 1、认识金属腐蚀的危害及防腐措施,感受化学对人类生产和生活的影响。 教学目标 (三维目 标) 2、掌握影响金属腐蚀快慢的比较 二、过程与方法 通过学习增强保护环境的意识,节约意识。 三、情感、态度与价值 通过化学实验(设计、验证和评价)这一科学研究方法,培养学生实事求是 的科学精神,帮助学生树立正确的科学态度。 重点和难 点 教学手段 教学方法 教学过程 [提 问]:请大家根据铁生锈的原因,我们可以采取哪些措施防止铁生锈? 金属腐蚀的防腐措施 计算机辅助教学 通过联系生活激发学生的兴趣,引导启发学生分析现象、探究实质、总结规律。
辅助阳极
[过
渡]:除此以外还有哪些防护方法?
[归纳小结]: 3、改变金属的内部结构(钢→不锈钢,在钢中加入镍和铬) 。 4、覆盖保护膜(涂油漆,电镀,钝化等) 。 5、金属被保护的效果比较: 电解池的阴极保护(外加电流阴极保护法)> 原电池的正极(牺牲阳极的阴极保护法)> 一 般保护 [典型例题]:例 3、 为了防止钢铁锈蚀, 下列防护方法中正确的是 A. 在精密机床的铁床上安装铜螺钉 B. 在排放海水的钢铁阀门上用导线连接一块石墨,一同浸入海水中 C. 在海轮舷上用铁丝系住锌板浸在海水里 D. 在地下输油的铸铁管上接直流电源的负极 例 4、下列事实不能用电化学理论解释的是 ( B ) ( CD )
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电解池 金属的电化学腐蚀与防护[考纲要求] 1.了解电解池的工作原理,写出电极反应和电池反应方程式。
2.理解金属发生电化学腐蚀的原因、金属腐蚀的危害、防止金属腐蚀的措施。
知识点一 电解池、电解原理1.电解原理(1)电解:使________通过电解质溶液(或熔融的电解质)而在__________引起____________________的过程。
(2)电解池(也叫电解槽):把____能转化为________能的装置。
(3)电极名称与电极反应:与电源正极相连的为________,发生________反应; 与电源负极相连的为________,发生________反应。
2.电解CuCl 2溶液(如右图所示)(1)阳极反应:__________________________________________________________ (2)阴极反应:___________________________________________________________ (3)总方程式:_________________________________________________________ 问题思考1.电解质的电离和溶液的导电有什么联系?2.电解池的阴、阳极与电极材料有什么关系?知识点二 电解原理的应用 1.电解饱和食盐水 (1)电极反应阳极反应式:___________________________________________________________ (________反应)阴极反应式:___________________________________________________________ (________反应)(2)总反应方程式:2NaCl +2H 2O=====电解2NaOH +H 2↑+Cl 2↑离子反应方程式:2Cl -+2H 2O=====电解2OH -+H 2↑+Cl 2↑ (3)应用:氯碱工业制________、________和________。
2.电镀右图为金属表面镀银的工作示意图,据此回答下列问题: (1)镀件作____极,镀层金属银作____极。
(2)电解质溶液是________________________________________________________ ________________________________________________________________________。
(3)电极反应:阳极:_________________________________________________________________; 阴极:_____________________________________________________________。
(4)特点:____极溶解,____极沉积,电镀液的浓度_________________________。
3.电解精炼铜(1)电极材料:阳极为________;阴极为________。
(2)电解质溶液:含Cu 2+的盐溶液。
(3)电极反应:阳极为_______________________________________________________________; 阴极为_________________________________________________________________。
4.电冶金利用电解熔融盐的方法来冶炼活泼金属Na 、Ca 、Mg 、Al 等。
(1)冶炼钠2NaCl(熔融)=====电解2Na +Cl 2↑ 电极反应:阳极:_________________________________________________________________, 阴极:________________________________________________________________。
(2)冶炼铝2Al 2O 3(熔融)=====电解4Al +3O 2↑ 电极反应:阳极:_________________________________________________________________, 阴极:_________________________________________________________________。
问题思考3.如何设计实验验证电解饱和食盐水的各种产物?4.电解过程中放H 2生碱型和放O 2生酸型的实质是什么?5.用惰性电极电解,若要使电解后的溶液复原,应怎样操作?知识点三 金属的腐蚀和防护 1.金属腐蚀的本质金属原子________变为________,金属发生________。
2.金属腐蚀的类型(1)化学腐蚀与电化学腐蚀化学腐蚀电化学腐蚀条件金属跟__________接触不纯金属或合金跟________________接触现象____电流产生______电流产生本质金属被____ 较活泼金属被________联系两者往往同时发生,________腐蚀更普遍析氢腐蚀吸氧腐蚀条件电极反应负极正极总反应式联系__________更普遍问题思考6.铁锈是怎样形成的?3.金属的防护(1)电化学防护①牺牲阴极的阳极保护法—________原理a.________:比被保护金属活泼的金属;b.________:被保护的金属设备。
②外加电流的阴极保护法—________原理a.________:被保护的金属设备;b.________:惰性金属。
(2)改变金属的内部结构,如制成合金、不锈钢等。
(3)加防护层,如在金属表面喷油漆、涂油脂、电镀、喷镀或表面钝化等方法。
一、电解池的电极及电极产物的判断1.如何分析电解池中的两极变化?2.如何判断电解池的电极产物及书写电极反应式和总反应式?典例导悟1将含有KCl、CuCl2、Na2SO4三种物质的水溶液用铂电极进行电解,且电解时间足够长。
有以下结论:①溶液中几乎没有Cl-②电解质溶液为无色③最终溶液显碱性④K+、Na+、SO2-4的浓度几乎没有变化正确的是(设全部气体从溶液中出)( )A.①②③B.仅③C.①④D.均正确听课记录:二、电解类型及有关计算类型电极反应特点实例电解对象电解质浓度pH电解质溶液复原电解水型阴:4H++4e-===2H2↑阳:4OH--4e-===2H2O+O2↑NaOHH2SO4Na2SO4电解电解质型电解质电离出的阴、阳离子分别在两极放电HClCuCl2放H2生碱型阴极:H2O放H2生碱阳极:电解质阴离子放电NaCl放O2生酸型阴极:电解质阳离子放电阳极:H2O放O2生酸CuSO4电解池中有关量的计算或判断主要包括以下方面:根据直流电源提供的电量求产物的量(析出固体的质量、产生气体的体积等)、溶液的pH、相对原子质量或某元素的化合价、化学式等。
解题依据是得失电子守恒。
典例导悟2(1)用惰性电极电解400 mL一定浓度的硫酸铜溶液(不考虑电解过程中溶液体积的变化),通电一段时间后,向所得的溶液中加入0.1 mol CuO后,使溶液恰好恢复到电解前的浓度和pH,电解过程中转移的电子为________ mol。
(2)如果向所得的溶液中加入0.1 mol Cu(OH)2后,使溶液恰好恢复到电解前的浓度和pH,电解过程中转移的电子为________ mol。
(3)如果向所得的溶液中加入0.1 mol Cu2(OH)2CO3后,使溶液恰好恢复到电解前的浓度和pH(不考虑CO2的溶解),电解过程中转移的电子为________ mol。
3.比较金属腐蚀快慢判断金属腐蚀快慢的规律(1)电解池原理引起的腐蚀>__________引起的腐蚀>________腐蚀>有防护措施的腐蚀。
(2)对同一种金属来说,腐蚀的快慢:强电解质溶液>弱电解质溶液>非电解质溶液。
(3)活泼性不同的两金属,活泼性差别越大,活泼性强的金属腐蚀越________。
(4)对同一种电解质溶液来说,电解质溶液浓度_______________________________,腐蚀越快。
典例导悟3下面各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是( ) A.④>②>①>③ B.②>①>③>④C.④>②>③>① D.③>②>④>①题组一电解原理及其应用1.(2013·上海,16)用电解法提取氯化铜废液中的铜,方案正确的是( )A.用铜片连接电源的正极,另一电极用铂片B.用碳棒连接电源的正极,另一电极用铜片C.用氢氧化钠溶液吸收阴极产物D.用带火星的木条检验阳极产物2.(2013·海南,9)利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述正确的是( )A.电解时以精铜作阳极B.电解时阴极发生还原反应C.粗铜连接电源负极,其电极反应是Cu-2e-===Cu2+D.电解后,电解槽底部会形成含少量Ag、Pt等金属的阳极泥3.(2013·全国理综Ⅱ,29)右图是一个用铂丝作电极,电解稀的MgSO4溶液的装置,电解液中加有中性红指示剂,此时溶液呈红色。
(指示剂的pH变色范围:6.8~8.0,酸色—红色,碱色—黄色) 回答下列问题:(1)下列关于电解过程中电极附近溶液颜色变化的叙述正确的是________(填编号);①A管溶液由红变黄② B管溶液由红变黄③A管溶液不变色④B管溶液不变色(2)写出A管中发生反应的反应式:_________________________________________;(3)写出B管中发生反应的反应式:_______________________________________;(4)检验a管中气体的方法是_______________________________________________________________________________________________________________________;(5)检验b管中气体的方法是_______________________________________________________________________________________________________________________;(6)电解一段时间后,切断电源,将电解液倒入烧杯内观察到的现象是____________。
题组二金属的电化学腐蚀和防护4.(2013·北京理综,8)结合下图判断,下列叙述正确的是( )A.Ⅰ和Ⅱ中正极均被保护B.Ⅰ和Ⅱ中负极反应均是Fe-2e-===Fe2+C.Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-===4OH-D.Ⅰ和Ⅱ中分别加入少量K3[Fe(CN)6]溶液,均有蓝色沉淀5.(2013·山东理综,15)以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是( )A.未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程B.因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系C.电镀时保持电流恒定,升高温度不改变电解反应速率D.镀锌层破损后即对铁制品失去保护作用6.(2013·浙江理综,10)将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如右图所示。
