压缩空气系统检测记录
压缩空气系统再确认方案
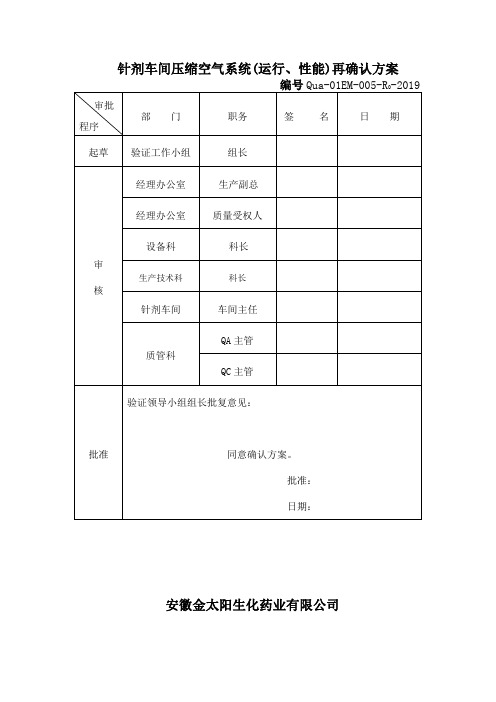
针剂车间压缩空气系统(运行、性能)再确认方案编号Qua-01EM-005-R0-2019审批程序部门职务签名日期起草验证工作小组组长审核经理办公室生产副总经理办公室质量受权人设备科科长生产技术科科长针剂车间车间主任质管科QA主管QC主管批准验证领导小组组长批复意见:同意确认方案。
批准:日期:安徽金太阳生化药业有限公司目录1.概述2.验证目的3.范围4.验证小组其责任5.风险评估6.确认内容6.1确认所需文件6.2确认用仪器仪表校验6.3运行确认6.4性能确认7.偏差处理情况8.验证结果数据汇总分析与评价9.验证周期10.批准1.概述公司小容量注射液车间压缩空气系统主要用于为洗瓶、灌封工序提供经除油、除水、除菌和净化处理的洁净工艺用气及为纯化水机组、蒸馏水机组、水浴式灭菌柜、纯蒸汽灭菌柜等设备上的气动元件提供气源。
公司压缩空气系统主要由空气压缩机、空气储罐、冷冻式干燥机、多级别过滤器及使用点终端过滤器组成,生产出的洁净压缩空气通过不透钢管道,输送至车间各用气点。
公司螺杆空气压缩机由上海德耐尔压缩机制造有限公司生产,型号为GA37P-7.5,排气量:7.3m ³/min ;最大工作压力:0.8Mpa ,压力露点为-40℃。
冷冻式压缩空气干燥机为德耐尔压缩机制造有限公司生产,型号为DAD-15HTF ,处理量为18m ³/min 。
微热再生吸附式压缩空气干燥机为德耐尔压缩机制造有限公司生产型号为DAD-15MXF 处理量18m ³/min 。
管路系统由安徽仁和轻工机械有限公司完成,管路的材质均采用304不锈钢。
洗瓶、灌封、起泡点试验用压缩空气均经过0.22μm 过滤器过滤。
系统流程图如下:洗瓶HF7主管路过滤器精度:1μm灌封 0.22μm 过滤0.22μm 过滤 水浴式灭菌柜纯蒸汽灭菌柜 纯化水制备系统空压机 7.3m 3/min 满载压力:0.8Mpa压缩空气罐 容积2m 3多效蒸馏水机 起泡点实验0.22μm 除菌过滤干燥机 18m 3/min工作压力:1.0冷干机 18m 3/min最大工作压力:1.3MPa合成车间2.验证目的由于本次验证的空气压缩机已经运行多年,运行平稳,经过了验证,未经历过影响压缩空气质量的大修,本次验证其目的:(1)通过运行确认证明设备能够正常运行且各项性能、参数指标符合设计要求。
压缩空气系统微生物检测记录
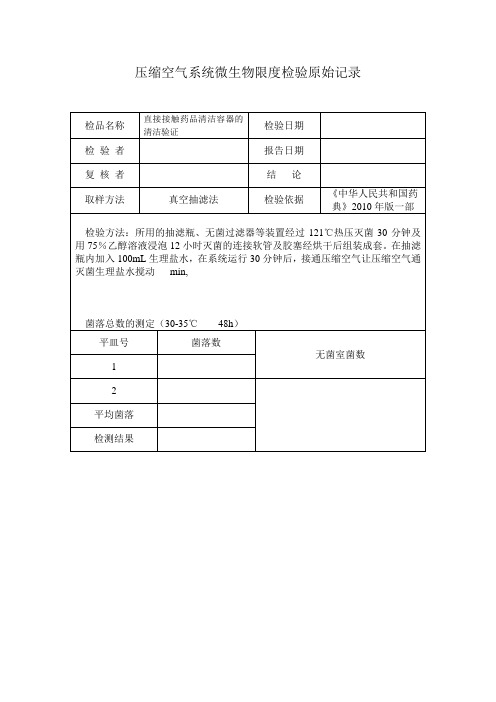
平皿号
菌落数
无菌室菌数
1
2
平均菌落
检测结果
压缩空气系统微生物限度检验原始记录
检品名称
直接接触药品清洁容器的清洁验证
检验日期
检验者
报告日期
复核者
结论
取样方法
真空抽滤法
检验ห้องสมุดไป่ตู้据
《中华人民共和国药典》2010年版一部
检验方法:所用的抽滤瓶、无菌过滤器等装置经过121℃热压灭菌30分钟及用75%乙醇溶液浸泡12小时灭菌的连接软管及胶塞经烘干后组装成套。在抽滤瓶内加入100mL生理盐水,在系统运行30分钟后,接通压缩空气让压缩空气通灭菌生理盐水搅动min,
(整理)液体二车间压缩空气系统验证方案[1](1)
](https://img.taocdn.com/s3/m/3bc64a225f0e7cd185253609.png)
广东康臣药业集团内蒙古康源药业有限公司液体二车间压缩空气系统验证文件验证实施时间验证报告时间再验证时间归档日期:档案责任人:CKP广东康臣药业集团内蒙古康源药业有限公司验证方案方案批准时间方案实施时间二零一三年1 目的:检查并确认液体制剂二车间压缩空气系统的设计、安装、运行、性能符合相关法规和GMP要求,可以满足液体二车间产品生产工艺要求。
通过对压缩空气系统的确认,制定合理并符合规范的再确认周期。
2 范围:液体二车间压缩空气系统的设计、安装、运行、性能确认。
3 责任:验证领导小组、验证项目小组。
4 内容:4.1 概述GA55型空气压缩机2013年11月购于无锡阿特拉斯公司,用于液体二车间作为生产工艺用压缩空气系统。
主要设备GA55型螺杆式压缩机。
辅助设备有YC-75AH/冷冻式干燥机、C-8/1.0储气罐、QE-150吸附式干燥机及C、T、A、H四级过滤器组成。
GA55型蜗杆式空气压缩机系统流程:将空气经过空气滤清器滤去尘埃、杂质,由减荷阀控制进入压缩机工作腔,随着蜗杆与两侧星轮片的合运动,空气被压缩,并在压缩过程开始时与喷入的润滑油混合,经压缩后的混合气体进入油气分离器,利用旋风分离法和上返分离法粗分离油气后,经精分离器滤芯进行精分离、通过最小压力阀排出的气体是比较纯净压缩空气;然后经过板翘式冷却器,将压缩空气冷却,空气中水蒸汽饱和析出,与压缩空气一起排出。
高温压缩空气送入C-8/1.0储气罐初步冷却除水后经C级过滤器(除油)进入YC-75AH/冷冻式干燥机冷(进一步处除水)、,再经过另外C级过滤器进入QE-150吸附式干燥机(进一步处除水)、经A级精密过滤器(除尘、进一步除油)、T过滤器、H级过滤器后最后送到用气点。
经过处理后的压缩空气能够达到常压露点≤-23℃;含油量≤0.01ppm;固体尘≤0.01µm。
4.1.1工艺流程图如下:4.2 验证项目小组成员及职责:4.3 验证依据4.3.1依据药品生产质量管理规范(2010年修订)、2010版药品GMP指南、中国药典2010 年版、药品生产验证指南(2003年版)。
压缩空气系统再验证报告

压缩空气系统再验证报告起草人审核人批准人起草日期审核日期批准日期颁发部门:质量管理部分发部门与数量:设备工程部.1,质量管理部.1,生产技术部.1,通化金恺威药业有限公司验证证书验证项目名称: 压缩空气系统再验证验证文件(方案) 编号: STP-SB-X-ZYB-03再验证周期: 1.设备大修或更换时2.一年定期再验证验证评价: 该系统经验证,确认系统的安装运行、性能符合要求;系统可靠,批准使用,文件可交付使用。
批准人:批准日期: 年月日再验证报告审批表起草人所在部门签字日期审核人所在部门签字日期质量管理部生产技术部设备工程部批准人所在部门签字日期验证委员会备注目录1.验证组织系统2.概述3.验证目的4.相关文件5.验证范围6.人员培训7.验证内容7.1压缩空气系统安装情况的稳定性检查7.2运行确认7.3性能确认8 特殊情况处理9再验证结果评定与结论10文件执行11文件归档12附表附表1:再验证方案变更申请表附表2:压缩空气系统机组上仪器仪表校验记录附表3:压缩空气系统空调机组安装检查记录附件4:压缩空气系统运行确认检测记录附表5:压缩空气系统油污检测记录附表6:压缩空气系统尘埃粒子数检测报告附表7:压缩空气系统微生物数检测记录附表8:漏项、偏差处理表附表9:压缩空气系统空气干燥检测记录1验证组织系统1.1验证委员会机构验证委员会工艺验证小组设备验证小组系统验证小组清洁验证小组1.1.1验证委员会成员及其职责职务姓名所在部门职务主任赵登峰——总经理委员丁年质量管理部部长委员高光波生产技术部部长委员范晓光设备工程部部长1.1.2验证委员会职责主任:负责验证方案、验证报告的批准;负责签发验证证书。
委员:审核验证方案、验证报告,制定验证计划。
1.2验证小组成员及其职责1.2.1系统验证小组成员小组成员姓名所在部门组长质量管理部王永欣组员生产技术部孟范静组员设备工程部郝世功组员化验室张静组员综合制剂车间张惠群1.2.2各成员职责组长——负责验证实施全过程的组织协调工作;组员——负责验证过程中的具体工作,并做好记录工作。
压缩空气系统验证报告

福建太平洋制药有限公司GMP 文件文件名称 压缩空气系统验证报告文件编码 STP(R)-YZ-01-001-00 页 码第1页,共10页起草 人 审 核 人 QA 审核起草日期 审核日期审核日期批 准 人 颁发部门 质量管理部 执行部门各职能部门批准日期颁发日期生效日期分发部门 验证小组、质量管理部1 概述本压缩空气系统由预处理系统连接管路至车间各用气点构成。
预处理系统位于制剂大楼二楼空调机房内,主要有LS16-75H 固定式螺杆空压机、储气罐、主管路过滤器、冷冻式压缩空气干燥机、压缩空气精密过滤器等设施,这些设施于2011年5月采购,2011年10月进行安装;连接管路及阀门全部采用304L 不锈钢材质,并且双面抛光。
系统为工艺生产气动设备及仪表的使用而提供无油无水的干燥空气,空压机排出的压缩空气,首先经过主管路过滤器,过滤粒径为1µm ,然后经过冷冻式压缩空气干燥机除去水份,最后分别再经过二台0.01µm 的压缩空气精密过滤器,保证了压缩空气质量满足GMP 生产要求。
验证小组根据验证方案中法规要求和风险分析结论,对压缩空气系统进行了设计确认(DQ )、安装确认(IQ )运行确认(OQ )、性能确认(PQ )。
现对验证过程中所取得的数据进行收集和整理报告如下: 2 验证范围检查并确认验证范围包括(1)压缩空气系统的设计确认(DQ ) (2)压缩空气系统的安装确认(IQ ) (3)压缩空气系统的运行确认(OQ ) (4)压缩空气系统的性能确认(PQ )3 验证目的3.1 检查并确认该系统所有设备所用材质、设计、制造及制造厂家符合GMP 和本公司生产工艺的要求。
3.2 检查该系统的文件资料齐全且符合GMP 要求;检查并确认设备的安装符合生产要求,公用工程系统配套齐全且符合设计要求;确认该设备的各种仪器、仪表经过校正且合格。
3.3 调查设备的运行性能,确认该设备在空载运行时,能稳定运行;检查标准操作规程是否符合设备的实际操作。
洁净压缩空气系统再验证方案

洁净压缩空气系统再验证方案VP-XT-18005起草人:日期:审核人:日期:批准人:日期:目录1概述2验证人员及职责3计划验证日期4资料档案确认5验证内容5.1安装确认5.2运行确认5.3性能确认6再验证周期7验证总结及结果批准7.1验证总结7.2验证结果审查7.3验证结果批准1、概述洁净压缩空气系统是按照GMP要求设计安装的压缩空气气源。
采用空气压缩机将空气压缩,经过冷冻式干燥机去除水分、通过三级空气过滤器将压缩空气进行净化,并在末端安装除菌过滤器,使压缩空气的洁净度符合工艺用气要求。
1.1系统组成:本系统由岩田SLPJ110B空气压缩机、1m3不锈钢304贮气罐、过滤器、冷冻干燥机和304不锈钢管道输送系统组成。
1.2本系统具有以下几个特征1.2.1整套系统设备配置先进,所用材质、制造、安装均符合设计要求。
1.2.2分配管路采用304不锈钢管及304不锈钢球阀避免了净化后的压缩空气产生二次污染。
1.2.3空气压缩机的操作为自动方式,可保证系统稳定地运行。
1.2.4后处理系统为冷冻干燥和三级过滤,可保证压缩空气洁净度达到万级要求。
1.3主要技术参数1.3.1压缩空气产量 1.2m3/min/0.6MPa。
1.3.2三级过滤孔径分别为3μm、1μm、0.01μm。
1.3.3贮气罐容量为1m3。
1.3.4末端过滤为除菌过滤器。
1.3系统工艺流程姓名职务职责验证组长负责本公司验证工作,直接协调并指导全厂性的验证活动,批准验证方案与验证报告,发放验证证书。
质量管理部负责人审核验证实施过程,总结评价验证结果。
设备部负责人审核验证方案及验证报告,组织实施验证方案,总结验证结果设备运行员负责相关验证方案起草,具体实施验证过程,验证过程的记录等工作。
QA 负责制订验证计划,起草或协调起草验证方案,监督验证实施过程,每项验证结果评价复核,环境监测工作,验证数据的收集、整理,报告和验证文件的管理。
3验证进度本次验证时限为年月日至年月日。
压缩空气验证报告

题目: 压缩空气系统验证报告文件编号:PQ-xxx-02发行版次:A制作日期:xxxxxxxxx共15 頁第1 頁签批签批顺序制做审核批准签批职务工程师主管/经理厂务经理签名/日期会签会签部门生产部品质部文控中心会签职务主管/经理主管/经理管理者代表签名/日期修訂履歷版修訂詳情修訂人修訂日期本A初版分發清單持有部門/持有部門/人仕持有部門/人仕持有部門/人仕人仕目录1.压缩空气系统验证报告2.验证记录材料2.1纯化水系统的基本情况2.2验证人员2.3时间进度表2.4验证目的2.5验证内容2.5.1安装确认2.5.1.1文件资料的确认2.5.1.2公用介质的安装确认2.5.1.3压缩气体设备的安装确认2.5.1.4管道分配系统的安装确认2.5.1.5安装确认小结2.5.2运行确认2.5.2.1检查并保证设备可运行2.5.2.2正常运行确认后小结2.5.3性能确认2.5.3.1 性能确认的内容2.5.3.2 性能验证的周期2.5.3.3 监测方法2.5.3.3.1系统压力验证2.5.3.3.2 压力露点2.5.3.3.3 油分2.5.3.3.4 尘埃粒子2.5.3.5 压缩空气系统检测记录2.5.3.6 性能确认结论:2.6 验证结论1.压缩空气系统验证报告压缩空气系统验证报告一、验证项目名称:压缩空气系统二、各验证项目结论:1. 安装确认:验证系统的安装是否符合设备安装的要求.⏹可接受标准:设计施工文件资料齐全,系统性能设计符合要求;设备安装符合设计规范;管道密封符合要求.⏹结果:查阅设备档案设计施工文件齐全,系统性能设计符合要求;设备安装符合设计规范;管道密封符合要求.(详见验证记录材料2.5.1)安装确认结论: 压缩空气系统的安装符合要求.2. 运行确认:验证压缩空气系统符合生产工艺要求.⏹可接受标准:各操作参数符合要求.⏹验证结果:系统参数测试符合要求(详见验证记录材料2.5.2)。
⏹运行确认结论:压缩空气系统达到设计要求.3. 性能确认:验证压缩空气系统能稳定地提供符合要求的压缩空气.⏹可接受标准:用本系统在规定周期内能够正常、稳定地运行,保证压缩空气各项指标持续达到设计标准的要求.⏹验证结果:所有检测项目均符合企业压缩空气质量标准的要求.(详见验证记录材料2.5.3)⏹性能确认结论:压缩空气系统能够正常、稳定地运行,输出符合标准要求的压缩空气.三、评价与建议:1、评价:通过对压缩空气系统进行安装确认、运行确认性能确认、测试结果表明:压缩空气系统能在规定周期内稳定的提供符合要求的纯化水,系统可用于生产.2、建议:通过对空气净化系统进行验证,对该系统的维护保养、清洁和日常检测作如下建议:2.1日常保养2.1.1每天打掃機房環境衛生,清潔機身.2.1.2每天檢查電源配電線路,保護開關有無松動﹑發熱等問題.2.1.3每天排水三次,具體時間是:上午10:00、下午16:00、晚上21:00.2.1.4每天檢查空壓系統有無漏氣,漏油,漏水等現象.2.2 定期保養.2.2.1空壓系統運行10天,清洗P級、Q級空氣過濾器一次.2.2.2空壓系統運行二個月,更換空壓機機油一次.2.2.3空壓系統運行一年更換空壓機傳動皮帶一次.2.2.4運行一年檢查空壓系統電機軸承(加潤滑油或更換)及測試线圈繞组間的阻抗.3、再验证:3.1 压缩空气系统改建后(如关键设备的改动)必须作验证。
压缩空气系统验证方案

目录1.0 方案审核及授权2.0 人员3.0 范围及概述4.0 职责5.0 方案/计划描述6.0 验证目的7.0验证程序8.0 验证实施 8.1安装确认 8.2运行确认 8.3性能确认9.0 验证原始记录 10.0 再验证周期 附表1偏差表格 1.0方案授权2.0人员所有负责执行此方案的人员必须按如下签字表格中进行签字。
签字内容包括:姓名、职务、日期等。
姓名 职务 签字 日期 李学成质量部经理授 权起草人 审核人 批准人 生效日期 姓名: 职务: 签字: 日期: 姓名 职务: 签字: 日期:姓名: 职务: 签字: 日期:景晓卫车间主任叶素芳QA主管工艺员QC人员QA人员马月芳操作工孙月平操作工3.0范围。
3.1此方案适用于小容量注射剂车间压缩空气系统的验证。
按照GMP要求,确定验证系统的验证方法及文件编号,保证被验证系统能以正确的方法验证并使系统运行满足使用要求。
压缩空气系统是按照GMP要求设计安装的压缩空气气源。
使用固定式螺杆压缩机将空气压缩,使用压缩空气冷冻式干燥机、过滤器将压缩空气进行净化,使之达到无油、无水、无菌,通过不锈钢管道,输送至车间各用气点。
本系统由空气压缩机、压缩空气过滤器、压缩空气高效除油器、储气罐、吸附干燥机和不锈钢管道系统组成。
3.2 有足够的文件系统证明压缩空气系统能达到检测要求。
3.3 所有的必须适用性文件将表明验证在这个方案中将被确认和证明其有效性。
3.4 在方案的执行过程中遇到任何短缺的数据或异常情况应被作为偏差记录下来并审核确认。
异常情况将被调查并终止引起该情况的行动。
在执行的同时所有数据应及时记录,该方案中应包括最终的总结。
3.5验证时间:年月日---- 年月日3.6制备:空气经空气压缩机制得,再经四级过滤、终端除菌过滤。
3.6.1工艺流程空气空气压缩机储灌C级压缩空气过滤器吸附干燥机储气罐压缩空气高效除油器3.6.2 设备生产厂家: 柳州富达机械有限公司。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
编号:QJ/CX股……
检 测 项 目
悬 浮 粒 子
微生物
油类检测
水分检测
检测人
检测时间
检查方法
尘埃粒子检测仪。 每季度检测一次
用微生物计数法测定。
每季度检测一次
将油检测盒推入适配器; 将适配器按照箭头方向插入检测通道—适配器的开口端朝向压缩空气检测仪;打开压缩空气阀门; 进行测量:测量持续时间为5分钟;关闭压缩空气气源;移走油检测盒的保护膜读取油的浓度。 每月检测一次
检
测
点
年月日
年月日
年月日
年月日
年月日
年日
年月日
将检测管上箭头所指的一端折断,背离箭头的一端只刻划痕;打开压缩空气气源;将箭头所指一端插入“H2O”检测通道;切掉背离箭头的一端,立即插入检测通道;开始计时,测量2.5min。 每月检测一次
判断标准
0.5um:≤3500个/m³5um: 0个/m³
<1cfu/ m³
≤0.1mg/m3
露点不大于-22℃
