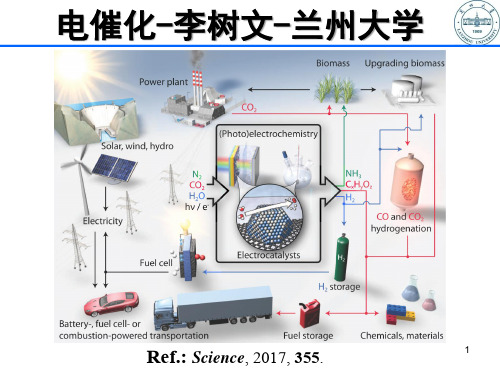
第六章 析氢反应机理教程文件
电催化析氢-氮还原
参考书
3
电化学基础知识
化学能 原电池G<0 电解池G>0
电能
负载
–
+
电极
V A
Zn
多 孔 隔 ZnSO4 膜
Cu
CuSO4
G = – 212 kJmol-1
电解质 溶液
H2 ←
Fe
Ni
阴 NaOH 阳
→O2
石棉隔膜
H2O(l)H2(g)+½O2(g) G =237.2 kJmol-1
13
衡量析氢阴极材料优劣的特征参数
2.塔菲尔斜率(b) 塔菲尔斜率是指在较高的过电位区间内,材料的过电势 与电流密度对数值之间线性关系的斜率值。塔菲尔斜率 值越小,证明材料在一个低的过电位下就可以达到一个 大的电流密度值,更有利于氢气的析出。
14
衡量析氢阴极材料优劣的特征参数
3. 阴极电流密度为10 mA cm-2时的过电势(η10) η10是不同阴极材料性能比较的一个重要参数,是指析氢 过程中电流密度达到10 mA cm-2时所需要的过电位值。 η10越小,材料的析氢性能越好。
25
HER 研究实例:
Ref.: J. Mater. Chem. A, 2015, 3 , 21772-21778
26
HER 研究实例:
Ref.: J. Mater. Chem. A, 2016, 4 , 18499-18508
27
HER 研究实例:
Ref.: J. Mater. Chem. A, 2016, 4 , 18499-18508
电催化氮还原-研究进展
43
Ref: Angew. Chem. Int. Ed., 2018, 57, 6073-6076
第六章 析氢反应机理

三、氢析出反应的可能反应机理
假设:
1.
H原子具有高度的活性,可以吸附态存在于电极 表面;
2. H2价键饱和,无活性,常温下在电极表面不吸附; 3. H3O+不可能在电极表面同一点同时放极上发生氧化或还原反 应,当这种气体反应成为电极上的主反应或成为不可避免 的副反应时,就称该电极过程为气体电极过程.
在各种实际电化学体系中,最常见的气体电极过程是氢电 极过程和氧电极过程.
6.1 氢电极反应的电催化
氢电极反应包括:氢气的析出和氧化。
(2)
pH 7, H 2O e MH OH I K FK [ H 2O ]e
0 K
F
RT
( 1 )
2 RT ln I K 1 F RT 0 e e ln[ H ] F 2 RT RT H 常数 ln I K ln[ H ] 1 F F H H 2.3RT pH lg[ H ] F 59 mV I , 1 I , 1
F
阴离子影响;
有机分子影响; 阳离子影响。
(2)pH值对 H 的影响
在酸、碱溶液中, 1 对 H 影响正好相反:
当电流密度一定时, I 10 4 A / cm2 , H 与pH值有影响 : (1) pH 7, H ( H 3 O) e MH
H 常数
在氢气氧化反应的机理中,除包含有上述两步骤外,当然还包括H2、 H+(或OH-)等物种的扩散过程。
电催化析氢-氮还原

(R8)
N2 + e- ↔ N2- (aq), E0 = -4.16 V vs.NHE or E0 = -3.37 V vs. RHE [pH=14] (R9)
电催化氮还原-装置
34
Ref: Adv. Energy Mater., 2018, 8, 1800369
电催化氮还原-检测方法
35
Ref: Adv. Energy Mater., 2018, 8, 1800369
电催化氮还原-研究进展
Ref: ACS Catal., 2018, 8, 7820-7827 Ref: Adv. Energy Mater., 2018, 8, 1800369
Ref : Catal. Today, 2017, 286. 57-68
Ref: Energy Environ. Sci., 2018, 11, 45-56
4OH 2H2O+O2 +4e
7
HER:氢析出反应
标准状态下(T=298 K, PH2=1 atm),根据能斯特方程, 析氢反应的能斯特电位与标准氢电位之间的关系可以用
以下方程来表示:
EHER
E0 (H2/H )
RT F
ln(a H
/
PH21/2 )
= 0.059 ( pH ) V vs. NHE=0 V vs. RHE 8
31
电催化氮还原-机理
交替结合途径 远端结合途径
32
Ref : Catal. Today, 2017, 286. 57-68
电催化氮还原-机理
不同NRR产物所需的平衡电势:
N2 + 6H+ + 6e− ↔ 2NH3 (g), E0= +0.55 V vs. NHE [pH=0]
第六节 氢解反应

Raney Ni/H2
N
(75%)
(2) 化学还原法 采用采用化学还原法来还原氢解二硫化合物是制备 硫醇最常用的方法。常用锌–乙酸、金属复氢化物等还 原剂。如化合物(57)在锌–乙酸作用下,氢解还原得 硫巯基苯甲酸(58)。
S
S SH Zn/HOAc heat (84%) COOH (58)
OHC
H3C
Pd C
, H2
O
MeO
O
MeO
(92%)
②活泼金属还原 活泼金属(如锌粉、合金等)在一定反应条件下,也 可发生脱卤氢解。例如
COOH
COOH
Ni-Al/NaOH 100% Cl
• ③金金属复氢化物还原 • 氢化铝锂、硼氢化钠等金属复氢化物,在非质子溶剂 中,可用于卤代烃的氢解。其中,氢化铝具有更强的还 原能力,可用于C–F键的氢解。例如:
R
X + Pd
°
PdX H2
H R PdX H
R H
+ HX + Pd°
化学还原法的脱卤氢解反应机理参见本章第一节相 关内容。
• 3 影响因素 卤代烃的氢解活性由两方面因素决定,即卤 原子的活性和卤原子在分子中所处的位置。 (1)原子的活性 从取代的卤原子来看,活性顺序为碘>溴> 氯>>氟。 (2)卤原子在分子中所处的位置 酰卤、α 位有吸电子的基的卤原子、苄位或烯位 α 卤原子和芳环上电子云密度较小未位置的卤原子 易发生氢解。因此,酮羰基、氰基、硝基、羧基 和磺酸基等官能团的α位卤原子,均易发生氢解。 α
SH BF3-Et2O SH 0℃ O (59) S
S (60)
Raney Ni/EtOH reflux
析氢反应机理 文献

析氢反应机理文献析氢反应是指将水分子分解为氢气和氧气的化学反应。
在常规的化学反应中,通常需要加热或通过电流使反应发生,但析氢反应是一种光催化反应,需要辅助光源来提供能量。
光解水反应被广泛研究,因为它具有巨大的潜力,可以用作清洁能源的重要来源。
“绿色能源”一词已经成为了当今社会的热门话题,而析氢反应正是绿色能源的一个重要组成部分。
析氢反应的机理复杂而多样。
一种常见的机理是光解水反应中的光催化过程。
光子在光催化剂上受激发,产生激发态的电子。
这些激发态的电子能够在电子传递的过程中从价带跃迁到导带。
光催化剂上的激发态电子能够通过连续的光电还原和氧化反应分别从还原剂和氧化剂中捕获电子,从而实现水分子的分解。
一种常用的光催化剂是二氧化钛(TiO2)。
TiO2是一种半导体材料,具有良好的光催化性能。
光解水反应中,TiO2会吸收光子并激发电子。
激发态电子会传递给水分子,将其分解为氢气和氧气。
然而,TiO2的光催化效率有限,需要进一步的改进和优化。
提高光催化剂的效率是当前研究的一个重要方向。
研究人员通过改变光催化剂的组成、形貌和结构等方法来提高其光催化性能。
一种常用的方法是控制光催化剂的晶面结构。
研究发现,改变催化剂晶面的表面形貌可以显著影响光催化剂的活性。
此外,改变催化剂的组成,如引入一些纳米材料作为催化剂的助剂,也可以提高光催化剂的效率。
除了研究光催化剂的优化方法,研究人员还开展了许多其他方面的研究。
例如,一些研究表明,改变反应条件,如光照强度、反应温度和氧气含量等,也可以显著影响析氢反应的效率。
此外,研究人员还利用计算化学和理论模拟等方法来解释和预测析氢反应的机理。
总之,析氢反应是一种重要的清洁能源制备方法。
通过研究光催化剂的优化、反应条件的调节以及理论模拟的应用,我们可以更好地理解析氢反应的机理,并提高其效率。
这将有助于推动绿色能源的开发和利用,为人类创造更加可持续和环保的未来。
电解水析氢her反应机理-概述说明以及解释

电解水析氢her反应机理-概述说明以及解释1.引言1.1 概述在概述部分,你可以简要介绍一下电解水析氢反应机理的背景和意义。
以下是可能的一种写作方式:概述:电解水析氢反应机理是一种重要的化学过程,通过电化学的方法将水分解为氢气和氧气。
这一过程被广泛应用于能源转化和储存领域,具有重要的科学、工程和环境意义。
在过去的几十年里,人们一直致力于开发和改进电解水析氢的技术,以满足日益增长的能源需求和环境保护的要求。
通过深入研究电解水析氢反应机理,可以帮助我们理解反应过程中的关键步骤和物质转化规律,为合理设计和优化电解水析氢技术提供指导。
此外,该研究还有利于发现新的催化剂和改进电解水析氢反应的效率和稳定性。
本文旨在探讨电解水析氢反应机理的基本原理、氢气的产生机理以及总结电解水析氢反应机理的研究进展。
同时,对未来的研究方向进行展望,以期提供对电解水析氢反应机理深入理解和技术发展的参考。
文章结构:本文主要分为引言、正文和结论三大部分,每个部分分别包含若干小节,具体如下:1. 引言1.1 概述在这一小节中,将介绍电解水析氢反应机理的研究背景和意义。
提出了水的电解是绿色能源发展中重要的一环,水的分解为氢气和氧气不仅可以作为可再生能源,还可以用于氢能源的存储和传递等方面,因此电解水析氢反应机理的研究具有重要的科学意义和应用价值。
1.2 文章结构这一小节将介绍本文的整体结构和内容安排。
首先会对电解水的基本原理进行阐述,包括电解水的定义和过程。
然后会详细探讨氢气的产生机理,涵盖了电解水析氢反应的化学反应机理以及催化剂在反应过程中的作用等方面。
最后,结论部分将对电解水析氢反应机理进行总结,并展望未来的研究方向。
1.3 目的在这一小节中,将明确本文的研究目的。
本文旨在系统地介绍电解水析氢反应机理的基本原理和关键环节,为深入理解该反应的机制提供一定的理论基础,并对未来的研究方向进行展望,促进相关领域的科学发展和应用推广。
2. 正文2.1 电解水的基本原理这一小节将详细介绍电解水的基本原理,包括电解水的定义、电解水的化学反应方程以及在电解过程中所涉及的电极材料和电解质等。
不同ph值环境下的析氢反应过程

英文回答:The hydrolysis reaction is the reaction of a metal orpound to an acid solution, resulting in a chemical process that produces hydrogen gas. Depending on the environment pH, the hydrogen reaction process varies. In an acidic environment, metal orpounds and acid reactions quickly produce large amounts of hydrogen, and the reaction of zinc powder with scals containing hydrochloric acid quickly releases large quantities of hydrogen and is apanied by violent bubbles. In a neutral or alkaline environment, the hydrolysis response process is inhibited to a certain extent, the reaction speed is slowed and the amount of hydrogen produced is relatively small. This illustrates the characteristics of the hydrogen analysis response under different environmental conditions and provides a reference for the formulation of appropriate policies and measures.析氢反应是金属或化合物与酸性溶液发生反应,导致产生氢气的化学过程。
析氢反应方程式

析氢反应方程式二氧化硫转化为三氧化硫的方程式: 2HS+O2=2CH2S+H2O=2CH2O。
2SO2=2H2O+O2↑,化学方程式为: 2S+O2=2CH2S+H2O。
这是一个非常简单的复分解反应。
【推断题】反应物中如果既有可燃性气体又有不可燃性气体时,只发生可燃性气体部分的分解反应(如氢气和一氧化碳反应)。
【证明题】加热某固体混合物发现有白色沉淀产生,而将其灼烧后得到粉末,则该混合物中有Na、 Al、 Si等活泼金属存在,若将粉末放在水中得到的白色沉淀与可燃性气体反应,不能产生Na2O3沉淀。
【简答题】加热硝酸铵和碳酸钙的混合物至全部分解,生成氧气、氮气、水蒸气、二氧化碳。
一个金属原子失去最外层电子变成离子,称为阳离子。
例如,钠原子失去最外层3个电子,就变成钠离子,也就是钠原子上带1个单位正电荷;钠离子上带1个单位负电荷。
一个阴离子得到最外层电子变成离子,称为阴离子,也就是阴原子上带1个单位负电荷;阴离子上带1个单位正电荷。
由于原子的最外层电子数相同,所以阳离子的电子总数必然等于阴离子的电子总数,即阴阳离子的总电荷量一定相等。
在非金属元素周期表中,金属元素的正价总数为+1,非金属元素的正价总数为-1。
根据原子守恒原理,得出金属元素的原子量总数等于非金属元素的原子量总数之和。
所以金属元素的原子量大于非金属元素的原子量,因此金属元素原子量总数小于非金属元素原子量总数。
一般规律:原子量越大的金属元素,其原子序数越小。
非金属元素的原子序数等于金属元素的原子序数。
根据元素周期律,得出金属元素原子序数的最小值为H,非金属元素原子序数的最小值为He。
金属元素原子序数的范围为1≤He≤K, He≤P,最小值为8;非金属元素原子序数的范围为1≤P≤n, n≤F,最小值为16。
一般规律:金属元素的质量比等于非金属元素的质量比的平方根。
根据密度公式:ρN/ρm=n/M,得出金属元素的密度总是比非金属元素的密度小。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
三、氢析出反应的可能反应机理
假设: 1. H原子具有高度的活性,可以吸附态存在于电极
表面; 2. H2价键饱和,无活性,常温下在电极表面不吸附; 3. H3O+不可能在电极表面同一点同时放电,初始产
第六章 析氢反应机理 与电化学催化
电极材料是实现电催化过程极为重要的支配因 素。
电化学反应一般是在“电极/溶液”界面的电极 表面上发生的,因此,电极表面的性能如何则 是更为重要的因素。
由于受电极材料种类的限制,如何改善现有电 极材料的表面性能,赋予电极所期望的电催化 性能,便成了电化学工作者研究的一个永恒的 课题。
按照a值的大小,可将常用电极材料大致分为三类
1.高超电势金属(a≈1.0—1.5V),主要有Pb,Cd,Hg,T1, Zn,Ga,Bi,Sn等;
2.中超电势金属(a≈0.5~0.7V),其中最主要的是Fe,Co, Ni,Cu,W,Au等;
3.低超电势金属(a≈0.1—0.3V),其中最重要的是Pt,Pd, Ru等铂族金属.
(Ⅰ) (Ⅱ) (Ⅲ) (Ⅳ)
(Ⅱ) 、(Ⅳ) 是迟缓放电理论; (Ⅰ)是复合脱附理论; (Ⅲ)是电化学脱附理论。
四、三种理论的动力学方程
1.迟缓放电理论 假若发生阴极极化,
IH ik ia
如
IHi0 ex R n p T F H ex R p nT F H
IH i0
IH i0expRnTFH
a的分类方法虽然简单, 但对电化学实践中选择 电极材料还是有一定的参考价值
高过电位金属: (1)电解工业中用作阴极材料; (2)化学电源:负极;
低过电位金属: (1)制备平衡氢电极; (2)电解水工业中制造阴极; (3)氢-氧燃料电池中作负极;
经验常数 b
在大多数金属的纯净表面上,公式中的经验 常数b具有比较接近的数值(≈100—140mV), 表示表面电场对氢析出反应的活化效应大致相 同.
2.在低电流密度下 测H 量时,必须考虑到由于改 变电极电势而引起的双电层充电电流。
3.极化曲线测量的速度和方向。考虑建立稳定 的表面状态所需时间与测量速度相对大小之 间的关系。
二、基本实验事实
在许多电极上氢的析出反应都伴随着较大的超 电势 。
1905年Tafel首先发现,许多金属上的氢析出超 电势均服从经验公式:
ablgI
此式称为Tafel公式.
经验常数a的物理意义
是当电流密度为lA·cm-2时超电势的数值. 它与电极材料、电极表面状态、溶液组成以及实验温度
有关。 氢超电势的大小基本上决定于a的值,因此a的值越小,
氢超电势也愈小,其可逆程度越好,电极材料对氢的催 化活性也愈高。 在用不同材料制成的电极上a的数值可以很不相同,表 示不同电极表面对氢析出过程有着很不相同的“催化能 力”.
气体电极过程: 在电化学反应过程中,气体在电极上发生氧化或还原反应, 当这种气体反应成为电极上的主反应或成为不可避免的副 反应时,就称该电极过程为气体电极过程.
在各种实际电化学体系中,最常见的气体电极过程是氢电 极过程和氧电极过程.
6.1 氢电极反应的电催化
氢电极反应包括:氢气的析出和氧化。 氢气的析出反应:氯碱工业上的阴极反应,金
H2 iknFKcOexpR nT F平 0
IH2FKcH MH exR pFTH
i0
expRnTFk
2FKcHM 0 H ex 1p R F TH
H常数 12 .3RFTlgIH MHM 0 HexpRFTH
H 测量的有关问题
实验数据分散,不同实验室数据不一,重现性差,电极表面状态的变 化与界面污染是造成这种现象的原因。
测量要注意的问题:
H
1. 溶液和电极的净化
⑴ 高纯净的药品; ⑵高纯净的水;
⑶ 高纯净的金属材料制成电极;
⑷ 全玻璃封闭式电池;
⑸ 研究溶液实验前要经过长时间预电解净化,通过高纯H2或惰性气体 以除去溶解在溶液中的O2.
0 MH
而通过电流时若假定电化学步骤的平衡基本上未受到破
坏
He RFTlnM M 0 H H
MHM 0 HexpRFTH
IH2FM 2 k H 2F(k M 0 )H 2ex R 2F pT H
H常数 2.23F RTlgIH
3.电化学脱附机理
H+(或H2O)+MH十e
属沉积反应和有机物还原反应中是一个竞争反 应,并且也是金属腐蚀中的反应之一。 氢气的氧化反应,受燃料电池研究的推动,对 其电催化过程的研究具有十分重要的意义。
一、氢电极过程的重要性
1. 标准氢电极的电极电位是公认的电极电位的基准,以它
为基准的电位系列称为氢标电位。在电化学研究和电化 学测试中应用极为普遍。 2. H电极反应,是一类去极化剂。 金属在溶液中发生电化学腐蚀的根本原因是溶液中含有 能使该种金属氧化的物质,即腐蚀的去极化剂。去极化 剂还原的阴极过程与金属氧化的阳极过程共同组成整个 腐蚀过程。 3. 研究这一过程所采用的研究方法,以及所获得的电极过 程的一般规律对其它过程均有指导作用。
H2 .3 n RF lToi0g 2 .3 n RF lToIH g
2.复合脱附机理
如果复合脱附步骤为析氢电极反应的控制性步骤,设平
衡电位下
(0 覆盖度),有电流通过时
MH
,MH
MHM 0 H
如果H吸很少时,可以用 MH代替 aM。H 不通过电流时的电极电势可写成:
e
e0
RTlnaH
F
物应是H原子,而不是H2.
析氢反应历程中可能出现的步骤
1.电化学步骤 H+(或H2O)+e-→MH
2.复合脱附步骤 MH+MH→H2,
3.电化学脱附步骤 H+(或H2O)+MH十e
[A] [B] H2 [C]
氢析出过程的反应机理 可以有下面四种基本方案:
电化学步骤 (快)+复合脱附 (慢) 电化学步骤 (慢)+复合脱附 (快) 电化学步骤 (快)+电化学脱附 (慢) 电化学步骤 (慢)+电化学脱附 (快)
