2018年秋九年级科学上册第1章物质及其变化第6节几种重要的盐第4课时实验:碱和盐的性质课件(新版)浙教版
科学九年级上册

第一章物质及其变化第1节物质的变化1、化学变化的实质:构成物质分子的原子重新进行组合形成了新的分子。
物理变化中肯定没有化学变化;化学变化中常常伴随着物理变化。
(蜡烛的燃烧是化学变化,熔化是物理变化)区别:是否有新物质生成。
物理性质:颜色、状态、熔点、沸点、硬度、密度、延展性、导电性、导热性、气味等。
化学性质:酸性、碱性、可燃性(H2、CO2、CH4、酒精、汽油)、助燃性(O2)、氧化性(O2、CuO等)、还原性(C、H2、CO)等2、探索物质变化的方法①物体的形状会发生变化;(物理变化)②物质混合时会产生沉淀;(化学变化)③物质颜色的变化;(化学变化)④物质变化时有气体产生;(物理变化或化学变化都有可能)⑤物质在一定条件下状态发生变化。
(物理变化)3、CuSO4·H2O=CuSO4+H2O CuSO4+H2O=CuSO4·5H2O(蓝色晶体) (白色粉末)白色粉末遇水变蓝,此变化用以检验某些反应生成物中是否有水生成,检验蛋白质的存在,重金属铜的中毒,农药波尔多液【Ca(OH)2、CuSO4】杀虫剂。
4、硫氰化钾检验三价铁离子Fe3+5、电离:物质溶解于水或受热熔化而形成自由移动离子的过程。
第2节物质的酸碱性1、生活中常见的酸:食醋里含有醋酸,人的胃液里含有盐酸,水果中含有柠檬酸。
2、酸:在水中电离时,生成的阳离子全部都是氢离子的化合物。
3、酸碱性(大约的)酸碱酸碱指示剂:紫色石磊试液红色蓝色无色酚酞试液不变色红色检测范围PH:8~10酸碱度(确定值):PH试纸(比色卡)或PH计步骤:用洁净的玻璃棒,蘸取少许待测液,滴在试纸上,稍候与标准比色卡对照4、盐酸能使鸡蛋壳变软:2HCl+CaCO3=CaCl2+H2O+CO2↑5、盐酸硫酸与铁锈反应:6HCl+Fe2O3=2FeCl3+3H2O Fe+2HCl=2FeCl2+H2↑H2SO4+Fe2O3=2FeSO4+H2O Zn+H2SO4=ZnSO4+H2↑6、盐酸硫酸与氧化铜反应:2HCl+CuO=CuCl2+H2O(黑色)H2SO4+CuO=CuSO4+H2O7、蓝色絮状沉淀溶解:Cu(OH)2+H2SO4=CuSO4+2H2O生成白色沉淀:BaCl2+H2SO4=BaSO4↓+2HCl第3节常见的酸1、酸的共性:①酸能使指示剂变色;②酸能与碱反应生成盐和水;③酸能与某些金属氧化物反应生成盐和水;④酸能与某些金属反应生成盐和氢气;⑤酸能与某些盐反应生成新的盐和新的酸。
九上第一章酸碱盐知识点完整整理
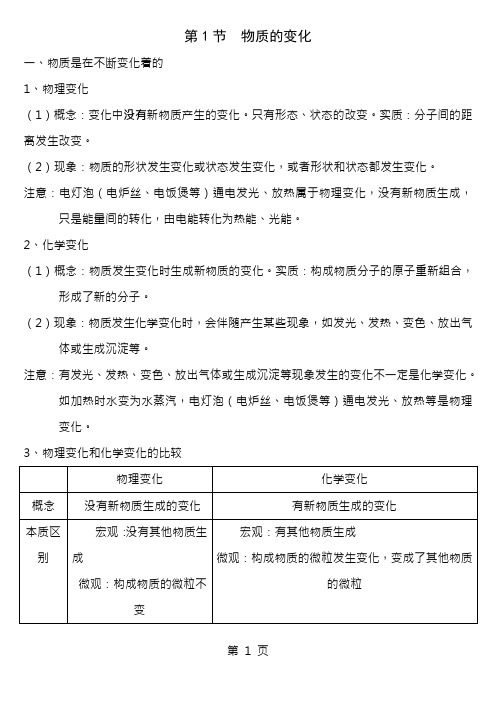
第1节物质的变化一、物质是在不断变化着的1、物理变化(1)概念:变化中没有新物质产生的变化。
只有形态、状态的改变。
实质:分子间的距离发生改变。
(2)现象:物质的形状发生变化或状态发生变化,或者形状和状态都发生变化。
注意:电灯泡(电炉丝、电饭煲等)通电发光、放热属于物理变化,没有新物质生成,只是能量间的转化,由电能转化为热能、光能。
2、化学变化(1)概念:物质发生变化时生成新物质的变化。
实质:构成物质分子的原子重新组合,形成了新的分子。
(2)现象:物质发生化学变化时,会伴随产生某些现象,如发光、发热、变色、放出气体或生成沉淀等。
注意:有发光、发热、变色、放出气体或生成沉淀等现象发生的变化不一定是化学变化。
如加热时水变为水蒸汽,电灯泡(电炉丝、电饭煲等)通电发光、放热等是物理变化。
3、物理变化和化学变化的比较二、探究物质变化的方法1、观察化学反应通常要注意:(1)反应前的现象(2)反应中的现象(3)反应后的现象(1)通过观察和实验等来寻找物质变化的证据。
物质变化的证据:生成沉淀、颜色改变、气体产生、温度变化、性质变化、发光发热、PH变化、状态变化等。
(2)演示实验:硫酸铜晶体的变化①取1块硫酸铜晶体,观察形状、颜色。
蓝色固体②向盛有硫酸铜晶体的试管中加水,观察晶体能否溶解,水溶液颜色有什么变化。
能溶解,形成蓝色溶液。
③在硫酸铜溶液中滴加氢氧化钠溶液,观察溶液有什么变化。
(写出化学方程式)形成蓝色絮状沉淀2NaOH+CuSO4=Na2SO4 +Cu(OH)2↓④另取1块硫酸铜晶体,将它放在大试管中加热,观察硫酸铜晶体有什么变化。
(写出化学方程式)蓝色固体逐渐变白CuSO4·5H2O = CuSO4 + 5H2O⑤实验完成后,熄灭酒精灯,冷却大试管,再在冷却后的硫酸铜白色粉末中逐滴加水,观察有什么现象产生(写出化学方程式)白色固体逐渐变蓝CuSO4 + 5H2O === CuSO4·5H2O根据现象,进行分析:有颜色变化的实验是2、3、4 、5,原因是发生物理变化和化学变化有沉淀产生的实验是3, 原因是发生化学变化;有状态变化的实验是2、3、4、5, 原因是发生物理变化或化学变化;并总结出硫酸铜晶体的性质(包括物理性质和化学性质):蓝色晶体、易溶于水、受热易分解、能与氢氧化钠反应生成蓝色絮状沉淀【小结】根据物质变化中所获得的信息对物质的性质进行分析推测的方法,是认识物质、探索物质变化规律的基本方法。
九年级科学上册 第1章 物质及其变化复习知识点归纳

第1章物质及其变化第1节物质的变化知识点1 物质是在不断变化着的1.物理变化和化学变化:产生新物质的变化属于化学变化,不产生新物质的变化属于物理变化。
2.化学变化的基本特征是生成新物质.化学变化一定伴随发生物理变化,但物理变化中不一定发化学变化。
知识点2 探索物质变化的方法1.化学变化中常伴随发光、放热、放出气体、产生沉等现象,但有这些现象的变化不一定是化学变化.判断化学变化的依据是生成了新物质。
2.探索物质的变化和变化规律时,可以通过观察、实验等方法,从物质的状态、颜色、温度(吸热或放热)、有无沉淀或气体生成等方面寻找证据.第2节物质的酸碱性知识点1 酸性物质和碱性物质1.电离:物质溶解于水或受热熔化而形成自由移动离子的过程,叫做电离。
2.酸是由氢离子和酸根离子组成的化合物,碱是由金属离子和氢氧根离子组成的化合物.3.酸在水中电离时,生成的阳离子都是氢离子;碱在水中电离时,生成的阴离子都是氢氧根离子。
知识点2 酸碱指示剂1.在酸性或碱性溶液里能显示不同颜色的物质,叫做酸碱指示剂,通常简称指示剂。
2.紫色的石蕊试液在酸性溶液中显示红色,在碱性溶液中显示蓝色;无色的酚酞试液在酸性溶液中不变色,在碱性溶液中显示红色;蓝色石蕊试纸在酸性溶液中显示红色,在碱性溶液中显示蓝色;红色石蕊试纸在酸性溶液中显示红色,在碱性溶液中显示蓝色.3.酸性溶液或碱性溶液使指示剂变色,不能说成指示剂使酸性溶液或碱性溶液变色。
因为变色的物质是指示剂,不是酸性或碱性溶液.4.花瓣中含有一些植物色素,这些色素在酸性或碱性溶液中呈现不同的颜色,用花的汁液可以制成酸碱指示剂。
知识点3 溶液酸碱性的强弱程度1.溶液的酸碱性强弱程度简称酸碱度。
2.化学上通常用pH表示溶液的酸碱度。
pH的范围通常在0~14之间。
3.pH=7,溶液呈中性;pH<7,溶液呈酸性,pH越小,物质酸性越强;pH〉7,溶液呈碱性,pH越大,物质碱性越强。
4.pH=0的溶液是酸性溶液,但不是酸性最强的。
2018年秋九年级科学 第1章物质及其变化第6节几种重要的盐第1课时常见的盐课件新版浙教版

作建筑 材料, 生产石 灰和水
泥 配生理 盐水, 杀菌、
备注
石灰石 和大理石 的主要成
分
食盐的 主要成分
第1课时 常见的盐
[注意] ①潮解是物理变化,风化是化学变化。 ②氢氧化钙与碳酸钠的反应是制取烧碱的原理。 ③由于碳酸钙与硫酸反应时生成的硫酸钙微溶,会附着在碳酸钙 表面,使反应不能继续进行,所以实验室制取二氧化碳时不能用石 灰石和稀硫酸反应。
[_课__堂__速__记__]____________________________________________ _____________________________________________________
第1课时 常见的盐
[情景展示2]
第1课时 常见的盐
[情景分析] 大理石、石灰石、汉白玉、鸡蛋壳、水垢等物质的主要成分都是 碳酸钙,碳酸钙是一种难溶的盐,它是碳酸和氢氧化钙发生酸碱反 应的产物:H2CO3+Ca(OH)2===CaCO3↓+2H2O。 [问题探究] 回忆之前碳酸钙参与的化学反应,你能归纳出碳酸钙有什么性 质?它又有哪些用途? [思__考__交__流__]_____________________________________________
第1课时 常见的盐
[继续探究] 怎样证明一块岩石是碳酸盐? [思考交流]
__________________________________________
第1课时 常见的盐
[归纳总结] 取少量小块岩石样品于试管内,滴加适量稀盐酸,若气泡不断产 生,将产生的气体通入澄清石灰水,若使澄清石灰水变浑浊,说 明有二氧化碳气体产生,从而推知岩石的成分中含有碳酸盐。
九年级科学上册 第1章 物质及其变化 第6节《几种重要的盐》课件2浙教级上册自然科学课件

3.化肥(huàféi)的作用与制取 氮 肥
(1)作用:能盛促,使含农有作组物成的叶茎绿叶素生的长重要(shēn元gzhǎ素ng)茂
(2)氮肥(铵盐)的制取:
常用酸与氨气 反应制取
NH3+H2O+CO2=NH4HCO3(碳铵) 2NH3+H2SO4=(NH4)2SO4(硫铵)
1.4几种(jǐ 重要的盐 zhǒnɡ)
12/9/2021
第二 课时 (dìèr)
第一页,共二十二页。
一、盐的制取 1.盐的溶解性
(1).根据(gēnjù)盐的溶解性的不同可将盐分为 _可__溶__性____盐和__不__溶__性_盐。 (2).常见(chánɡ jiàn)盐的溶解性表:
钾、钠、硝酸、铵盐溶, 氯化物不溶氯化银,硫酸盐不溶硫酸钡, 碳1酸2/9/202盐1 只溶钾钠铵。碱只溶钾、钠钙钡。
第四页,共二十二页。
讨论:参照酸和碱性质的推断方法(fāngfǎ),推 测盐的性质
(1)酸+盐=新盐+新酸
条件:除碳酸盐外,盐要可溶,生成物中有沉 淀 或气体 (chéndiàn)
(2)碱+盐=新碱+新盐
条件:盐和碱都要可溶,生成物中有沉淀
12/9/2021
第五页,共二十二页。
[实验]在盛有Na2CO3溶液(róngyè)的试管里加 入CaCl2溶液,可发现:_白__色__(bá_is_è)_沉
因上为述---1物:质碱不(wù能zhì)与能金发属生氧化化物学反应反。应2:的酸是不能:与
非_金_12/9_/2属0_21 _氧_化4__物_反__应_。__3_:_F_e_(O_H_)3_难_溶_____
第十页,共二十二页。
浙教版九年级科学上册《几种重要的盐》PPT精品课件

咸肉
咸菜
为什么可以用食盐水清洗伤口?
因为浓的食盐溶液会使细胞内的水渗出,使蛋白质凝固,具有杀菌作用。
④. 清洗伤口杀菌作用
1.了解碳酸钙、氯化钠的性质 2.了解复分解反应发生的条件
例1:下列对氯化钠的描述中,正确的是( C )
A、氯化钠固体极易溶于水,溶解时放出大量的热 B、其水溶液有涩味和滑腻感所以呈碱性 C、其水溶液有一定的杀菌消毒作用 D、其水溶液能使紫色石蕊试液变蓝色
2. 碳酸钙的化学性质
(1). 与酸反应
CaCO3 + 2 HCl = CaCl2 + H2O + CO2 (实验室制取CO2原理)
(2). 加热分解 CaCO3 高=温 CaO + CO2 生石灰 (工业上制取CO2原理)
3. 碳酸钙形成的岩石的用途: 洁白纯净的碳酸钙岩石叫汉白石。 含杂质而有美丽花纹的碳酸钙叫大理石。 质地致密的碳酸钙岩石叫石灰石。
思考:化肥有助于植物生长,长期使用化肥好吗? 虽然化肥有助于植物生长,但长期使用化肥往往会使土壤板结,破坏土壤结构。
4、 农家肥料(有机肥)
农家肥料中含有大量有机物和多种营养元素 (如微量元素硼、锌、铜、锰、钼等)
主要作用有: 有利于改良土壤结构,提高土壤肥力。使作物吸收多种营养元素。
1.了解几种重要的盐的溶解性 2.知道化肥的作用
4、碳酸盐:大多难溶。(除钾盐、钠盐、 铵盐可溶外);
1. 可溶性盐 K+、Na+、NH4+等离
盐
子与酸根离子组成的盐。
2. 不溶性盐 AgCl BaSO4 BaCO3
部分酸碱盐的溶解性表(20℃)
应用:粗盐中可溶性杂质的去除 溶液(含杂质Na2SO4、CaCl2、MgCl2) 加入试剂的顺序及操作(可供选择的试剂有:NaOH、Na2CO3、BaCl2、HCl)
九年级上册科学:第1章 物质及其变化(1.6几种重要的盐)

九年级上册科学【高频考点解读】(考试范围:1.6几种重要的盐)考点1:常见的盐考点解读:盐是指由金属阳离子(或铵根离子)和酸根离子构成的一类化合物。
盐可分为可溶性盐和难溶性盐,常见的可溶性盐有钾盐、钠盐、铵盐、硝酸盐。
常见的难溶性盐有Ag Cl、BaSO4及大部分的碳酸盐。
纯碱又称苏打,是碳酸钠(化学式Na2CO3)的俗名。
它的水溶液呈碱性,能使无色酚酞变红色。
当碳酸钠从溶液中结晶析出时,晶体里结合了一定数量的水分子,其化学式为Na2CO3·10H2O。
碳酸钠晶体暴露在干燥的空气中易失去结晶水而最后变成粉末,此变化叫风化,属于化学变化。
碳酸钙是大理石、石灰石的主要成分,它是一种白色固体,难溶于水。
碳酸钙形成的岩石是重要的建筑材料。
氯化钠俗称食盐,它是一种白色固体,易溶于水,有咸味。
氯化钠既是人类不可缺少的食物佐料,又是重要的化工原料。
例1:同学们整理实验室时,发现一瓶敞口放置且失去标签的白色粉末状药品,实验员老师告诉大家原瓶药品可能是碳酸钠,碳酸钙、氯化钠、氢氧化钠中的一种,同学们对此很好奇,于是他们对这瓶白色粉末的成分做了如下探究:实验一:小明取一定量白色粉末于烧杯中,加水搅拌,充分溶解后,过滤,得到固体和无色溶液。
实验二:小明取实验一得到的固体于试管中,滴加足量稀盐酸后,观察到有(现象)产生,于是小明马上就得出结论,该瓶中白色粉末一定是碳酸钙,但是小军却认为小明的结论不一定正确,固体还可能是碳酸钠,你认为小军的理由是,请你写出上述有气体生成的反应的化学方程式(任写一个)。
实验三:小明和小军认为有必要再对实验一中滤液的成分进行探究.过程如下:实验步骤实验现象实验结论(1)取少量滤液于试管中,向其中滴加2-3滴无色酚酞试液,振荡溶液由无色变为红色该瓶中白色粉末一定不是(2)另取少量滤液于试管中,滴加过量氯化钙溶液,振荡,静置该瓶中白色粉末一定有碳酸钠,涉及的化学方程式为。
反思与交流:实验结束后,同学们通过讨论,一致认为原试剂瓶中的药品也可能不是碳酸钠,你认为他们的理由是.实际应用:某工厂化验室用15%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,共消耗氢氧化钠溶液40g,洗涤后的溶液呈中性,这一定量石油产品中含H2SO4的质量是多少?考点2:盐的化学性质考点解读:盐的化学性质:①盐溶液+金属→新盐+新金属(条件:盐要可溶;金属单质必须比盐中的金属元素活动性更强)②盐溶液+酸溶液→新盐+新酸(条件:一般盐、酸均溶于水;符合复分解反应的条件;碳酸盐等弱酸盐可与强酸反应)③盐溶液+碱溶液→新盐+新碱(条件:盐和碱必须可溶;符合复分解反应的条件)④盐溶液+盐溶液→新盐+新盐(条件:盐和盐必须可溶;符合复分解反应的条件)例2:某同学从物质类别的角度构建了如图甲所示的知识网络图,借助网络图回答:(1)写出用酸和碱生成氯化钠的化学方程式。
九年级科学上册第1章物质及其变化第6节几种重要的盐盐与化肥

第十四页,共二十四页。
第3课时 盐与化肥
新知学习
新知(xīn zhī)三 铵根离子(NH4+)的鉴定
1.实验(shíyàn):(1)在盛有硫酸铵浓溶液的试管里滴加氢氧化钠溶液,
闻到__刺__鼻_(c_ìb的í) 气味;
蓝
(2)把湿润的红色石蕊试纸放在试管口,试纸的颜色变为__生成的氨气与水反应生成了氨水,氨
无机(wújī)铜素
波尔多液(bō ěr duō yè)是______________杀菌剂,是硫酸铜、氢氧化铜 和氢氧化钙的碱式复盐。
第二十二页,共二十四页。
3课时 第
(kèshí)
盐与化肥
课堂小结
第二十三页,共二十四页。
内容(nèiróng)总结
第6节 几种重要的盐。第3课时 盐与化肥。2.磷肥:能促进农作物________发达,增强____________和 ____________的能力,促进作物穗数增多、籽粒饱满。硝酸铵属于(shǔyú)氮肥,过磷酸钙属于(shǔyú)磷肥,氯化钾属于 (shǔyú)钾肥,磷酸二铵属于(shǔyú)复合肥。不同种类的化肥对农作物的生长有什么作用。氮肥含有组成叶绿素的重要元素, 能促使农作物的茎叶生长茂盛。氨与碳酸:NH3+H2O+CO2===NH4HCO3(碳铵)
第十六页,共二十四页。
第3课时 盐与化肥
互动(hù dònɡ)探究
探究(tànjiū)点二 铵态氮肥的制取和检验
[情景(qíngjǐng)展示]
第十七页,共二十四页。
第3课时 盐与化肥
[情景分析]
在氮肥中,NH4HCO3、(NH4)2SO4、NH4NO3 等含有铵根离子的盐,我们习惯 上称为铵态氮肥。
四反应 放出具有刺激性气味的气 无刺激性气味的气 第十页,共二十四页。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第4课时 实验:碱和盐的性质
(续表)
操作示意图
现象 澄清石灰水变 浑浊 ________
结论 氢氧化钙能与某 些非金属氧化物反 盐 应生成________和 水 ________ 氢氧化钙能与某 些盐反应生成 新盐 和________ 新碱 ______
澄清石灰水变 浑浊 ________
第4课时 实验:碱和盐的性质
互动探究
探究点一 碱的性质
[情景展示] 小明在某食品包装袋内发现了一包生石灰干燥剂,并对它现在的成
分产生了兴趣,并猜想干燥剂中可能有氢氧化钙或碳酸钙,小红说
可以利用氢氧化钙的化学性质对干燥剂的成分进行检验。
第4课时 实验:碱和盐的性质
[问题探究]
氢氧化钙有哪些性质?请利用我们已学过的一些碱的共性知识,设计 探究氢氧化钙化学性质的实验方案(用操作示意图表示),进行实验后 ,填写实验报告。
第4课时 实验:碱和盐的性质
[归纳总结] 盐能与某些酸生成新盐和新酸,盐能与某些盐反应生成另 两种盐。 [继续探究] 从实验中你能归纳出检验硫酸根离子和氯离子的方法吗?滴加稀
硝酸的目的是什么??
[思考交流] __________________________________________
第4课时 实验:碱和盐的性质
沉淀不消失 ______________
硫酸铜溶液
产生________________
白色沉淀
第4课时 实验:碱和盐的性质
(2)取3支试管,分别倒入稀盐酸、氯化钠溶液、碳酸钠溶液,在 这3支试管中分别滴加几滴硝酸银溶液。再往这3支试管中各滴入几 滴稀硝酸,振荡后观察现象。
溶液 稀盐酸 氯化钠溶液 碳酸钠溶液
氢氧化钙能与 澄清石灰水变 某些非金属氧 浑浊 化物反应
澄清石灰水变 氢氧化钙能与 浑浊 某些盐反应
第4课时 实验:碱和盐的性质
[继续探究] 怎样证明干燥剂中是否含有氢氧化钙?哪种方法最简单?
[思考交流] __________________________________________
第4课时 实验:碱和盐的性质
硫酸铜溶液 碳酸钠溶液 2. 取3支试管,分别倒入稀盐酸、氯化钠溶液、碳酸钠溶液,在
这3支试管中分别滴加少量硝酸银溶液,记录观察到的现象。再往
这3支试管中各滴入几滴稀硝酸,振荡后观察现象并记录实验现象。
第4课时 实验:碱和盐的性质
溶液 盐酸
滴加少量硝酸银溶液的现 再滴加稀硝酸后的现 象 象
氯化钠溶液
互动探究
探究点二 盐的性质
[情景展示] 1.取3支试管,分别倒入稀硫酸、硫酸铜溶液、碳酸钠溶液。
在这3支试管中分别滴加少量氯化钡溶液,记录观察到的现象。
再往这3支试管中各滴入几滴稀硝酸,振荡后观察现象并记录
实验现象。
第4课时 实验:碱和盐的性质
溶液
滴加少量氯化钡溶液的 再滴加稀硝酸后的
现象 现象
稀硫酸
第4课时 实验:碱和盐的性质
新知学习
新知二 盐的某些性质
实验:(1)取3支试管,分别倒入稀硫酸、硫酸铜溶液、碳酸钠溶液。
在这3支试管中分别滴加少量氯化钡溶液。再往这3支试管中各滴入几
滴稀硝酸,振荡后观察现象。
溶液 稀硫酸 滴加少量氯化钡溶液后 的现象 产生_________________ 白色沉淀 再滴加稀硝酸后的现象 沉淀不消失
碳酸钠溶液
第4课时 实验:碱和盐的性质
[问题探究] 这两组实验体现出了盐的哪些性质?
[思考交流] _____________________________________________________ _____________________________________________________
新知学习
新知一 探究氢氧化钙的化学性质
操作示意图
现象 结论 1号试管溶液变为 氢氧化钙能使无 红 色, _____ 色酚酞试液变 红 2号试管溶液变为 ______ ,使紫色石 蓝 蓝 _____ 色 蕊试液变________ 溶液先变为 氢氧化钙能与酸 红 盐 ________ 色,后 反应生成________ 红 水 ________ 色褪去 和________
滴加几滴硝酸银溶液 后的现象 白色沉淀 产生______________ 白色沉淀 产生______________ 白色沉淀 产生______________
再滴加稀硝酸后的现象 沉淀不消失 沉淀不消失 ______________ 沉淀消失 ______________
第4课时 实验:碱和盐的性质
第1章
物质及其变化
第6节 几种重要的盐 第4课时 实验:碱和盐的性质
第1章 物质及其变化
第4课时
实验:碱和盐的性质
新知学习 互动探究 课堂小结
第4课时 实验:碱和盐的性质
重要提示: 无论是检验Cl-还是SO42-,都不要忘记加稀硝酸,以排除可能存在 的CO32-的干扰。
第4课时 实验:碱和盐的性质
[思考交流] _____________________________________________________ _____________________________________________________
第4课时
[归纳总结]
操作步骤
实验:碱和盐的性质
操作示意图 现象 结论
向盛有澄清石灰水的两支试
[归纳总结] 取样后先滴加少量氯化钡溶液,若产生白色沉淀,再滴加稀硝酸,若 沉淀不消失,则证明含有硫酸根离子。滴加少量硝酸银溶液,若产生 白色沉淀,再滴加稀硝酸,若沉淀不消失,则证明含有氯离子。滴加 稀硝酸的目的是除去CO32-等杂质离子的干扰。因为CO32-与AgNO3 或 BaCl2 溶液接触时,也有白色沉淀Ag2CO3 、BaCO3 生成,但这些沉淀 都溶于稀硝酸,而AgCl和BaSO4 不溶于稀硝酸。 。 [课堂速记] ______________________________________________
管中滴加无色酚酞试液和紫 色石蕊试液
1号试管溶液变成红色号试 氢氧化钙溶液能使无色
管溶液变成红色,2号试管 酚酞试液变红,紫色石 溶液变成蓝色 蕊试液变蓝
向盛有澄清石灰水的试管中 滴加1滴酚酞试液1滴酚酞试 溶液先变红后红色褪去 氢氧化钙能与酸反应
第4课时 实验:碱和盐的性质
[归纳总结]
向盛有澄清石 灰水的试管中 通入二氧化碳 向盛有澄清石 灰水的试管中 滴加碳酸钠溶 液
[归纳总结] 取样后加适量水溶解,倒出上层清液,可以利用加酸碱指示剂、 通入二氧化碳气体等方法检验,用加指示剂的方法检验最简单。
[课堂速记] _____________________________________________________ _____________________________________________________
