混合法测量固体比热容
5实验五 混合法测量比热容

实验五混合法测量比热容Experiment 5 Determining thermal capacity using mixing method量热学是以热力学第一定律为理论基础的一门科学,量热学所研究的范围就是如何计量物质系统借温度变化、相变、化学反应等所吸收和放出的热量。
量热学的实验方法有混合法、稳流法、冷却法、潜热法、电热法等,本实验采用混合法测金属样品的比热容。
实验目的Experimental purpose1.掌握混合法测定金属比热容的方法;2.巩固物理天平的使用方法。
实验原理Experimental principle将温度不同的物体混合后,如果由这些物体组成的系统没有与外界交换热量,最后系统将达到稳定的平衡温度。
在此过程中,高温物体放出的热量等于低温物体所吸收的热量。
这就是热平衡原理。
根据这一原理可用混合法测量金属的比热容。
为了做好实验,需有一个隔热良好的量热器。
本实验用的量热器如图1所示,它由外筒和内筒组成,内筒放置在绝热架上,与外筒隔开,外筒用绝热盖盖住,盖上开两个小孔,可放入温度计和搅拌器(连有绝缘柄)。
由于内筒与外筒间充有不图1量热器结构图良导体的空气,它们间传导的热量很小;又由于外筒装有绝热盖,对流的热量也很小,内筒的外壁和外筒的内外壁都抛光,以减少热辐射。
这样的量热器可被看做近似符合热平衡原理的实验系统。
实验时,将待测金属样品置于加热器中加热至温度θ1,并迅速将它投入量热器的水(温度为θ2)中,最后达到平衡温度θ。
设待测样品的质量为m ,比热容为c ,则其放出的热量为()θθ-=11mc Q (1)设量热器内筒的质量为m 1,比热容为c 1;水的质量为m 2,比热容为c 2,则量热器和水吸收的热量为()()222112θθ-+=c m c m Q (2)根据热平衡原理,Q 1= Q 2。
由式(1)和(2)可得待测样品的比热容为()()()θθθθ--+=122211m c m c m c (3) 以上讨论并没有考虑系统热量的散失,但实际上只要有温差存在,总会发生系统与外界热交换现象。
固体比热容的测定及误差分析

固体比热容的测定及误差分析郭超200802050234 08物理(2)班摘要:比热容是物质的一个重要物理特性,比热容的测量是热学中的一个基本测量,在新能源的开发和新材料的研制中,物质的比热容的测量往往是不可缺少的,但由于散热因素多而且不容易控制和测量,使量热实验的准确度往往较低,因此,设法改进实验方法,提高使用精确度便成为人们关注的问题,本实验用混合法测出来金属块的比热容,并进行了散热修正是误差减小到了最低。
关键词:固体、比热容、误差分析Abstract: The specific heat capacity is an important material and physical properties, specific heat capacity of thermal measurement is a basic measurement, development of new energy and new material, the material specific heat capacity measurements are indispensable, but the heat factor more and not easy to control and measurement, so that calorimetry experiments are often less accurate, therefore, seek to improve the experimental methods, increase the accuracy of people have become issues of concern, the experiment measured by the piece of metal mixed with the specific heat capacity, and amendment to the heat reduced to a minimum error.Key words: solid, specific heat capacity, error analysis一、实验原理:1.1实验原理的引入:测量固体的比热容的方法与有很多种,例如混合法、比较法、冷却法等,但是这些方法在实际操作中都会引入较大的误差。
比热容测定方法

比热容测定方法
1. 嘿,你知道混合法测比热容不?就像调鸡尾酒一样,把不同的东西混在一起就能得到结果哦!比如,把热水和冷水倒在一起,通过测量温度变化来算出比热容呢!
2. 哎呀,量热计法也很厉害呀!这就好比是一个超级精准的温度计,能精确地测出来物质吸收或放出的热量,从而算出比热容呀!比如测测铁块的比热容。
3. 还有冷却法呢!这就像让热的东西慢慢变凉,然后观察这个过程就能算出比热容咯!像测测烧热的石头冷却时的数据。
4. 哇塞,绝热法也很有意思哦!这不就是给物质打造一个绝热的小空间嘛,看看它在里面的变化来测定比热容呀!就像给一个小宝贝创造一个特别的环境来观察它一样。
5. 嘿,你们想过比较法吗?就像比较两个东西的优缺点一样,通过对比来测定比热容呀!比如把铜和铁的比热容比较一下。
6. 热流式法也很酷啊!就像是热量在流动,我们顺着这个流去找到比热容呢!好比顺着河流找到宝藏。
7. 天平法呢,就如同用天平称东西一样准确,来称出比热容的大小呀!比如称称那一小片金属的比热容。
8. 诶哟,滴液法也不能小瞧呢!就像是慢慢滴下的水滴一样,一点点的测量出比热容呢!可以试试对某种液体用滴液法。
9. 我觉得这些比热容测定方法都各有各的奇妙之处呀,每一种都像是打开科学大门的一把钥匙,让我们能更深入地了解物质的特性!。
固体比热容

c0
4.取出量热器的内筒,称其总质量并减去 m+ m ,即为 1 水的质量 m ; 0 5.小量筒测出温度计浸入水中的体积V;另换温水,重 复上述实验一次。 6.实验时应注意 (1)本实验的误差主要来自温度的测量,因此在测量温 度时要特别注意,读数迅速且要准确(准确到0.1℃); (2)倒入量热器中的温水不要太少,必须使投入的金属 块悬挂浸没在其中。 水的比热容 c0 为 4.187×103 J ⋅ kg−1⋅oC−1
实验结果分析和处理
1.将实验中测出的各个数值填入下表:
前8分钟 t(℃) 次 1 2 3 4 t 次 (℃) 5 6 7 8 次 1 2 3 4 中间2分钟 t(℃) 次 5 6 7 8 t(℃) 次 1 2 3 4 后8分钟 t(℃) 次 5 6 7 8 t(℃)
t2(℃) m 0(kg) m (kg) m1(kg) C(J·k—1·℃—1)
在上述混合过程中,实际上系统总要与外界交换热量, 这就破坏了(1)式的成立条件。为消除影响,需要采用散 热修正。本实验中热量散失的途径主要有三个方面。第一, 若用先加热金属块投入量热器的混合法,则投入前有热量损 失,且这部分热量不易修正,只能用尽量缩短投放时间来解 决;第二,将室温的金属块投入盛有热水的量热器中,混合 过程中量热器向外界散失热量,由此造成混合前水的温度与 混合后水的温度不易测准。为此,绘制水的温~时曲线,
实验仪器
电子温度计;量热器;天平
实验步骤
测环境温度 测内桶和搅拌器质量 加水,测总质量 备冰 投冰,搅拌,测温 测至系统温度有上升为止 测内桶及水总质量 测环境温度 绘制温度时间曲线,求冰的溶解热
注意事项
投冰前应将其拭干,且不得直接用手触摸;其质量 不能直接放在天平盘上称衡,而应由投冰前、后量 热器连同水的质量差求得。 为使温度计示值确实代表系统的真实温度,整个实 验过程中(包括读取前)要不断轻轻地进行搅拌 (搅拌的方式应因搅拌器的形状而异)。
固体比热测定

固体比热容的测定指导老师:王亚辉小组成员:李彦辉张燚杨朋波胡宏明电热法测固体比热容实验的改进1引言在传统的混合法测固体比热容实验中, 量热器等的吸热和散热一直是制约实验结果准确度的一个关键因素. 为了消除此类热量传递对测量结果的影响, 在一定的实验条件下, 可以近似地用作图法消除热交换的影响, 其次还要考虑量热器、搅拌器等的等效比热容和质量, 处理过程相当麻烦. 本实验采用电热法, 通过控制放试件和不放试件两种情况下的初末温度和液面高度, 将上述种种热散失抵消掉, 使测量较准确, 操作较简单. 另外, 本实验采用传感器加模拟电路来测量温度, 使温度的测量更准确; 用不锈钢杜瓦瓶代替传统的量热器筒和保温套筒,减少了向外界的热量散失, 且使用方便2实验改进方法实验装置如图1所示. 待测样品及水放在杜瓦瓶中, 并设置了AD590温度传感器和电加热器、搅拌器. 水面高度为杜瓦瓶的3/ 5左右;样品不宜太大或太小; AD590和样品大致位于水深的中部; 电加热器置于偏下部.设加热电压为U, 电流为I, 则电加热器在时间T内放出的热量为UIS. 此热量使量热器的整体温度由t1 升至t2. 根据能量守恒定律, 可得如下方程UIT= (mc+ m0c0+ C1 + C2 + C3) (t2 - t1) + ΔQ ( 1)式中, m, c为待测物的质量和比热容; m0, c0 为水的质量和比热容; C1, C2, C3 分别为在此实验状况下量热器( 包括搅拌器) 、电加热器、温度传感器的等效热容量; ΔQ为其它因素散失的热量.本实验测量的困难在于C1, C2, C3 及ΔQ均为未知的参量. 为解决这一问题, 采用同等实验条件下的系统误差差值消去法.实验分两步进行: 第一步不加待测试件, 加热T1时间后, 系统从t1 升温至t2; 第二步放入t1温度的水和试件, 且要求水位和第一步等高, 加热T2 时间后, 同样使温度升高到t2. 据( 1) 式有UIT1 = (m01c0+ C1+ C2 + C3)(t2 - t1) + Δ Q1 ( 2)UIT2= (m02c0 + C1+ C2+ C3+ mc)(t2- t1) + ΔQ2( 3)( 2) 式减去( 3) 式得UI ( T1 - T2) =- mc( t2- t1) + ( m01 - m02) c0( t2 - t1) +ΔQ1 -ΔQ2故\( m01- m02) c0( t 2- t 1) - UI( T1- T2) +Q1 -Q2∆∆( 4) c=m( t2- t1)考虑到在前后两步测量中, 初末温度相同,水的高度相同, 环境条件也相同, 因此量热器热量交换情况基本相同, 其差别仅在于电加热的时间T1 与T2 略有差别, 造成ΔQ1 与ΔQ2 略有不同. 由于用了高真空杜瓦瓶作为量热器, ΔQ1与ΔQ2 均很小, 而其差值将更小. 测试结果也表明平衡后系统的温度随时间的变化极缓慢, 如图2所示. 因此, 可以忽略该项差别, 认为ΔQ1- ΔQ2= 0, 则( 4) 式化得为( m01- m02) c0( t 2- t 1) - UI( T1- T2)c=m( t2- t1)本实验应该注意的几个问题:1) 本实验的关键之一在于两步实验初末温度的控制, 最好相同, 稍有差别也是可以的, 但一定要保证t2-t1 相同.2) 加热过程中要充分地、不断地搅拌, 否则传感器即数字毫伏表反映的温度与实际平衡温度会有差别.3) 计时器的开关要迅速及时, 必要时可两人配合. 关闭加热器和计时器后应继续搅拌片刻, t2 应取最大读数值.4) 要选择恰当的电加热功率. 功率太大, 会使计时器的控制难度加大, 且增加量热器内温度的不均匀性; 太小会使实验时间延长, 增大散热引起的误差.数据记录:烧杯:m1=66.3 筒:m2=66.6 筒+水:m3=212.1g筒+水+珠:m4=298.7g 烧杯+铜珠:m5=166.4g只加水: U=11.99v I=1.026A稍加热停止时末温T0 T1 T221.2℃21.8℃22.2℃继续加热停止时末温时间T3 T4 T132℃32.4℃599.1s水+珠:稍加热停止时 末温 '0T '1T '2T21.0℃ 21.7℃ 22.2℃继续加热停止时 末温 时间'3T '4T '5T31.8℃ 32.4℃ 590.1s数据处理:m=m5-m1=100.1g m10=m3-m2=145.5gm20=m4-m-m2=132gC 测珠=m m m 2010-*Co 水-)24()21(T T m t t VI -- =1.1001325.145-×4.2×103J/g ℃-)2.224.32(**1.100)1.5901.599(_*026.1*99.11103---J/(g ℃) =566.4 J/g ℃-108.4 J/g ℃=458 J/g ℃误差分析:因为数字毫伏表容许误差为0.1℃,电压表,电流表准确度分别为0.1V,0.01A,启停数字计数器的误差之和为0.4s,天枰的感量为0.02g.u( t1) = u( t2) = 0. 1/ 3 = 0. 06℃u( U) = 0. 1/ 3 = 0. 06Vu( I) = 0. 01/ 3 = 0. 006Au( Ʈ1) = u(Ʈ 2) = 0. 4/ 3 = 0. 23su( m01) = u( m02) = u( m) =0. 02/ 3= 0. 016g则故u( c) = u2( c1) + u2( c2) = 5J/ ( g *℃)取公认值480J/(g*℃)测量值与真实值之差与标准值取百分比 η=480458480 *100%=4.6% 在允许百分误差(5%)以内,故该实验测量比热容是可行的。
两种物质混合比热容

两种物质混合比热容物质的热容是描述物体吸热性质的物理量,用来衡量物质在温度变化下吸收或释放热量的能力。
在混合物的热容中,存在着两种物质混合比热容的研究。
本文将探讨这两种物质混合比热容的原理、实验方法和相关应用。
1.方法一:等体积法等体积法是通过将两种物质按照相同体积进行混合,然后测量混合物的温度变化来计算混合物的比热容。
该方法适用于两种物质相互溶解或反应导致混合物温度变化的情况。
2.方法二:等质量法等质量法是通过将两种物质按照相同质量进行混合,然后测量混合物的温度变化来计算混合物的比热容。
该方法适用于两种物质相互不溶或反应不明显的情况。
三、实验步骤1.选择适合的实验装置,并确保其正确使用和校准。
2.按照选定的方法,准备相应的样品和试剂。
3.将两种物质按照相应的比例或相等体积/质量混合在一起。
4.在混合物中插入温度计,并记录初始温度。
5.进行反应或溶解过程,同时记录混合物的温度变化。
6.根据所选方法,计算混合物的比热容。
四、结果分析根据实验所得数据和计算结果,可以得出两种物质混合比热容的相关结论。
比热容越高的物质在混合物中所起的作用越显著,其温度变化也会更大。
同时,不同物质的混合比热容也可能会导致混合物整体的比热容发生变化。
五、应用领域1.工业生产中的温度控制:通过混合物的比热容,可以调节工业生产中的温度,实现对反应过程的控制。
2.热能储存和传输:混合物的比热容可以影响其储存和传输能力,从而应用于热能储存和传输领域。
3.材料研究:混合物的比热容对于材料的性质研究有重要影响,对于热学性能的分析和材料改进具有一定的指导作用。
两种物质混合比热容是研究物质吸热性质的重要内容。
通过实验方法的选择和实验结果的分析,可以得出混合物比热容的相关结论。
同时,混合物比热容的应用广泛,涉及到工业生产、热能储存和传输以及材料研究等领域。
这些研究对于深入理解和应用相关物质具有重要意义。
4 固体比热容的测量
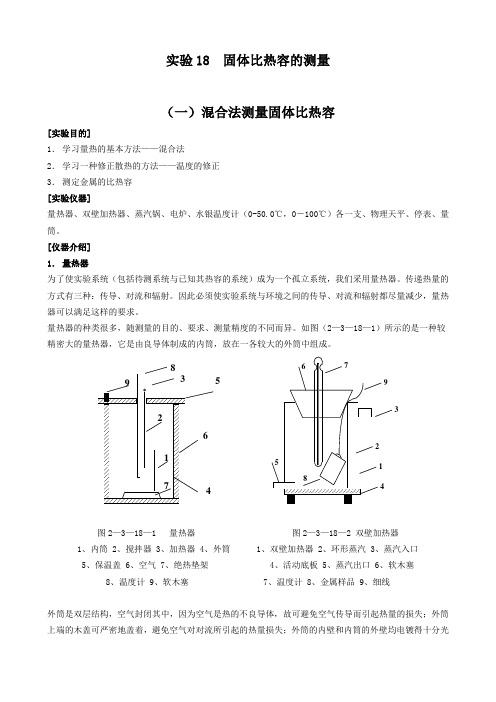
实验18 固体比热容的测量(一)混合法测量固体比热容[实验目的]1.学习量热的基本方法——混合法2.学习一种修正散热的方法——温度的修正3.测定金属的比热容[实验仪器]量热器、双壁加热器、蒸汽锅、电炉、水银温度计(0-50.0℃,0-100℃)各一支、物理天平、停表、量筒。
[仪器介绍]1.量热器为了使实验系统(包括待测系统与已知其热容的系统)成为一个孤立系统,我们采用量热器。
传递热量的上端的木盖可严密地盖着,避免空气对对流所引起的热量损失;外筒的内壁和内筒的外壁均电镀得十分光接着立即作投放加热样品的准备工作,并读取温度1T ,此时停表应继续走动,直至样品投放到水中,记下这个时刻的时间1t ,同时一边搅拌,一边记录每经过几秒钟到十几秒钟的水温,因为曲线BC 这一段温升很快,所以测温时间间隔要短。
测CD 线段时,其测温得时间间隔可适当拉长,测量5个测温点即可作CD 段。
根据上述测量的T -t 数据,以T 为纵坐标,以t 为横坐标,即得如图(2—3—18—4)的T -t 曲线。
A 点对应的时刻就是测水温开始的时间0t ,B 点对应的时刻就是1t ,而不是5分钟末的时间。
然后作图 即得混合前后冷水的初温2T 和末温T 。
把各个物理量的测量值代入式(2-3-18-1)即可算出金属样品的比热容x C 。
图(2—3—18—4)中的G 点所对应的温度应为室温所在的位置,这样才不影响温度的修正。
[实验内容和要求]1.混合法测定铜块的比热容 2. 混合过程中散热的温度修正法3.混合前量热器(含水)系统温度低于室温(加冰块),测量系统随时间吸热变化的温度。
4.混合过程快速测量变化的温度 5.数据处理:C x 与标准值求百分误差 [注意事项]1.作温度值修正法曲线图,FE 垂直于t 轴,满足S 1=S 2,图中G 点对应的温度接近室温为佳。
2.从曲线图中定出初温T 2和末温T 。
[实验思考]请分析本实验主要的误差来源。
固体比热容测定实验的研究

关键词 : 牛顿冷却定律; 固体 比热容 ; 改进 ; 实践 创新
中图分类号 : 43 0 -3 文献标 识码 : A 文章编号 :0416 (0 0 0 -0 00 10 —0 9 2 1 )30 1-4
Ex e i e t lr s a c n m e s r n o i pe i c h a a i p r m n a e e r h o a u i g s l s c f e tr t d i o HA i・n S N Me ja , I G Z i o g N X u1 ,U iu n D N h- n i - y
(colfP yw n l t nc i c ,ua gTahr C lg ,u agA h i 30 1C i ) Sho o hs s dEe r i S e e F y n ece oeeF yn n u 2 64 ,hn a co n s c s l a
Ab ta t T et r l o e t np n il o p r e t ntes ei ch a o l ert a y a a zd s r n o sr c : h ema c r ci r c e f x e m n o c i e t s i i t oe cl n l e t t gf m h r o i p e i h p f o d s h i l f y ai r
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验报告姓名:叶洪波学号:PB05000622固体比热容的测量*实验原理1.混合法测比热容设一个热力学孤立体系中有n 种物质,其质量分别为m i ,比热容为c i (i=1,2,…,n )。
开始时体系处于平衡态,温度为CT 1,与外界发生热量交换后又达到新的平衡态,温度为T 2。
若体系中无化学反应或相变发生,则该体系获得(或放出)的热量为))(...(122211T T c m c m c m Q n n -+++= (1)假设量热器和搅拌器的质量为m 1,比热容为c 1,开始时量热器与其内质量为m 的水具有共同温度T 1,把质量为m x 的待测物加热到T ’后放入量热器内,最后这一系统达到热平衡,终温为T 2。
如果忽略实验过程中对外界的散热或吸热,则有))(0.2()'(1231112T T cm K VJ c m mc T T c m x x -⋅⋅++=--- (2) 式中c 为水的比热容。
310.2--⋅⋅cm K VJ 代表温度计的热容量,其中V 是温度计浸入到水中的体积。
2.系统误差的修正在量热学实验中,由于无法避免系统与外界的热交换,实验结果总是存在系统误差,有时甚至很大,以至无法得到正确结果。
所以,校正系统误差是量热学实验中很突出的问题。
为此可采取如下措施:(1) 要尽量减少与外界的热量交换,使系统近似孤立体系。
此外,量热器不要放在电炉旁和太阳光下,实验也不要在空气流通太快的地方进行。
(2) 采取补偿措施,就是在被测物体放入量热器之前,先使量热器与水的初始温度低于室温,但避免在量热器外生成凝结水滴。
先估算,使初始温度与室温的温差与混合后末温高出室温的温度大体相等。
这样混和前量热器从外界吸热与混合后向外界放热大体相等,极大地降低了系统误差。
(3) 缩短操作时间,将被测物体从沸水中取出,然后倒入量热器筒中并盖好的整个过程,动作要快而不乱,减少热量的损失。
(4) 严防有水附着在量热筒外面,以免水蒸发时带走过多的热量。
(5)沸点的校正。
在实验中,我们是取水的沸点为被测物体加热后的温度,但压强不同,水的沸点也有所不同。
为此需用大气压强计测出当时的气压,再由气压与沸点的关系通过表5.3.3-1查出沸点的温度。
在采取以上措施后,散热的影响仍难以完全避免。
被测物体放入量热器后,水温达到最高温度前,整个系统还会向外散热。
所以理论上的末温是无法得到的。
这就需要通过实验的方法进行修正:在被测物体放入量热器前4~5min就开始测读量热器中水的温度,每隔1min 读一次。
当被测物体放入后,温度迅速上升,此时应每隔0.5min测读一次。
直道升温停止后,温度由最高温度均匀下降时,恢复每分钟记一次温度,直到第15min截止。
由实验数据作出温度和时间的关系T-t曲线(图5.3.3-1)。
为了推出式(2)中的初温T1和末温T2,在图5.3.3-1中,对应于室温T室曲线上之G 点作一垂直于横轴的直线。
然后将曲线上升部分AB及下降部分CD延长,与此垂线分别相交于E点和F点,这两个交点的温度坐标可看成是理想情况下的T1和T2,即相当于热交换无限快时水的初温与末温。
*实验内容实验内容是测量锌粒的比热容,实验装置如图5.3.3-2。
1.称出质量为m x 的锌粒,放入试管中隔水加热(注意:水不能溅入)。
在沸水中至少15min ,才可以认为锌粒与水同温。
水沸腾后测出大气压强p 。
2.在锌粒加热的同时,称出量热器内筒及搅拌器质量m 1,然后倒入适量的水,并加入冰屑使水温降低到室温下3~4℃(注意:不能使筒外表有水凝结),利用公式(2)估算出水的质量m 后,称出质量m 1+m 。
3.在倒入锌粒前,一面用棒轻轻搅动,一面每隔一分钟测一次水温(注意:一定要待冰屑全部融化后才能开始测温),计时5分钟后将热好的锌粒迅速而准确地倒入量热器内(注意:不能使量热器中水溅出,又切勿碰到温度计),立即将盖盖好并继续搅拌(注意:搅拌不能太使劲),同时,每隔半分钟测一次水温。
至水温均匀下降,每隔一分钟测一次水温,连续10min 左右为止。
4.温度计浸没在水下的体积可用一个小量筒测得,先将水注入小量筒中,记下其体积V 1,然后将温度计插入水中,使温度计插入水中的体积与在量热筒中没入水中的体积相同(以从量热筒中取出温度计上水印为准),读出液面升高后的体积V 2,则温度计插入量热筒水中的体积12V V V -=(注意:实验中温度计中的水银泡一定要没入水中,但又不能碰到锌粒) 5.查表5.3.3-1得到实验气压条件下水的沸点T ’,即作为锌粒加热后的温度。
6. 作温度-时间曲线,求出T 1和T 2。
根据式(2)求出锌的比热c x ,并和锌的标准比热)/(386.0K g J 比较,求出相对误差。
*实验测量数据,计算结果及误差分析已知量热器的比热容 0.093卡/(克.度)=0.3906J/(g*K) 1卡=4.2焦 水的比热容 4.2 J/(g.K) 量热器筒的质量154.9g*第一次实验锌粒质量 250.1g量热器筒和水的质量m1+m 354.9g 水的质量200.0g气压p 750.2mmHg 对应水的沸点99.70 室温:实验开始时27.00 结束时26.70 平均值(27.00+26.70)/2=27.85 计算温度计浸入水中的体积:小量筒的读数 前V1 =3.00ml 后V2= 3.25ml 计算温度计浸入水中的体积:V=V2-V1=0.25ml=0.25cm 3加入\锌粒前,每隔1分钟记录一次读数23.00 23.10 23.20 23.20 23.20从加入锌粒前的最后一次记录读数到加入锌粒后的第一次记录读数的时间间隔为20秒. 加入锌粒后,每隔20秒记录一次读数 24.10 24.70 25.40 25.80 26.30 26.70 27.10 27.40 27.70 227.90 28.1028.2528.3028.4028.5028.6028.6028.60228.60此后每隔1分钟记录一次读数 28.70 28.80 28.80 28.8028.8528.8528.8528.8928.90228.90 28.9028.90Tt/s时间—温度关系曲线))(0.2()'(1231112T T cm K VJ c m mc T T c m x x -⋅⋅++=---x m =250.1'T =99.702T =28.90m=200.0 c=4.21m =154.9 1c =0.3906V=0.251T =23.20)())(0.2(2'123111T T m T T cm K VJ c m mc c x x --⋅⋅++=--==0.290038kJ/(kg*K)相对误差为: 24.87%*第二次实验锌粒质量 250.0g量热器筒和水的质量m1+m 354.9g 水的质量200.0g气压p 750.2mmHg 对应水的沸点99.70 室温:实验开始时26.70 结束时26.10 平均值(26.70+26.10)/2=26.40 计算温度计浸入水中的体积:小量筒的读数 前V1 =3.00ml 后V2= 3.25ml 计算温度计浸入水中的体积:V=V2-V1=0.25ml 加入锌粒前,每隔1分钟记录一次读数 22.8022.8022.7522.7022.7022.7022.7022.70从加入锌粒前的最后一次记录读数到加入锌粒后的第一次记录读数的时间间隔为9秒. 加入锌粒后,每隔20秒记录一次读数 23.10 23.70 24.50 25.10 25.40 26.00 26.30 26.60 26.85 227.20 27.30 27.40 27.50 27.60 27.70 27.80 27.85 27.90 227.95 28.00 28.00 28.00 28.05 28.10 28.10 28.10 28.10 228.10 28.10 28.1028.1528.1528.1528.1528.1528.15228.15 28.152223242526272829Tt/s时间—温度关系曲线))(0.2()'(1231112T T cm K VJ c m mc T T c m x x -⋅⋅++=---x m =250.0'T =99.702T =28.15m=200.0 c=4.21m =154.9 1c =0.3906V=0.251T =22.70)())(0.2(2'123111T T m T T cm K VJ c m mc c x x --⋅⋅++=--==0.27441 J/(g*K) =0.27441kJ/(kg*K)相对误差为:28.91%误差分析:实验误差很大,原因可能是加热时试管中装锌粒的部分没有全部浸入沸水中,以致加热后锌粒的温度没有达到水的沸点,使得末温偏低,进而计算结果远小于标准值。
思考题为使系统从外界吸热与向外界放热大体相抵,你采取了哪些措施?结果怎样?答:将锌粒倒入量热器筒前使水的初温低于室温3~4度。
