紫外可见光(精)
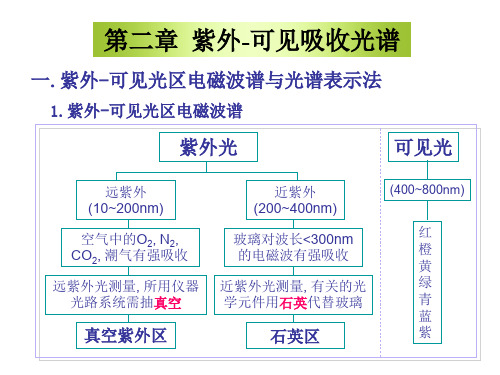
第二章紫外-可见光谱
例如:
CH3OH: n→σ* 所产生的吸收带λmax为183nm. ε=150
三. 常见的光谱术语
1.发色团:
可以使分子在紫外-可见光区产生吸收带的基团. (一般为带π电子基团(C=C,C C,苯环,C=O,N=N,NO2)
如果一个化合物分子中:
-发色团之间不发生共轭: 吸收光谱包括发色团各自的 吸收带
-发色团之间彼此形成共轭体系: 原来各自发色团的吸 收带消失,而产生新的吸收谱带(波长和吸收强度比原 来明显加大)
2.助色团:
有些原子或基团单独在分子中存在时,本身在紫 外区和可见区不产生吸收的原子或基团,当连接发 色团后,使发色团的吸收带波长移向长波, 同时使 吸收强度增加.(助色团一般为带有p电子的原子或 原子团. 如-OH,-OR,-NHR, -SR, -Cl, -Br, I, 烷 基等)
λ/nm
5. 末端吸收
吸收峰随着波长变短而强度增强,直至仪器测量的极 限,而不显示峰型(这主要是因为其最大吸收在短波长 处),这种极限处吸收称为末端吸收.
6. 吸收带的分类
1). K吸收带(源于德文konjugierte, 共轭)
由共轭体系的π→π* 跃迁产生的强吸收带, 一般 εmax>104
2). R吸收带(源于德文radikalartig, 基团)
如果一个分子在不同的pH 值介质中形成阳离子或阴 离子, 吸收波长随离子化而改变
例如
Hale Waihona Puke NH2 H+_
OH
+ NH3
_
OH
O
_
OH
H+
λmax/nm (εmax)
原因
230(8600) 203(7500) 211(6200) 236(9400) 280(1470) 254(160) 270(1450) 287(2600)
紫外可见光吸收-概述说明以及解释

紫外可见光吸收-概述说明以及解释1.引言1.1 概述概述部分的内容:紫外可见光吸收是指物质对紫外光和可见光的吸收现象。
光是一种电磁波,在不同波长范围内的光对物质的相互作用产生了不同的效果。
紫外可见光吸收是光谱学中的一个重要研究领域,它涉及到物质结构的分析、理解和应用。
在大自然或实验室中,我们能够观察到许多物质对紫外可见光的吸收现象。
这些物质可以是有机化合物、无机化合物、生物分子等。
通过测量物质对紫外可见光的吸收特性,我们可以了解到物质的电子结构、能级间距、电子转移过程等信息,从而对其性质和应用进行研究和评估。
紫外可见光吸收具有许多重要的应用,例如光谱分析、物质鉴定、药物分析、环境监测等。
通过测量物质对不同波长光的吸收强度,我们可以确定物质的组成成分、浓度、反应动力学等参数,为科学研究和工程技术应用提供了重要的实验手段和理论依据。
随着科学研究和技术进步的不断推进,对紫外可见光吸收的深入理解和应用需求也越来越高。
研究人员们通过改进仪器设备、开展理论模拟和计算、设计新的功能材料等手段,不断拓展和深化了对紫外可见光吸收的研究。
这些努力不仅有助于推动科学的发展和技术的进步,还为解决环境污染、新能源开发、生物医学等重大问题提供了新的思路和方法。
在本文中,我们将系统地介绍紫外可见光吸收的定义和特点、吸收机制以及其在实际应用中的意义。
通过对这些内容的深入探讨,我们可以更好地理解和应用紫外可见光吸收的原理和方法,为相关领域的研究和应用提供有力支持。
1.2 文章结构:本文共分为三个主要部分:引言、正文和结论。
首先,在引言部分,将对紫外可见光吸收进行概述,介绍其定义和特点。
然后,对本文的结构进行说明,包括各个部分的内容及其对整篇文章的重要性。
此外,还会明确本文的目的,即为读者提供关于紫外可见光吸收的全面认识。
接下来,在正文部分,将详细探讨紫外可见光的吸收机制,包括分析其原理和过程。
此外,还将探讨紫外可见光吸收在实际应用中的意义,例如在光谱分析、材料科学和生物医学等领域的应用。
紫外-可见光光谱解析

分析原理
朗伯定律
1729年波格尔在实验中发 现物质对光的吸收与吸光物 质的厚度有关。朗伯—波格 尔的学生进一步研究指出: 当溶液的浓度一定,光的吸 收程度与液层厚度成正比, 这就是朗伯定律。 表示为: A=k1b
A——吸光度
K1——比例常数
分析原理
1852年比尔(beer)在研
究各种无机盐对红光的吸
栅极,Grill
光束 屏蔽
紫外-可见光光度计
检测器
光束 阴极
e
阳极丝(Ni)
光电池
抽真空
紫外-可见光光度计
单色器
将光源发射的复合光分解成单色光并可从中选出 任一波长单色光的光学系统。 入射狭缝:光源的光由此进入单色器; 准光装置:透镜或返射镜使入射光成为平行光束; 色散元件:将复合光分解成单色光;棱镜或光栅; 聚焦装置:透镜或凹面反射镜,将分光后所得单色
光聚焦至出射狭缝;
出射狭缝: 光源进入吸收池。
紫外-可见光光度计
吸收池
也叫比色皿,有玻璃的,有石英的,在紫外区须
采用石英池,可见区一般用玻璃池。 。要求自身对
光的吸收要小。
紫外-可见光光度计
利用光电效应将透过吸收池的光
检测器
信号变成可测的电信号,常用的有光电池、光电管或
光ቤተ መጻሕፍቲ ባይዱ倍增管。
石英套
光 电 倍 增 管
阳极
1个光子产生106~107个电子
收后又指出:当单色光通 过溶液层的厚度一定时, 溶液的吸光度与溶液的浓 度成正比,即比尔定律, 表示为: A = log( I0/ I ) = K2c
分析原理
将朗伯定律和比尔定律合并,即为朗伯比尔定律。
A = log( I0 / I ) = log( 1/ T) = kcb
TU-1901双光束紫外可见分光光度计使用说明(精)

TU-1901双光束紫外可见分光光度计1 仪器介绍紫外可见分光光度计是一种历史悠久、覆盖面很广、使用很多的分析仪器, 在有机化学、生物化学、药品分析、食品检验、医药卫生、环境保护、生命科学等各个领域的科研、生产工作中都得到了极其广泛的应用。
北京普析通用仪器有限责任公司作为分析仪器的专业制造企业, 多年的紫外分光光度计设计和制造经验在 TU1901系列上得到了更充分地体现。
TU-1901、 TU-1900紫外可见分光光度计系列产品以其出色的技术指标和稳定可靠的工作特性, 友好直观的显示界面, 流畅的人机对话操作, 成功实现了超高精度和可靠性测量的严格要求,能极大地满足最专业用户分析工作需要。
2 主要特点①强劲的仪器性能:极其优良的光学系统,先进的电子学系统,高水准的机械系统,保证了 0.010%T的超低杂散光;②稳定可靠的品质:双光束动态反馈比例记录测光系统保证了基线稳定性; 氘灯、光电倍增管等关键器件均用进口件,保证仪器的稳定可靠和长寿命; ③精准的测量:采用进口优质全息光栅,进一步降低仪器的杂散光,使仪器分析更加准确;④轻松高效的人机对话:基于 WINDOWS 环境设计的 UVWin 中文操作软件, 提供了丰富的仪器控制和操作功能。
简单易用, 灵活高效, 轻松满足使用者的分析要求;⑤优异的可扩展性:有蠕动进样器、超微量池架、恒温池架、光学积分球、镜面反射、光纤附件和比色皿系列等大量用户可选专用附件, 使仪器的应用范围大大扩展;⑥简单方便设备维护:独特的插座式钨灯和氘灯,换灯时免去光学调试,使设备仪器调试、维护更加简便。
3 技术参数波长范围:190nm ~900nm波长准确度:±0.3nm (开机自动校准波长重复性:0.1nm光谱带宽:TU-1900:2nmTU-1901:0.1nm 、 0.2nm 、 0.5nm 、 1.0nm 、 2.0nm 、 5.0nm 杂散光:≤0.01%T (220nm, NaI; 340nm, NaNo2光度方式:透过率、吸光度、反射率、能量光度范围:-4.0~4.0Abs光度准确度:±0.002Abs (0~0.5Abs ; ±0.004Abs (0.5~1.0Abs ; ±0.3%T (0~ 100%T 光度重复性:0.001Abs (0~0.5Abs ; 0.002Abs (0.5~1.0Abs基线平直度:±0.001Abs基线漂移:0.0004Abs/h (500nm, 0Abs预热 2小时后光度噪声:±0.0004Abs4 仪器操作①打开计算机的电源开关, 进入 Windows 操作环境。
紫外可见光光谱

波长: 400 — 800 nm,1.5 — 3 eV
一般的电子跃迁能量变化在1 – 20 eV。
10
能级 跃迁
电子能级间跃迁 的同时,总伴随 有振动和转动能 级间的跃迁。即 电子光谱中总包 含有振动能级和 转动能级间跃迁 产生的若干谱线 而呈现宽谱带。
11
物质对光的选择性吸收
物质吸收光之后
Bisdisulizole disodium: UVA 苯基二苯并咪唑四 磺酸酯二钠
7
化学防晒霜成分特点
苯环 不饱和键多 杂原子化合物 不饱和键越多,吸收往UVA移
为什么?
8
防晒霜的使用
该涂抹多少?或 是防晒霜的浓度 多高才有效?
9
紫外线为什么会伤害?---- 能 量
紫外光
近紫外: 200 — 400 nm, 3 — 6 eV 真空紫外:100 — 200 nm, 6 — 12 eV
光谱的来源主要是在这些有机分子中s、 p和n轨道上的电子的跃迁。(The observed transitions involve electrons engaged in s or p or nonbonding n electron orbitals.
43
分子轨道(molecular orbitals)
41
Electronic Transitions of organic compounds etc.
紫外可见光谱和分子轨道的跃迁
42
概要
紫外可见光谱研究的主要对象是有机分 子 (Organic compounds represent the majority of the studies made in UV/Vis.)
Ce(IV)离子的吸收光谱 A:使用玻璃比色皿 B:使用石英比色皿 虚假峰的出现(虚假吸收)
紫外-可见光谱

取代苯 烷基取代苯:影响小,由于超共轭效应,导致红移,
降低B- 带的精细结构; 助色团取代苯:n 电子与苯环形成 p-π共轭,导致红移,
增强B-带的强度,降低B- 带的精细结构
连有推电子基团的红移强弱顺序为: CH3 < Cl < Br < OH < OCH3 < NH2 < O-
同环双键母体 253 两个延长双键 60 三个环外双键 15 五个取代烃基 25 —————————
353nm
IV
具有四个以上双键的共轭体系,K- 带λmax 和εmax 值按规则计算:
λmax = 114 + 5M + n(48.0-1.7n) – 16.5 Rendo -10 Rexo εmax = (1.74 x 104) n
红移 紫移
取代苯的λmax 值经验计算参数 λmax = 203.5 + 取代基位移值 (误差有时较大)
Scott 规则
多核芳香族化合物:总体红移。 多联苯以及苯并多环
杂环芳香族化合物
六元环:较苯的吸收加强;并产生 n→π* 跃迁;
五元环:类似双烯。
6. 影响紫外光谱的因素: 外部因素:
溶剂:纯度极其重要;极性影响复杂; 浓度:控制吸光度为0.7-1.2范围; 样品池:应不影响样品对紫外的吸收;
内部因素: 位阻:
平衡体系的紫外光谱:
一些极性化合物,在极性或pH 不同的溶剂中 光谱有较大的变化,如互变异构平衡及酸碱平衡:
中性
碱性
7. 紫外光谱解析
缺点:只提供分子中共轭体系和一些基团的结构信 息,不能推知分子结构。
紫外-可见光谱分析

吸收曲线与最大吸收波长 max可用不同波长的单色
光照射,测吸光度得到——扫描
同一种物质对不同波长光的吸光度不同。吸光度最大
处称为吸收峰,所对应的波长称为最大吸收波长max
峰 肩
末端吸收 谷
吸收曲线可以提供 物质的结构信息,并 作为物质定性分析的 依据之一。 不同浓度的同一种物质,其吸收曲线形状相似λmax不变。而 对于不同物质,它们的吸收曲线形状和λmax则不同。
二、无机化合物的吸收光谱
无机化合物的UV-Vis光谱吸收光谱主要有: 电荷迁移跃迁及配位场跃迁
配位场跃迁( d一d、 f 一f 跃迁)
在配体存在下过渡金属元素5个能量相等的d 轨道和镧系、 锕系7个能量相等的的 f 轨道裂分,吸收辐射后,低能态的d 电子或f电子可以跃迁到高能态的d或f轨道上去。 绝大多数过渡金属离子都具有未充满的 d 轨道,按照晶体场 理论,当它们在溶液中与水或其它配体生成配合物时,受配 体配位场的影响,原来能量相同的 d轨道发生能级分裂,产 生 d-d 电子跃迁。 必须在配体的配位场作用下才可能产生, 所以称为配位场跃迁;
n<p
n
n
p
非极性溶剂中 极性溶剂中
n >p
n p
非极性溶剂中 极性溶剂中
溶剂的极性除了影响吸收峰的位置,还影响吸收光谱 的精细结构:
N HC
N
CH 对称四嗪
N
极性溶剂使精细结构消失
蒸汽中
环己烷
水中
4. 体系pH的影响
pH影响吸光物质的存在形态,产生不同的吸收光谱. 如苯酚,在酸性或中性水溶液中,有210.5nm及270nm 两个吸收带;而在碱性溶液中,则分别红移到235nm和
吸收波长为150~250nm,大部分在远紫外区
紫外可见光

I-<Br-<Cl-<F-<OH-<C2O42-~H2O<SCN-<NH3<en<NO2-<CN
Vis UV
"Spectrochemical Series"
2、电荷转移跃迁
在光辐射作用下,金属络离子中一方的电子向另一方 的轨道跃迁而产生的吸收光谱
M
n
L M
hv
b
n1
L
b1
1、d-d配位场跃迁
晶体场理论:配位场的影响,金属离子的d轨道分裂
特点: (1)有配位场存在,d轨道分裂 (2)d-d跃迁几率小,弱吸收,=0.1~100之间
( 3 )吸收波长与分裂能有关,配位场越强,分裂能
越大,波长越小
再如:Cu2+,H2O:浅蓝色(794nm);
NH3:深蓝色(663nm)
Substituents may have any of four effects on a chromophore • Bathochromic shift (red shift) – a shift to longer ; lower energy • Hypsochromic shift (blue shift) – shift to shorter ; higher energy • Hyperchromic effect – an increase in intensity • Hypochromic effect – a decrease in intensity
n
弱吸收,
p 跃迁
集中在280 nm。
C O
能量低,紫外-可见光区,
e 100 含杂原子不饱和基团(—C ≡N ,C= O )s ps phv
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
紫外与可见光吸收光谱类型
* ∏→ ∏*跃迁; * n → ∏*跃迁; * Ó → Ó*跃迁; * n → Ó*跃迁; * 电荷转移; * 配位体场跃迁;
发色团
使物质具有颜色的基团称为发 色团。
最有用的紫外—可见光谱是由 ∏→ ∏*, n → ∏*跃迁产生 的。这两种跃迁均要求有机 物分子中含有不饱和基团。 这类含有∏键的不饱和基团 称为发色团。简单的发色团 由双键或三键体系组成,如; 烯基,炔基,羰基,亚硝基, 偶氮基—N=N—,氰基— C≡N—等。
(5) 溶剂
*一般螯合物在有机 溶剂中溶解度大,提 高显色反应的灵敏度
(6)共存离子干扰 干扰组分有色或干扰组分与L生成有色络合物,产生正干扰,A值
增大;干扰组分与L或M生成无色络合物,则会使M或L浓度降低, 产生负干扰,A值减少。 *利用络和反应消除干扰。例如:使用EDTA—柠檬酸为掩蔽剂可掩 蔽铝,铋,镉,铬,钼,锑,锡,,钛,铀,钨,锌和锆等元素。
形成多元络合物
多元络合物是由三种或三种以上的组分 所形成的络合物。目前应用较多的是由一种 金属离子与两种配位体所组成的三元络合物。 三元络合物在吸光光度分析中应用较普遍。
金属离子与一种络合剂 形成未饱和络合物,然后与另一种络合剂结 合,形成三元混合配位络合物,简称三元混 配络合物。例如,V(V),H2O2和吡啶偶氮间 苯二酚(PAR)形成1:1:1的有色络合物,可用 于钒的测定,其灵敏度高,选择性好
形成离子缔合物
金属离子先与络合剂生成络阴离
子或络阳离子,再与带反电荷的离子
生成离子缔合物。主要用于萃取光度 法。 如:Ag+与1,10-邻二氮菲形成
阳离子,再与溴邻苯三酚红的阴离子 形成深蓝色的离子缔合物。用F-、 HAg2O+。2、EDTA作掩蔽剂,可测定微量
作为离子缔合物的阳离子,有碱 性染料、1,10-邻二氮菲及其衍生物、
用分光光度法测定时,为提高测定的灵敏度和选 择性,一般利用显色反应。选择适当的试剂与被 测离子反应生成有色化合物再进行测定是分光光 度法测定金属离子最常用的方法。所发生的反应 为显色反应,所选的试剂称为显色剂。
有机显色剂
A 磺基水杨酸 OO型螯合剂,可与很多高价金属离 子生成稳定的螯合物,主要用于测Fe3+。 B 丁二酮肟 NN型螯合显色剂,用于测定Ni2+。 C 1,10-邻二氮菲 NN型螯合显色剂,测微量Fe2+。 D 二苯硫腙 含S显色剂,萃取光度测定Cu2+, Pb2+,Zn2+,Cd2+ Hg2+等。 E 偶氮胂Ⅲ(铀试剂Ⅲ) 偶氮类螯合剂,强酸性溶液 中测Th(Ⅳ),Zr(Ⅳ),U(Ⅳ)等;在弱酸性溶液中测 稀土金属离子。 F 铬天青S 三苯甲烷类显色剂,测定Al3+。 G 结晶紫 三苯甲烷类碱性染料,测定Tl3+。
安替比林及其衍生物、氯化四苯砷 (或磷、锑)等;作为阴离子,有X-, S性C染N料-,等C。lO4-,无机杂多酸和某些酸
形成金属离子-络合剂-表面活性剂体系 金属离子与显色剂反应时,加入某些
表面活性剂,可以形成胶束化合物,它们 的吸收峰向长波方向移动(红移),而测定 的灵敏度显著提高。目前,常用于这类反 应的表面活性剂有溴化十六烷基吡啶、氯 化十四烷基二甲基苄胺、氯化十六烷基三 甲基铵、溴化十六烷基三甲基铵 、溴化 羟基十二烷基三甲基铵、OP乳化剂。例 如,稀土元素、二甲酚橙及溴化十六烷基 吡啶反应,生成三元络合物,在pH 8~9 时呈蓝紫色,用于痕量稀土元素总量的测 定。
杂多酸 溶液在酸性的条件下,过量的钼酸盐与磷
酸盐、硅酸盐、砷酸盐等含氧的阴离子作用生 成杂多酸,作为吸光光度法测定相应的磷、硅、 砷等元素的基础。杂多酸法需要还原反应的酸 度范围较窄,必须严格控制反应条件。很多还 原剂都可应用于杂多酸法中。氯化亚锡及某些 有机还原剂,例1-氨基-2-萘酚-4-磺酸加亚硫 酸盐和氢醌常用于磷的测定。硫酸肼在煮沸溶 液中作砷钼酸盐和磷钼酸盐的还原剂。抗坏血 酸也是较好的还原剂。
*选择掩蔽剂的几个经验规律: 根据“硬亲硬 ”、“软亲软”原则选择;
硬金属离子与硬配位体的络合物稳定性随金属离子电荷增多而提高, 软金属离子和配位体络合物稳定性时常与此相反;
配位体通过硫或氮与金属离子成键时,低价离子络合物比较稳定。
*可利用配位体缓冲作用提高掩蔽剂的选择掩蔽作用。 *混合掩蔽剂带有协同作用,因此常使用混合掩蔽剂。 *控制一定酸度使干扰组分不生色。 *选择适当的波长。 *选择适当的参比溶液。 *分离干扰离子。
紫外—可见光 分光光度法的显色
03081041 何洁丽
对紫外,可见光有吸收的物 质有可能用紫外—分光光度 法测定。
被测组分溶液有颜色是有可 能用可见光分光光度法测定 的必要条件。
物质会呈现特征的颜色,是 由于它们对可见光中某些特 定波长的光线选择吸收的缘 故。
物质只能选择吸收能量相当 于该分子振动能量变化△ E 振,转动能量△转以及电子 运动能量变化△E电子之总 和的辐射。
助色团
有些基团本身虽然不会使物
质具有颜色(不能吸收大 于200nm的光),但它们 与发色团相连时会发生n → ∏共轭作用,增大某一 发色团的发色能力(吸收
波长向长波方向移动,且
吸收强度增加),这样的
基团称为助色团。助色团 通常是一些含有为共享n 电子对的氧原子,氮原子 或卤素原子的基团(— OH、—OR、— NH2、 ——NHR、— X)。
pH与吸光度关系曲线确定pH范围 。
(2)显色剂用量
*为使反应尽可能完全, 应加过量的显色剂。 *对稳定性较高的络和物, 只要加入稍过量的试剂 就能定量进行。 *对某些不稳定的或形成 逐级络和物的反应,必 须控制试剂的用量。
(3)温度 *通过实验确定温度范围,
通常在室温下进行.
(4)时间 *通过实验确定显色 时间及测量吸光:溶液酸度,显色剂用量,
试剂加入顺序,显色时间,显色温度,有 机络合物的稳定性及共存离子的干扰等。 (1)溶液的酸度
M+HR===MR + H+ * 影响显色剂的平衡浓度和颜色 * 影响被测金属离子的存在状态 * 影响络合物的组成
控制溶液PH值是试剂电离出的离子浓度在 一定范围内,使主反应能定量进行或不显 著进行。
