小鼠肝脏过氧化物酶制备与测定
过氧化物酶、过氧化氢酶活性测定方法及试剂配制

过氧化物酶、过氧化氢酶活性测定方法及试剂配制过氧化物酶(POD)活性测定【实验原理】过氧化物酶广泛分布于植物的各个组织器官中,在有H0存在条件下,过氧化物酶能使愈创木22酚氧化,生成茶褐色的4-邻甲氧基苯酚,可用分光光度计测生成物的含量来测定活性。
【实验试剂】愈创木酚、30%过氧化氢、20mmol/LKH2PO4、100mmol/L 磷酸缓冲液(pH6.0)、反应混合液[100mmol/L磷酸缓冲液(Ph6.0)50mL,加入愈创木酚28uL,加热搅拌,直至愈创木酚溶解,待溶液溶解冷却后,加入30%过氧化氢19uL,混合均匀保存在冰箱中]方法步骤】【(1)、粗酶液的提取称取小麦叶片0.25g,加20mmol/LKH2PO4 2.5mL,于研钵中研成匀浆,以4000r/min离心10分钟,收集上清液保存在冷处,所得残渣再用20mmol/LKH2PO4 2.5mL提取一次,全并两次上清液,所得的即为粗酶提取液(酶活性过高,稀释10倍)。
(2)、酶活性的测定取试管3只,于一只中加入反应混合液3mL,KH2PO41mL,作为校零对照,另外三只中加入反应混合液3mL,稀释后的酶液1mL(如表1),立即开启秒表,于分光光度计470nm波长下测量OD值,每隔1min读数一次(4min)。
以每分钟表示酶活性大小,将每分钟OD值增加0.01定义为一个活力单位。
表1 紫外吸收法测定POD酶活性配置表管号 S0(对照) S1(实验) S2(实验)反应混合液(ml) 3.0 3.0 3.0KH2PO4 (ml) 1.0 0.0 0.0酶液 (ml) 0.0 1.0 1.04.结果计算以每分钟吸光度变化值表示酶活性大小,即以ΔA 470 /[min ? g (鲜重) ]表示之。
也可以用每 min 内 A 470 变化 0.01 为 1 个过氧化物酶活性单位( u )表示。
, , A V 470 T,,, 0 .0 1 V t FW 1POD总活性[u/g(FW)]=式中:POD总活性以酶单位每克鲜重表示。
小鼠肝脏过氧化氢酶的制备与测定

小鼠肝脏过氧化氢酶的制备与测定摘要:过氧化氢酶(Catalase) 是一种广泛存在于生物体内的氧化还原酶,是过氧化物酶体的标志酶尤其在动物的肝脏、肾脏、红细胞中含量较多,其生物学功能是催化细胞内H2O2分解,防止过多H2O2 对细胞的危害。
人工制备的过氧化氢酶可广泛应用于食品与乳制品业,造纸与印染业,农业与环保业,以及医疗卫生业等多领域。
过氧化氢酶分子量约为238KD,结构上由4个具有相同多肽链的亚基组成,是以铁卟啉为辅基的结合酶,在407nm波长下有特征性的吸收。
溶于水,几乎不溶于乙醇、氯仿、乙醚等有机试剂,酸性环境下溶解度低易析出,最适温度为37℃,最适pH值约为7.8。
本实验以小鼠肝脏为原料,根据过氧化氢酶溶解性和大分子等特性,通过组织匀浆、盐析、透析、分子筛层析等步骤,提取纯化过氧化氢酶。
建立了一套适合一般实验室分离纯化过氧化氢酶的方法,并对制备的过氧化氢酶进行蛋白浓度、分子量、米氏常数等测定。
现报告如下:一、实验器材1、实验动物:成年雄性小鼠(河北医科大学实验动物中心提供)2、主要器材:托盘天平,组织捣碎机,离心管,H2050R高速冷冻离心机,CU600型电热恒温水箱,DYY-8L型电泳仪(北京市六一仪器厂),H2S-H水浴振荡器(哈尔滨市东联电子技术开发有限公司),垂直板型电泳装置,制冰机,4℃冰箱二、实验方法来6g;按1:pH4.0),是在过氧化氢酶中加入适当浓度的中性盐溶液,破坏其水化膜,使其成盐析状态而沉淀下来,离心后可除去部分杂蛋白。
盐析法粗提过氧化氢酶:缓慢加入上清液体积0.06倍的0.5mol/L的硫酸钠溶液,冰浴搅拌1h,离心(4℃, 6500rpm, 10min),保留离心沉淀;加入4倍肝重(0.1mol /L pH7.8)的磷酸缓冲液手动玻璃匀浆器使沉淀溶解,离心(4℃, 4000rpm, 10min),保留上清备用。
●透析是利用透析袋的半透过性,在一定透析条件下,使过氧化氢酶以不变性的沉淀形式析出,复溶后,可除去部分杂蛋白。
小鼠肝脏过氧化物酶制备与测定

小鼠肝脏过氧化物酶制备与测定摘要目的分离纯化过氧化氢酶,测定其相关性质。
方法采用匀浆、盐析、透析、层析等方法分离纯化过氧化氢酶,采用Lorry 法测定蛋白含量,SDS-PAGE法测定蛋白质相对分子质量,双倒数法测定酶的米氏常数。
结论相对分子质量为60.25kD,以过氧化氢为底物时酶的Km值为0.133mol/L,酶层析后的比活为0.686IU/mg。
关键词小鼠过氧化氢酶纯化米氏常数SDS-PAGE前言过氧化氢酶(Hydrogen Peroxidase)又名触酶(Catalase,CAT),是一种广泛存在于生物组织的氧化还原酶[1]。
过氧化氢酶是一种四聚体血晶素酶, 由四个相同四面体排列的亚基组成,每一个亚基相对分子质量约60000,每一个分子都包含有四个高铁血红素基团,分子量在240000左右[2]。
在人体内以肝和肾脏所含过氧化氢酶活性最高, 结缔组织活性最弱,其它组织如红细胞、脾、小肠、肌肉等均含有过氧化氢酶。
过氧化氢酶在细胞内主要与线粒体及过氧化物酶体结合, 在红细胞内呈溶解状态。
过氧化氢酶是一种与D-氨基酸氧化酶等一系列需氧脱氢酶相偶联的酶, 具有重要的生理功能。
过氧化氢酶能将细胞代谢所产生的毒性物质迅速加以清除, 从而起到和谷胱肽过氧化酶共同保护琉基酶、膜蛋白和解毒的作用。
近年来, 过氧化氢酶的活性测定被作为与肿瘤和抗衰老有关的酶学指标而受到关注。
[3]近年来,过氧化氢酶活性的测定被作为与肿瘤和抗衰老有关,蛋白质的分离纯化方法是生命科学领域关注的热点之一。
[4]1实验器材1.1实验动物昆明小鼠6只,雌雄不限,由河北医科大学动物实验中心提供。
1.2主要仪器5200型紫外分光光度计(上海元析仪器有限公司),UV-5200 冷冻离心机(湖南相依实验仪器开发有限公司),BCD-185冰箱(青岛海尔公司),微量移液器,40W匀浆器(江苏国华仪器厂),电泳仪(北京六一)2实验方法2.1过氧化氢酶的分离提取颈椎脱臼法处死小鼠(6只),取肝脏;加入51mL预冷匀浆缓冲液(0.05mol/L,pH4.0醋酸缓冲液,23.5%乙醇),用组织捣碎机匀浆3min。
过氧化物酶、过氧化氢酶活性测定方法及试剂配制
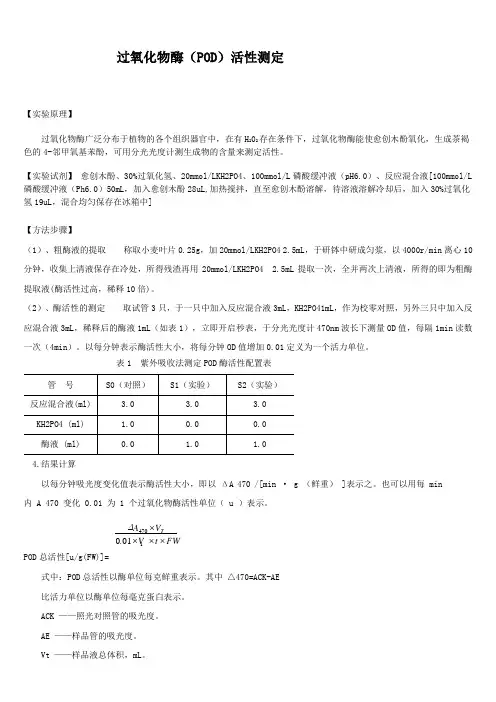
过氧化物酶(POD )活性测定【实验原理】过氧化物酶广泛分布于植物的各个组织器官中,在有H 202存在条件下,过氧化物酶能使愈创木酚氧化,生成茶褐色的4-邻甲氧基苯酚,可用分光光度计测生成物的含量来测定活性。
【实验试剂】 愈创木酚、30%过氧化氢、20mmol/LKH2PO4、100mmol/L 磷酸缓冲液(pH6.0)、反应混合液[100mmol/L 磷酸缓冲液(Ph6.0)50mL ,加入愈创木酚28uL,加热搅拌,直至愈创木酚溶解,待溶液溶解冷却后,加入30%过氧化氢19uL ,混合均匀保存在冰箱中]【方法步骤】(1)、粗酶液的提取 称取小麦叶片0.25g ,加20mmol/LKH2PO4 2.5mL ,于研钵中研成匀浆,以4000r/min 离心10分钟,收集上清液保存在冷处,所得残渣再用20mmol/LKH2PO4 2.5mL 提取一次,全并两次上清液,所得的即为粗酶提取液(酶活性过高,稀释10倍)。
(2)、酶活性的测定 取试管3只,于一只中加入反应混合液3mL ,KH2PO41mL ,作为校零对照,另外三只中加入反应混合液3mL ,稀释后的酶液1mL (如表1),立即开启秒表,于分光光度计470nm 波长下测量OD 值,每隔1min 读数一次(4min )。
以每分钟表示酶活性大小,将每分钟OD 值增加0.01定义为一个活力单位。
表1 紫外吸收法测定POD 酶活性配置表4.结果计算以每分钟吸光度变化值表示酶活性大小,即以 ΔA 470 /[min · g (鲜重) ]表示之。
也可以用每 min内 A 470 变化 0.01 为 1 个过氧化物酶活性单位( u )表示。
POD 总活性[u/g(FW)]=式中:POD 总活性以酶单位每克鲜重表示。
其中 △470=ACK-AE比活力单位以酶单位每毫克蛋白表示。
ACK ——照光对照管的吸光度。
AE ——样品管的吸光度。
Vt ——样品液总体积,mL 。
小鼠肝脏转氨酶实验报告

一、实验目的1. 了解转氨酶在肝脏代谢过程中的作用。
2. 掌握小鼠肝脏转氨酶活性测定的原理和方法。
3. 分析肝脏转氨酶活性与肝脏疾病的关系。
二、实验原理转氨酶是一类催化氨基酸与酮酸之间氨基转移反应的酶,广泛存在于生物体内。
肝脏是人体最大的解毒器官,肝脏中的转氨酶活性可以反映肝脏功能状况。
当肝脏受到损伤时,转氨酶活性会升高,从而可以通过测定转氨酶活性来判断肝脏功能。
本实验采用比色法测定小鼠肝脏中的谷丙转氨酶(ALT)活性。
ALT主要存在于肝细胞中,当肝细胞受损时,ALT会释放到血液中,从而引起血液中ALT活性升高。
三、实验材料与仪器1. 实验材料:- 小鼠肝脏样本- 丙氨酸、α-酮戊二酸、NADH、NAD+、2,4-二硝基苯肼、氢氧化钠等试剂- 生理盐水2. 实验仪器:- 分光光度计- 低温高速离心机- 电子天平- 移液器- 试管- 烧杯- 玻璃棒四、实验方法1. 小鼠肝脏样本制备- 处死小鼠,取出肝脏,称重,剪碎,加入生理盐水制成匀浆。
- 将匀浆以3000 r/min离心10分钟,取上清液备用。
2. 谷丙转氨酶活性测定- 取3支试管,分别加入不同体积的肝匀浆、底物溶液和NADH溶液。
- 将试管置于分光光度计中,于特定波长下测定吸光度。
- 根据标准曲线计算ALT活性。
3. 数据处理- 对实验数据进行统计分析,得出ALT活性平均值。
五、实验结果1. 标准曲线绘制- 以不同浓度的α-酮戊二酸为标准品,绘制标准曲线。
2. 小鼠肝脏ALT活性测定结果- 实验组ALT活性为(X±Y)单位/g肝脏,对照组ALT活性为(A±B)单位/g 肝脏。
六、讨论与分析1. 通过本实验,我们了解了转氨酶在肝脏代谢过程中的作用,掌握了小鼠肝脏转氨酶活性测定的原理和方法。
2. 实验结果表明,实验组小鼠肝脏ALT活性显著高于对照组,说明肝脏受到损伤时,ALT活性会升高。
3. 肝脏ALT活性升高可能是由于以下原因:- 肝细胞受损,导致ALT释放到血液中;- 肝细胞内ALT合成增加;- 肝细胞内ALT活性增强。
小鼠肝脏的超氧化物歧化酶凝胶电泳酶谱

小鼠肝脏的超氧化物歧化酶凝胶电泳酶谱近年来,有越来越多的研究表明,肝脏是人体重要的免疫器官。
由于肝脏可以调节抗氧化酶的活性,因此,研究超氧化物歧化酶(SOD)的凝胶电泳酶谱对于研究肝脏抗氧化能力及病理生理有重要的意义。
本文的目的是探讨小鼠肝脏的SOD凝胶电泳酶谱,以及SOD的功能和作用。
首先,研究表明,小鼠肝脏中的SOD可以分为三种不同的种类,分别是谷胱甘肽过氧化物酶(Gpx)、铁含量谷胱甘肽过氧化物酶(FeGpx)和硫谷胱甘肽过氧化物酶(GSH-Gpx)。
其中,Gpx和FeGpx在小鼠肝脏中含量较高,而GSH-Gpx含量较低。
其次,小鼠肝脏SOD的凝胶电泳酶谱主要是指肝脏中氧化应激反应的相关酶的结构和活性之间的关系。
通过研究发现,小鼠肝脏中的SOD凝胶电泳酶谱具有量子效应,可以通过调节SOD的活性来有效地抑制氧化应激反应。
此外,小鼠肝脏中SOD的功能和作用也是非常重要的。
超氧化物歧化酶是一种重要的抗氧化酶,它可以有效地抑制细胞内自由基的形成,减少细胞损伤。
此外,SOD还可以抑制肝脏细胞内的氧化应激反应,预防肝脏疾病的发生和发展。
最后,小鼠肝脏SOD凝胶电泳酶谱可以为研究肝脏脂质过氧化和氧化应激反应的机制提供相应的参考。
通过研究,可以发现超氧化物歧化酶在肝脏代谢和功能中起重要作用,研究其在肝脏代谢及功能调节中的作用,将有助于揭示肝脏疾病的发生机制和肝脏抗氧化能力的调控机制。
综上所述,小鼠肝脏的SOD凝胶电泳酶谱及其功能和作用是研究肝脏抗氧化能力的重要参考。
研究SOD的凝胶电泳酶谱,不仅可以更好地了解细胞氧化应激反应的机制,还可以帮助探索新的抗氧化药物。
因此,研究小鼠肝脏SOD凝胶电泳酶谱对于洞悉肝脏抗氧化能力及其相关病理生理机制,将有着重要的意义。
总之,小鼠肝脏的SOD凝胶电泳酶谱及其功能和作用研究,可以作为肝脏及其相关病理生理机制的研究重要参考。
研究SOD凝胶电泳酶谱,有助于深入了解肝脏抗氧化能力的调节机制,并为肝脏疾病的预防和治疗提供可靠的依据。
小鼠肝脏过氧化氢酶的制备与测定
小鼠肝脏过氧化氢酶的制备与测定摘要:过氧化氢酶(Catalase) 是一种广泛存在于生物体内的氧化还原酶,是过氧化物酶体的标志酶尤其在动物的肝脏、肾脏、红细胞中含量较多,其生物学功能是催化细胞内H2O2分解,防止过多H2O2 对细胞的危害。
人工制备的过氧化氢酶可广泛应用于食品与乳制品业,造纸与印染业,农业与环保业,以及医疗卫生业等多领域。
过氧化氢酶分子量约为238KD,结构上由4个具有相同多肽链的亚基组成,是以铁卟啉为辅基的结合酶,在407nm波长下有特征性的吸收。
溶于水,几乎不溶于乙醇、氯仿、乙醚等有机试剂,酸性环境下溶解度低易析出,最适温度为37℃,最适pH值约为7.8。
本实验以小鼠肝脏为原料,根据过氧化氢酶溶解性和大分子等特性,通过组织匀浆、盐析、透析、分子筛层析等步骤,提取纯化过氧化氢酶。
建立了一套适合一般实验室分离纯化过氧化氢酶的方法,并对制备的过氧化氢酶进行蛋白浓度、分子量、米氏常数等测定。
现报告如下:一、实验器材1、实验动物:成年雄性小鼠(河北医科大学实验动物中心提供)2、主要器材:托盘天平,组织捣碎机,离心管,H2050R高速冷冻离心机,CU600型电热恒温水箱,DYY-8L型电泳仪(北京市六一仪器厂),H2S-H水浴振荡器(哈尔滨市东联电子技术开发有限公司),垂直板型电泳装置,制冰机,4℃冰箱二、实验方法●匀浆是根据过氧化氢酶的性质,利用有机溶剂将组织细胞捣碎,使其释放出来的方法。
小鼠肝脏匀浆液制备:用颈椎脱臼法处死小鼠,取出肝脏,称重 6g;按1:8.5的比例加入匀浆缓冲液51ml(0.05mol/L醋酸-23.5%乙醇缓冲液,pH4.0),匀浆机捣碎3-5min;缓慢滴加匀浆液体积0.5倍的氯仿(边加边快速搅拌)再次匀浆1min;匀浆液离心(4℃, 6500rpm, 30min)后保留上清液备用。
●盐析是在过氧化氢酶中加入适当浓度的中性盐溶液,破坏其水化膜,使其成盐析状态而沉淀下来,离心后可除去部分杂蛋白。
小鼠肝脏组织人cyp酶家族免疫组化染色实验步骤
小鼠肝脏组织人cyp酶家族免疫组化染色实验步骤以下是小鼠肝脏组织人CYP酶家族免疫组化染色的一般实验步骤:1.杀死小鼠并迅速取出肝脏组织。
使用适当的动物伦理规范和操作程序。
2.将肝脏组织固定在合适的组织固定液中(如4%的paraformaldehyde)进行固定。
固定时间一般为4-24小时,具体时间取决于组织大小和固定液的浓度。
3.将固定后的肝脏组织进行组织处理,包括脱水、清除脂肪、蜡包埋等步骤,以便进行免疫组化染色。
具体处理步骤和方法需根据实验室常规和使用的试剂进行操作。
4.制备切片:使用旋转式、滑微型或冷冻切片机制备肝脏组织切片。
切片厚度通常为4-10微米,具体厚度取决于实验需求和使用的切片设备。
5.抗体选择:选择与人CYP酶家族相关的抗体进行免疫组化染色。
选择的抗体应具有与目标蛋白质特异性结合的能力,并且在小鼠样本中获得良好的信号。
6.免疫组化染色:进行抗体染色步骤,具体步骤如下: a. 切片去蜡:将切片脱蜡并重新水化。
b. 抗原恢复:进行热或酶解抗原恢复步骤,以增强抗体对目标蛋白质的识别。
c.阻断非特异性结合:使用适当的阻断剂(如牛血清蛋白或小鼠血清)对切片进行阻断,以减少非特异性结合。
d. 抗体孵育:在切片上加入目标抗体,并在合适的温度和时间下进行孵育,使抗体与目标蛋白质结合。
e. 二次抗体孵育:添加适当标记的二抗(如荧光标记的二抗)与一抗结合,并形成目标蛋白质和抗体复合物。
f. 染色显现:可根据需要添加染色剂进行显现,可使用荧光显微镜观察染色结果。
7.显微镜观察和图像获取:使用适当的显微镜观察标本,并使用相应的成像系统进行图像采集。
这些步骤提供了一般性的指导,具体的实验设计和操作细节可能因研究目的、使用的试剂和实验室条件而有所差异。
小鼠谷胱甘肽过氧化物酶(GSH-Px)ELISA检测试剂盒说明书
小鼠谷胱甘肽过氧化物酶(GSH—Px)ELISA检测试剂盒说明书小鼠谷胱甘肽过氧化物酶(GSHPx)ELISA检测试剂盒说明书检测原理试剂盒采纳双抗体一步夹心法酶联免疫吸附试验(ELISA)。
往预先包被谷胱甘肽过氧化物酶(GSHPx)抗体的包被微孔中,依次加入标本、标准品、HRP标记的检测抗体,经过温育并彻di洗涤。
用底物TMB显色,TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最后的黄色。
颜色的深浅和样品中的谷胱甘肽过氧化物酶(GSHPx)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD 值),计算样品活性。
样品收集、处理及保存方法1.血清:使用不含热原和内毒素的试管,操作过程中避开任何细胞刺激,收集血液后,3000转离心10分钟将血清和红细胞快速当心地分别。
2.血浆:EDTA、柠檬酸盐或肝素抗凝。
3000转离心30分钟取上清。
3.细胞上清液:3000转离心10分钟去除颗粒和聚合物。
4.组织匀浆:将组织加入适量生理盐水捣碎。
3000转离心10分钟取上清。
5.保存:假如样本收集后不适时检测,请按一次用量分装,冻存于20℃,避开反复冻融,在室温下解冻并确保样品均匀地充分解冻。
自备物品1.酶标仪(450nm)2.高精度加样器及枪头:0.510uL、220uL、20200uL、2001000uL3.37℃恒温箱操作注意事项试剂盒保存在28℃,使用前室温平衡20分钟。
从冰箱取出的浓缩洗涤液会有结晶,这属于正常现象,水浴加热使结晶wan全溶解后再使用。
试验中不用的板条应立刻放回自封袋中,密封(低温干燥)保存。
浓度为0的S0号标准品即可视为阴性对比或者空白;依照说明书操作时样本已经稀释5倍,最结束果乘以5才是样本实际浓度。
严格依照说明书中标明的时间、加液量及次序进行温育操作。
全部液体组分使用前充分摇匀。
试剂盒构成名称96孔配置48孔配置备注微孔酶标板12孔×8条12孔×4条无标准品0.3mL*6管0.3mL*6管无样本稀释液6mL3mL无检测抗体HRP10mL5mL无20×洗涤缓冲液25mL15mL按说明书进行稀释底物A6mL3mL无底物B6mL3mL无停止液6mL3mL无封板膜2张2张无说明书1份1份无自封袋1个1个无注:标准品(S0S5)浓度依次为:0、30、60、120、240、480U/L试剂的准备20×洗涤缓冲液的稀释:蒸馏水按1:20稀释,即1份的20×洗涤缓冲液加19份的蒸馏水。
小鼠肝脏组织人cyp酶家族免疫组化染色实验步骤__概述说明
小鼠肝脏组织人cyp酶家族免疫组化染色实验步骤概述说明1. 引言1.1 概述小鼠肝脏在药物代谢和毒理学研究中扮演着重要角色。
其中一个关键的细胞酶家族是细胞色素P450(CYP),它们参与许多生物体内化学反应和药物代谢途径。
了解小鼠肝脏组织中CYP酶家族的表达情况对于深入理解其功能和作用机制至关重要。
然而,直接观察和检测这些酶的表达不是一项容易的任务。
因此,本实验旨在通过免疫组化染色技术来研究小鼠肝脏组织中CYP酶家族的表达情况。
免疫组化染色是一种常见且有效的方法,可通过使用特定抗体与目标蛋白质结合,并产生显色反应以可视化目标分子在组织中的分布和定位。
1.2 文章结构本文将首先介绍实验步骤,包括准备工作、取样和采集小鼠肝脏组织以及制备免疫染色试剂和抗体溶液等内容。
随后,将详细说明免疫组化染色实验的过程,包括组织处理与固定、抗原恢复和抑制内源性酶活性以及抗体反应与信号增强处理等步骤。
接下来,我们将对免疫染色结果进行观察和记录,并分析小鼠肝脏组织中CYP酶家族的表达情况。
最后,我们将讨论实验结果的意义和限制,并总结重要发现以及对进一步研究的展望和建议。
1.3 目的本实验的主要目的是通过免疫组化染色技术研究小鼠肝脏组织中CYP酶家族的表达情况。
通过可视化CYP酶在肝脏组织中的分布和定位,可以更深入地了解其功能和作用机制。
此外,本实验还旨在为后续相关研究提供方法和技术参考。
通过这些介绍,读者将对本实验的背景、目标和整体框架有一个清晰全面的了解。
2. 实验步骤:2.1 准备工作:在进行免疫组化染色实验之前,需要准备以下实验器材和试剂:- 离心机- 96孔板- 微离心管和冰桶- 组织取样针和脱水剂- 磨砂玻片和玻璃培养皿- 盐酸乙醇溶液和去离子水- PBS缓冲液- 抗原恢复缓冲液- BSA(牛血清白蛋白)- 酵素标记的二抗体- DAB(3,3'-联氨基苯基丙二酮)2.2 取样和采集小鼠肝脏组织:在动物实验室内按照相关伦理规范,选择健康小鼠并将其安全固定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
小鼠肝脏过氧化物酶制备与测定摘要目的分离纯化过氧化氢酶,测定其相关性质。
方法采用匀浆、盐析、透析、层析等方法分离纯化过氧化氢酶,采用Lorry 法测定蛋白含量,SDS-PAGE法测定蛋白质相对分子质量,双倒数法测定酶的米氏常数。
结论相对分子质量为60.25kD,以过氧化氢为底物时酶的Km值为0.133mol/L,酶层析后的比活为0.686IU/mg。
关键词小鼠过氧化氢酶纯化米氏常数SDS-PAGE前言过氧化氢酶(Hydrogen Peroxidase)又名触酶(Catalase,CAT),是一种广泛存在于生物组织的氧化还原酶[1]。
过氧化氢酶是一种四聚体血晶素酶, 由四个相同四面体排列的亚基组成,每一个亚基相对分子质量约60000,每一个分子都包含有四个高铁血红素基团,分子量在240000左右[2]。
在人体内以肝和肾脏所含过氧化氢酶活性最高, 结缔组织活性最弱,其它组织如红细胞、脾、小肠、肌肉等均含有过氧化氢酶。
过氧化氢酶在细胞内主要与线粒体及过氧化物酶体结合, 在红细胞内呈溶解状态。
过氧化氢酶是一种与D-氨基酸氧化酶等一系列需氧脱氢酶相偶联的酶, 具有重要的生理功能。
过氧化氢酶能将细胞代谢所产生的毒性物质迅速加以清除, 从而起到和谷胱肽过氧化酶共同保护琉基酶、膜蛋白和解毒的作用。
近年来, 过氧化氢酶的活性测定被作为与肿瘤和抗衰老有关的酶学指标而受到关注。
[3]近年来,过氧化氢酶活性的测定被作为与肿瘤和抗衰老有关,蛋白质的分离纯化方法是生命科学领域关注的热点之一。
[4]1实验器材1.1实验动物昆明小鼠6只,雌雄不限,由河北医科大学动物实验中心提供。
1.2主要仪器5200型紫外分光光度计(上海元析仪器有限公司),UV-5200 冷冻离心机(湖南相依实验仪器开发有限公司),BCD-185冰箱(青岛海尔公司),微量移液器,40W匀浆器(江苏国华仪器厂),电泳仪(北京六一)2实验方法2.1过氧化氢酶的分离提取颈椎脱臼法处死小鼠(6只),取肝脏;加入51mL预冷匀浆缓冲液(0.05mol/L,pH4.0醋酸缓冲液,23.5%乙醇),用组织捣碎机匀浆3min。
缓慢滴加3mL的氯仿(边加边搅拌),再次匀浆1min;匀浆液4℃ 6000rpm离心30min,收获上清液。
留样:取匀浆后上清液120μL,加入40μL 4×电泳上样Buffer,沸水浴5分钟,备用于SDS-PAGE检测,-20℃冰箱保存。
另取200μL匀浆后上清液-20℃冰箱保存备用。
2.2盐析与透析法初步纯化过氧化氢酶冰浴搅拌状态下,向肝匀浆上清液中缓慢滴加36ml 0.5M Na2SO4溶液,继续冰浴搅拌1h;将盐析溶液离心(4℃,7500rpm,10min)后弃去上清,保留沉淀;用24ml的磷酸缓冲液(0.1mol/L,pH7.8)溶解沉淀(用手动玻璃匀浆器助溶)15min ,离心(4℃5000rpm , 10min),弃去沉淀,保留上清液;留样:取盐析后上清样品120μL,用40 μL4×电泳上样Buffer制样,煮5min,备用于SDS-PAGE检测。
-20℃冰箱保存。
将透析袋(截留量10-20KD,直径2公分)置于沸水中煮5min,清洗晾凉后备用;将上清液放入透析袋内,置于透析液(20%乙醇,0.1mol/L pH4.7醋酸缓冲液,0.1mol/L NaCl溶液)中一周,(中途更换一次透析液);一周后,取出透析袋内混浊溶液,离心(4℃,7500rpm,10min)后,收集沉淀,用2ml的磷酸缓冲液(0.1mol/L,pH7.8)溶解沉淀15min (用手动玻璃匀浆器助溶),离心(4℃,5000rpm,10min)后,收获上清液。
取上清样品120μL,加40 μL 4×电泳上样Buffer沸煮5min,放置-20℃冰箱保存备用。
将收获的样品液(三组样品合并为一组)放入处理后的透析袋中,置于50%的甘油中包埋浓缩2天,待样品浓缩至1.2mL收样,放置-20℃冰箱保存。
2.3凝胶层析法进一步纯化纯化过氧化氢酶[5]实验室老师准备凝胶。
实验时取层析柱一支,将层析柱出口接上乳胶管,在柱底部填入一薄层棉花。
将层析柱垂直夹于铁架上,夹紧层析柱下端的止水夹,向柱中加入约7cm 高的缓冲液,用细玻璃棒将凝胶颗粒搅成悬液,顺玻璃棒缓缓倒入层析柱中。
当凝胶颗粒沉积约2cm高时,开启止水夹子,使缓冲液缓缓流出,同时继续倒入凝胶悬液,掌握倒入速度,使其与缓冲液流出速度大体相同,直至凝胶床高度达35cm(柱床体积约60mL)时为止,关闭止水夹子。
凝胶床表面要保留10cm高的缓冲液,最后放入略小于层析柱内径的滤纸片;打开层析柱出口,控制流速为0.5mL/min (10滴/min),用磷酸盐缓冲液(0.1mol/L ,pH7.8)流洗平衡20min;浓缩样品;加样:打开层析柱出口,使缓冲液缓缓流出,当液面与凝胶床表面平齐时,关上出口。
用吸管吸取待分离的浓缩后样品溶液500μL,在接近凝胶床表面处沿层析柱内壁缓缓加入。
打开层析柱出口,使样品溶液进入柱床(开始收集)。
待样品液恰好完全进入凝胶柱上端面内时,立即用滴管沿层析柱内壁加入少量磷酸盐缓冲液(0.1mol/L ,pH7.8)小心冲洗壁管上的蛋白质,然后再加入磷酸盐缓冲液至距凝胶床表面约4cm高。
不断补加磷酸盐缓冲液(0.1mol/L ,pH7.8)洗脱,保持0.5mL/min(约10滴/min)的流速;当样品进胶开始,用试管收集流出液,每管收集1mL(约20滴)。
收集管依次在407nm和280nm波长下,以磷酸盐缓冲液(0.1mol/L,pH7.8)调零,测定各管吸光度值。
以管号为横坐标,吸光度为纵坐标,绘制洗脱曲线;合并收集OD407nm和OD280 nm 重叠峰值管,再次测定即为最终纯化得到的产物;留样取2mL纯化产物存样,备用于蛋白浓度及Km值测定,再取纯化样品60μL,用20μL4×电泳上样Buffer制样沸煮5min备用SDS-PAGE检测,样品放入放置-20℃冰箱保存。
2.4 Lorry 法测定纯化蛋白含量取标准蛋白按表1示,绘制标准曲线;匀浆样品稀释50倍,100倍,层析样品稀释5倍,10倍,按照表2示进行操作,测定在650nm 下吸光度值,在标准曲线下得出蛋白含量。
以H 2O 2为底物,用过氧化氢酶催化其分解1min,加入硫酸终止催化反应,并用已知浓度高锰酸钾滴定剩余的H 2O 2 , 换算出减少的H 2O 2 的量,进而计算出酶的活力。
在Km 值测定中采用此法测定酶活力。
过氧化氢酶活力单位定义为:以每分钟催化1μmol H 2O 2 减少所需的过氧化氢酶的量作为一个酶活性单位(U) 。
样品的比活以每毫克样品蛋白所含的酶活性单位数表示。
1 2 3 4 5 6 标准蛋白溶液(0.1mg/mL )0 0.2 0.4 0.6 0.8 1.0 生理盐水(mL ) 1.0 0.8 0.6 0.4 0.2 0 试剂AB(9:1) 混合液(mL )111111混匀后置于50℃水浴10min ,冷却试剂c (mL )3.03.03.03.03.03.0立即混匀,置于50℃水箱保温20min ,冷却后测定650nm 吸光度值7(匀浆稀释50倍) 8(匀浆稀释100倍)9(层析稀释5倍) 10(层析稀释10倍) 稀释的待测样品(mL ) 20μL 10μL200μL100μL试剂AB (9:1)1111表1 不同浓度标准蛋白组配置表2待测样品试剂配制混合液(mL)混合后50℃水浴保温10分钟,冷却试剂C(mL) 3.0 3.0 3.0 3.0立即混匀,置于50℃水箱保温20min,冷却后测定650nm吸光度值,查标准曲线,以g/L为单位2.5 双倒数作图法测定纯化过氧化氢酶米氏常数[6]取未知浓度的H2O2溶液2mL和25%H2SO4 2.0mL,用0.002mol/LKMnO4滴定至微红,记录滴定毫升数,重复实验,取平均值,计算H2O2 浓度;将层析样品稀释2000倍,匀浆样品稀释3000倍(置于6号瓶中);取6只干燥的50mL锥形瓶,编号,按表3示进行操作;反应10min,立即加入25% H2SO4 2.0mL终止反应;用标准0.002mol/L KMnO4进行滴定,记录消耗KMnO4的体积。
表3 过氧化氢酶的稀释瓶号 1 2 3 4 5 6H2O2mL 2.50 2.00 1.50 1.00 0.50 1.00蒸馏水mL0.00 0.50 1.00 1.50 2.00 1.50酶液mL 0.50 0.50 0.50 0.50 0.50 0.50 2.6 SDS-PAGE法测定纯化的过氧化物酶分子量实验室老师安装夹心式垂直板电泳槽和配胶及凝胶板的制备; 加样,预电泳采用30mA 90min。
待样品进入分离胶后,改为30mA,当染料前沿距硅橡胶框底边1.5cm时,停止电泳,关闭电源,取下凝胶模,卸下硅橡胶框,用不锈钢药铲或镊子撬开短玻璃板,在凝胶板切下一角作为加样标志,在两侧溴酚蓝染料区带中心,插入细铜丝作为前沿标记;将凝胶板放在大培养皿内,加入固定液,固定过夜;考马斯亮蓝染色1h,用蒸馏水漂洗数次,再用脱色液脱色,直到蛋白质区带清晰;将大培养皿放在一张坐标纸上,量出加样端距蓝色条带间的距离(cm)以及各蛋白质样品区带中心与加样端的距离(cm),计算相对迁移率,绘制标准曲线。
表4 分子量标准蛋白Marker 分子量分子量log值磷酸化酶b 91400 4.96牛血清白蛋白66200 4.82卵清蛋白42700 4.63碳酸酐酶31000 4.49溶菌酶14400 4.163 实验结果3.1分离纯化的结果实验采用sephadexG-200葡萄糖凝胶层析柱可以实现过氧化氢酶与其他分子量杂蛋白的分离,通过检测洗脱液在407nm(过氧化氢酶特异吸波长)和280nm波长下的吸光度值变化,合并收集OD407nm和OD280nm重叠峰值管,只可获得纯化的过氧化氢酶。
如表5和图1所示可知纯化的过氧化氢酶在7号和8号管中[6]。
表5 层析后蛋白吸光度变化曲线3.2 Lorry法测蛋白质含量[7]测的匀浆样品的蛋白浓度为17.6mg/ml,层析纯化后蛋白浓度表6 标准蛋白质纯品1 2 3 4 5 6 7 8 91mg/mL标准蛋0 0.2 0.4 0.6 0.8 1.0白液/mL待测蛋白/mL 0.1 0.2 0.01 生理盐水(mL)10.8 0.6 0.4 0.2 0 0.9 0.8 0.99 试剂A(mL)0.9 0.9 0.9 0.9 0.9 0.9 0.9 0.9 0.9 试剂B 0.1 0.1 0.1 0.1 0.1 0.1 0.1 0.1 0.1 试剂C 3.0 3.0 3.0 3.0 3.0 3.0 3.0 3.0 3.0 每管中蛋白质0 0.2 0.4 0.6 0.8 1.0含量/mg吸光度值/A650nm0 0.12 0.19 0.30 0.39 0.46 0.33 0.51 1.47图2 标准蛋白曲线3.3小鼠过氧化氢酶Km 值测定经K 2MnO 4标定计算得H 2O 2浓度为0.039mol/L , 由图2可得出Km 值为0.133mol/L图3 过氧化氢酶Km 值测定表7 过氧化氢酶Km 值测定3.4 SDS-PAGE测定蛋白相对分子质量蛋白质相对分子质量中溴酚蓝相对迁移距离为41mm,待测样品相对迁移7.5mm,结果如表8所示.由图4标准曲线可知,待测蛋白相对分子质量为60.25KD表8 标准蛋白质纯品Array图4 SDS-PAGE标准曲线3.5 蛋白质酶活测定4 讨论本次实验采用一般生物化学实验方法从小鼠肝脏中提取、纯化过氧化氢酶,之后对其蛋白质相关性质进行检测,测的Km值为0.191mol/L,蛋白相对分子质量为60.25KD,与所查的酶分子量相近[8]。
