氯气的性质
氯气的性质

练 习
1、不能用氯气跟金属单质直接化合制取的物质是() 、不能用氯气跟金属单质直接化合制取的物质是()
A、AlCl3 B、FeCl3 C、CuCl2 、 、 、 D、FeCl2 、
2、用氯气消毒的自来水配制下列溶液时,会使配 用氯气消毒的自来水配制下列溶液时, 制的溶液变质的是( 制的溶液变质的是( ) ①NaOH ②AgNO3 ③Na2CO3 D、全部 ④KI溶液 KI溶液
点燃
化学方程式: 化学方程式:
H2+Cl2
光照
2HCl
安静的燃烧
H2+C交流
通过氢气在氯气中的燃烧实验, 通过氢气在氯气中的燃烧实验,你对燃烧 的条件及其本质有什么新的认识? 的条件及其本质有什么新的认识? 燃烧条件:有可燃物及助燃物, 燃烧条件:有可燃物及助燃物,达到着火点 燃烧本质: 燃烧本质:剧烈的发光发热的氧化还原反应
①CO2 A ①②③
②HCl B ①②③
③H2O(g) C ②③
④O2 D ①②③④
祝 学 习 进 步
再 见
1 氯气是黄绿色气体;密度比空气大;能溶于水, 氯气是黄绿色气体;密度比空气大;能溶于水, 黄绿色气体 1体积水能溶 体积氯气;氯气有毒。 体积水能溶2体积氯气 有毒。 体积水能溶 体积氯气;氯气有毒 2 氯气的化学性质极为活泼(强氧化性) 氯气的化学性质极为活泼 强氧化性) 化学性质极为活泼( (1)氯气与绝大多数的金属反应, )氯气与绝大多数的金属反应, (2)氯气与许多非金属反应 ) ;(4) (3)与水反应;( )与碱反应 )与水反应;( 3 新制氯水成分 HClO 、HCl、 H2O、Cl2 、 、 4 久制氯水成分 稀盐酸 5 漂白粉的有效成分:次氯酸钙 Ca(ClO)2 漂白粉的有效成分:
氯气的性质

方向进行,同时又可以向逆反应方向进行。
“氯水” 分子:Cl2 、 H2O、HClO; 的微粒 离子:H+、Cl–、ClO–(OH–)
光照
2HClO 或△ 2HCl+O2↑
思考
氯气和水反应生成HCl和HClO,试分析 氯气和氢氧化钠、氢氧化钙溶液反应的产物。
1.请写出Cl2和NaOH溶液反应的化学方程式:
铁在氯气 中燃烧
剧烈燃烧,产 生大量白烟
剧烈燃烧,产生 棕褐色烟
点燃
2Na+ Cl2 2NaCl 2Fe + 3Cl2点燃2FeCl3
铜在氯气
剧烈燃烧,产生 棕黄色的烟
中燃烧
点燃 Cu + Cl2 CuCl2
氯气的化学性质很活泼,可与大多数金属在点 燃或加热的条件下直接化合,而且生成高价态 金属氯化物。
Cl2+2NaOH
NaCl+NaClO+H2O
2.请写出Cl2和石灰乳反应的化学方程式:
2Cl2+2Ca(OH)2
CaCl2+Ca(ClO)2+2H2O
【其有效成分是Ca(ClO)2 】漂白粉
为什么漂白粉可以用来漂白?结合有关次氯酸 的知识, 试解释漂白粉作用原理。
Ca(ClO)2+CO2+H2O====CaCO3↓+2HClO
二、氯气可以和许多安静燃烧,发出苍白色火焰,瓶口出现 白雾
实验结论:
点燃
H2+Cl2
2HCl
1、与H2混合光照
实验现象:
发生爆炸,产生白雾。
实验结论:
光照
H2+Cl2
2HCl
思考:H2与Cl2 在点燃和光照的条件下 都能反应生成HCl,那么在工业制盐酸采 用什么条件?(点燃还是光照)
氯气的化学性质

氯气的化学性质氯气(Cl2)是一种常见的卤素元素,具有一系列特殊的化学性质。
在本文中,将详细介绍氯气的化学性质。
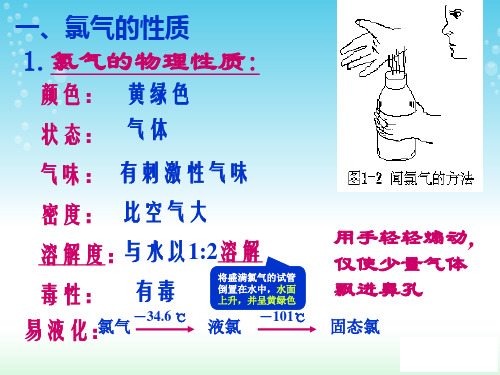
1. 氯气的物理性质氯气是一种黄绿色的气体,具有刺激性气味。
它的密度比空气大约2.5倍,可溶于水,与大多数有机物和无机物反应。
氯气有较高的沸点和凝固点,沸点为-34.04℃,凝固点为-101.5℃。
2. 氯气的燃烧性质氯气具有较强的氧化性,可与许多物质发生燃烧反应。
当氯气与可燃物质接触时,常常会引发剧烈的反应。
例如,当氯气与石油、木材、纸张等可燃材料接触时,会迅速燃烧产生火焰。
3. 氯气的反应性氯气是一种非常活泼的元素,与大多数金属和非金属元素反应产生化合物。
与金属反应时,氯气会接替金属原子中的电子,从而形成金属离子和氯离子。
与非金属反应时,氯气会直接与非金属原子共享电子,形成共价键化合物。
4. 氯气与水的反应氯气与水反应时,会形成盐酸(HCl)。
这是一种强酸,可与许多金属和碱发生反应。
由于盐酸的腐蚀性强,使用氯气时需要注意安全,避免与水接触导致酸性溶液的形成。
5. 氯气的氧化性氯气的氧化性强,可以氧化许多物质。
例如,与一些金属反应时,氯气会将金属氧化为金属离子。
与某些有机物反应时,氯气可以氧化有机物中的羟基(-OH)为酮基(C=O)。
6. 氯气的漂白性氯气是一种强力漂白剂,可以将许多有色物质漂白。
当氯气与有机染料等物质接触时,它会使有色物质分解或失去吸收特定波长光线的能力,从而导致褪色或变白现象。
7. 氯气的水处理应用氯气广泛应用于水处理领域。
在水处理过程中,氯气可以消除水中的细菌、病毒和其他微生物,达到杀菌消毒的作用。
然而,由于氯气的致癌性和对环境的负面影响,近年来逐渐被其他更环保、更安全的水处理方法所取代。
总结:氯气具有很多独特的化学性质,包括燃烧性质、反应性、氧化性、漂白性等。
它可以与许多物质发生反应,产生新的化合物。
在水处理领域,氯气曾广泛应用于杀菌消毒,但由于其有害性和环境影响,目前正逐渐被其他替代方法所取代。
高中化学 氯气化学性质

高中化学氯气化学性质氯气是一种拥有黄绿色的有毒气体,具有强烈的刺激性气味,它的化学式为Cl2。
在大气中,氯气以分子形式存在,并具有较大的相对分子质量。
氯气的化学性质氯气可以与许多元素或化合物反应,常见的化学性质如下:1. 与金属反应氯气与金属反应可以发生置换反应,生成对应的金属氯化物。
这种反应能够区分活泼度,活泼金属如钠和钾反应速率很快,而不活泼的金属如铜和银需要高温才能反应。
2. 与非金属反应氯气还能够与非金属元素进行反应,比如与氢反应生成氯化氢,与氧反应可以生成氧化氯,与硫反应可以生成二氧化硫和四氧化硫等。
3. 氯离子的生成当氯气溶解在水中,可以生成氯离子(Cl-),同时水分子也发生了部分的电离,会生成一定量的氢离子(H+)和氢氧根离子(OH-),所以氯气水溶液呈现强酸性,即盐酸。
4. 氢氯化反应氯与氢在一定温度和压力下可以反应生成氢氯化气体,即化合式为HCl。
这种反应是化学工业生产氯化碱等化学品的重要反应。
5. 与含有双键的物质反应含有双键的物质,如乙烯和丙烯,可以与氯气发生加成反应,生成对应的氯化物,这种反应具有很大的工业用途。
6. 氧化还原反应氯可以参与氧化还原反应,在这种反应中氯可以被还原或者氧化,而另一个化学物质则相反。
比如,在强光照射下,氯可以将水分子的氢原子剥离,生成氧气和盐酸。
氯气的用途氯气在工业生产和实验室领域有很多用途,如下:1. 工业用途氯气被广泛用于生产氯化碱、氯化氢、氯化物等化学品。
高纯度的氯气还用于水处理、污水处理等。
2. 消毒和漂白由于氯气具有强氧化性和杀菌能力,因此广泛用于消毒、漂白和净化水质等领域。
3. 冶金行业氯气用于提取金属、精炼硅等冶金行业和电子行业,具有重要的作用。
4. 医学应用氯气的消毒性能使其在医学领域具有很大潜力,以杀死细菌和病毒等微生物为目的。
5. 实验室应用氯气还被广泛用于化学实验中,作为溶剂、反应试剂、催化剂等。
需要注意的是,氯气是一种有毒气体,长时间吸入会引起严重的呼吸系统和眼睛刺激,更高浓度则会引起窒息和死亡。
探究氯气的性质
这就是漂白粉 的主要成份
小 结: 氯水与液氯的区别?
液 氯
制 法
氯 水
将氯气加压、 氯气溶于水 降温
H2O、 Cl2、HClO、H +、 ClO - 、 Cl-
所含微粒 Cl2分子
化学性质 具有氯气的化 具有所含微粒的性 学性质 质
氯气的性质:
物理性质
与金属 的反应 颜色--黄绿色;状态--气态;气味--刺激性气味; 溶解性--能溶于水得氯水;毒性—有毒 与Fe反应:2Fe+3Cl2===2FeCl3(棕红色烟) 与Cu反应:Cu+Cl2===CuCl2(棕黄色烟) 与Na反应:2Na+Cl2===2NaCl(白烟)
点燃 或光照 点燃 点燃 点燃
氯气 化 学 性 质
与非金属反应 H2与Cl2反应: H2+Cl2====2HCl(燃烧或爆炸) Cl2+H2O===HCl+HClO 与水反应 HClO是不稳定的一元弱酸,有漂白性,能杀菌 消毒(干燥Cl2无漂白性) Cl2+2NaOH===NaCl+NaClO (工业或实验室中吸收多余Cl2的反应) 2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2 (工业上制漂白粉的原理)
探究
氯水与一些物质的反应 实验内容 实验现象 有无色气泡逸 出;氯水颜色 变浅 有白色沉淀生 成 纸条褪色 实验结论 氯水中含有 Cl2盐酸 新制的氯水中 含有:Cl2、 氯水含漂白 HCl、HClO、 H+、 Cl- 等 剂 氯水含有Cl氯水中含有 盐酸和漂白 剂
1、氯水与镁 的反应 2、氯水与硝 酸银溶液反应 3、氯水与红 色纸条反应
A、AgNO3溶液
C、紫色石蕊试液
氯气的性质

氯气与水的反应: 实验内容 观察到的现象
解释与结论Байду номын сангаас
观察新制氯水的 颜色
滴加HNO3酸化 的AgNO3
滴加紫色石蕊
与有色布条反应
氯气与水的反应: 实验内容 观察到的现象
解释与结论 溶液中含Cl2分子
观察新制氯水的 颜色
滴加HNO3酸化 的AgNO3
黄绿色
滴加紫色石蕊
与有色布条反应
氯气与水的反应: 实验内容 观察到的现象
黄绿色
生成不溶于酸的白色沉 淀 先变红,后褪色
与有色布条反应
氯气与水的反应: 实验内容 观察到的现象 观察新制氯水的 颜色
解释与结论
溶液中含Cl2分子
黄绿色 生成不溶于酸的白色沉 淀
先变红,后褪色
滴加HNO3酸化 的AgNO3
滴加紫色石蕊
生成AgCl沉淀,溶 液中含Cl-
溶液中含H+与强氧 化性物质 Cl2无漂白性 HClO 有漂白性
HCl的制备 工业制法:H2+Cl2
点燃
2HCl
实验室制法:NaCl(s)+H2SO4(浓)===NaHSO4+HCl↑ 2NaCl(s)+H2SO4(浓) Na2SO4+2HCl↑ 收集法:向上排空气法 尾气吸收:用水吸收,使用倒置 漏斗防倒吸。
氯离子的检验
试剂
HCl溶液 NaCl溶液 Na2CO3溶液
阴极区 阳极区
H2和Cl2 混合不安全。 Cl2会和NaOH反应,会使得到的NaOH不纯。
离子交换膜法制烧碱 H+ +
↑Cl2 ↑H2
Na+
OH-
Cl-
Cl2
H2 _
氯气的性质

�
探究
氯气能与水反应 吗
影片5播放 影片 播放
实验现象:湿布条褪色 实验现象:湿布条褪色
结论:氯水有漂白性( 结论:氯水有漂白性(HClO) ) 次氯酸的性质: 次氯酸的性质: 1.强氧化性:杀菌,消毒,漂白 强氧化性:杀菌,消毒, 强氧化性 2.弱酸性: 弱酸性: 弱酸性 3.不稳定性2 HClO 不稳定性 HClO
史料:第一次世界大 战期间,德军与英,法军 在比利时伊普尔对峙.德 军动用了世界上第一支专 业的毒气部队,5分钟释 放了180吨毒气,使15000人 中毒,三分之一的人死去. 这是1915年4月22日发生的 令人发指的事件.
图为德军士兵正在投掷毒气弹
二,化学性质: 化学性质: 1,与金属反应 ,
光照( 光照(△)
H++ClO2HCl + O2
影片6播放 影片 播放
探究
新制氯水中含有哪些微粒? 新制氯水中含有哪些微粒? 如何证明这些微粒的存在? 如何证明这些微粒的存在? 3,与水反应 , (此反应为可逆反应 此反应为可逆反应) 此反应为可逆反应 Cl2通入水制得的溶液称为氯水,它与液 通入水制得的溶液称为氯水, 氯的区别
点燃
),Cu+Cl2==CuCl2 (1), ), 现象:铜丝在 燃烧, 现象:铜丝在Cl2中燃烧,产生大量的棕色 的烟, 的烟,溶于水得到蓝绿色的溶液
点燃
),2Fe + 3Cl2 == 2FeCl3 影片 播放 (2), ), 影片0播放 现象:铁丝在 燃烧, 现象:铁丝在Cl2中燃烧,产生大量的棕黄 色的烟,溶于水得到棕 色的烟,溶于水得到棕黄色的溶液 用钢瓶贮运氯气(常温下干燥Cl 用钢瓶贮运氯气(常温下干燥 2不与铁 反应) 反应)
氯气的物理性质

氯气化学式为Cl₂,常温常压下为有强烈刺激性气味的黄绿色的气体。
氯气密度是空气密度的2.5倍。
氯气熔沸点较低,常温常压下,熔点为-101.00℃,沸点-34.05℃,常温下把氯气加压至600~700kPa或在常压下冷却到-34℃都可以使其变成液氯。
氯气的物理性质
氯气可溶于水,易溶于有机溶剂,难溶于饱和食盐水。
1体积水在常温下可溶解2体积氯气,形成黄绿色氯水,密度为3.170g/L,比空气密度大。
氯原子最外层有7个电子,反应中易得到1个电子或共用一个电子对达到稳定结构(共价键)。
氯分子为双原子分子,分子式Cl₂。
氯气的化学性质
1.助燃性
氯气支持燃烧,许多物质都可在氯气中燃烧(除少数物质如碳单质等)。
2.氧化性:氯气具有强氧化性,加热下可以与所有金属反应
(1)与钠的反应:2Na+Cl2=2NaCl
现象:钠在氯气里剧烈燃烧,产生大量的白烟,放热。
(2)与铜的反应:Cu+Cl2=CuCl2
现象:红热的铜丝在氯气里剧烈燃烧,瓶里充满棕黄色的烟,加少量水后,溶液呈蓝绿色(绿色较明显),加足量水后,溶液完全显蓝色。
(3)与铁的反应:2Fe+3Cl2=2FeCl3
现象:铁丝在氯气里剧烈燃烧,瓶里充满棕红色烟,加少量水后,溶液呈黄色。
(4)与镁的反应:Mg+Cl2=MgCl2
现象:非常剧烈的燃烧,生成白色的烟。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二.学情分析
1.学生的认知基础: 研究物质的实验方法 原子结构基础 2.化学理论薄弱,好奇心强
三.教学目标
1.知识与能力 2.过程与方法 3.情感态度与价值观
四.教学重点和难点
1.教学的重点:a.氯气的化学性质及实验室制法 b.氯离子的性质
2.教学难点:氯气的化学性质
五.说教法与学法
1.
学生分组实验 教师演示实验 多媒体展示 教师讲述
氯气的性质
说课流程 说教材 学情分析 教学目标
教学重点与难点
说教法与学法 说课堂教学程序
一.说教材
1.教材的作用,地位和特点 氯气是高中阶段学生接触到的第一种卤素元素, 本节内容学习方法的掌握为对后面的专题的学习方 法和思维习惯有较好的借鉴作用。这节课的教学内 容包括氯气的性质,用途,氯气的实,实验,讨论
六.说课堂教学程序
1.创设情境,引入新课; 2.展示实物,归纳物理性质 3.理论分析,推测化学性质 4.实验探究,研究化学性质 5.图片展示,了解氯在生活中的应用 6.归纳总结,提升物质研究方法
板书设计
氯气的性质 一.物理性质
二.化学性质 1.与金属反应 2Fe+3Cl2点燃2FeCl3 2.与非金属单质反应点燃 H2+Cl2点燃2HCl 3.与水反应 H2O+Cl2=HCl+HClO 4.与碱反应 2NaOH+Cl2=Na+NaClO+H2O
