氯气的性质
氯气的性质

练 习
1、不能用氯气跟金属单质直接化合制取的物质是() 、不能用氯气跟金属单质直接化合制取的物质是()
A、AlCl3 B、FeCl3 C、CuCl2 、 、 、 D、FeCl2 、
2、用氯气消毒的自来水配制下列溶液时,会使配 用氯气消毒的自来水配制下列溶液时, 制的溶液变质的是( 制的溶液变质的是( ) ①NaOH ②AgNO3 ③Na2CO3 D、全部 ④KI溶液 KI溶液
点燃
化学方程式: 化学方程式:
H2+Cl2
光照
2HCl
安静的燃烧
H2+C交流
通过氢气在氯气中的燃烧实验, 通过氢气在氯气中的燃烧实验,你对燃烧 的条件及其本质有什么新的认识? 的条件及其本质有什么新的认识? 燃烧条件:有可燃物及助燃物, 燃烧条件:有可燃物及助燃物,达到着火点 燃烧本质: 燃烧本质:剧烈的发光发热的氧化还原反应
①CO2 A ①②③
②HCl B ①②③
③H2O(g) C ②③
④O2 D ①②③④
祝 学 习 进 步
再 见
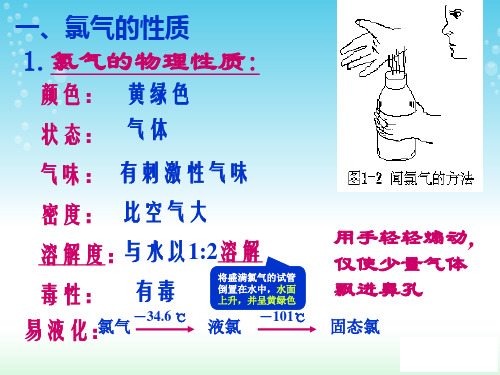
1 氯气是黄绿色气体;密度比空气大;能溶于水, 氯气是黄绿色气体;密度比空气大;能溶于水, 黄绿色气体 1体积水能溶 体积氯气;氯气有毒。 体积水能溶2体积氯气 有毒。 体积水能溶 体积氯气;氯气有毒 2 氯气的化学性质极为活泼(强氧化性) 氯气的化学性质极为活泼 强氧化性) 化学性质极为活泼( (1)氯气与绝大多数的金属反应, )氯气与绝大多数的金属反应, (2)氯气与许多非金属反应 ) ;(4) (3)与水反应;( )与碱反应 )与水反应;( 3 新制氯水成分 HClO 、HCl、 H2O、Cl2 、 、 4 久制氯水成分 稀盐酸 5 漂白粉的有效成分:次氯酸钙 Ca(ClO)2 漂白粉的有效成分:
氯气的性质

方向进行,同时又可以向逆反应方向进行。
“氯水” 分子:Cl2 、 H2O、HClO; 的微粒 离子:H+、Cl–、ClO–(OH–)
光照
2HClO 或△ 2HCl+O2↑
思考
氯气和水反应生成HCl和HClO,试分析 氯气和氢氧化钠、氢氧化钙溶液反应的产物。
1.请写出Cl2和NaOH溶液反应的化学方程式:
铁在氯气 中燃烧
剧烈燃烧,产 生大量白烟
剧烈燃烧,产生 棕褐色烟
点燃
2Na+ Cl2 2NaCl 2Fe + 3Cl2点燃2FeCl3
铜在氯气
剧烈燃烧,产生 棕黄色的烟
中燃烧
点燃 Cu + Cl2 CuCl2
氯气的化学性质很活泼,可与大多数金属在点 燃或加热的条件下直接化合,而且生成高价态 金属氯化物。
Cl2+2NaOH
NaCl+NaClO+H2O
2.请写出Cl2和石灰乳反应的化学方程式:
2Cl2+2Ca(OH)2
CaCl2+Ca(ClO)2+2H2O
【其有效成分是Ca(ClO)2 】漂白粉
为什么漂白粉可以用来漂白?结合有关次氯酸 的知识, 试解释漂白粉作用原理。
Ca(ClO)2+CO2+H2O====CaCO3↓+2HClO
二、氯气可以和许多安静燃烧,发出苍白色火焰,瓶口出现 白雾
实验结论:
点燃
H2+Cl2
2HCl
1、与H2混合光照
实验现象:
发生爆炸,产生白雾。
实验结论:
光照
H2+Cl2
2HCl
思考:H2与Cl2 在点燃和光照的条件下 都能反应生成HCl,那么在工业制盐酸采 用什么条件?(点燃还是光照)
氯气的化学性质

氯气的化学性质氯气(Cl2)是一种常见的卤素元素,具有一系列特殊的化学性质。
在本文中,将详细介绍氯气的化学性质。
1. 氯气的物理性质氯气是一种黄绿色的气体,具有刺激性气味。
它的密度比空气大约2.5倍,可溶于水,与大多数有机物和无机物反应。
氯气有较高的沸点和凝固点,沸点为-34.04℃,凝固点为-101.5℃。
2. 氯气的燃烧性质氯气具有较强的氧化性,可与许多物质发生燃烧反应。
当氯气与可燃物质接触时,常常会引发剧烈的反应。
例如,当氯气与石油、木材、纸张等可燃材料接触时,会迅速燃烧产生火焰。
3. 氯气的反应性氯气是一种非常活泼的元素,与大多数金属和非金属元素反应产生化合物。
与金属反应时,氯气会接替金属原子中的电子,从而形成金属离子和氯离子。
与非金属反应时,氯气会直接与非金属原子共享电子,形成共价键化合物。
4. 氯气与水的反应氯气与水反应时,会形成盐酸(HCl)。
这是一种强酸,可与许多金属和碱发生反应。
由于盐酸的腐蚀性强,使用氯气时需要注意安全,避免与水接触导致酸性溶液的形成。
5. 氯气的氧化性氯气的氧化性强,可以氧化许多物质。
例如,与一些金属反应时,氯气会将金属氧化为金属离子。
与某些有机物反应时,氯气可以氧化有机物中的羟基(-OH)为酮基(C=O)。
6. 氯气的漂白性氯气是一种强力漂白剂,可以将许多有色物质漂白。
当氯气与有机染料等物质接触时,它会使有色物质分解或失去吸收特定波长光线的能力,从而导致褪色或变白现象。
7. 氯气的水处理应用氯气广泛应用于水处理领域。
在水处理过程中,氯气可以消除水中的细菌、病毒和其他微生物,达到杀菌消毒的作用。
然而,由于氯气的致癌性和对环境的负面影响,近年来逐渐被其他更环保、更安全的水处理方法所取代。
总结:氯气具有很多独特的化学性质,包括燃烧性质、反应性、氧化性、漂白性等。
它可以与许多物质发生反应,产生新的化合物。
在水处理领域,氯气曾广泛应用于杀菌消毒,但由于其有害性和环境影响,目前正逐渐被其他替代方法所取代。
探究氯气的性质
这就是漂白粉 的主要成份
小 结: 氯水与液氯的区别?
液 氯
制 法
氯 水
将氯气加压、 氯气溶于水 降温
H2O、 Cl2、HClO、H +、 ClO - 、 Cl-
所含微粒 Cl2分子
化学性质 具有氯气的化 具有所含微粒的性 学性质 质
氯气的性质:
物理性质
与金属 的反应 颜色--黄绿色;状态--气态;气味--刺激性气味; 溶解性--能溶于水得氯水;毒性—有毒 与Fe反应:2Fe+3Cl2===2FeCl3(棕红色烟) 与Cu反应:Cu+Cl2===CuCl2(棕黄色烟) 与Na反应:2Na+Cl2===2NaCl(白烟)
点燃 或光照 点燃 点燃 点燃
氯气 化 学 性 质
与非金属反应 H2与Cl2反应: H2+Cl2====2HCl(燃烧或爆炸) Cl2+H2O===HCl+HClO 与水反应 HClO是不稳定的一元弱酸,有漂白性,能杀菌 消毒(干燥Cl2无漂白性) Cl2+2NaOH===NaCl+NaClO (工业或实验室中吸收多余Cl2的反应) 2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2 (工业上制漂白粉的原理)
探究
氯水与一些物质的反应 实验内容 实验现象 有无色气泡逸 出;氯水颜色 变浅 有白色沉淀生 成 纸条褪色 实验结论 氯水中含有 Cl2盐酸 新制的氯水中 含有:Cl2、 氯水含漂白 HCl、HClO、 H+、 Cl- 等 剂 氯水含有Cl氯水中含有 盐酸和漂白 剂
1、氯水与镁 的反应 2、氯水与硝 酸银溶液反应 3、氯水与红 色纸条反应
A、AgNO3溶液
C、紫色石蕊试液
氯气的性质

�
探究
氯气能与水反应 吗
影片5播放 影片 播放
实验现象:湿布条褪色 实验现象:湿布条褪色
结论:氯水有漂白性( 结论:氯水有漂白性(HClO) ) 次氯酸的性质: 次氯酸的性质: 1.强氧化性:杀菌,消毒,漂白 强氧化性:杀菌,消毒, 强氧化性 2.弱酸性: 弱酸性: 弱酸性 3.不稳定性2 HClO 不稳定性 HClO
史料:第一次世界大 战期间,德军与英,法军 在比利时伊普尔对峙.德 军动用了世界上第一支专 业的毒气部队,5分钟释 放了180吨毒气,使15000人 中毒,三分之一的人死去. 这是1915年4月22日发生的 令人发指的事件.
图为德军士兵正在投掷毒气弹
二,化学性质: 化学性质: 1,与金属反应 ,
光照( 光照(△)
H++ClO2HCl + O2
影片6播放 影片 播放
探究
新制氯水中含有哪些微粒? 新制氯水中含有哪些微粒? 如何证明这些微粒的存在? 如何证明这些微粒的存在? 3,与水反应 , (此反应为可逆反应 此反应为可逆反应) 此反应为可逆反应 Cl2通入水制得的溶液称为氯水,它与液 通入水制得的溶液称为氯水, 氯的区别
点燃
),Cu+Cl2==CuCl2 (1), ), 现象:铜丝在 燃烧, 现象:铜丝在Cl2中燃烧,产生大量的棕色 的烟, 的烟,溶于水得到蓝绿色的溶液
点燃
),2Fe + 3Cl2 == 2FeCl3 影片 播放 (2), ), 影片0播放 现象:铁丝在 燃烧, 现象:铁丝在Cl2中燃烧,产生大量的棕黄 色的烟,溶于水得到棕 色的烟,溶于水得到棕黄色的溶液 用钢瓶贮运氯气(常温下干燥Cl 用钢瓶贮运氯气(常温下干燥 2不与铁 反应) 反应)
氯气的性质
Cu + Cl2 == CuCl2
固体: 固体:棕黄色 溶液:蓝色、蓝绿色、 溶液:蓝色、蓝绿色、绿色
点燃
燃烧
4、氯气与氢气反应 、氯气与氢气反应 氢气
光照
H2 + Cl2 == HCl
火焰: 火焰:苍白色
点燃
H2 + Cl2 == HCl
爆炸
光照
5、氯气与水反应 、氯气与水
H2O + Cl2 == HCl +
固态氯
二、氯气的化学性质: 氯气的化学性质:
1、根据氯原子结构推断 、 氯原子的性质是否活泼? 氯原子的性质是否活泼?
Cl
+17
2 8 7
2、氯气是易于哪些物质 、 反应? 反应?
二、氯气的化学性质: 氯气的化学性质: 1、氯气与钠反应 、氯气与钠 2、氯气与铁反应 、氯气与铁 3、氯气与铜反应 、氯气与铜 4、氯气与氢气反应 、氯气与氢气反应 氢气 5、氯气与水反应 、氯气与水 6、氯气与碱反应 、氯气与碱
氯 气 的 性 质
一、氯气的物理性质: 氯气的物理性质:
黄绿色气体, 黄绿色气体,有刺激性气味 密度比空气大,可溶于水(1: 密度比空气大,可溶于水 :2) 有毒 同T、P, M1/M2=ρ1/ρ2
101KPa,- ,-101℃ ,- ℃
易液化 ,-34.6℃ ,- 氯气 101KPa,- ℃ 液氯
次氯酸盐
2Ca(OH)2 + Cl2 == CaCl2+ Ca(ClO)2 + H2O
漂白粉的主要成分
Ca(ClO)2 + H2O + CO2== CaCO3 + 2HClO
危险化学用品的标志
氯气的性质

氯气的性质一.物理性质在通常情况下,氯气是一种、有气味的气体;密度比空气,溶于水(),但难溶于饱和食盐水;易液化(液氯)。
二.化学性质氯原子最外层有个电子,易得电子,化学性质。
★1、与金属反应与铁反应:现象:。
注意:反应只生成FeCl3,常温下,干燥的Cl2不与Fe反应,液氯可用钢瓶贮存。
与铜反应:现象:[归纳]2、与非金属反应与氢气反应:现象:注意:烟与雾的区别:燃烧:3、与水反应(1)氯水的性质实验(2)验证新制氯水中的微粒:Cl2:Cl-:H+:HClO:(3)新制氯水、久置氯水、液氯比较(4)次氯酸(HClO)的性质:a.强氧化性:★注意:b.弱酸性:c.不稳定性:4、与碱反应(1)与NaOH的反应:(用于实验中尾气的吸收)(2)与石灰乳的反应:(工业上制取漂白粉)漂白粉的主要成分为:有效成分为:漂白粉的漂白原理:漂白粉的失效原理:漂白粉的保存:5、与还原性物质反应三、氯气的用途1、制氯化物2、制漂白剂:氯水、漂白粉、二氧化氯3、冶炼金属4、制药物、染料5、制塑料:聚氯乙烯、氯丁橡胶例题:1.下列氯化物中,既能由金属和氯气直接反应制得,又能由金属和盐酸反应制得的是A.CuCl2 B.FeCl2 C.FeCl3 D.AlCl3 ()2. 检验氯化氢气体中是否有氯气,可采用的方法是()A.用湿润的淀粉碘化钾试纸B.用干燥有色布条C.将气体通入硝酸银溶液D.用干燥的蓝色石蕊试纸3. 除去Cl2中混有的少量HCl气体,可将气体通入()A.饱和NaH CO3溶液B. NaOH溶液C.饱和NaCl溶液D. 澄清石灰水4. 自来水一般是用少量的氯气消毒。
下列哪些药品不能用自来水配制。
A、Na2SO4B、NaClC、AgNO3D、K2CO3 ()。
氯气的性质

H2O
Cl 、 H 、 OH
―
+
―
新制氯水 类别 微粒 混合物
久置氯水 混合物
液氯 纯净物 Cl2
H2O、Cl2、HClO、 + H O 、 H 2 H+、Cl—、ClO—、 —、OH— Cl OH—
主要 呈浅黄绿色,导电, 无色,导 黄绿色、不 性质 具有酸性,有氧化 电,有酸 导电,具有
性、漂白性 性 氧化性、无 漂白性
如果反应,可能的产物:
操作 步骤
完成实验 得出结论
产生新问题
现象 结果
pH试纸先变红后褪色
出现白色沉淀 溶液中存在Cl-
溶液显酸性
Cl2能与H2O反应,产物中有H+、Cl-、… 氯水中具有漂白性的物质是什么?
提出问题 做出假设 设计实验
具有漂白性的物质是什么?
可能是氯水中溶解的氯气, 也可能氯气与水反应生成的新的物质
(2)燃烧不一定有氧气参加。氯气也可作助燃剂。任何 剧烈的发光发热的化学反应(氧化还原反应)均可叫做燃烧。
(3)通常情况下,干燥的氯气与铁不反应,所以可用钢 瓶储存液氯。 (4)金属与氯气化合生成金属氯化物。反之,金属氯化 物不一定可由金属与氯气化合生成。如FeCl3是Fe与氯气 化合而成,但FeCl2只能是Fe与盐酸(或氯化铜等)反应 生成。
氯气的性质
2005年3月29日,京沪高速 液氯泄漏,造成28人死亡, 2万多亩农作物受损。
2005年10月30日,武汉一废品 收购点的液氯钢瓶发生泄漏, 消防队员正在紧急处理。
如果你在氯气事故
现场,你该采取哪
2005年4月12日,无锡 一自来水厂氯气泄漏。
些应急措施?
研究物质的物理性质一般有以下方面:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
联系初中所学知识,探究氯气的水溶性。
过渡:我们在初中学过:氧气不易溶于水且不于水反应;二氧化碳能溶于水且能与水反应。那么,氯气除了能溶于水,是否也能和水反应呢?
Ca(ClO)2+CO2+H2O=CaCl2+2HClO
氯气的用途
巩固训练 见学案
教后反思
氯化钙和次氯酸钙就是我们熟知的漂白粉的主要成分,工业上就是利用这个反应来制取漂白粉。
设问:我们夏天去游泳池游泳,游泳池就是用漂白粉来消毒的,但是漂白粉中的成分本身并没有杀菌、消毒的作用。还有生活中用的84消毒液能够杀菌、消毒,是因为里面的含有次氯酸钠。这些次氯酸盐怎样在使用过程中变成次氯酸呢?
思考与讨论:学生猜测次氯酸盐转变成次氯酸的可能途径。
氯气的性质
课 题
氯气的性质
课 型
新授课
三维教学目标
知识与技能1:使学生了解氯气的物理性质;
2:使学生初步掌握氯气与金属、氢气等反应的化学性质;
3.使学生初步掌握氯气与水、碱等反应的化学性质;
过程与方法:1:引导学生自主、合作、探究学习;
2.培养学生的观察能力、推理能力、总结归纳的能力。
情感态度与价值观
活动探究:见书本P42-43
总结归纳:氯水和液氯的区别 见学案
过渡:由于次氯酸盐比次氯酸稳定,因此,在工业生产和生活中,多用次氯酸盐和碳酸、盐酸等发生反应制取次氯酸。如何将氯气转换成次氯酸盐呢?
氯气与一些碱溶液反应:
Cl2+2NaOH=NaCl+NaClO+H2O
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
氯气除了能跟金属反应外,还能与非金属反应,比如氢气在氯气中(填反应条件)生成。反应方程式。
小 结:此反应说明燃烧(一定或不一定)要有氧气参加。
反思:氯气能与大多数金属、非金属发生反应,可见氯气的化学性质非常活泼,为什么会如此活泼呢?
引导从最外层电子分析:氯原子的最外层电子数为7,不稳定,易得一个电子。故此,氯表现出很强的氧化性。
二:氯气的物理性质(略)
三:氯气的化学性质
1:氯气与金属钠反应,氯气与金属铜反应(参照书本 )
2:把细铁丝伸入盛有氯气的集气瓶中
实验现象:铁丝在氯气中,生成大量烟。
实验结论:在加热的条件下铁与氯气发生反应。反应方程式为:。
资料:铁有和两种价态。铁与氯气反应只生成而不生成说明氯气的活泼性
小结:此反应说明氯气与具有可变价态的金属反应时,一般生成价态(高或低)的金属氯化物。
1.通过对氯气的重要用途和氯气是有毒气体的介绍,使学生意识到化学对社会进步的促进作用。
2.过实验探究,培养学生科学意识和科学养;
重难点
氯气的化学性质
氯水和液氯的区别
教学方法
比较与分类方法、启发讨论、分析讲解
二次备课
预习设计
见学案
教
学
过
程
知识构建
一:情景创设
在化工生产过程中,大多直接或间接有用氯气作为原料。那么,氯气到底是种什么样的物质呢?
