氯气的性质
氯气的性质

练 习
1、不能用氯气跟金属单质直接化合制取的物质是() 、不能用氯气跟金属单质直接化合制取的物质是()
A、AlCl3 B、FeCl3 C、CuCl2 、 、 、 D、FeCl2 、
2、用氯气消毒的自来水配制下列溶液时,会使配 用氯气消毒的自来水配制下列溶液时, 制的溶液变质的是( 制的溶液变质的是( ) ①NaOH ②AgNO3 ③Na2CO3 D、全部 ④KI溶液 KI溶液
点燃
化学方程式: 化学方程式:
H2+Cl2
光照
2HCl
安静的燃烧
H2+C交流
通过氢气在氯气中的燃烧实验, 通过氢气在氯气中的燃烧实验,你对燃烧 的条件及其本质有什么新的认识? 的条件及其本质有什么新的认识? 燃烧条件:有可燃物及助燃物, 燃烧条件:有可燃物及助燃物,达到着火点 燃烧本质: 燃烧本质:剧烈的发光发热的氧化还原反应
①CO2 A ①②③
②HCl B ①②③
③H2O(g) C ②③
④O2 D ①②③④
祝 学 习 进 步
再 见
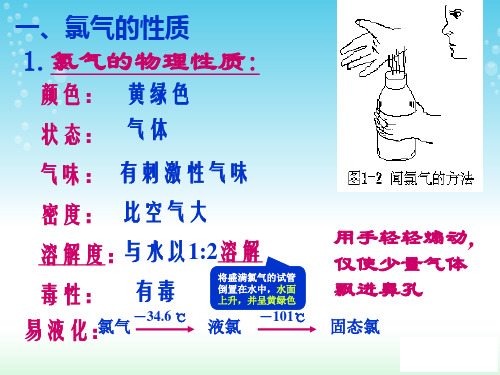
1 氯气是黄绿色气体;密度比空气大;能溶于水, 氯气是黄绿色气体;密度比空气大;能溶于水, 黄绿色气体 1体积水能溶 体积氯气;氯气有毒。 体积水能溶2体积氯气 有毒。 体积水能溶 体积氯气;氯气有毒 2 氯气的化学性质极为活泼(强氧化性) 氯气的化学性质极为活泼 强氧化性) 化学性质极为活泼( (1)氯气与绝大多数的金属反应, )氯气与绝大多数的金属反应, (2)氯气与许多非金属反应 ) ;(4) (3)与水反应;( )与碱反应 )与水反应;( 3 新制氯水成分 HClO 、HCl、 H2O、Cl2 、 、 4 久制氯水成分 稀盐酸 5 漂白粉的有效成分:次氯酸钙 Ca(ClO)2 漂白粉的有效成分:
氯气的化学性质

氯气的化学性质氯气(Cl2)是一种常见的卤素元素,具有一系列特殊的化学性质。
在本文中,将详细介绍氯气的化学性质。
1. 氯气的物理性质氯气是一种黄绿色的气体,具有刺激性气味。
它的密度比空气大约2.5倍,可溶于水,与大多数有机物和无机物反应。
氯气有较高的沸点和凝固点,沸点为-34.04℃,凝固点为-101.5℃。
2. 氯气的燃烧性质氯气具有较强的氧化性,可与许多物质发生燃烧反应。
当氯气与可燃物质接触时,常常会引发剧烈的反应。
例如,当氯气与石油、木材、纸张等可燃材料接触时,会迅速燃烧产生火焰。
3. 氯气的反应性氯气是一种非常活泼的元素,与大多数金属和非金属元素反应产生化合物。
与金属反应时,氯气会接替金属原子中的电子,从而形成金属离子和氯离子。
与非金属反应时,氯气会直接与非金属原子共享电子,形成共价键化合物。
4. 氯气与水的反应氯气与水反应时,会形成盐酸(HCl)。
这是一种强酸,可与许多金属和碱发生反应。
由于盐酸的腐蚀性强,使用氯气时需要注意安全,避免与水接触导致酸性溶液的形成。
5. 氯气的氧化性氯气的氧化性强,可以氧化许多物质。
例如,与一些金属反应时,氯气会将金属氧化为金属离子。
与某些有机物反应时,氯气可以氧化有机物中的羟基(-OH)为酮基(C=O)。
6. 氯气的漂白性氯气是一种强力漂白剂,可以将许多有色物质漂白。
当氯气与有机染料等物质接触时,它会使有色物质分解或失去吸收特定波长光线的能力,从而导致褪色或变白现象。
7. 氯气的水处理应用氯气广泛应用于水处理领域。
在水处理过程中,氯气可以消除水中的细菌、病毒和其他微生物,达到杀菌消毒的作用。
然而,由于氯气的致癌性和对环境的负面影响,近年来逐渐被其他更环保、更安全的水处理方法所取代。
总结:氯气具有很多独特的化学性质,包括燃烧性质、反应性、氧化性、漂白性等。
它可以与许多物质发生反应,产生新的化合物。
在水处理领域,氯气曾广泛应用于杀菌消毒,但由于其有害性和环境影响,目前正逐渐被其他替代方法所取代。
探究氯气的性质
这就是漂白粉 的主要成份
小 结: 氯水与液氯的区别?
液 氯
制 法
氯 水
将氯气加压、 氯气溶于水 降温
H2O、 Cl2、HClO、H +、 ClO - 、 Cl-
所含微粒 Cl2分子
化学性质 具有氯气的化 具有所含微粒的性 学性质 质
氯气的性质:
物理性质
与金属 的反应 颜色--黄绿色;状态--气态;气味--刺激性气味; 溶解性--能溶于水得氯水;毒性—有毒 与Fe反应:2Fe+3Cl2===2FeCl3(棕红色烟) 与Cu反应:Cu+Cl2===CuCl2(棕黄色烟) 与Na反应:2Na+Cl2===2NaCl(白烟)
点燃 或光照 点燃 点燃 点燃
氯气 化 学 性 质
与非金属反应 H2与Cl2反应: H2+Cl2====2HCl(燃烧或爆炸) Cl2+H2O===HCl+HClO 与水反应 HClO是不稳定的一元弱酸,有漂白性,能杀菌 消毒(干燥Cl2无漂白性) Cl2+2NaOH===NaCl+NaClO (工业或实验室中吸收多余Cl2的反应) 2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2 (工业上制漂白粉的原理)
探究
氯水与一些物质的反应 实验内容 实验现象 有无色气泡逸 出;氯水颜色 变浅 有白色沉淀生 成 纸条褪色 实验结论 氯水中含有 Cl2盐酸 新制的氯水中 含有:Cl2、 氯水含漂白 HCl、HClO、 H+、 Cl- 等 剂 氯水含有Cl氯水中含有 盐酸和漂白 剂
1、氯水与镁 的反应 2、氯水与硝 酸银溶液反应 3、氯水与红 色纸条反应
A、AgNO3溶液
C、紫色石蕊试液
氯气的性质

氯气与水的反应: 实验内容 观察到的现象
解释与结论Байду номын сангаас
观察新制氯水的 颜色
滴加HNO3酸化 的AgNO3
滴加紫色石蕊
与有色布条反应
氯气与水的反应: 实验内容 观察到的现象
解释与结论 溶液中含Cl2分子
观察新制氯水的 颜色
滴加HNO3酸化 的AgNO3
黄绿色
滴加紫色石蕊
与有色布条反应
氯气与水的反应: 实验内容 观察到的现象
黄绿色
生成不溶于酸的白色沉 淀 先变红,后褪色
与有色布条反应
氯气与水的反应: 实验内容 观察到的现象 观察新制氯水的 颜色
解释与结论
溶液中含Cl2分子
黄绿色 生成不溶于酸的白色沉 淀
先变红,后褪色
滴加HNO3酸化 的AgNO3
滴加紫色石蕊
生成AgCl沉淀,溶 液中含Cl-
溶液中含H+与强氧 化性物质 Cl2无漂白性 HClO 有漂白性
HCl的制备 工业制法:H2+Cl2
点燃
2HCl
实验室制法:NaCl(s)+H2SO4(浓)===NaHSO4+HCl↑ 2NaCl(s)+H2SO4(浓) Na2SO4+2HCl↑ 收集法:向上排空气法 尾气吸收:用水吸收,使用倒置 漏斗防倒吸。
氯离子的检验
试剂
HCl溶液 NaCl溶液 Na2CO3溶液
阴极区 阳极区
H2和Cl2 混合不安全。 Cl2会和NaOH反应,会使得到的NaOH不纯。
离子交换膜法制烧碱 H+ +
↑Cl2 ↑H2
Na+
OH-
Cl-
Cl2
H2 _
氯气性质知识点汇总

氯气的知识点汇总物理性质: 黄绿 色有 刺激性气味的 气 体, 可 溶于水(1 ︰2 ) Fe 现象: 产生棕黄色烟 方程式: 2Fe+3Cl 2=====2FeCl 3 与金属 Cu 现象: 产生棕褐色烟 方程式:Cu+Cl 2 ===== CuCl 2 非金属:H 2现象:产生苍白色火焰 方程式:H 2+Cl 2=========2HCl H 2O (H 2O ):方程式: Cl 2 +H 2O=HCl+ HClO氧化物 离子方程式: Cl 2 +H 2O=H ++ Cl -+ HClOSO 2(H 2O ):方程式: S O 2+Cl 2 +2H 2O=H 2S O 4+2HCl离子方程式: S O 2+Cl 2 +2H 2O=4H ++ 2Cl -+S O 42-与 酸 H 2S : H 2S +Cl 2 = 2HCl+S氯气 H 2SO 3: H 2S O 3+Cl 2 +H 2O= H 2S O 4+2HCl NaOH : 2NaOH +Cl 2 = Na Cl+Na ClO+ H 2O碱 Ca (OH )2: 2Ca (OH )2+2Cl 2 =Ca Cl 2+Ca (ClO)2 +2H 2O离子方程式: 2OH -+Cl 2 =Cl -+ClO - +H 2OFeCl 2: 2Fe 2++Cl 2= 2Fe 3++2Cl - ,NaBr : 2Br -+Cl 2=Br 2+2Cl -盐 KI :2I -+Cl 2=I 2+2Cl - , Na 2SO 3: S O 32-+Cl 2 +H 2O=2H ++S O 42-+2 Cl - 烷烃取代 有机化合物 烯烃加成存在: 化合态原理: MnO 2+4HCl (浓)====MnCl 2+Cl 2↑+2H 2O 、 制备 除杂质( HCl ):通过盛有 饱和食盐水 的洗气瓶 干燥:通过盛有 浓硫酸 的洗气瓶或盛有 CaCl 2的干燥管验满: 湿润的碘化钾淀粉试纸或湿润的蓝色石蕊试纸 尾气处理: 氢氧化钠溶液 2NaOH +Cl 2 = Na Cl+Na ClO+ H 2O 氯气只做氧化剂时:Cl 2~2e -;氯气既做氧化剂又做还原剂时:Cl 2~e -(如Cl 2 +H 2O=HCl+ HClO )Cl 2~5/3e -(如3Cl 2 +6NaOH ==5Na Cl+Na ClO 3+3 H 2O )化学性质点燃点燃点燃 实验室Δ氯水性质的多重性次氯酸的性质“84”消毒液制备“84”消毒液的反应:2NaOH +Cl 2 = Na Cl+Na ClO+ H 2O ;“84”消毒液杀菌消毒或漂白的原理: Na ClO+ CO 2+H 2O = Na HCO 3 +HClO 。
氯气的性质

�
探究
氯气能与水反应 吗
影片5播放 影片 播放
实验现象:湿布条褪色 实验现象:湿布条褪色
结论:氯水有漂白性( 结论:氯水有漂白性(HClO) ) 次氯酸的性质: 次氯酸的性质: 1.强氧化性:杀菌,消毒,漂白 强氧化性:杀菌,消毒, 强氧化性 2.弱酸性: 弱酸性: 弱酸性 3.不稳定性2 HClO 不稳定性 HClO
史料:第一次世界大 战期间,德军与英,法军 在比利时伊普尔对峙.德 军动用了世界上第一支专 业的毒气部队,5分钟释 放了180吨毒气,使15000人 中毒,三分之一的人死去. 这是1915年4月22日发生的 令人发指的事件.
图为德军士兵正在投掷毒气弹
二,化学性质: 化学性质: 1,与金属反应 ,
光照( 光照(△)
H++ClO2HCl + O2
影片6播放 影片 播放
探究
新制氯水中含有哪些微粒? 新制氯水中含有哪些微粒? 如何证明这些微粒的存在? 如何证明这些微粒的存在? 3,与水反应 , (此反应为可逆反应 此反应为可逆反应) 此反应为可逆反应 Cl2通入水制得的溶液称为氯水,它与液 通入水制得的溶液称为氯水, 氯的区别
点燃
),Cu+Cl2==CuCl2 (1), ), 现象:铜丝在 燃烧, 现象:铜丝在Cl2中燃烧,产生大量的棕色 的烟, 的烟,溶于水得到蓝绿色的溶液
点燃
),2Fe + 3Cl2 == 2FeCl3 影片 播放 (2), ), 影片0播放 现象:铁丝在 燃烧, 现象:铁丝在Cl2中燃烧,产生大量的棕黄 色的烟,溶于水得到棕 色的烟,溶于水得到棕黄色的溶液 用钢瓶贮运氯气(常温下干燥Cl 用钢瓶贮运氯气(常温下干燥 2不与铁 反应) 反应)
氯气的物理性质

氯气化学式为Cl₂,常温常压下为有强烈刺激性气味的黄绿色的气体。
氯气密度是空气密度的2.5倍。
氯气熔沸点较低,常温常压下,熔点为-101.00℃,沸点-34.05℃,常温下把氯气加压至600~700kPa或在常压下冷却到-34℃都可以使其变成液氯。
氯气的物理性质
氯气可溶于水,易溶于有机溶剂,难溶于饱和食盐水。
1体积水在常温下可溶解2体积氯气,形成黄绿色氯水,密度为3.170g/L,比空气密度大。
氯原子最外层有7个电子,反应中易得到1个电子或共用一个电子对达到稳定结构(共价键)。
氯分子为双原子分子,分子式Cl₂。
氯气的化学性质
1.助燃性
氯气支持燃烧,许多物质都可在氯气中燃烧(除少数物质如碳单质等)。
2.氧化性:氯气具有强氧化性,加热下可以与所有金属反应
(1)与钠的反应:2Na+Cl2=2NaCl
现象:钠在氯气里剧烈燃烧,产生大量的白烟,放热。
(2)与铜的反应:Cu+Cl2=CuCl2
现象:红热的铜丝在氯气里剧烈燃烧,瓶里充满棕黄色的烟,加少量水后,溶液呈蓝绿色(绿色较明显),加足量水后,溶液完全显蓝色。
(3)与铁的反应:2Fe+3Cl2=2FeCl3
现象:铁丝在氯气里剧烈燃烧,瓶里充满棕红色烟,加少量水后,溶液呈黄色。
(4)与镁的反应:Mg+Cl2=MgCl2
现象:非常剧烈的燃烧,生成白色的烟。
氯气的性质

工业制盐酸?
• 提出探究性问题: • 消防员为什么可以用水进行处理和稀释泄漏 空气中的氯气?处理中,氯气是溶于水还是 与水发生了反应,或者两者都存在?请设计 最简单的实验方案
氯气能溶于水,常温下,1体积水约溶解2体积 的氯气。 氯气的水溶液叫‚氯水‛。 对比氯气颜色,观察氯水颜色,说明氯水中有何种粒 子 Cl2 。
液呈黄色 方程式:
(3)与铜反应: 剧烈燃烧,生成棕黄色的烟。
加水后,溶液呈蓝绿色或蓝色 方程式:
写出氯气与下列金属反应的化学方程式
Mg + Cl2 Al + Cl2
2、与非金属单质H2反应
H2 + Cl2
点燃或光照 2HCl
①将氢气点燃后伸入氯气中
安静燃烧,火焰呈苍 白色,瓶口有白雾
②混合后强光照射
问
题
氯气泄露时,若当时有一些化学药品,可以把他们浸湿捂在嘴上, 你会选择?( ) A. NaOH B . 白开水 C.食盐水 D.肥皂水(弱碱性)
氯气与碱溶液反应
①与NaOH Cl2+H2O
HCl+HClO
HCl +NaOH==NaCl + H2O HClO + NaOH==NaClO + H2O Cl2 + 2NaOH = NaCl + NaClO + H2O 84消毒液的主要成分
三、氯气的用途
1.自来水消毒;
2.制盐酸和漂白粉; 3.制多种农药、氯仿等有机溶剂
4.其它用途(P44)
——重要的化工原料。
小结
一、物理性质 氯气是一种黄绿色有刺激性气味的气体, 有毒,密度比空气大,能溶于水,易液化。 二、化学性质
1、与金属单质反应
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二节 氯及其化合物
氯气的性质
1.通过实验探究,观察现象以及讨论总结,认识氯气的主要性质,体会实验对认识和研究物
质性质的重要作用,培养证据推理意识,发展科学探究与创新意识的学科核心素养。
2.通过归纳总结,知道含氯物质性质不同是由于它们所含粒子不同,发展宏观辨识与微
观探析的学科核心素养。
3.通过含氯物质性质和用途的学习,感受物质性质与用途的关系,体会化学对生活、环
境保护的重要意义,增加社会责任感。
1.氯气的主要化学性质
2.氯水、次氯酸盐的主要化学性质
【第1课时】
一、氯气的用途与物理性质
1.氯的存在:氯是一种重要的“ 元素”,自然界中除了以NaCl 、MgCl 2、CaCl 2
等形式大量存在于海水中,还存在于陆地的盐湖和盐矿中。
2.氯气的主要用途:主要的 ,制造 ,有机溶剂、农药、染料和药品
等,也可生产漂白液和漂白粉等。
3.氯气的物理性质
Cl 2是一种 色、有 气味的气体,有毒,熔点为 ,沸点为 ,密度为3.214 g·L -1,比空气的密度 。
25 ℃时,1体积水可溶解 体积Cl 2,其水溶液称为 。
4.18世纪70年代,瑞典化学家 发现了Cl 2,1810年,英国化学家 确认为Cl 2。
二、氯气的化学性质
氯原子结构示意图为 ,最外层有7个电子,化学反应中容易 1个电子,达到8电子稳定结构,故Cl 2是很活泼的非金属单质,是一种 剂,具有 性。
1.氯水与金属单质的反应
写出下列反应的化学方程式
(1)与钠反应: 。
(2)与铁反应:。
(3)与铜反应:。
【特别提醒】氯气能与绝大多数金属反应,一般把变价金属(如Fe、Cu)氧化到最高价。
2.氯气与非金属单质的反应
【实验2-7 】氢气在氯气中燃烧
在空气中点燃氢气,然后把导管伸入盛有氯气的集气瓶中。
(1)现象:氢气在氯气中安静地,发出火焰,集气瓶口上方出现。
(2)化学方程式:。
(3)HCl溶于水形成。
【思考与讨论】物质燃烧一定有O2参加吗?如何定义燃烧?
3.氯气与水反应
(1)Cl2与H2O反应的化学方程式为,生成的具有强氧化性,能杀菌、消毒。
(2)【实验2-8】实验探究
℃取干燥的和湿润的有色布条分别放入两个盛有干燥Cl2的集气瓶中,盖上玻璃片,现象为干燥的有色布条,湿润的有色布条。
℃将有色鲜花放入盛有干燥Cl2的集气瓶中,盖上玻璃片,现象为有色鲜花。
结论:通过以上两实验可得出没有漂白性,具有漂白性。
【思考与讨论】
(1)氯气溶于水即得氯水,氯水中含有哪此微粒?氯水应具有哪些性质呢?
(2)阅读课本,总结次氯酸的性质和用途。
【特别提醒】用Cl2对自来水消毒时,Cl2会与水中有机物反应,生成的有机氯化物可能对人体有害,现在已开始使用新的自来水消毒剂如ClO2、O3等。
1.关于氯气的叙述中,下列正确的是()
A.氯气是一种黄绿色、有毒的气体
B.氯气在自然界中既可以以化合态存在,也可以以游离态存在
C.氯气不能溶解于水,所以可用排水法收集氯
D.氯气、氯水、液氯是同一种物质,只是状态不同,都属于纯净物
2.下列氯化物既能由金属和氯气直接化合制得,又能由金属和盐酸反应制得的是() A.CuCl2B.FeCl2C.NaCl D.FeCl3
3.下列关于液氯和氯水的叙述中正确的是()
A.液氯无色,氯水呈黄绿色
B.液氯是纯净物,而氯水是混合物
C.液氯与氯水均有酸性
D.液氯较氯水的漂白作用更强
4.某同学用氯气消毒的自来水配制下列物质的溶液,会产生明显变质的是()
①FeCl2②AgNO3③NaHCO3④AlCl3⑤KI
A.①②④B.①②③⑤C.①④⑤D.全部
5.在探究新制氯水成分及性质的实验中,依据下列方法和现象,不能得出相应结论的是
1.同学们为研究氯气和次氯酸两种物质究竟谁具有漂白性,设计了如图所示的实验装置。
请回答问题。
(1)浓硫酸的作用是。
(2)写出与研究目的直接相关的实验现象;B中干燥的有色布条,C中湿润的
有色布条 。
(3)从物质性质的方面来看,本实验还存在安全隐患 。
(4)研究的结果是两种物质中,具有漂白性的是 (填化学式)。
【第2课时】
(1)氯气与水反应的化学方程式为: 。
(2)向pH 试纸上滴加新制氯水,发现试纸先变红后褪色,原因是什么?
二、氯气的化学性质
4.氯气与碱的反应
(1)与氢氧化钠溶液反应——制取漂白液
℃写出盐酸与氢氧化钠溶液反应的化学方程式和离子方程式:。
℃写出次氯酸与氢氧化钠溶液反应的化学方程式和离子方程式:。
℃写出氯气(或氯水)与氢氧化钠溶液反应的化学方程式和离子方程式:。
④漂白液的有效成分是 。
(2)与石灰乳反应——制取漂白粉
℃制取反应的化学方程式: 。
℃漂白粉的主要成分是 ,有效成分是 ,漂粉精的主要成分是 。
【思考与讨论】氯水作漂白剂相对于漂白粉和漂白液作漂白剂的不足有哪些?
探究次氯酸盐的化学性质
(1)向碳酸氢钠溶液中滴加醋酸溶液,有气泡产生,
反应的化学方程式是: ;
结论:酸性CH 3COOH >H 2CO 3
(2)参考上(
1)方法,设计实验验证酸性强弱:H
2CO 3>HClO
;
(3)漂白液、漂白粉、漂粉精既可以用作漂白棉、麻、纸张的漂白剂,有时用作游泳池
等场所的消毒剂。
它们的漂白、消毒原理相同,都是在酸性条件下生成有漂白、消毒作用的HClO 。
漂白或消毒原理的方程式: ;
漂白粉失效的方程式: ;。
如何证明漂白粉已失效或部分失效: 。
(4)指出下列含氯物质中氯元素的化合价:NaCl 、Cl 2、 NaClO 、Ca(ClO)2、ClO 2、KClO 3、
HClO 4 ,从价态规律判断次氯酸盐的性质。
若向NaClO 溶液中加入酸进行酸化则有次氯酸生成,此时溶液应有 性。
(5)根据你所学知识判断下列反应能否进行,若能写出有关化学反应方程式或离子方
程式:
℃NaClO 溶液用硫酸酸化后加入NaCl 溶液 ; ℃NaClO 溶液用硫酸酸化后加入 FeSO 4溶液 ;
【小结】次氯酸盐的化学性质和用途
【思考与讨论】通过学习,我们知道氯气是活泼的非金属单质,除了能与金属、非金属、水和碱等反应外,还能与哪些物质反应呢?举例并写出相关反应式。
【小结】二、氯气的化学性质
5.与还原性物质反应:
1.将Cl 2制成漂白粉的主要目的是( )
A.增强漂白和消毒作用
B.使它转化为较稳定的物质,便于保存和运输
C.使它转化为较易溶于水的物质
D.增加氯的含量,有利于漂白、消毒
2.城市生活用水常用漂白粉杀菌、消毒。
下列关于漂白粉的叙述正确的是( )
A .漂白粉的有效成分是Ca(ClO)2和CaCl 2
B .漂白粉是由Cl 2与烧碱制得的
C.漂白粉能杀菌、消毒是因为它有强氧化性D.在使用漂白粉时应用浓盐酸
3.制氯水最好的方法是()
4.KClO3溶液与浓盐酸混合有氯气生成,写出化学反应方程式:。
1.氯气及其相关产品在生活、生产中应用广泛。
(1)氯气属于有毒气体,在实验室进行相关实验时,除必须进行尾气处理外,还应注意的问题是;若在生活中遇贮氯罐意外泄漏,应
(填“顺风”或“逆风”)疏散,消防员喷洒稀NaOH溶液的作用是。
(用化学方程式表示)
(2)℃ 实验室常用NaOH溶液吸收多余氯气,下列试剂也可用于吸收氯气的是(填字母)。
a. NaCl溶液
b. FeSO4溶液
c. Na2SO3溶液
℃ 写出℃中你选择的吸收试剂与Cl2反应的离子方程
式:。
(3)家庭中常用消毒液(主要成分NaClO)与洁厕灵
(主要成分盐酸)清洁卫生。
某品牌消毒液包装上说明
如右图。
℃ 分析“对金属制品有腐蚀作用”的原因。
℃ 需“密闭保存”的原因。
℃ “与洁厕灵同时使用”会产生有毒的氯气,写出反应的离子方
程式:。
(4)若空气中氯气的含量超过0.1 mg/m3就会引起中毒。
某
液氯生产车间在一次测定空气中氯气的含量时,测得消耗了0.001
mol/L的KI溶液100mL,为
了判断空气中氯气的含量是否超标,还需要获得的数据。
课后练习
【课后练习答案】1.(1)干燥氯气(2)不褪色褪色
(3)缺少尾气处理(4)HClO
【课后练习答案】1.(1)通风逆风Cl2 + 2NaOH == NaCl + NaClO + H2O (2)① b c ① 2Fe2+ + Cl2 = 2Fe3+ + 2Cl-SO32-+ Cl2 + H2O = SO42-+ 2Cl-+ 2H+(3)① NaClO有强氧化性,而一般金属具有较强还原性
① 消毒液的有效成分NaClO能与空气中的CO2作用,使其变质
① Cl-+ ClO-+ 2H+ = Cl2↑+ H2O
(4)通入空气的体积。
