[配套K12]2018年秋高中化学 初高中衔接 专题22 二氧化硫、一氧化氮及酸雨学案
江苏省启东市2018届高考化学专项复习 硫和氮的氧化物 二氧化氮和一氧化氮(1)练习 苏教版

二氧化氮和一氧化氮1.下列只能用排空气法收集的气体有()A.NO B.NO2 C.H2 D.CO2.相同状况下,在体积相同的三个烧瓶中分别盛满NH3、HCl和NO2气体,并分别倒立在水槽里,充分溶解后烧瓶内三种溶液中溶质的物质的量浓度之比为(设烧瓶内液体未扩散到水槽里) ()A.1∶1∶1 B.2∶2∶3 C.3∶3∶2 D.2∶2∶13.下列物质中,不能直接用单质反应制得的是()A.Cu2S B.SO2 C.FeCl2 D.NO4. Murad等三位教授最早提出NO分子在人体内有独特功能,近年来此领域研究有很大发展,因此这三位教授荣获了1998年诺贝尔医学及生理学奖。
下列关于NO的叙述不正确的是()A.NO可以是某些含低价N物质氧化产物 B. NO不是亚硝酸酐C.NO可以是某些含高价N物质的还原产物 D.NO是棕色气体5.盛有NO和NO2混合气体的量筒倒立在盛有水的水槽中,过一段时间后,量筒内的气体体积减小为原来的一半。
则原混合气体中NO和NO2的体积比是( )A.3∶1 B.1∶3C.2∶1 D.1∶26.将盛有12mLNO2和O2混合气体的量筒倒立于水槽中,充分反应后,还剩余2mL无色气体,则原混合气体中O2的体积是( )A.1.2Ml B.2.4mL C.3.6mL D.3mL7.某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体。
现将此无色透明的混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色。
对于原混合气体成分的判断中正确的是( )A.肯定有SO2和NOB.可能有Cl2、O2和NO2C.可能有Cl2和O2D.肯定只有NO8.某地发生了食用熟牛肉中毒事件,导致四个死亡、一百多人中毒。
经过对该牛肉的检测,发现其中某盐的含量比国家标准允许的含量高800多倍,则该盐可能是( )A.NaNO2 B.NaNO3 C.NaCl D.BaSO49.下列关于NO的叙述不正确的是( )A.NO对环境的危害在于破坏臭氧层、形成酸雨等方面B.NO可以是某些含高价N物质的还原产物也可以是某些含低价N物质的氧化产物C.实验室制取少量的NO可以用向下排空气法收集D.生物体内存在少量NO能提高其生理机能,如扩张血管、促进免疫力等10. (14分)非金属单质A经图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题:ABCD(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
高中化学 硫和氮的氧化物课件 新人教版必修1

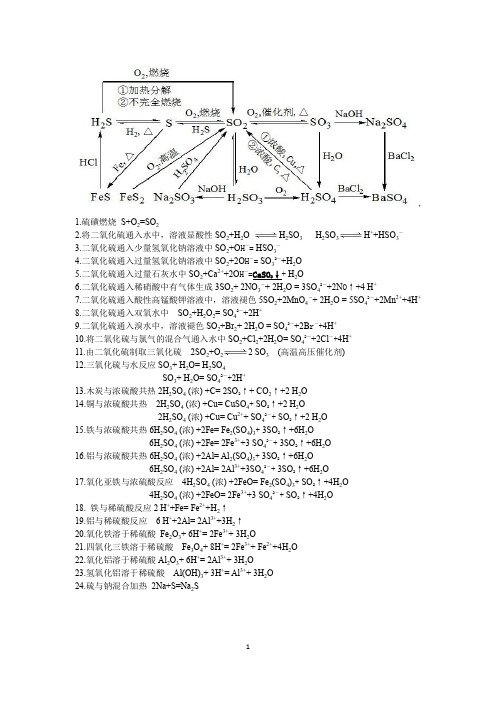
3NO2 + H2O = 2HNO3 + NO
雷雨发庄稼
三、二氧化硫的污染
1.什么是酸雨? 2.正常雨水pH应在什么范围? 3.酸雨是怎样形成的? 4.酸雨有什么危害?
NO和NO2的转化
放电或高温
N2 + O2 = 2NO
(无色,不溶于水)
2NO + O2 = 2NO2
4NO + 3O2 + 2H2O = 4HNO3
例1、在标准状况下,一个充满NO2气体的干燥烧 瓶,将烧瓶倒置于水中,瓶内液面逐渐上升。当
液面不再上升后,烧瓶内溶液的物质的量浓
度为(假设溶液不扩散)
1 mol/L。 22.4
解: 设NO2的物质的量为3 mol
3NO2 + 2H2O = 2HNO3 + NO
SO2 + 2 H2O+Cl2 = 2HCl + H2SO4
SO2 + 2 H2O+2FeCl3 = 2HCl+ 2FeCl2 + H2SO4
④、SO2 的漂白性:
实验现象:把品红溶液滴入溶有SO2的水溶液 中,品红溶液褪色。再加热,又恢复原来的 颜色。
结论:SO2 具有漂白作用
SO2 与某些有 色物质化合生成 无色 物质,但 是这些无色物质 不稳定,容易分 解而恢复原来的 颜色 。
实验室制备SO2的硫酸是 用浓的还是稀的?
提示:二氧化硫易溶于水。
工业制备硫酸:
高温
4FeS2 + 11 O2 = 2 Fe2O3 + 8 SO2
点燃
(S + O2 = SO2 )
催化剂
[配套K12]2018版高中化学 专题4 硫、氮和可持续发展 第二单元 生产生活中的含氮化合物 第1课时 氮氧化物的
![[配套K12]2018版高中化学 专题4 硫、氮和可持续发展 第二单元 生产生活中的含氮化合物 第1课时 氮氧化物的](https://img.taocdn.com/s3/m/2e572e9584254b35eefd3498.png)
第1课时氮氧化物的产生及转化[学习目标定位] 1.理解氮氧化物(NO、NO2)的来源和性质。
2.了解氮氧化物对环境的影响。
一、一氧化氮和二氧化氮1.两支大试管分别集满NO和NO2气体,观察它们的颜色状态,嗅闻它们的气味,比较它们密度的大小。
填写下表:2.判断下列说法是否正确?(1)氮元素可形成五种价态的氧化物,其中+4价的有NO2和N2O4两种( )(2)NO和NO2的颜色、气味、水溶性不同,但它们都是有毒的气体( )(3)实验室只能用排水法收集NO,用向上排空气法收集NO2( )(4)NO具有较强的还原性,在空气中极易被氧化( )(5)将盛满NO的试管打开塞子置于空气中,无色气体变为红棕色( )答案(1)√(2)√(3)√(4)√(5)√3.二氧化氮溶于水的实验如下图所示:把充满NO2的试管倒立水中,再通入O2。
(1)图1实验试管内气体的颜色慢慢变为无色,水面上升,最后静止在距试管底部的1/3处。
(2)图2实验把充满NO2的试管倒立水中,试管内水面上升,有无色气体NO生成,再通入氧气,最后试管全部充满液体。
(3)图3实验试管内液面上升,最后试管全部充满液体。
(1)二氧化氮溶于水反应的化学方程式:3NO2+H2O===2HNO3+NO,氧化剂与还原剂的物质的量之比是1∶2。
(2)水吸收NO 2制硝酸的原理 3NO 2+H 2O===2HNO 3+NO ; 2NO +O 2===2NO 2; 4NO 2+O 2+2H 2O===4HNO 3。
(3)二氧化氮溶于氢氧化钠溶液反应的化学方程式是2NO 2+2NaOH===NaNO 2+NaNO 3+H 2O 。
1.最新的病毒学研究证实,一氧化氮对SARS 病毒有直接抑制作用。
下列关于一氧化氮的叙述正确的是( )A .一氧化氮是一种红棕色气体B .常温常压下,一氧化氮不能与空气中的氧气直接化合C .一氧化氮可由氮气和氧气在放电条件下直接化合得到D .一氧化氮易溶于水,不能用排水法收集 答案 C解析 NO 是一种无色难溶于水的气体,可以用排水法收集;常温常压下,NO 容易与氧气直接化合生成NO 2。
高中化学《硫和氮的氧化物》教案+随堂练习新人教版必修

高中化学《硫和氮的氧化物》教案+随堂练习新人教版必修一、教学目标1. 让学生了解硫和氮的氧化物的性质、组成和分类。
2. 让学生掌握硫和氮的氧化物的化学式、制备方法和反应特点。
3. 培养学生运用化学知识分析和解决实际问题的能力。
二、教学内容1. 硫的氧化物:二氧化硫、三氧化硫。
2. 氮的氧化物:一氧化氮、二氧化氮、氮气。
三、教学重点与难点1. 教学重点:硫和氮的氧化物的性质、制备方法和反应特点。
2. 教学难点:硫和氮的氧化物的化学式和制备方法。
四、教学方法1. 采用问题驱动法,引导学生探究硫和氮的氧化物的性质。
2. 利用实验现象,让学生直观地了解硫和氮的氧化物的制备方法和反应特点。
3. 通过小组讨论,培养学生的合作能力和表达能力。
五、教学过程1. 导入:回顾硫和氮的元素性质,引导学生思考硫和氮的氧化物。
2. 教学新课:介绍硫和氮的氧化物的性质、组成和分类。
3. 实验演示:展示硫和氮的氧化物的制备方法和反应现象。
4. 小组讨论:让学生分析硫和氮的氧化物的制备方法和反应特点。
5. 课堂练习:随堂练习题,巩固所学知识。
6. 总结:回顾本节课所学内容,强调重点和难点。
7. 作业布置:布置相关习题,巩固所学知识。
随堂练习:1. 判断题:(1)硫的氧化物只有二氧化硫和三氧化硫。
()(2)氮的氧化物只有一氧化氮和二氧化氮。
()(3)二氧化硫是无色、有刺激性气味的气体。
()2. 选择题:(1)下列哪个不是硫的氧化物?A. 二氧化硫B. 三氧化硫C. 二氧化硅D. 三氧化二硫(2)下列哪个不是氮的氧化物?A. 一氧化氮B. 二氧化氮C. 氮气D. 三氧化二氮3. 简答题:(1)请简述硫的氧化物的制备方法。
(2)请简述氮的氧化物的制备方法。
4. 计算题:某实验室制备了20g二氧化硫,请问理论上可以制备多少氮气?(提示:根据反应方程式进行计算。
)六、教学内容1. 硫和氮的氧化物的应用:环境污染和大气化学。
2. 硫和氮的氧化物的检测方法。
高三化学专题-硫、氮及其化合物
B.甲、乙两试管都没有白色沉淀生成 C.甲试管没有白色沉淀生成而乙试管有 D.甲试管有白色沉淀生成而乙试管没有 9. 今有一混合物的水溶液, 只可能含有以下离子中的若干种: K+、 NH4+ 、 Cl、 Mg2+、 Ba2+、 CO32、SO42,现取三份 100 mL 溶液进行如下实验: (1)第一份加入 AgNO3 溶液有白色沉 淀产生; (2)第二份加足量 NaOH 溶液加热后,收集到气体 0.04 mol; (3)第三份加足量 BaCl2 溶液后,得干燥沉淀 6.27g,经足量盐酸洗涤、干燥后,沉淀质量为 2.33g。根据上述 实验,以下推测正确的是 A.K+一定不存在,SO42一定存在 C.Cl一定不存在,CO32一定存在 ( ) B.100 mL 溶液中含 0.02mol CO32 D.Ba2+一定不存在,Mg2+可能存在
(1)试管 C 口部的棉团上发生反应的离子方程式是 (2)试管 B 中的实验现象是 可以观察到
。 ,若将该试管中反应后的溶液加热, 性。 ,
。试管 C 中溶液变浑浊,则证明 SO2 具有
(3)试管 C 口部的棉团既可浸碱溶液,又可浸 NaHCO3 溶液,其作用是
3
如果浸 NaHCO3 溶液,则发生反应的化学方程式是 。 14 . 写 出 浓 硫 酸 与 木 炭 粉 在 加 热 条 件 下 反 应 的 化 学 方 程 式 , 并 标 出 电 子 转 移 关 系 。w.w.w.k.s.5.u.c.o.m
Fe+2Fe(NO3)3→3Fe(NO3)2 4、C+4HNO3(浓) 五、硝酸盐 2NaNO3 Cu(NO3)2 2AgNO3 2NaNO2+ O2↑(在金属活动性顺序表中,镁之前的金属) Cu O+4NO2↑+ O2↑(镁与铜之间,包括镁与铜) 2 Ag +2NO2↑+ O2↑(铜之后) CO2↑+4NO2↑+2H2O
人教版高中化学必修一课后提升训练: 二十 4.3.2二氧化氮和一氧化氮 二氧化硫和二氧化氮对大气的污染 Word

此套题为Word版,请按住Ctrl,滑动鼠标滚轴,调节合看比例,答案解析附后。
课后提升训练二十二氧化氮和一氧化氮二氧化硫和二氧化氮对大气的污染(30分钟50分)一、选择题(本题包括5小题,每小题5分,共25分)1.下列说法正确的是( )A.pH=6的降雨是酸雨B.氯气泄漏后应顺风向低处跑C.SO2和HClO都具有漂白性,两者的漂白原理相同D.我国城市环境中的大气污染物主要有SO2、NO2、CO、可吸入颗粒物等【解析】选D。
A项,pH<5.6的降雨称之为酸雨;B项,Cl2密度比空气大,Cl2泄漏后,人应向高处转移;C项,SO2与HClO漂白原理不同,前者是SO2与有色物质结合生成无色物质,后者是将有色物质氧化为无色物质;D项说法正确。
2.(2017·银川高一检测)发射卫星的运载火箭,其推进剂引燃后发生剧烈反应,产生大量的高温气体从火箭尾部喷出。
引燃后产生的高温气体主要成分是CO2、H2O、N2、NO,这些气体均无色,但在卫星发射现场却看到火箭喷出大量红烟。
产生红烟的原因是( )A.高温下N2遇空气生成NO2B.NO遇空气生成NO2C.CO2与NO反应生成CO与NO2D.NO和H2O反应生成H2和NO2【解析】选B。
NO在空气中能被氧气氧化为NO2,NO2是红棕色气体。
【补偿训练】工业废气NO、NO2是造成大气污染的气体之一,工业上常用原理:NO x+NH3N2+H2O,使其转化为无毒的N2,现有NO、NO2的混合气体3.0 L,可与3.5 L相同状况的NH3恰好完全反应,全部转化为N2,则在原混合气体中NO和NO2的物质的量之比是( )A.1∶1B.2∶1C.3∶1D.1∶3【解析】选D。
相同状况下,气体的体积比等于物质的量之比,则3.0 mol NO、NO2混合气体与3.5 mol NH3恰好反应生成N2,设NO 为xmol,则NO2为(3-x)mol,由得失电子守恒可知2x+4(3-x)=3×3.5,x=0.75 mol,故原混合气体中NO和NO2的物质的量之比为1∶3。
人教版高中化学必修一第三节硫和氮的氧化物第2课时—课时学案.docx

高中化学学习材料唐玲出品第三节硫和氮的氧化物第2课时1.了解一氧化氮和二氧化氮的性质。
2.了解二氧化硫和二氧化氮对大气的污染。
二、二氧化氮和一氧化氮1.氮气性质,通常情况下不与氧气反应。
但是在条件下,和可以直接化合生成NO。
有关的反应方程式为。
2.一氧化氮(1)物理性质:色、溶于水的有毒气体。
(2)化学性质:常温下极易与氧气反应,化学方程式为。
3.二氧化氮(1)物理性质:色、有气味的有毒气体,密度比空气大,液化,溶于水。
(2)化学性质:溶于水时与水发生反应,化学方程式为。
三、二氧化硫和二氧化氮对大气的污染1.空气中和的来源的来源:的燃烧及某些含的金属矿物的冶炼,往往会生成二氧化硫。
(2)NO、的来源:等。
和的危害(1)直接危害人体健康,引起疾病,严重时会使人死亡。
(2)大气中的和溶于水后形成性溶液,随雨水降下,成为。
正常雨水由于溶解了,pH为,而酸雨的pH<。
酸雨有很大的危害,能直接破坏农作物、森林、草原,使土壤、湖泊酸化,还会加速建筑物、桥梁、工业设备、运输工具及电信、电缆的腐蚀。
3.汽车尾气的成分汽车尾气中除含有外,还含有,未燃烧的、 (如使用含铅汽油)和颗粒物等。
4.防治酸雨的措施(1)原煤;(2)改进技术;(3)对煤燃烧后形成的烟气。
1.下列各组气体,在常温、常压下不能共存的是( )与 B.NO与与与2.在被水吸收的反应中,发生还原反应和氧化反应的物质的质量之比为( )A.3∶1B.1∶3C.2∶1D.1∶23.下列物质不能由单质直接化合生成的是( )4.造成大气污染的气体,主要是来自( )A.汽车尾气B.硫酸工厂释放的气体C.石油和煤的燃烧D.火山爆发5.下述做法能改善空气质量的是( )A.以煤等燃料作为主要生活燃料B.利用太阳能、风能和氢能等能源替代化石能源C.鼓励私人购买和使用汽车代替公交车D.限制使用电动车课内探究二、二氧化氮和一氧化氮1.一氧化氮的生成与转化(1)根据NO的物理性质,实验室制取NO时应选择何种收集方法?。
人教版高中化学必修1 同步测试 二氧化氮和一氧化氮二氧化硫和二氧化氮对大气的污染18

第二课时二氧化氮和一氧化氮二氧化硫和二氧化氮对大气的污染课后提能·层级练层级一学业达标练1.酸雨是对呈酸性(pH小于5.6)降水的统称。
下列说法错误的是( )A.空气中的SO2溶于水,最终形成酸雨B.汽车排放的尾气、硝酸厂和化肥厂的废气都含有氮氧化物C.工业废水任意排放是造成酸雨的主要原因D.为了减少酸雨的形成,必须减少SO2的排放量,对燃料脱硫处理解析:选C 工业废水任意排放引起江河湖泊污染,而酸雨是由于SO2和NO2溶于水引起的。
2.对3NO2+H2O===2HNO3+NO反应的下列说法正确的是( )A.氧化剂与还原剂的质量比为1∶2B.氧化产物与还原产物的物质的量之比为1∶2C.NO2是氧化剂,H2O是还原剂D.在反应中若有6 mol NO2参与反应时,有3 mol电子发生转移解析:选A NO2既是氧化剂,又是还原剂,物质的量之比为1∶2,HNO3是氧化产物,NO是还原产物,物质的量之比为2∶1,由3 mol NO2参加反应转移电子2 mol,知6 mol NO2参加反应,有4 mol电子发生转移。
3.下列物质:①氮氧化物②未完全燃烧的碳氢化合物③含铅化合物④二氧化硫⑤一氧化碳,其中属于汽车尾气成分的是( )A.①②③④B.①②③⑤C.②③④⑤D.全部解析:选D 汽车尾气中的成分比较复杂,有不完全燃烧产生的CO、碳氢化合物、碳的固体颗粒,有N2和O2反应产生的NO、NO2,有汽油中的S元素与O2生成的SO2,汽油中的抗爆剂是含铅的化合物。
4.环保部门测得某市空气里的成分有①N2,②O2,③CO2,④Ar,⑤SO2,⑥NO2,⑦可吸入碳颗粒。
其中导致酸雨的是( )A.③⑤⑥B.⑤⑥C.④⑤⑦D.除①②以外解析:选B SO2、NO2易形成酸雨。
5.一定条件下,将等体积NO和O2充入一试管,并将试管倒立于水槽中,充分反应后剩余气体的体积约为原总体积的( )A.14B.34C.18 D .38解析:选C 4NO +3O 2+2H 2O===4HNO 3;若NO 和O 2都取4体积,则反应后剩余O 21体积,所以充分反应后剩余气体的体积约为原总体积的18。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题22 二氧化硫、一氧化氮及酸雨
【知识回放】
1.如何鉴别二氧化硫与二氧化碳气体?
2.请写出氮元素的原子结构示意图。
【答案】
1.①SO2的还原性,用酸性高锰酸钾溶液或溴水或碘水,是否褪色鉴别;
②SO2的漂白性,用品红溶液鉴别。
2.
【新知精讲】
一、氮气、二氧化氮及一氧化氮
1.氮气
N2约占空气体积的4/5左右,在放电或高温条件下,N2与O2反应的化学方程式为N2+O22NO。
2.一氧化氮和二氧化氮
(1)物理性质。
(2)化学性质。
①常温下,NO不稳定,易与O2结合。
化学方程式为2NO+O2===2NO2。
②NO2溶于水时与水发生反应。
化学方程式为3NO2+H2O===2HNO3+NO。
二、SO2、NO2对大气的污染
1.SO2与NO2的主要来源、危害和防治
(1)
(2)
(3)
2.酸雨
(1)概念:pH<5.6的降雨。
(2)成因:主要是大气中的SO2与NO2溶于水形成的。
(3)危害。
①直接破坏农作物、森林、草原,使土壤、湖泊酸化。
②加速建筑物、桥梁、工业设备、运输工具及电信电缆的腐蚀。
【科学探究】
探究一氮氧化物之间的转化及其重要性质
问题导引
氮氧化物之间的转化关系:
1.民间有谚语:“雷雨发庄稼”,即在雷雨过后,植物生长得更旺盛,其中蕴含了什么化学原理?请写出相关的化学方程式。
提示空气中的氮气和氧气在放电的条件下生成NO,NO最终转化生成硝酸,硝酸随雨水落入土壤,与其中的矿物质等发生反应生成硝酸盐,为土壤补充了氮肥,所以庄稼生长得更旺盛。
相关的化学方程式为N2+O2
2NO,2NO+O2===2NO2,3NO2+H2O===2HNO3+NO。
2.实验室能否用排空气法收集NO气体?能否用排水法收集NO2?为什么?
提示不能。
NO易与空气中的O2反应,故不能用排空气法收集,一般用排水法收集;NO2易与H2O发生反应,故不能用排水法收集,一般用向上排空气法收集。
探究二二氧化硫和二氧化氮对大气的污染
问题导引
酸雨的形成
1.由上图可知常见的酸雨类型有哪些?写出有关化学方程式。
提示①硫酸型:SO2+H2O H2SO3,2H2SO3+O2===2H2SO4
②硝酸型:3NO2+H2O===2HNO3+NO
或4NO2+O2+2H2O===4HNO3
2.硫酸型酸雨放置一段时间后,酸性会增强,其原因是什么?
【重点突破】
1.一氧化氮和二氧化氮的区别与联系
2
2.氮氧化物溶于水的常见计算类型
(1)NO2与O2的混合气体溶于水。
如果V(NO2)∶V(O2)=x,则有以下三种情况:
(2)NO与O2的混合气体溶于水。
如果V(NO)∶V(O2)=x,则有以下三种情况:
3.酸雨形成图示
4.常见环境污染及危害
【典题探究】
典例1
下列说法中,正确的是( )
A.NO2能与水反应生成硝酸,故NO2为酸性氧化物
B.可用排空气法收集NO和NO2
C.NO2与溴蒸气的鉴别可用NaOH溶液,溶于NaOH溶液得无色溶液的是NO2,得橙色溶液的为溴蒸气
D.NO2是大气污染物之一
【答案】:D
变式训练1-1
下列物质不属于空气污染物的是( )
A.SO2
B.CO2
C.NO2
D.NO
【答案】:B
【解析】:SO2、NO2、NO均是形成酸雨的主要物质,是对大气有污染的气体;而CO2气体不属于空气污染物。
变式训练1-2
减少空气污染的措施是( )
①实验室使用排风电扇②开发新能源③冶金工厂产生的工业废气经净化处理后,才能排放到空气中
④向煤中掺入一定量的石灰石
A.①②③
B.②③④
C.①③④
D.①②③④
【答案】:B
【解析】:实验室使用排风电扇可降低室内空气污染,但不能减少对空气的污染;开发新能源可减少化石燃料的使用量、冶金工厂废气净化处理、向煤中掺入一定量的石灰石都可减少空气污染。
变式训练1-3
空气是人类生存所必需的重要资源。
为改善空气质量而启动的“蓝天工程”得到了全民的支持。
下列措施不利于“蓝天工程”建设的是( )
A.推广使用燃煤脱硫技术,防止SO2污染
B.实施绿化工程,防治可吸附性颗粒污染
C.研制开发燃料电池汽车,消除机动车尾气污染
D.加大石油、煤的开采速度,增加化石燃料的供应量
【答案】:D
【解析】:化石燃料燃烧能增加CO2和SO2的排放,不利于改善空气质量。
典例2
将40 mL NO2和NO的混合气体通入倒立于水槽中盛满水的试管里,充分反应后试管中剩余20 mL气体,则原混合气体中NO2和NO的体积比为( )
A.2∶1
B.1∶3
C.3∶1
D.1∶1
【答案】:C
【解析】:3NO 2+H 2O===2HNO 3+NO ΔV
3mL
1mL 2mL
V (NO 2) (40mL-20mL) 2()324020V NO ml
ml ml ml
=
-,解得V (NO 2)=30mL 所以原混合气体中V (NO)=40mL-30mL=10mL, 因此V (NO 2)∶V (NO)=30mL ∶10mL=3∶1。
变式训练2-1
将10 mL 充满NO 2和O 2的混合气体的试管,倒置在水槽中,反应停止后试管内剩余2 mL 的无色气体,求原混合气体中NO 2和O 2各多少毫升?
【答案】:若剩余的气体是NO,则NO 2和O 2的体积分别为9.2 mL 和0.8 mL;若剩余的气体是O 2,则NO 2和O 2的体积分别为6.4 mL 和3.6 mL 。
变式训练2-2
如图所示,室温下向盛有3.0 mL NO 的试管中缓缓通入1.5 mL O 2(所有气体体积均在标准状况下测定)。
请回答下列问题:
(1)写出观察到的现象:
① ; ② ;
③。
(2)最终试管中剩余的气体是,体积为。
【答案】:(1)①通入O2后试管内气体变为红棕色②试管内液面升高③最后试管内剩余一种无色气体(2)NO 1.0 mL
变式训练2-3
环境污染已成为人类社会面临的重大问题。
下列名词与环境污染无关的是( )
①白色垃圾②潮汐③酸雨④光化学烟雾⑤臭氧空洞⑥可吸入颗粒物⑦赤潮⑧绿色化学
A.①⑦
B.②⑤
C.②⑧
D.①③④⑤⑥⑦
【答案】:C
【解析】:潮汐是自然现象;白色垃圾主要是难降解的白色塑料,会造成土壤污染;酸雨是氮的氧化物和硫的氧化物造成的污染;光化学烟雾是氮的氧化物等排放造成的;臭氧空洞是由氟氯代烃等物质造成的;赤潮是水体的富营养化造成的,其危害是造成水中溶解氧减少,导致生物死亡。
