2-2-多电子原子的结构
核外电子分层排布示意图

(1)x表示该元素原子核内的质子,数 该粒子有 3 个电 子层,y与粒子的 化学性质 关系非常密切。
(2)当x-y=10,该粒子为 原子 别)。
(填类
(3)y=8时,该粒子带有2个单位的负电荷,该
粒子的符号为 S2-
。
(4)当y=1的中性原子与y=7的中性原子化合 时,形成的化合物属于 离子 化合物。
A.S和S2-
B.F-和Mg2+
C.Ne和H2O
D.Na和Na+
5.右图是钠原子的结构示意图:
弧线表示 电子层 。 原子核内的质子数 是 11 。第二层上的电子数是 8 。
6.金属元素在化学反应中一般较易 失去 电
子,变成 阳
离子,这是因为金属原
子最外层电子数目一般 少于
4个。
7.某种原子结构简图为
粒子结构 区 粒子电性 别
符号
联系
原子
阳离子
离子
阴离子
质子数=核外电子数 质子数>核外电子数 质子数<核外电子数
不显电性
用元素符号表示如 Na、Cl
显正电性
显负电性
用阳离子符号表示如 用阴离子符号表示如
Na+、Mg2+
Cl-、S2-
阳离子
原子
阴离子
物质与其构成粒子间的关系
[例1]六种粒子结构示意图分别为:
。
(2)横行中,三种元素的原子在结构上的相同点是
电子层数相同
,不同点是 最外层电子数不同 。
•
树立质量法制观念、提高全员质量意 识。20. 10.22 20.10. 22Thur sday, October 22, 2020
•
人生得意须尽欢,莫使金樽空对月。 00:59:4900:5 9:490 0:5910 /22/2 020 12:59:49 AM
原子的电子层排布规律

核外电子的分层排布规律:1、第一层不超过2个,第二层不超过8个;2、最外层不超过8个。
每层最多容纳电子数为2n2个(n代表电子层数),即第一层不超过2个,第二层不超过8个,第三层不超过18个;3、最外层电子数不超过8个(只有1个电子层时,最多可容纳2个电子)。
4、最低能量原理:电子尽可能地先占有能量低的轨道,然后进入能量高的轨道,使整个原子的能量处于最低状态。
5、泡利原理:每个原子轨道里最多只能容纳2个电子,且自旋状态相反。
6、洪特规则:当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,且自旋状态相同。
扩展资料一、核外电子排布与元素性质的关系1、金属元素原子的最外层电子数一般小于4,较易失去电子,形成阳离子,表现出还原性,在化合物中显正化合价。
2、非金属元素原子的最外层电子数一般大于或等于4,较易获得电子,活泼非金属原子易形成阴离子。
在化合物中主要显负化合价。
3、稀有气体元素的原子最外层为8电子(氦为2电子)稳定结构,不易失去或得到电子,通常表现为0价。
4、核外电子排布的几条规律之间既相互独立又相互统一,不能孤立地应用其中一条,如当M层不是最外层时,最多排布的电子数为2×32=18个,而当M 层是最外层时,则最多只能排布8个电子。
5、书写原子结构示意图时要注意审题和书写规范:看清是原子还是离子结构示意图,勿忘记原子核内的“+”号。
二、1~18号元素原子结构的特征1、原子核中无中子的原子:H。
2、最外层有1个电子的元素:H、Li、Na。
3、最外层有2个电子的元素:Be、Mg、He。
4、最外层电子数等于次外层电子数的元素:Be、Ar。
5、最外层电子数是次外层电子数2倍的元素:C;是次外层3倍的元素:O;是次外层4倍的元素:Ne。
6、电子层数与最外层电子数相等的元素:H、Be、Al。
7、电子总数为最外层电子数2倍的元素:Be。
8、次外层电子数是最外层电子数2倍的元素:Li、Si。
核外电子的排布规律
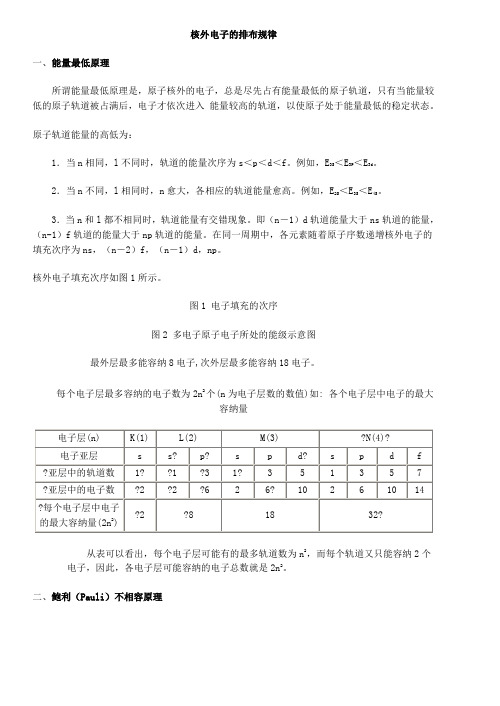
核外电子的排布规律一、能量最低原理所谓能量最低原理是,原子核外的电子,总是尽先占有能量最低的原子轨道,只有当能量较低的原子轨道被占满后,电子才依次进入能量较高的轨道,以使原子处于能量最低的稳定状态。
原子轨道能量的高低为:1.当n相同,l不同时,轨道的能量次序为s<p<d<f。
例如,E3S<E3P<E3d。
2.当n不同,l相同时,n愈大,各相应的轨道能量愈高。
例如,E2S<E3S<E4S。
3.当n和l都不相同时,轨道能量有交错现象。
即(n-1)d轨道能量大于ns轨道的能量,(n-1)f轨道的能量大于np轨道的能量。
在同一周期中,各元素随着原子序数递增核外电子的填充次序为ns,(n-2)f,(n-1)d,np。
核外电子填充次序如图1所示。
图1 电子填充的次序图2 多电子原子电子所处的能级示意图最外层最多能容纳8电子,次外层最多能容纳18电子。
每个电子层最多容纳的电子数为2n2个(n为电子层数的数值)如: 各个电子层中电子的最大容纳量从表可以看出,每个电子层可能有的最多轨道数为n2,而每个轨道又只能容纳2个电子,因此,各电子层可能容纳的电子总数就是2n2。
二、鲍利(Pauli)不相容原理鲍利不相容原理的内容是:在同一原子中没有四个量子数完全相同的电子,或者说在同一原子中没有运动状态完全相同的电子。
例如,氦原子的1s轨道中有两个电子,描述其中一个原子中没有运动状态的一组量子数(n,l,m,ms)为1,0,0,+1/2,另一个电子的一组量子数必然是1,0,0,-1/2,即两个电子的其他状态相同但自旋方向相反。
根据鲍利不相容原理可以得出这样的结论,在每一个原子轨道中,最多只能容纳自旋方向相反的两个电子。
于是,不难推算出各电子层最多容纳的电子数为2n2个。
例如,n=2时,电子可以处于四个量子数不同组合的8种状态,即n=2时,最多可容纳8个电子,见下表。
在等价轨道中,电子尽可能分占不同的轨道,且自旋方向相同,这就叫洪特规则。
原子结构

电子在确定的轨道上,能量状态确定,称为定态。
En = -B /n2 , B = 2.18×10-18J
n = 1时轨道能量最低,称为基态,n=2, 3, 4….的状态称为激发态。 轨道跃迁假设
ΔE = En2-En1 = B(1/n12 –1/n22) = hν
25
1s 2s
z
3s
z
z
x
x
y
2pz
2px
2py
y
z
z
z
y
x
x
y
x
x
3dxy
3dxz
3dyz
3dz2
3dx2-y2
26
核外电子几率分布和径向分布
D = |ψ2| dV
电子出现几率
该函数存在极值现象。
27
核外电子出现几率的径向分布图
D
1) n-l 个极值;
0.5
2) n 相同,l越小,小峰、离核越近,
12
Lyman Balmer Paschen
紫外 可见 红外 光区 光区 光区
13
玻尔理论的意义和局限性
成功解释了原子的稳定性氢原子光谱。 不能解释多电子原子光谱,不能解释光谱在磁场中的分裂。
还没有认识到波粒二象性是微观粒子的运 动的普遍特征。
14
9.2 单电子原子的波函数
薛定谔方程
2ψ +
x2
自旋量子数ms
与电子自旋状态相关的参数。取值为±(1/2),以↑和↓表示。
23
单电子原子中电子的可能运动状态与四个量 子数之间的关系
nl 10
0 2
1
原子的结构

原子一、原子1.原子的结构原子是由位于原子中心的中子构成的。
原子核位于原子的做高速运动。
注:(1)不是所有原子的原子(2)核电荷数=质子数(3)原子的质子数(或核数不同。
(4)原子核内质子数与中2.核外电子的排布 (1)原子的核外电子排布①电子层在含有多个电子的原子里能量高的通常在离核较远的区稍远的叫第二层,由里向外依②原子结构示意图:如钠(2)元素原子最外层电子原子的相关知识 中心的带正电的原子核和核外带负电的电子构成。
原子原子的中心,体积很小,原子里有很大的空间,电子的原子核中都有中子。
子数=核外电子数。
或核电荷数)决定原子的种类,因此不同种类的原数与中子数不一定相等。
子排布 原子里,电子的能量并不相同,能量低的通常在离核较近远的区域运动。
把能量最低、离核最近的叫第一层,向外依次类推,叫三、四、五、六、七层。
如钠原子结构示意图。
层电子数与元素化学性质的关系原子核是由质子和电子在这个空间里类的原子,核内质子核较近的区域运动,,能量稍高、离核元素类别 稀有气体元素 金属元素非金属元素 一般多(3)原子结构示意图的书要正确书写原子结构示意①每一电子层上所容纳的纳2×12=2个;第二层上能容纳②核外电子是逐层排布的依此类推。
③最外层电子数不得超过二、离子1.离子概念:带电的原子(或原分类:阳离子:带正电的原子或原阴离子:带负电的原子或原离子的形成过程:(1)金属原子的最外层电核外电子数,所以带正电荷(2)非金属原子的最外层于核外电子数,所以带负电荷2.离子符号(1)离子符号表示的意义(2)分子、原子和离子的最外层电子数 得失电子倾向 8个(He 为2) 不易得失 一般少于4个 易失去最外层电子 一般多于4个或等于4个 易得到电子图的书写及相关判断构示意图,必须遵循核外电子排布的一般规律:容纳的电子数不超过2n 2个(n 为电子层数)。
例如,能容纳2×22=8个电子;第三层上能容纳2×32=18个电子排布的,先排满第一层,再排第二层,第二层排满后得超过8个。
第一章:原子结构

n 光谱符号
1 K
2 L
3 M
4 N
5 O
· · · · · ·
对氢原子来说,电子能量完全由n决定:
2.181018 Z 2 E J 2 n
四 个 量 子 数
B:角量子数:l 取值:0、1,2,3,. n-1
它表示原子轨道和电子云的形状 ,l与能级或称电子亚层对应。
(也是决定能量高低的因素)
自然界的物质种类繁多,性质各异,但它们都是由种类不同的原子组成,
原子以不同的种类.数目和方式结合,形成了无数的物种,因此,原子结构的
知识是了解物质结构和性质的基础。 化学变化包含着旧的化学键断裂和新的化学键的形成,化学变化一般 只涉及核外电子运动状态的变化,所以研究原子结构时,主要研究核外电子
的运动状态。
∴|ψ|2 ∝电子的几率密度
电子云角度分布图表示出电子在空间不同角度所出现的几率密度大小。
三、波函数的空间图象
B:电子云角度分布图 ︱Y(θ.φ) ︱2
z
+
→ θ.φ 作图,就得到电子云角度分布图
z y
+
z
+
x
-
x
+ -
x
pz z
x
s px z z x s px x x pz x py y
py
三、波函数的空间图象
E 光子 E E 2 E1 h 2.18 10
18
Z n 2n 2 2 1
2
1
←波长
青
氢原子光谱的一部分
课堂小结
玻尔理论最大贡献:建立微观粒子量子化特性,成功地解释了氢
原子光谱是线状光谱,为化学键理论奠定了基础。
结构化学复习-资料

②会解F方程,了解主量子n,角量子数l,磁量子数m的物理
含义及取值范围;单电子原子的能级公式。 ③屏蔽常数的计算,电离能的计算; ④掌握角动量耦合规则,会推求原子光谱项,会推求基谱项。
第二章 原子的结构和性质
2.1 单电子原子的Schrödinger 方程及其解
ns态 D(r)4r2n2s
径向分布图的讨论
0.6
0.3
☆1s态:核附近D为0;r=a0时,D极大。表
0 0.24
明在r=a0附近,厚度为dr的球壳夹层内找
0.16 0.08
到电子的几率要比任何其它地方同样厚度 0
的球壳夹层内找到电子的几率大。
0.24 0.16
0.08
D1,0(r)4r2 1s24(aZ0)3r2e2aZ 0r
的轨道在核附近有较大的几率。可以证
0
0.12
明,核附近几率对降低能量的贡献显著。 0.08
Pb2+ 比 Pb4+, Bi3+ 比 Bi5+的稳定的原因
0.04 0
就是6s电子比6p电子钻得更深可以更好
0.12 0.08
的避免其它电子的屏蔽效应, 6s电子不 0.04
易电离,只电离6p电子。
0 0
1s 2s 2p 3s 3p 3d
径向分布图的讨论
0.6
0.3
0
☆每一n和l确定的状态,有n-l个
0.24 0.16
极大值和n-l-1个D值为0的点。
0.08 0
0.24
Dn.l (r) r2R2n.l (r)
0.16 0.08
2zr
r2(blrl bl1rl1 bn1rn1)2e na0
多电子原子的结构

多电子原子的结构首先要了解的是,每个电子都有四个量子数,即主量子数(n)、角量子数(l)、磁量子数(ml)和自旋量子数(ms)。
主量子数决定了电子所处的能级,角量子数决定了电子轨道的形状和能量,磁量子数决定了电子轨道在空间中的取向,而自旋量子数表示电子自旋方向上的差异。
根据波尔的原子模型,多电子原子的结构可以用壳、亚壳、轨道来描述。
壳是由具有相同主量子数的电子的集合组成,亚壳是由具有相同主量子数和角量子数的电子的集合组成,而轨道则是由具有相同主量子数、角量子数和磁量子数的电子的集合组成。
每个壳包含的亚壳数目等于主量子数n的值,而每个亚壳包含的轨道数目等于2l+1,其中l是角量子数的值。
例如,当n=1时,只有一个壳,其中含有一个s亚壳,包含一个s轨道。
当n=2时,有两个壳,其中一个含有一个s亚壳和一个p亚壳,而另一个则只含有一个s亚壳,每个亚壳又包含一个s轨道和三个p轨道。
多电子原子的能级结构比氢原子更加复杂,这是因为电子之间的相互作用会引起能级的分裂。
这种相互作用包括库仑相互作用(电子之间的静电相互作用)和斯塔克效应(电子在外加电场中的行为)。
当电子之间的相互作用不考虑时,多电子原子的能级就是简并的,也就是说,拥有相同主量子数的能级具有相同的能量。
然而,这种简并可以通过考虑相互作用来取消。
由于库仑相互作用,主量子数相同但角量子数不同的亚壳之间的能级发生了分裂。
例如,在n=2的壳中,2s亚壳的能级低于2p亚壳的能级。
同样,角量子数相同但磁量子数不同的轨道之间的能级也发生了分裂。
最后,自旋量子数不同的电子具有不同的能量。
这种由于相互作用引起的能级分裂称为自旋-轨道相互作用。
要描述多电子原子的结构,可以使用一种方法称为Hartree-Fock方法。
在这种方法中,先假设每个电子都处于一个平均势场中,其它所有电子引起的平均势场。
然后,通过求解薛定谔方程来获得每个电子的波函数和能量。
然而,Hartree-Fock方法只能给出近似解,因为它没有考虑到电子之间的动态相关性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
径向分布图
2 R ( r ) 与 R r)的 形 状 只 与和有 n l 关 nl , nl , ( 2 当 半 径 增 加 时 , R ( r ) 与 R r) 都 很 快 趋 于 零 , 离 核 较 远 的 地 方 发 现 nl , nl , (
电 子 的 概 率 非 常 小 。
2 n 越 大 , R ( r ) 与 R r) 函 数 图 形 的 伸 展 范 围 越 大 ,决 n 定 波 函 数 伸 展 nl , nl , (
电子层结构。
2.3 波函数及电子云的图形
( r ,,) R ( r ) Y ( ,)
n l m n l l m
波函数(Ψ,原子轨道)和电子云(|Ψ|2在空间的分布)是三 维空间坐标的函数,将它们用图形表示出来,使抽象的数学 表达式成为具体的图象,对于了解原子的结构和性质,了解 原子化合为分子的过程都具有重要的意义。 Ψ随r的变化关系----径向分布;
20
0.00 0
10
20
r/a r/a00
径向分布图
2 pn ( 2 ,l 1 )
1( sn 1 ,l 0 )
2 s( n 2 ,l 0 )
3 s( n 3 ,l 0 )
3 pn ( 3 ,l 1 )
3 dn ( 3 ,l 2 )
2 径 向 密 度 函 数 Rr () r 图 n , l
教学目标和要求
第三节 波函数和电子云的图形 掌握 s、p、d原子轨道轮廓图及其特征
第四节 多电子原子的结构
掌握 简单多电子原子体系的Schrödinger方程的表示方法; 简单多电子原子的全波函数表示——Slater行列式。 第五节 元素周期表与元素周期性质 掌握 基态原子核外电子排布原则,第三周期前任一元素的
径向分布图
R10 2 1 0.0 0 0 1 2 0.0 0 5 R20 0.5 0.1 R21
3
4
r/a0 0
5
10
r/a0
10
r/a0
径 向 波 函 数 Rr () r 图 n , l
R30 0.2 0.1 0.0 -0.1 0 10 20 r/a0 0.00 -0.05 0 10 r/a0 R31 0.05 R32 0.04 0.02
意义:
r R (r) d r Dr ( )d r
2 2 0 0
D(r):表示半径为r的球面上电子出现的概率密度 D(r)dr:表示半径为r,厚度为dr的球壳内电子出现的概率
径向分布图
22 径 向 分 布 函 数 r R ( r ) r 图 n , l
径向分布图
但 l 值 越 小 , 峰 数 目 越 多 , 最 内 层 的 峰 离 核 最 近 ( 钻 穿 效 应 ) 。
径向分布图
思考:两图是否矛盾
径向分布图
比较D(r)和 2(r)
D10, r=a0, 即在半径 a0 处取得极大,而 1s2 则在核附近取得极大。D10与1s2的不同之
0.6 0.5 0.4 0.3 0.2 0.1 0.0 0
处在于它们代表的物理意义不同, 1s2 是
几率密度,而 D10是半径为r处的单位厚度 的球壳内发现电子的几率,在核附近,尽 管 1s2很大,但单位厚度球壳围成的体积 很小,故几率 |1s|2d 自然很小。 r 很大处
D 1s
2
1 2 3 4 5
,尽管单位厚度球壳围成的体积很大,但
1s2 几乎为零,所以只有两个因子 |1s|2 与
Dnl(r)的来历
2 把 在 , 的 全 部 变 化 范 围 积 分 :
2 2 ( r , , ) r s in d d d r 0 0 0 2 ( ) ( )d ( )s in d r2R (r) d r 2 0 0 0 2 2
2 2. 径 向 密 度 函 数 R 图 n,l (r) r
表 示 任 意 给 定 角 度 方 向 上 (即 一 定 和 ), 概 率 密 度 2随变 r 化 情 况 。 即 :
2 2 2 2 R ( r ) / R ( r ) ( r , , )/ n,l 1 n,l 2 1 2 (r 2,,) 1
规律
球节面数 n-l-1 极大值数 n-l
最可几半径:最大的极大值所对应的r为最可几半径
n 不 同 , l 相 同 : 主 量 子 数 小 的 轨 道 主 峰 靠 近 原 子 核 的 内 层 , 所 以 能 量 低 。 n 相 同 , l 不 同 : 虽 然 主 峰 位 置 随 l 的 增 大 而 向 核 靠 近 ,
范 围 越 大 。 nl 1 时 , 会 出 现 R r) 0 的 球 节 面 , 即 在 这 个 球 节 面 上 发 现 电 子 nl , ( 的 概 率 密 度 为 零 。 球 节 面 的 个 数 : n-l -1
径向分布图
2 2 3 .径 向 密 度 函 数 r Rr () r 图 n , l 2 2 定 义 : D () r r Rr () 为 径 向 分 布 函 数 n , l
Ψ随θ,φ的变化情况称为角度分布;
Ψ随r, θ, φ的变化情况,即空间分布。
2.3.1 径向分布图
径 向 分 布 图 形
2 2 2 研 究 : R ( r ) 、 R ( r ) 、 r R r ) nl , nl , nl ,(
1.径 向 波 函 数 R 图 n,l (r) r 表 示 任 意 给 定 角 度 方 向 上 (即 一 定 和 ), 波 函 数变 r 化 情 况 。 即 : R n,l (r 1) / R n,l (r 2 ) 1(r 1,,)/2(r 2,,)
d 适中时,才有最大的乘积。
氢原子1s电子的分布图
2.3.2 角度分布图
★ 原子轨道的角度分布 Ylm ( , )
( r , , ) R Y (, )
n l m n ll m
从坐标原点(原子核)引出一直线,方向为(,),长度为 |Y| ,将所有这些直线的端点联接起来,在空间形成一个封 闭曲面,它表示同一个球面上各点 值的相对大小。
