2-2-多电子原子的结构
多电子原子结构

8≤Z≤20:4s对K,L内层原子芯钻穿大, E4s<E3d Z≥21 :4s对原子芯钻穿效应相对变小, E4s>E3d
II. 原子核外电子排布原则(构造原理)
1)能量最低原理 基态原子核外电子先填充能量低的轨道, 后填充能量高的轨道。尽可能保持体系的能量最低。 2) Pauli 泡利不相容原理 基态原子中不可能同时存在4个 量子数完全相同的电子。即在一个轨道里最多只能容纳2个电 子,且自旋方向相反。 3)洪特规则 电子在能量简并的轨道中,尽量以相同自旋 方式成单排布。简并的各轨道保持一致,则体系的能量低。
注:该方法对n小于4的原子轨道准确性较好, 而n大于4后其与光谱实验有较大误差。
这样多电子原子的原子轨道能量公式为:
( Z ) eV Z eV E 13.6 13.6 2 n n2
2 *2
(2)钻穿效应
电子进入原子内部空间, 受到核的较强的吸引作用。 为什么电子在填充时会发 生能级交错现象? 这是因4s电子具有比3d 电子较大的穿透内层电子 而被核吸引的能力,即钻 穿效应--能级交错(分裂)
电子又在不停地运动,因此,要精确地确定其余两个电子对选 定电子的作用是很困难的。一般可用近似的方法来处理。
其余两个电子对所 选定的电子的排斥作用, 认为是它们屏蔽或削弱 了原子核对选定电子的 吸引作用。
这种其余电子对所选定的电子的排斥作用,相当于降低 了部分核电荷()对指定电子的吸引力,称为屏蔽效应。 Z* = Z- Z*—有效核电荷 Z —核电荷
轨道全空
半充满
全充满
由构造原理可见,随核电核数的增加,电子填 入能级的顺序是:
1s,2s,2p,3s,3p,4s,3d,4p,5s,4d,5p,6s,4f,5d,6p…
第八章 原子结构(2)
电负性( P)变化
主 族 元 素
元素的原子半径变化趋势
第四周期元素 r/pm 第五周期元素
Sc 161 Y
Ti 145 Zr
V 132 Nb
Cr 125 Mo
r/pm 第六周期元素 r/pm
181 Lu 173
160 Hf 159
143 Ta 143
146 W 137
镧系元素从左到右,原子半径减小幅 度更小,这是由于新增加的电子填入外数 第三层上,对外层电子的屏蔽效应更大, 外层电子所受到的 Z* 增加的影响更小。镧 系元素从镧到镱整个系列的原子半径减小 不明显的现象称为镧系收缩。
同一周期:
短周期:从左到右,Z*显著增加。 长周期:从左到右,前半部分有Z*增加 不多,后半部分显著增加。 同一族:从上到下,Z*增加,但不显著。
2. 原子半径
在同一周期中,从左到右减小 主 由于核电荷的增加,核外电子受核的引 族 力增大,原子半径减小。 元 素 在同一族中,从上到下增加 由于主量子数 n 的增加,原子半径一般增 加。 过渡元素:从左到右r 缓慢减小; 从上到下r略有增大。
Z=56,Ba: [Xe] 6s2 。
四个量子数小结:
原子中每个电子的运动状态可以用n,l,m, ms四个量子数来描述:主量子数n决定电子层 数和主要电子的能量;角量子数l决定原子轨道
的形状,同时也影响电子的能量;磁量子数m
决定原子轨道在空间的伸展方向;自旋量子数
ms决定电子自旋的方向。四个量子数确定后,
3. 电离能
第一电离能——处于基态的1mol气态原子失去 1mol电子成为气态一价正离子所需的能量,称 为该元素的第一电离能。 同一周期中 自左至右,第一电离能一般增加,但有一 些波动。当电子结构为全充满或半充满时, 其第一电离能相应较大。 同一族中 主族,自上而下第一电离能依次减小。
原子结构中的电子排布规律与原子能级图

原子结构中的电子排布规律与原子能级图在原子结构中,电子的排布规律决定了元素的性质和化学行为。
电子按照一定的规则分布在原子的能级上,形成了原子能级图。
本文将探讨原子结构中的电子排布规律以及原子能级图的构建。
一、电子排布规律1. 起始原则:根据泡利不相容原理,每个原子中的电子的四个量子数(主量子数n、角量子数l、磁量子数ml和自旋量子数ms)不能完全相同。
因此,首先填充最低能级的电子。
2. 奥卡规则:根据奥卡规则,电子填充顺序为按照能级的升序(主量子数n增大)填充。
当能级相同时,按照角量子数l的升序填充。
这一规则保证了电子填充的有序性。
3. 霍克规则:根据霍克规则,每个轨道(具有相同主量子数n和角量子数l的电子组合)最多容纳2个电子,且这2个电子的自旋量子数相反。
这一规则成为“违反泡利不相容原理”的例外。
二、原子能级图在原子能级图中,横坐标表示主量子数n,纵坐标表示能量。
每条横线代表一个能级,能级距离越小,电子的能量越高。
以下是一些常见的原子能级图:1. 氢原子:氢原子只有一个电子,根据能级公式En = -13.6/n^2(n为主量子数),氢原子的能级图为一系列离散的水平线。
每条水平线上的能级数目由角量子数l决定。
2. 多电子原子:多电子原子的能级图更为复杂。
由于电子之间的排斥作用,使得能级分裂成了更多的子能级。
不同角量子数对应的子能级之间存在能级差。
3. 周期表:通过观察周期表中的元素,我们可以了解到原子能级图的一些规律。
周期表中的每一行代表一个主量子数n的能级,而每个周期表中的元素代表不同的电子填充顺序。
总结起来,原子结构中的电子排布遵循一定的规律,其中起始原则、奥卡规则和霍克规则是主要的规律。
而原子能级图则是用来表示不同能级和子能级之间的能量关系。
通过研究电子的排布规律和原子能级图,我们可以更好地理解原子的性质和化学行为。
通过本文的讨论,我们可以得出结论:原子结构中的电子排布规律与原子能级图是相互关联的,它们共同构成了描述原子结构的重要工具。
多电子原子

第二种情况: 在同一nl态中具有k个电子,即k个同科电子 1.忽略电子之间的相互作用: nl的状态数为N=2(2l+1)。当k个电子按这些状态 分布时,由于泡利原理的限制,不能存在 ml和 ms 相同的电子。因而,问题便归结为求N个状态按k 的组合数,即简并度
G
k Cn
N ( N 1)( N 2) ( N k 1) k!
n 1
★一个能级包含的量子态数目,称这一能级的简并 度
多电子组态: 第一种情况:每个nl (次壳层)中,只有一个电子
★若忽略电子之间的相互作用,电子能量与量子数 n和l有关 电子i可以有Ni个态:Ni=2(2l+1) 多电子的组合,原子的能级简并度为 G=N1﹒N2﹒N2 …Ni 1.如果忽略电子的自旋—轨道相互作用 角动量L可有2L+1种取向, 角动量S可有2S+1种可能的取向 ●由量子数L和S表征的能级的简并度为 GLS=(2L+1)(2S+1)
共振线 (n1P→n1S0)
互组合线 (n3P→n1S0) 无 457.115nm 657.278nm 689.259nm 791.134nm
B Mg Ca Sr Ba
234.861nm 285.213nm 422.673nm 460.733nm 553.54பைடு நூலகம்nm
弱 强 强 较强
1
两者是竞争的,其能级寿命很短,主要以 前者自电离方式衰变,因而是一个自电离 态。
3.双电子被激发时,n逐渐增大,电子-电子相互作 用甚至可与电子与核的作用比较,因而两个电子 的运动产生了关联。这种双电子激发的里德堡态 是研究电子关联的理想体系,自 1989 年以来人们 开始关注这方面的理论工作。 4.一般来说,原子的自电离态有较高的衰变率,谱 线较宽。但是近来也发现不少窄线宽的自电离态, 它们具有较长寿命,特别在双电子高激发态中出 现。这种亚稳自电离态为产生真空紫外激光提供 了可能性。
结构化学(2-2)-3-24

2 写出下列原子能量最低的光谱支项的符号:(a) Si; (b) Mn; (c) Br; (d) Nb; (e) Ni 解:一般步骤:
写出个原子的基组态和最外层电子排布(对
对全满的电子层,电子的自旋互相抵消,个电子
的轨道角动量矢量也相互抵消,不必考虑),根
据Hund规则推出原子最低能态的自旋量子数S、
(1)稀有气体的I1总是处于极大值 (完满电子层),碱金属的I1处于极 小值(原子实外仅一个电子),易形 成一价正离子;碱土金属的I1比碱 金属稍大,I2仍较小,所以易形成 二价正离子。 (2)除过渡金属外,同一周期元素 的I1基本随Z增加而增大(半径减 小);同一族中随Z增加I1减小;因 此周期表左下角金属性最强,右上 角元素最稳定。
logI/eV
I1和I2与Z的关系
2.5.4.
电子亲和能(Y)
• 定义: 气态原子获得一个电子成为一价负离子 时所放出的能量称为电子亲和能,用符号Y 表示。 A(g) +e→A-(g)+Y • P49表2.5.2列出了主族元素的电子亲和能. 将之与表中列出的元素的电离能比较,我们 发现:电子亲和能的绝对值比电离能的绝对 值小一个数量级。原因:负离子的有效核电 荷较原子少。
1 S (1) (1) 1 S ( 2 ) ( 2 )
但该波函数不能经受坐标的交换:
1 S (1) (1) 1 S ( 2 ) ( 2 ) 1 S ( 2 ) ( 2 ) 1 S (1) (1)
为了满足Pauli原理,即交换任意两个电子的坐标后,全波函 数反对称: (1, 2 ) ( 2 ,1) 则需将上两个波函数进行线性组合:
● 电子在原子轨道中填充时,最外层的不规则现象:部分原因是由于 d,f轨道全充满、半充满、全空或接近全满、半满、全空时更稳定所致。 但仍有解释不了的。
第一章原子结构第二节

的电子能级分组表- n+0.7l) 徐光宪的电子能级分组表-(n+0.7 )近似规律
原子轨道
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d
n+0.7l n+0.7
1.0 2.0 2.7 3.0 3.7 4.0 4.4 4.7 5.0 5.4 5.7 6.0 6.1 6.4 6.7 7.0 7.1 7.4
一 特短周期 短周期 二 三 短周期 四 长周期 五 长周期 六 特长周期 七 不完全周期
铁元素的原子序数为26,其核外电子排布式为: 铁元素的原子序数为 ,其核外电子排布式为:
1s 2 2 s 2 2 p 6 3s 2 3 p 6 3d 6 4 s 2
铁位于第四周期 元素在周期表中所处的周期号数等于该元素原子 核外电子的层数
1.
鲍林原子轨道近似能级图
Linus Pauling(美国) 美国) 美国
特点: 特点:
能级组间能量差大, ⑴ 能级组间能量差大,能级组内能量差小 简并轨道能量相同( ⑵ 简并轨道能量相同(3个p,5个d,7个f) 相同, 越大能量越高。 ⑶ l相同,n越大能量越高。例:E2P<E3P<E4P 相同, 越大能量越高。 ⑷ n相同,l越大能量越高。 例:E4s<E4p<E4d<E4f ……….“能级分裂” 能级分裂” . 能级分裂 同时变动时, ⑸ n和l同时变动时,发生能级交错 E6s<E4f<E5d<E6p
离子电子排布: ☺ 离子电子排布: 原子失电子时则先失去最外层电子 失电子时则先失去最外层电子。 原子失电子时则先失去最外层电子。 Fe : 1s2 2s2 2p6 3s2 3p6 3d6 4s2 Fe2+ : 1s2 2s2 2p6 3s2 3p6 3d6 3+ : 1s2 2s2 2p6 3s2 3p6 3d6 Fe
原子物理学5
同一电子组态在j-j耦合中和L-S耦合中形成的原子 态的数目相同,代表原子态的J值也是相同的。
例题:
若某原子的两个价电子处于2s2p组态,利用j-j耦合, 求可得到其原子态的个数。
同一电子组态在j-j耦合中和L-S耦合中形成的原 子态对应的能级间隔不同。
1P 1
3 1 ( , )1 2 2 3 1 ( , )2 2 2
5
5 4
4 3
4
3 2
4 3
4
3
4
3
2 2
19.77eV
2
主线系 第二辅线系 第一辅线系 柏格曼线系
E 1
He原子能级图
He原子能级结构
两套结构: 单层:S=0,重数为1; 两套能级间不发生跃迁 三层:S=1,重数为3;
两个亚稳态:
21S0 和23S1
电离能和第一激发电势很大 在三层结构中没有(1s)对应的能级(?) 三重态能级低于相应的单一态能级
倒序排列:
3P > 3P > 3P 0 1 2
能级的形成:
基态:两个电子都处于最低的1s态 激发态:所有能级都是由一个电子处于1s态,另一 个电子被激发到较高能态形成的。
试计算一下如果两个电子都处于激发态至少 需要多少能量?
单层结构 n
7.62eV
1S 1P 0 1 1D 2 1F 3 3S 1 3P 2
不同的电子组态具有不同的能量 H: 2s↔2p; 能级间隔小 2s ↔1s 能级间隔大 He: 1s1s ↔1s2s 能级间隔大 Mg: 3s3s ↔3s3p 能级间隔小 原子态 每一种电子组态都对应相应的原子态 H: 基态1s ↔ 2S1/2,激发态3p ↔ 32P1/2, 32P3/2 多电子原子的原子态是怎样的呢?
电子排布式 电子排布图 原子结构示意图比较大全
族IA IIA ⅢB ⅣB ⅤB ⅥB ⅦB ⅠB ⅡB ⅢA ⅣA ⅤA ⅥA ⅦA 0周期表中纵列数第1列第2列第3列第4列第5列第6列第7列第8列第9列第10列第11列第12列第13列第14列第15列第16列第17列第18列第一周期(1-2号)原子序数元素符号名称1 H 氢2 He 氦2种元素电子排布式 1s 11s 2电子排布图原子结构示意图第二周期(3-10号)原子序数元素符号名称3 Li 锂4 Be 铍5 B 硼6 C 碳7 N 氮8 O 氧9 F 氟10 Ne 氖8种元素电子排布式 1s 22s 1 1s 22s 21s 22s 22p 11s 22s 22p 21s 22s 22p 31s 22s 22p 41s 22s 22p 51s 22s 22p 6电子排布图原子结构示意图第三周期(11-18号)原子序数元素符号名称11 Na 钠12 Mg 镁13 Al 铝14 Si 硅15 P 磷16 S 硫17 Cl 氯18 Ar 氩8种元素电子排布式1s 22s 22p 63s 11s 22s 22p 63s 21s 22s 22p 63s 23p 11s 22s 22p 63s 23p 21s 22s 22p 63s 23p 31s 22s 22p 63s 23p 41s 22s 22p 63s 23p 51s 22s 22p 63s 23p 6电子排布图原子结构示意图第四周期18种(19-36号)原子序数元素符号名称19 K 钾20 Ca 钙21 Sc 钪22 Ti 钛23 V 钒24 Cr 铬25 Mn 锰26 Fe 铁27 Co 钴28 Ni 镍29 Cu 铜30 Zn 锌31 Ga 镓32 Ge 锗33 As 砷34 Se 硒35 Br 溴36 Kr 氪电子排布式【Ar 】4s 11s 22s 22p 63s 23p 64s 21s 22s 22p 63s 23p 63d 14s2【Ar 】3d 24s 21s 22s 22p 63s 23p 63d 34s21s 22s 22p 63s 23p 63d 54s 1【Ar 】3d 24s 21s 22s 22p 63s 23p 63d 64s2【Ar 】3d 74s 21s 22s 22p 63s 23p 63d 84s21s 22s 22p 63s 23p 63d 104s 11s 22s 22p 63s 23p 63d 104s 21s 22s 22p 63s 23p 63d 104s 24p 11s 22s 22p 63s 23p 63d 104s 24p 2【Ar 】3d 104s 24p 31s 22s 22p 63s 23p 63d 104s 24p 4【Ar 】3d 104s 24p 5【Ar 】3d 104s 24p 6第五周期18种37-54号价电子排布式4s 14s 23d 14s 23d 24s 23d 34s 23d 54s 13d 54s 23d 64s 23d 74s 23d 84s 23d104s 13d 104s 24s 24p 14s 24p 24s 24p 34s 24p 44s 24p 54s 24p 6第六周期32种55-86号 镧系电子排布图价电子排布图第七周期?种满32种87-满118号锕系原子结构示意图共价键分类s-sσ键s-pσ键p-pσ键p-pΠ键分子或离子CO 2SO 2 CO 32-CH 4NH 4+ 中心原子杂化轨道类型spsp2sp3a 64+2=65-1=4x 234H 2O NH 3b221sp3sp3中心原子上的孤对电子数0100分子或离子的价层电子对数2334VSEPR模型名称直线形平面三角形平面三角形正四面体形正四面体形分子或离子的立体构型名称直线形V形平面三角形正四面体形正四面体形配合物形成:颜色改变、溶解度改变无机含氧酸分子酸性1、对于同一种元素的含氧酸来说,该元素的化合价越高,其含氧酸的酸性越强。
化学中-2和2-的区别
化学中-2和2-的区别化学中的-2和2-是两个常见的离子,它们在化学反应和化合物中起着重要的作用。
尽管它们看起来很相似,但它们在电荷、原子结构和化学性质方面有着明显的区别。
让我们来看一下它们的电荷。
-2离子表示原子或分子带有两个负电荷,而2-离子表示原子或分子带有两个正电荷。
这意味着-2离子具有比2-离子更多的电子,因此它们在化学反应中会表现出不同的行为。
它们的原子结构也有所不同。
-2离子通常是非金属元素接受两个电子而形成的。
当一个非金属元素接受两个电子时,它会变成一个带有负电荷的离子。
这种情况经常发生在氧化反应中,例如氧气接受两个电子形成氧化物离子(O2-)。
相反,2-离子通常是金属元素失去两个电子而形成的。
当一个金属元素失去两个电子时,它会变成一个带有正电荷的离子。
这种情况通常发生在金属与非金属元素形成化合物的过程中。
例如,钠(Na)失去两个电子形成钠离子(Na2+)。
它们在化学性质上也有差异。
-2离子通常是稳定的,而且很少参与反应。
这是因为它们已经获得了足够的电子来填充其外层电子壳,使其达到稳定的电子配置。
因此,-2离子在化学反应中往往是相对不活泼的。
相反,2-离子通常是不稳定的,容易参与化学反应。
由于它们失去了两个电子,它们的外层电子壳会变得不稳定,因此它们会寻找其他物质来与之反应,以重新获得电子并达到稳定的电子配置。
这也是为什么金属通常会与非金属形成化合物的原因。
-2和2-离子在化学中具有明显的区别。
它们的电荷、原子结构和化学性质都不同,因此它们在化学反应和化合物中扮演着不同的角色。
了解它们的区别有助于我们更好地理解化学反应和化合物的本质,并在实验和应用中更好地利用它们。
核外电子分层排布示意图
原子核
原子结构示意图
质子数(核电荷数)
要点: 圆圈标核电, 正号写在前, 弧线呈扇面,
电子数 电子层
数字一条线。
3、元素性质与元素最外层电子数的关系
元素分类 最外层电子数 得失电子倾向 (He为 不易得失、 稀有气体 8个(He为2个) 不易得失、相对 稳定 元素 金属元素 一般少于4个 一般少于4 化学性质 稳定
阳离子
物质与其构成粒子间的关系
[例1]六种粒子结构示意图分别为: 例
(1)A、B、C、D、E、F共表示 元素。 (2)表示原子的粒子是 下同)。 (3)表示离子的粒子是 ACF BDE
四
种 (填序号, 。
[例2]铜是由 铜元素 例 组成 铜原子 构成的;水 的,由 是由 氢元素和氧元素 组成的, 由 水分子 构成的;氯化钠 是由 氯元素和钠元素组成的, 由 钠离子和氯离子构成的。
课题3 离子
核外电子分层排布是分层排布的 电子层:1 2 3 4 5 离核:近 能量:低 6 7 远 高
能量低的在离核近的区域运动,能量高的 在离核远的区域运动
2、电子在电子层上的分布规律
第一层最多容纳2 第一层最多容纳2个电子 第二层最多容纳8 第二层最多容纳8个电子 18 第三层最多容纳18个电子 第三层最多容纳18个电子 2n2 个电子 第n层最多容纳 最外层最多容纳8个电子
5.右图是钠原子的结构示意图: 弧线表示 电子层 。 原子核内的质子数 11 。第二层上的电子数是 8 。 是 6.金属元素在化学反应中一般较易 失去 电 子,变成 离子,这是因为金属原 阳 少于 子最外层电子数目一般 4个。 7.某种原子结构简图为 ,该原子的 ,在化学反应中易 失 (填 核电荷数为 11 金属 “得”或“失”)电子,属 元素(填 “金属”或“非金属”)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3
4
r/a0 0
5
10
r/a0
10
r/a0
径向波函数Rn,l (r ) r图
R30 0.2 0.1 0.0 -0.1 0 10 20 r/a0 0.00 -0.05 0 10 r/a0 R31 0.05 R32 0.04 0.02
最可几半径:最大的极大值所对应的r为最可几半径
n不同,l相同:主量子数小的轨道主峰靠近原子核的内层,所以能量低。 n相同,l不同:虽然主峰位置随l的增大而向核靠近, 但l值越小,峰数目越多,最内层的峰离核最近(钻穿效应)。
径向分布图
思考:两图是否矛盾
径向分布图
比较D(r)和 2(r)
D10, r=a0, 即在半径 a0 处取得极大,而 1s2 则在核附近取得极大。D10与1s2的不同之于不同的物理模型,提出了不同的近似分拆方法。
2.4.1.1 零级近似
忽略电子间的相互作用
n n 1 2 ˆ Z H i 2 i 1 i 1 ri
1 Z 1 Z 1 Z 12 ( 2 2 ) L ( n 2 ) 2 r1 2 r2 2 rn ˆ H i
任意多电子原子Hamilton算符 2.4.1
由于Hamilton算符中含有双原子坐标变量项 e2 4 0 rij ,其薛定谔方程不能精确求解。
多电子原子的Schrö dinger方程及其近似解
采用原子单位制,Schrödinger方程为:
1 N 2 N Z N 1 i E i 1 r i 1 i j r i ij 2 i 1
0 , ;
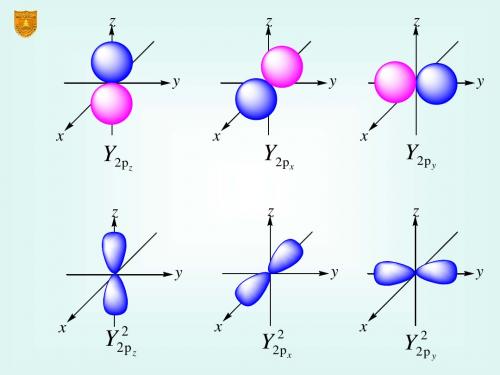
在 ±z 方向上
角度分布图
例
3 Y px sin cos 4
若作xz平面的剖面图,则 =0
Ypx 3 sin 4
z
若作xy平面剖面图,则 =90
Y px 3 cos 4
y
x
x
角度分布图
波函数的角度部分图Y ~ (注意标正负)
角度分布图
注意: ( x1, y1, z1, x2 , y2 , z2 ,, xn , y , zn ) (1, 2,, n)
意义: (1, 2, , n) 表示电子1出现在x1 , y1 , z1附近,同时电子2出现在 x2 , y2 , z2附近,的概率密度。
由于rij无法分离(涉及两个电子的坐标),只能采用近似方法来求解。 求 解 时 首 先 要 将 n 个 电 子 体 系 的 Schrö dinger 方 程 拆 分 成 n 个 单 电 子
0.6 0.5 0.4 0.3 0.2 0.1 0.0 0
处在于它们代表的物理意义不同, 1s2 是
几率密度,而 D10是半径为r处的单位厚度 的球壳内发现电子的几率,在核附近,尽 管 1s2很大,但单位厚度球壳围成的体积 很小,故几率 |1s|2d 自然很小。 r 很大处
D 1s
2
1 2 3 4 5
2 2. 径向密度函数Rn ,l ( r ) r图
表示任意给定角度方向上(即一定 和 ),概率密度 2随r变化情况。 即:
2 2 2 2 Rn ( r ) / R ( r ) ( r , , ) / ,l 1 n ,l 2 1 2 ( r2 , , ) 1
径向分布图
f ( x, y) f1 ( x) f 2 ( y),单电子近似数学上表示为:f ( x, y) f1 ( x) f 2 ( y)
电子层结构。
2.3 波函数及电子云的图形
nlm (r, , ) Rnl (r)Ylm ( , )
波函数(Ψ,原子轨道)和电子云(|Ψ|2在空间的分布)是三 维空间坐标的函数,将它们用图形表示出来,使抽象的数学 表达式成为具体的图象,对于了解原子的结构和性质,了解 原子化合为分子的过程都具有重要的意义。 Ψ随r的变化关系----径向分布;
意义:
r R (r )dr D(r )dr
2 2 0 0
D(r):表示半径为r的球面上电子出现的概率密度 D(r)dr:表示半径为r,厚度为dr的球壳内电子出现的概率
径向分布图
2 径向分布函数r 2 Rn ,l (r ) r图
径向分布图
规律
球节面数 n-l-1 极大值数 n-l
2
所反映的仅是角度部分的性质,并非波函数的整体性质。
2.3.3 空间分布图
等值线图
网格立体图
电子云黑点图 原子轨道轮廓图
空间分布图
波函数的等值线图
空间分布图
原子轨道网格图
空间分布图
电子云网格图图
空间分布图
电子云黑点图
球节面数: n - l -1;角节面数:l
空间分布图
例
某类氢原子轨道电子云的角度分布图和径向密度函数图 如下,该轨道式什么轨道,粗略画出其电子云图。
Ylm(,)或 |Ylm(,)|2只与 l,m 有关,而与 n 无关。所以2p, 3p, 4p 的 角度分布却是一样的。因为共价键的方向性主要由 Ylm(,)决定,所以 常以 Ylm(,)代替原子轨道。
角度分布图
电子云的角度分布图 Yl ,m ( , )
2
角节面数=l 角度分布图Yl ,m ( , )和电子云的角度分布图 Yl ,m ( , )
i 1 n
ˆ 1 2 Z) (其中 H i i 2 ri
将一个包含 n 个电子的 Hamilton 拆分成 n 单电子体系 Hamilton ,每 个单电子 Schrö dinger 方程与类氢体系的方程完全一样。第 i 个电子的 Schrö dinger方程方程为:
ˆ (i) E (i) (i) H i i i i
教学目标和要求
第三节 波函数和电子云的图形 掌握 s、p、d原子轨道轮廓图及其特征
第四节 多电子原子的结构
掌握 简单多电子原子体系的Schrödinger方程的表示方法; 简单多电子原子的全波函数表示——Slater行列式。 第五节 元素周期表与元素周期性质 掌握 基态原子核外电子排布原则,第三周期前任一元素的
Dnl(r)的来历
把 2在 , 的全部变化范围积分:
0 0 2 0
2
0
2 (r , , )r 2 sin d d dr
( ) ( ) d ( ) sin d r 2 R 2 ( r )dr
2 0 0
20
0.00 0
10
20
r/a r/a00
径向分布图
2 p (n 2, l 1)
1s (n 1, l 0) 2s (n 2, l 0)
3s (n 3, l 0)
3 p (n 3, l 1)
3d (n 3, l 2)
2 径向密度函数Rn ,l (r ) r图
H原子Hamilton算符
2 2 h e 2 ˆ H 2 8 m 4 0 r
He原子Hamilton算符
多电子原子的Schrö dinger方程及其近似解
原子单位
h 1 au; me 1 au; e 1 au; 4 0 1 au 2
He原子Hamilton算符用原子单位表示为:
z
例
1 Ylm ( , ) Y00 ( , ) 4
为一常数,角度分布为球对称图形。 x
y
角度分布图
例
3 Ypz Y10 ( , ) 10 ( ) 0 ( ) cos 4
3 cos 0 90 4
即xy平面
角向节面
极值
dYpz
3 sin 0 d 4
2.4.2
零级近似
对每一个电子都有(ri,i,i),(i)称为多电子体系中的单电子波函数,
也即原子轨道。原子轨道(i)对应的能量为:
Z2 E (i) 13.606 2 eV ni
体系的近似波函数
1 2 n i
i 1 n
体系的总能量
E E1 E2 En Ei
径向分布图
2 Rn ,l (r )与Rn ,l ( r ) 的形状只与n和l 有关 2 当半径增加时,Rn ,l (r )与Rn ,l ( r ) 都很快趋于零,离核较远的地方发现
电子的概率非常小。
2 n越大,Rn ,l (r )与Rn ,l ( r )函数图形的伸展范围越大,n决定波函数伸展
范围越大。 n l 1时,会出现Rn ,l (r ) 0的球节面,即在这个球节面上发现电子 的概率密度为零。 球节面的个数:n - l -1
径向分布图
2 3. 径向密度函数r 2 Rn , l ( r ) r图 2 定义:D(r ) r 2 Rn , l ( r )为径向分布函数
Ψ随θ,φ的变化情况称为角度分布;
Ψ随r, θ, φ的变化情况,即空间分布。
2.3.1 径向分布图
径向分布图形
2 2 2 研究:Rn,l (r )、 Rn ( r ) 、 r Rn,l (r ) ,l
1.径向波函数Rn ,l (r ) r图 表示任意给定角度方向上(即一定 和 ),波函数r变化情况。 即: Rn ,l (r1 ) / Rn ,l (r2 ) 1 (r1 , , ) / 2 ( r2 , , )
由Koopman定理预测,He原子的总能量应为: E 79. 0 eV 电子间的排斥能:
79.0 (108.8) 29.8 eV
显然,电子间的排斥能是不能忽略的。虽然零级近似在精度上十分粗糙,但 它启示我们,可以通过一定的近似模型,可以将多电子的拆分成单电子的形式。
